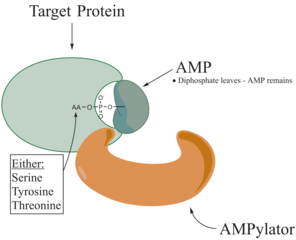
Adeniláció - Adenylylation
Az adeniláció , közismertebb nevén AMPylation egy olyan folyamat, amelyben egy adenozin -monofoszfát (AMP) molekula kovalensen kapcsolódik egy fehérje aminosav oldalláncához . Az AMP kovalens hozzáadása a fehérje hidroxil oldalláncához poszttranszlációs módosítás . Az adeniláció foszfodiészter kötést foglal magában az adenilizálandó molekula hidroxilcsoportja és az adenozin -monofoszfát nukleotid (azaz adenilsav) foszfátcsoportja között . Az enzimeket , amelyek képesek katalizálni ezt a folyamatot, AMPylatoroknak nevezzük.
A fehérjében ismert aminosavak a tirozin és a treonin, és néha a szerin. Amikor egy fehérje töltése megváltozik, az befolyásolja a fehérje tulajdonságait, általában az alakját megváltoztatva a fehérjét alkotó aminosavak kölcsönhatása révén. Az AMPylation különféle hatásokat gyakorolhat a fehérjére. Ezek a fehérje tulajdonságai, például a stabilitás, az enzimatikus aktivitás, a ko-faktor kötődés és a fehérje sok más funkcionális képessége. Az adeniláció egy másik funkciója az aminosavak aktiválása, amelyet a tRNS aminoacil -szintetáz katalizál. Az AMPilációt leggyakrabban azonosító fehérje a GTPázok és a glutamin -szintetáz .
Adenilátorok
Felelős enzimek AMPylation, úgynevezett AMPylators vagy Adenylyltransferase , esnek két különböző családok, mind attól függően, hogy a strukturális tulajdonságait és alkalmazott mechanizmus. Az AMPylatort két katalitikus homológ fele hozza létre. Az egyik fele felelős az adenilezési reakció katalizálásáért, míg a másik fele katalizálja a foszforolitikus halottiilezési reakciót . Ez a két család a DNS- β - polimeráz -szerű és a Fic család.
A DNS- β - polimeráz -szerű nukleotidiltranszferáz család . Pontosabban GlnE családként ismert. Van egy konkrét motívum, amely ezt a családot tisztázza. A motívum egy háromszálú β-lapból áll, amely a magnézium-ion koordináció és a foszfátkötés része. Az aszpartát elengedhetetlen ahhoz, hogy ebben a családban megtörténjen a tevékenység.
A Fic domén a Fido (Fic/Doc) szupercsaládhoz tartozik A Fic család , amely egy ciklikus AMP domén által indukált szál, ismert, hogy AMPilációt végez. Ez a fehérjecsalád megtalálható a földi élet minden területén. Ezt az ATP-kötőhely alfa-hélix motívumának mechanizmusa közvetíti. A fertőző baktériumok ezt a tartományt használják a fagocitózis megszakítására és sejthalálra. A fic domének evolúciósan konzervált domének a prokariótákban és eukariótákban , amelyek a Fido domén szupercsaládjába tartoznak.
Bebizonyosodott, hogy az AMPylatorok összehasonlíthatók a kinázokkal ATP hidrolízis aktivitásuk és a metabolit reverzibilis transzferje miatt a fehérje szubsztrát hidroxil oldallánca miatt. Az AMPiláció azonban nukleofil támadást katalizál az α-foszfát csoport ellen, míg a foszforilációs reakcióban lévő kináz a γ-foszfátot célozza meg. Az AMPiláció nukleofil támadása pirofoszfát felszabadulásához vezet, és az AMP-módosított fehérje az AMPilációs reakció terméke.
Adenililátorok
A de-AMPiláció az a fordított reakció, amelyben az AMP molekula leválik a láncfehérje aminosav oldaláról.
Ennek a reakciónak három ismert mechanizmusa ismert. A bakteriális GS-ATáz (GlnE) kétoldalú fehérjét kódol, külön N-terminális AMPylation és C-terminális de-AMPylation doménnel, amelyek aktivitását a P II és a kapcsolódó poszttranszlációs módosítások szabályozzák. Az AMPilált glutamin-szintetáz szubsztrátjának de-AMPilálása a GS adenil- tirozinja és az ortofoszfát közötti foszforolitikus reakción keresztül megy végbe , ami ADP és módosítatlan glutamin-szintetáz képződéséhez vezet.
A SidD, a Legionella pneumophila patogén baktériumok által a gazdasejtbe bejuttatott fehérje, de-AMPylates Rab1 egy másik, Legionella pneumophila enzim, az AMPylase SidM által AMPylated gazdaproteint. Jóllehet a két antagonista effektornak a gazdaszervezetbe történő bejuttatásának előnye a kórokozó számára nem világos, a SidD által végrehajtott biokémiai reakció egy foszfatázszerű domén használatát foglalja magában, hogy katalizálja az AMP hidrolitikus eltávolítását a gazdaszervezet Rab1 77 tirozinjából.
Az állati sejtekben az AMP eltávolítását a BiP/Grp78 518 -as treoninjából ugyanaz az enzim, az FICD katalizálja, mint az AMPylates BiP -t. A bakteriális GS-ATázzal ellentétben az FICD mindkét reakciót ugyanazon katalitikus doménnel hajtja végre.
Prokarióta
Bakteriális homeosztázis
Az AMPylation részt vesz a bakteriális homeosztázisban. A leghíresebb példa az AMPylator GS-ATase (GlnE), amely az AMPylation és a DeAMPylation részekben bevezetett glutamin szintetáz AMPylation révén hozzájárul a nitrogén metabolizmus komplex szabályozásához.
Egy másik példa a bakteriális homeosztázisban szerepet játszó AMPylatorokra az I. osztályú Fic AMPylators (FicT), amely módosítja a DNS -giráz GyrB alegységét, amely a Parois alegység ATP -kötődésének konzervált tirozinmaradéka a Topoizomeráz IV -nél. Ez a DNS -giráz -inaktiválás AMPilációval az SOS -válasz aktiválásához vezet, ami a DNS -károsodásra adott sejtválasz. Az FicT AMPylation aktivitása reverzibilis, és csak növekedési leálláshoz vezet, de nem sejthalálhoz. Ezért az FicT AMPylation szerepet játszik a sejtek stresszének szabályozásában, ami a Wolbachia baktériumokban kimutatható, hogy a FicT szintje nő a doxiciklin hatására.
Az N. meningtidis NmFic, III. Osztályú Fic AMPylatorja is módosítja az AMPylate GyrB -t a konzervált tirozinon az ATP -kötéshez. Ez azt mutatja, hogy a Fic domének erősen konzerváltak, ami jelzi az AMPylation fontos szerepét a baktériumok sejtes stresszének szabályozásában. Az NmFic szabályozása magában foglalja a koncentrációfüggő monomerizációt és autoAMPilációt az NmFic aktivitás aktiválásához.
Bakteriális patogenitás
A baktériumfehérjékről, más néven effektorokról kimutatták, hogy AMPilációt alkalmaznak. Az olyan effektorokról, mint a VopS, az IbpA és a DrrA, kimutatták az AMPylate gazda GTPázokat, és aktin citoszkeleton változásokat okoznak. A GTPázok az AMPylators általános célpontjai. A Rho , Rab és Arf GTPáz családok részt vesznek az aktin citoszkeleton dinamikájában és a vezikuláris kereskedelemben. Szerepet játszanak a sejtszabályozó mechanizmusokban is, mint például a gazdasejt fagocitózisa .
A kórokozó a gazdasejt fagocitózisának indukciójával vagy gátlásával fokozza vagy megakadályozza annak internalizálódását . A Vibrio parahaemolyticus egy Gram-negatív baktérium, amely ételmérgezést okoz az emberek nyers vagy alultáplált tenger gyümölcsei fogyasztása következtében. A VopSo, a Vibrio parahaemolyticus -ban található III. Típusú effektor , egy Fic domént tartalmaz, amely konzervált HPFx (D/E) GN (G/K) R motívummal rendelkezik, és amely tartalmaz AMPilációhoz nélkülözhetetlen hisztidinmaradékot. A VopS blokkolja az aktin összeállítást azáltal, hogy módosítja a treonin -maradékot az Rho GTPázok 1. kapcsoló régiójában. Ha egy AMP -részt ATP -vel transzferálunk a treonin -maradékba, sztérikus akadályokba ütközik, és ezáltal megakadályozza, hogy az Rho -GTPázok kölcsönhatásba lépjenek a downstream effektorokkal. A VopS adenilálja az RhoA -t és a sejtosztódási ciklust 42 (CDC42) is, ami az aktinszálak hálózatának széteséséhez vezet. Ennek eredményeként a gazdasejt aktin -citoszkeleton szabályozása le van tiltva, ami sejtkerekítéshez vezet.
Az IbpA a szarvasmarhák Gram-negatív baktériumából, a H. somni- ból szekretálódik eukarióta sejtekbe , amely légúti hámfertőzést okoz. Ez az effektor két Fic domént tartalmaz a C-terminális régióban. A Rho család GTPázai IbpA Fic doménjének AMPilációja felelős a citotoxicitásáért. Mindkét Fic domén hasonló hatással van a gazdasejtek citoszkeletonjára, mint a VopS. Az 1 -es kapcsolórégió tirozinmaradékán levő AMPiláció blokkolja a GTPázok kölcsönhatását a downstream szubsztrátokkal, mint például a PAK.
A DrrA a Dot/Icm típusú IV típusú transzlokációs rendszer DrrA szubsztrátja a Legionella pneumophila -ból . Ez az L. pneumophila által kiválasztott effektor a gazdasejtek GTPázainak módosítására. Ez a módosítás növeli a baktériumok túlélését a gazdasejtekben. A DrrA Rab1b- specifikus guanin-nukleotidcsere-faktor (GEF) doménből, C-terminális lipidkötő doménből és N-terminális doménből áll, amelyek citotoxikus tulajdonságai nem tisztázottak. Kutatási munkák azt mutatják, hogy az N-terminális és a teljes hosszúságú DrrA kimutatja az AMPylatorok aktivitását a gazda Rab1b fehérjéje (Ras rokon fehérje) felé, amely szintén a Rab1b GEF domén szubsztrátja. A Rab1b fehérje a GTPáz Rab, amely szabályozza a hólyagok szállítását és a membránfúziót. Az AMPylators baktériumok általi adenilezés meghosszabbítja a RTP1b GTP-hez kötött állapotát. Így az effektor DrrA szerepe a baktériumok vakuoljainak a fertőzés során történő replikációjához nyújtott előnyeihez kapcsolódik.
Eukarióta
A növényeknek és az élesztőknek nincsenek ismert endogén AMPiláló enzimjeik, de az állati genomok egy Fic-domén AMPilázt kódoló gén egyetlen példányával vannak ellátva, amelyet valószínűleg az állatok korai őse szerzett be egy prokarióta vízszintes géntranszfer útján . Az emberi fehérjét, amelyet általában FICD-nek neveznek, korábban Huntingtin-asszociált E-proteinként (HypE; egy élesztő-két hibrid szűrésből származó hozzárendelés, de megkérdőjelezhető relevanciával jelölték meg , mivel a Huntingtin és a HypE/FICD különböző sejtosztályokban találhatók) . CG9523 A Drosophila melanogaster (CG9523) és a C. elegans (Fic-1) homológjai is figyelmet kaptak. Az FICD minden állatban hasonló szerkezetű. Ez egy II. Típusú transzmembrán doménprotein, rövid citoplazmatikus doménnel, amelyet membránhorgony követ, amely a fehérjét az endoplazmatikus retikulumban (ER) tartja, és a hosszú C-terminális rész, amely az ER-ben található, és magában foglalja a tetratricopeptid ismétlődéseket (TPR), majd katalitikus Fic domain.
Endoplazmatikus retikulum
Fontos áttörést jelentett az állati sejt AMPiláz felfedezése, majd az ER lokalizációjának felfedezése, valamint az, hogy a BiP tevékenységének kiemelkedő szubsztrátja. A BiP (más néven Grp78) régóta ismert, hogy inaktiváló transzláció utáni módosításon megy keresztül, de a természet továbbra is megfoghatatlan. Széles körben feltételezik, hogy ADP-riboziláció , kiderül, hogy FICD-közvetített AMPiláció, mivel az FICD gén inaktiválása a sejtekben megszüntette a BiP minden mérhető poszttranszlációs módosítását.
A BiP egy ER-lokalizált fehérje-chaperon, amelynek aktivitását transzkripciós szinten szigorúan szabályozzák az Unfolded Protein Response (UPR) néven ismert génexpressziós programon keresztül . Az UPR egy homeosztatikus folyamat, amely összekapcsolja a BiP (és sok más fehérje) transzkripciós sebességét az ER-ben kibontott fehérjék terhelésével (ún. ER stressz), hogy segítse az ER proteosztázisának fenntartását . Az AMPylation újabb gyors, poszttranszlációs réteget ad a BiP aktivitásának szabályozásához, mivel a BiP szubsztrát-kötő doménjének Thr518 módosítása AMP-vel inaktív konformációba zárja a chaperont. Ezt a módosítást szelektíven alkalmazzák az ER stressz csökkenésekor, hogy inaktiválják a BiP többletet. Azonban, ahogy az ER stressz ismét emelkedik, ugyanaz az enzim, az FICD katalizálja az ellenkező reakciót, a BiP de-AMPylation-t.
Fokozatosan megjelenik a BiP AMPylation és a de-AMPylation szerkezeti alapjainak alárendeltsége, csakúgy, mint az allosztériumra utaló nyomok , amelyek szabályozhatják az FICD tevékenységének váltását, de ennek a folyamatnak a sejtben bekövetkező fontos részletei még felfedezésre várnak.
Az FICD szerepét a ThP518 BiP AMPylation (és de-AMPylation) folyamatában jól alátámasztják a biokémiai és szerkezeti vizsgálatok. Bizonyítékokat is bemutattak, hogy bizonyos körülmények között az FICD más aminosavat, a Thr366 -ot AMPilálhat a BiP nukleotidkötő doménjében.
Caenorhabditis elegans
A Fic-1 az egyetlen Fic fehérje a C. elegans genetikai kódjában . Elsősorban a felnőtt csíravonalsejtek és az embriósejtek ER nukleáris burkában található meg , de kis mennyiségben a citoplazmában is megtalálható. Ez az extra-ER medence FICD's-1 jóváírásra withAMPylation a mag hisztonok és EEF1-A típusú transzlációs faktorok a fonalféreg.
Bár a változó AMPilációs szintek nem hoztak észrevehető hatásokat a fonálférgek viselkedésére vagy fiziológiájára, a Fic-1 kiütéses férgek érzékenyebbek voltak a Pseudomonas aeruginosa által okozott fertőzésre, mint az aktív Fic-1 doménnel rendelkező társak, ami összefüggést jelez a sejtcélok AMPilációja és immunválasz a fonálférgekben.
Drosophila melanogaster
Az FICD -t (CG9523) nem tartalmazó legyeket vaknak írták le. Kezdetben ezt a hibát az FICD szerepének tulajdonították a capitat projekciók sejtfelületén - a neurotranszmitter -újrahasznosítás feltételezett helyén, azonban egy későbbi tanulmány a BiP Thr366 FICD által közvetített AMPylation -ját vonta be a látási problémába
Klinikai tünetek
A preszinaptikus α-synuclein fehérje az FICD AMPylation célpontja. Az αSyn HypE által közvetített adenilációja során az αSyn aggregációja csökken, és mind a neurotoxicitás, mind az ER stressz in vitro csökken . Így az αSyn adenilációja valószínűleg védő válasz az ER stresszre és az αSyn aggregációra. Mivel azonban az aSyn és az FICD különböző rekeszekben találhatók, további kutatásokra van szükség, amelyek megerősítik ezen állítások jelentőségét.
Érzékelés
Vegyi fogantyúk
Kémiai fogantyúkat használnak a transzláció utáni módosított fehérjék kimutatására. A közelmúltban létezik egy N6pATP, amely alkinil -címkét (propargil) tartalmaz az ATP adenin N6 -helyzetében. Ez az N6pATP a kattintási reakcióval kombinálva érzékeli az AMPilált fehérjéket. Az ismeretlen módosított fehérje kimutatására és a VopS szubsztrátok megjelölésére az ATP -származékokat használjuk, amelyek fluorofórral rendelkeznek az N6 NH2 adeninben.
Antitest-alapú módszer
Az antitest nagy affinitásáról és szelektivitásáról híres, ezért ez a jó módszer az AMPilált fehérjék kimutatására. A közelmúltban ɑ-AMP antitesteket használtak az AMPilált fehérjék (különösen az AMPilált tirozin és az AMPilált treonin) közvetlen kimutatására és izolálására a sejtekből és sejtlizátumokból. Az AMPylation egy poszttranszlációs módosítás, így módosítja a fehérje tulajdonságait az AMP poláris jellegének és a hidrofóbitásnak a megadásával. Így ahelyett, hogy egy teljes peptidszekvenciát detektáló antitesteket használnánk, előnyben részesítjük az AMP antitesteket, amelyek közvetlenül specifikus aminosavakra irányulnak.
Tömegspektrometria
Korábban számos tudományos munka tömegspektrometriát (MS) használt különböző fragmentációs módokban az AMPilált peptidek kimutatására. A megkülönböztető fragmentációs technikákra adott válaszként az AMPilált fehérje szekvenciák szétestek az AMP különböző részein. Míg az elektronátviteli disszociáció (ETD) minimális töredékeket és kevésbé bonyolult spektrumokat hoz létre, addig az ütközés által kiváltott disszociáció (CID) és a nagy energiájú ütközés (HCD) fragmentációja olyan jellemző ionokat hoz létre, amelyek alkalmasak az AMPilált fehérjék azonosítására, több AMP-fragmentum létrehozásával. Az AMP stabilitása miatt a peptid fragmentációs spektrumok könnyen olvashatók manuálisan vagy keresőmotorokkal.
Gátlók
Felfedezték a fehérje AMPiláció gátlóit, amelyek gátló állandója (K i ) 6-50 µM között van, és legalább 30 -szoros szelektivitás a HypE -vel szemben.