Amfetamin - Amphetamine
Amfetamin (szerződött egy LPHa - m etil- ph en et -etil -amin ) egy központi idegrendszeri (CNS) stimuláns , hogy használják a kezelésére figyelemhiányos hiperaktivitási rendellenesség (ADHD), narkolepszia , és az elhízás . Amfetamin fedezték fel 1887-ben, és létezik két enantiomer : levoamphetamine és dextroamfetamin . Az amfetamin helyesen egy specifikus vegyi anyagra, a racém szabad bázisra utal , amely a két enantiomer, a levoamfetamin és a dextroamfetamin egyenlő része tiszta amin formájában. Ezt a kifejezést gyakran informálisan használják az enantiomerek bármely kombinációjára vagy önmaguk bármelyikére. Történelmileg orrdugulás és depresszió kezelésére használták. Az amfetamint sportteljesítmény -fokozóként és kognitív fokozóként , valamint rekreációs célokra afrodiziákumként és euforiánsként is használják . Ez egy vényköteles gyógyszer sok országban, és a jogosulatlan birtoklása és terjesztése az amfetamin, gyakran szorosan szabályozott miatt jelentős egészségügyi kockázatok szabadidős használatra .
Az első amfetamin gyógyszer a Benzedrine volt , egy márka, amelyet különböző állapotok kezelésére használtak. Jelenleg, gyógyszerészeti amfetamin írja elő, mint a racém amfetamin, Adderall , dextroamfetamin , vagy az inaktív prodrug lisdexamfetamine . Az amfetamin növeli a monoamint és az izgató neurotranszmissziót az agyban, a leghatékonyabb hatásai a norepinefrin és a dopamin neurotranszmitter rendszereket célozzák .
Terápiás dózisokban az amfetamin érzelmi és kognitív hatásokat okoz, például eufóriát , változást a szexuális vágyban , fokozott ébrenlétet és javítja a kognitív kontrollt . Fizikai hatásokat indukál, mint például a jobb reakcióidőt, fáradtságállóságot és fokozott izomerőt. Nagyobb dózisú amfetamin károsíthatja a kognitív funkciókat és gyors izomleépülést okozhat . A függőség komoly veszélyt jelent a szabadidős amfetamin-használat során, de valószínűtlen, hogy terápiás dózisokban történő hosszú távú orvosi használat esetén fordul elő. A nagyon nagy dózisok pszichózist (pl. Téveszméket és paranoiát ) okozhatnak , ami ritkán fordul elő terápiás dózisok mellett, még hosszú távú használat esetén is. A szabadidős adagok általában sokkal nagyobbak, mint az előírt terápiás dózisok, és sokkal nagyobb kockázatot jelentenek a súlyos mellékhatásokra.
Az amfetamin a fenetilaminok osztályába tartozik . Ez egyben saját szerkezeti osztályának anyavegyülete, a helyettesített amfetaminok , amelyek olyan kiemelkedő anyagokat tartalmaznak, mint a bupropion , katinon , MDMA és metamfetamin . A fenetil -amin osztály tagjaként az amfetamin kémiailag rokon a természetben előforduló amin -nyom neuromodulátorokkal, különösen a fenetil -aminnal és az N -metil -fenetil -aminnal , amelyek mind az emberi szervezetben termelődnek. A fenetil -amin az amfetamin anyavegyülete, míg az N -metil -fenetil -amin az amfetamin helyzeti izomerje , amely csak a metilcsoport elhelyezésében különbözik .
Felhasználások
Orvosi
Amfetamin kezelésére alkalmazzák figyelemhiányos hiperaktivitási rendellenesség (ADHD), narkolepszia (alvási rendellenesség), és az elhízás , és néha előírt off-label annak már orvosi indikációk , különösen a depresszió és a krónikus fájdalom . Ismeretes, hogy bizonyos állatfajokban a hosszú távú amfetamin-expozíció kellően nagy dózisokban kóros dopaminrendszer- fejlődést vagy idegkárosodást okoz, de az ADHD-ban szenvedő embereknél a gyógyászati amfetaminok terápiás dózisokban javítják az agy fejlődését és az ideg növekedését. A mágneses rezonancia képalkotó (MRI) vizsgálatok áttekintései azt sugallják, hogy a hosszú távú amfetamin-kezelés csökkenti az agyi szerkezet és működés rendellenességeit az ADHD-ben szenvedő betegeknél, és javítja az agy több részének működését, például a bazális ganglionok megfelelő caudate-sejtmagját .
A klinikai stimuláns kutatások áttekintése megállapította az ADHD kezelésében a hosszú távú folyamatos amfetamin használat biztonságosságát és hatékonyságát. A folyamatos stimuláló terápia randomizált, kontrollált vizsgálatai az ADHD kezelésére 2 éven keresztül bizonyították a kezelés hatékonyságát és biztonságát. Két értékelés azt jelezte, hogy az ADHD hosszú távú, folyamatos stimuláló terápiája hatékonyan csökkenti az ADHD alapvető tüneteit (azaz a hiperaktivitást, figyelmetlenséget és impulzivitást), javítja az életminőséget és a tanulmányi eredményeket, valamint javítja számos funkcionális funkciót. az eredmények 9 kategóriájának eredményei, amelyek az akadémikusokkal, az antiszociális magatartással, a vezetéssel, a nem gyógyszeres kábítószer-használattal, az elhízással, a foglalkozással, az önbecsüléssel, a szolgáltatáshasználattal (azaz tudományos, foglalkozási, egészségügyi, pénzügyi és jogi szolgáltatásokkal) és a társadalmi funkcióval kapcsolatosak . Egy áttekintés kiemelte az ADHD-val kezelt, gyermekeknél végzett, kilenc hónapos, randomizált, kontrollált vizsgálatot az amfetamin-kezelésről gyermekeknél, amely átlagosan 4,5 IQ- növekedést, a figyelem további növekedését és a zavaró viselkedés és a hiperaktivitás folyamatos csökkenését találta . Egy másik felülvizsgálat azt mutatta, hogy az eddigi leghosszabb nyomon követési vizsgálatok alapján a gyermekkorban megkezdett élethosszig tartó stimuláló terápia folyamatosan hatékonyan kezeli az ADHD tüneteit, és csökkenti a szerhasználati zavar felnőttkori kialakulásának kockázatát .
Az ADHD jelenlegi modelljei azt sugallják, hogy az agy egyes neurotranszmitter -rendszereinek funkcionális károsodásával jár ; ezek a funkcionális károsodások magukban foglalják a dopamin neurotranszmisszió károsodását a mezokortikolimbikus projekcióban és a norepinefrin neurotranszmissziót a noradrenerg vetületekben a locus coeruleusból a prefrontális kéregbe . A pszichostimulánsok, mint a metilfenidát és az amfetamin hatékonyak az ADHD kezelésében, mivel növelik a neurotranszmitter aktivitást ezekben a rendszerekben. Az ilyen stimulánsokat alkalmazók körülbelül 80% -a látja az ADHD tüneteinek javulását. Azok az ADHD -s gyermekek, akik stimuláló gyógyszereket használnak, általában jobb kapcsolatokat ápolnak társaikkal és családtagjaikkal, jobban teljesítenek az iskolában, kevésbé zavaróak és impulzívak, és hosszabb a figyelmük. A Cochrane véleménye az ADHD kezeléséről gyermekeknél, serdülőknél és felnőtteknél gyógyszerészeti amfetaminokkal azt állította, hogy rövid távú vizsgálatok kimutatták, hogy ezek a gyógyszerek csökkentik a tünetek súlyosságát, de kedvezőtlenségeik miatt magasabb a megszakítási arányuk, mint a nem stimuláló gyógyszereknél. mellékhatások . Egy Cochrane Review az ADHD kezelésében gyermekeknél tic zavarok , mint a Tourette-szindróma jelezte, hogy a stimulánsok általában nem teszik tic rosszabb, de nagy adagban dextroamfetamint súlyosbíthatja tic egyes egyének.
A teljesítmény javítása
Kognitív teljesítmény
2015 -ben a magas színvonalú klinikai vizsgálatok szisztematikus áttekintése és metaanalízise azt mutatta ki, hogy alacsony (terápiás) dózisokban alkalmazva az amfetamin szerény, de egyértelmű javulást eredményez a kognícióban, beleértve a munkamemóriát , a hosszú távú epizodikus memóriát , a gátló kontrollt , és a figyelem egyes aspektusai , normális egészséges felnőtteknél; ezek a kognitív funkciót fokozó hatás az amfetamin ismert, hogy részben közvetíti a közvetett aktiválásából mind dopamin receptor D 1 és adrenoceptor alfa 2 a prefrontális kéregben . Egy 2014 -es szisztematikus áttekintés megállapította, hogy az alacsony dózisú amfetamin szintén javítja a memória konszolidációját , ami az információk jobb felidézéséhez vezet . Az amfetamin terápiás adagjai szintén fokozzák a kéreghálózat hatékonyságát, amely hatás minden személy munkamemóriájának javulását közvetíti. Az amfetamin és más ADHD-stimulánsok szintén javítják a feladatok megértését (motiválnak egy feladat elvégzésére), és fokozzák az izgalmat (ébrenlét), ami elősegíti a célirányos viselkedést. Az olyan stimulánsok, mint az amfetamin, javíthatják a nehéz és unalmas feladatok teljesítőképességét, és néhány tanuló tanulmányként és tesztelési segédeszközként használja őket. Az önként bejelentett illegális stimulánsok használatával kapcsolatos tanulmányok alapján az egyetemisták 5–35% -a eltérített ADHD-stimulánsokat használ , amelyeket elsősorban a tanulmányi teljesítmény javítására használnak, nem pedig szabadidős szerekként. Azonban a terápiás tartomány feletti magas amfetamin dózisok zavarhatják a munkamemóriát és a kognitív kontroll egyéb aspektusait.
Fizikai teljesítmény
Az amfetamint egyes sportolók pszichológiai és atlétikai teljesítménynövelő hatásaira használják , például fokozott állóképességre és éberségre; mindazonáltal tilos a nem orvosi amfetamin használata olyan sporteseményeken, amelyeket a kollegális, nemzeti és nemzetközi doppingellenes ügynökségek szabályoznak. Egészséges embereknél orális terápiás dózisokban kimutatták, hogy az amfetamin növeli az izomerőt , a gyorsulást, a sportteljesítményt anaerob körülmények között és az állóképességet (azaz késlelteti a fáradtság kialakulását ), miközben javítja a reakcióidőt . Az amfetamin elsősorban az újrafelvétel gátlása és a központi idegrendszer dopamin felszabadulása révén javítja az állóképességet és a reakcióidőt . Az amfetamin és más dopaminerg gyógyszerek szintén növelik a teljesítményt az észlelt erőkifejtés rögzített szintjén a "biztonsági kapcsoló" felülbírálásával, lehetővé téve a maghőmérséklet határértékének növekedését, hogy elérjék a normál esetben korlátozott tartalékkapacitást. Terápiás dózisokban az amfetamin káros hatásai nem akadályozzák a sportteljesítményt; azonban sokkal magasabb dózisok esetén az amfetamin olyan hatásokat idézhet elő, amelyek súlyosan rontják a teljesítményt, például gyors izomtörést és emelkedett testhőmérsékletet .
Ellenjavallatok
A Nemzetközi Kémiai Biztonsági Program (IPCS) és az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (USFDA) szerint az amfetamin ellenjavallt azoknál az embereknél, akiknek kórelőzményében kábítószerrel való visszaélés , szív- és érrendszeri betegségek , súlyos izgatottság vagy súlyos szorongás áll fenn. Ellenjavallt olyan betegeknél is, akik előrehaladott érelmeszesedésben (artériák megkeményedése), glaukómában (megnövekedett szemnyomás), hyperthyreosisban (pajzsmirigyhormon túlzott termelése) vagy közepes vagy súlyos magas vérnyomásban szenvednek . Ezek az ügynökségek azt jelzik, hogy azok az emberek, akik más stimulánsokkal szemben allergiás reakciókat tapasztaltak, vagy akik monoamin -oxidáz inhibitorokat (MAOI) szednek, ne szedjenek amfetamint, bár az amfetamin és a monoamin -oxidáz inhibitorok biztonságos egyidejű alkalmazását dokumentálták. Ezek az ügynökségek is kimondják, hogy bárki, aki az anorexia nervosa , a bipoláris zavar , depresszió, magas vérnyomás, máj- vagy vesebetegségben szenved, mánia , pszichózis , Raynaud-jelenség , görcsök , pajzsmirigy problémák, tic vagy Tourette-szindróma ellenőriznie kell a tüneteket, miközben az amfetamin. Emberi vizsgálatokból származó bizonyítékok azt mutatják, hogy a terápiás amfetaminhasználat nem okoz fejlődési rendellenességeket a magzatban vagy az újszülöttekben (azaz nem humán teratogén ), de az amfetaminnal való visszaélés veszélyt jelent a magzatra. Az amfetamin bejutott az anyatejbe is, ezért az IPCS és az USFDA azt tanácsolja az anyáknak, hogy kerüljék a szoptatást használatakor. A reverzibilis növekedési károsodások lehetősége miatt az USFDA azt tanácsolja, hogy figyeljék az amfetamin gyógyszert felírt gyermekek és serdülők magasságát és súlyát.
Káros hatások
Az amfetamin káros mellékhatásai sokfélék és sokfélék, és a felhasznált amfetamin mennyisége az elsődleges tényező a káros hatások valószínűségének és súlyosságának meghatározásában. Az olyan amfetamin-termékeket, mint az Adderall , a Dexedrine és ezek általános megfelelői, jelenleg az USFDA engedélyezi hosszú távú terápiás használatra. Az amfetamin rekreációs használata általában sokkal nagyobb dózisokkal jár, amelyek nagyobb kockázattal járnak a súlyos mellékhatások szempontjából, mint a terápiás célokra használt dózisok.
Fizikai
A szív- és érrendszeri mellékhatások közé tartozhat a magas vérnyomás vagy a vasovagalis válaszból származó hypotensio , a Raynaud -jelenség (a kéz és a láb véráramlásának csökkenése) és a tachycardia (megnövekedett pulzusszám). A férfiak szexuális mellékhatásai lehetnek merevedési zavar , gyakori erekció vagy hosszan tartó erekció . Az emésztőrendszeri mellékhatások közé tartozhatnak a hasi fájdalom , székrekedés , hasmenés és hányinger . Egyéb lehetséges fizikai mellékhatások közé tartozik az étvágytalanság , homályos látás , szájszárazság , túlzott fogcsikorgatás , orrvérzés, erős verejtékezés, rhinitis medicamentosa (gyógyszer okozta orrdugulás), csökkent görcsküszöb , tics (egyfajta mozgászavar), és fogyás . A veszélyes fizikai mellékhatások ritkák tipikus gyógyszerészeti adagok esetén.
Az amfetamin stimulálja a velős légzőközpontokat , gyorsabb és mélyebb légzést eredményez . Egy normális embernél terápiás dózisokban ez a hatás általában nem észrevehető, de amikor a légzés már sérült, akkor ez nyilvánvaló lehet. Az amfetamin összehúzódást is okoz a húgyhólyag záróizmában , amely a vizelést szabályozza, és ami vizelési nehézséget okozhat. Ez a hatás hasznos lehet az ágy nedvesedésének és a hólyagkontroll elvesztésének kezelésében . Az amfetamin hatása a gyomor -bél traktusra kiszámíthatatlan. Ha a bél aktivitása magas, az amfetamin csökkentheti a gyomor -bél traktus motilitását (azt a sebességet, amellyel a tartalom az emésztőrendszeren keresztül mozog); azonban az amfetamin fokozhatja a motilitást, ha a traktus simaizma ellazult. Az amfetamin enyhe fájdalomcsillapító hatással is rendelkezik, és fokozhatja az opioidok fájdalomcsillapító hatását .
Az USFDA által megrendelt, 2011-es tanulmányok azt mutatják, hogy gyermekeknél, fiatal felnőtteknél és felnőtteknél nincs összefüggés a súlyos szív- és érrendszeri események ( hirtelen halál , szívroham és stroke ) és az amfetamin vagy más ADHD-stimulánsok orvosi alkalmazása között. Azonban az amfetamin gyógyszer ellenjavallt szív- és érrendszeri betegségben szenvedőknél .
Pszichológiai
Normál terápiás dózisok mellett az amfetamin leggyakoribb pszichológiai mellékhatásai közé tartozik a fokozott éberség , félelmek, koncentráció , kezdeményezőkészség, önbizalom és társaságkedvelés, hangulatváltozások ( emelkedett hangulat, majd enyhén depressziós hangulat ), álmatlanság vagy ébrenlét , valamint csökkent fáradtságérzet. . Kevésbé gyakori mellékhatások közé tartozik a szorongás , a libidó megváltozása , a nagyképűség , az ingerlékenység , az ismétlődő vagy megszállott viselkedés és a nyugtalanság; ezek a hatások a felhasználó személyiségétől és aktuális mentális állapotától függenek. Az erős fogyasztóknál amfetamin -pszichózis (pl. Téveszmék és paranoia ) fordulhat elő. Bár nagyon ritka, ez a pszichózis terápiás dózisokban is előfordulhat hosszú távú terápia során. Az USFDA szerint "nincs szisztematikus bizonyíték" arra, hogy a stimulánsok agresszív viselkedést vagy ellenségeskedést váltanak ki.
Azt is kimutatták, hogy az amfetamin kondicionált helypreferenciát eredményez az embereknél terápiás adagokat szedve, ami azt jelenti, hogy az egyének előnyben részesítik az időtöltést azokon a helyeken, ahol korábban használtak amfetamint.
Erősítő rendellenességek
Függőség
| Függőség és függőség szószedet | |
|---|---|
| |
| Transzkripciós faktor szószedet | |
|---|---|
| |
|
|
A függőség komoly veszélyt jelent a szabadidős amfetamin-használat során, de valószínűtlen, hogy terápiás dózisokban történő hosszú távú orvosi használat esetén fordul elő; Valójában a gyermekkorban kezdődő ADHD élethosszig tartó stimuláló terápia csökkenti a szerhasználati zavarok kialakulásának kockázatát felnőttként. Az amfetamin -függőségben központi szerepet játszik a mezolimbikus útvonal kóros túlaktivációja , amely a dopamin útvonala, amely összeköti a ventrális tegmentális területet a nucleus accumbens -szel . Azok, akik gyakran adagoljanak maguknak nagy dózisú amfetamin magas kifejlődésének rizikója amphetamin, mivel a krónikus használata nagy dózisban fokozatosan növeli a szintjét accumbal ΔFosB , egy „molekuláris kapcsoló” és a „mester kontroll fehérje” a függőség. Amint a nucleus accumbens ΔFosB kellően túlexpresszálódik, elkezdi fokozni az addiktív viselkedés súlyosságát (azaz a kényszeres kábítószer-keresést), további expressziójával. Bár jelenleg nincsenek hatékony gyógyszerek az amfetamin -függőség kezelésére, úgy tűnik, hogy a rendszeres aerob testmozgás csökkenti az ilyen függőség kialakulásának kockázatát. A rendszeres, rendszeres aerob testmozgás az amfetamin -függőség hatékony kezelésének is tűnik; az edzésterápia javítja a klinikai kezelési eredményeket, és kiegészítő terápiaként alkalmazható a függőség viselkedési terápiáival együtt.
Biomolekuláris mechanizmusok
Az amfetamin túlzott dózisban történő krónikus használata megváltoztatja a génexpressziót a mezokortikolimbikus vetületben , amelyek transzkripciós és epigenetikai mechanizmusok révén keletkeznek . A legfontosabb transzkripciós faktorok , amelyek ezeket a változásokat okozzák, a Delta FBJ egér osteosarcoma vírus onkogén B homológja ( ΔFosB ), a cAMP válaszelem-kötő fehérje ( CREB ) és a nukleáris faktor-kappa B ( NF-κB ). ΔFosB a legjelentősebb biomolekuláris mechanizmus függőség miatt ΔFosB túlexpresszió (azaz, abnormálisan magas szintű génexpressziót, ami termel egy hangsúlyos gén-rokon fenotípus ) a D1-típusú közepes tüskés neuronok a nucleus accumbensben van szükséges és elégséges a sok a neurális adaptációkat és szabályozza a függőségben szerepet játszó több viselkedési hatást (pl. jutalomérzékenység és fokozódó gyógyszer -beadás ). Amint a ΔFosB kellően túlexpresszálódik, addiktív állapotot vált ki, amely egyre súlyosabbá válik a ΔFosB expresszió további növekedésével. Többek között alkohol- , kannabinoid- , kokain- , metil -fenidát- , nikotin- , opioid- , fenciklidin- , propofol- és helyettesített amfetamin -függőséggel is összefüggésbe hozták .
A ΔJunD , a transzkripciós faktor és a G9a , egy hiszton -metiltranszferáz enzim, mindketten ellenzik a ΔFosB funkcióját, és gátolják expressziójuk növekedését. Ha a ΔJunD -t kellően túlexpresszálja a nucleus accumbens -ben, vírusvektorokkal , teljesen blokkolhatja a krónikus kábítószerrel való visszaélés során észlelt számos idegi és viselkedési elváltozást (azaz a ΔFosB által közvetített elváltozásokat). Hasonlóképpen, accumbal G9a túlexpressziója eredményez jelentősen megnövekedett hiszton 3 lizin maradékot 9 dimetiláció ( H3K9me2 ) és gátolja az indukciója ΔFosB-közvetített neurális és viselkedési plaszticitás a krónikus kábítószer-használat, amelyek útján történik H3K9me2 által közvetített elnyomását a transzkripciós faktorok számára ΔFosB és H3K9me2- különböző ΔFosB transzkripciós célpontok (pl. CDK5 ) közvetített elnyomása . A ΔFosB fontos szerepet játszik a természetes jutalmakra , például az ízletes ételekre, a szexre és a testmozgásra adott viselkedési válaszok szabályozásában is . Mivel mind a természetes jutalmak, mind a függőséget okozó gyógyszerek indukálják a ΔFosB expresszióját (azaz az agyat termelik többet), ezeknek a jutalmaknak a krónikus megszerzése hasonló patológiás függőségi állapotot eredményezhet. Következésképpen a ΔFosB a legjelentősebb tényező mind az amfetamin-függőségben, mind az amfetamin-indukált szexuális függőségekben , amelyek kényszeres szexuális viselkedések, amelyek a túlzott szexuális tevékenységből és az amfetamin-használatból erednek. Ezek a szexuális függőségek olyan dopamin -diszregulációs szindrómával járnak, amely néhány dopaminerg gyógyszert szedő betegnél fordul elő .
Az amfetamin génszabályozásra gyakorolt hatása dózis- és útvonalfüggő. A génszabályozással és a függőséggel kapcsolatos kutatások nagy része állatkísérleteken alapul, amik intravénás amfetamin -adagolást végeznek nagyon nagy dózisokban. Az a néhány tanulmány, amely ekvivalens (súlyhoz igazított) humán terápiás dózist és orális adagolást alkalmazott, azt mutatja, hogy ezek a változások, ha bekövetkeznek, viszonylag csekélyek. Ez arra utal, hogy az amfetamin orvosi alkalmazása nem befolyásolja jelentősen a génszabályozást.
Farmakológiai kezelések
2019 decemberétől nincs hatékony farmakoterápia az amfetamin -függőség kezelésére. A 2015 -ös és 2016 -os felülvizsgálatok azt mutatták, hogy a TAAR1 -szelektív agonisták jelentős terápiás potenciállal rendelkeznek pszichostimuláns függőségek kezelésére; 2016. februárjától azonban az egyetlen olyan vegyület, amelyről ismert, hogy TAAR1-szelektív agonistaként működik, kísérleti gyógyszerek . Az amfetamin-függőség nagymértékben a dopamin-receptorok és a co-lokalizált NMDA-receptorok fokozott aktiválódása révén alakul ki a nucleus accumbensben; a magnéziumionok gátolják az NMDA -receptorokat a receptor kalciumcsatorna blokkolásával . Egy áttekintés azt sugallta, hogy állatkísérletek alapján a kóros (függőséget kiváltó) pszichostimulánsok alkalmazása jelentősen csökkenti az agyban az intracelluláris magnézium szintjét. Kiegészítő magnézium- kezelésről kimutatták, hogy csökkenti a amfetamin önadagolását (azaz, dózisok adott magát) emberekben, de ez nem egy hatékony monoterápia az amphetamin.
A 2019-től származó szisztematikus felülvizsgálat és metaanalízis értékelte az RCT-kben alkalmazott 17 különböző farmakoterápia hatékonyságát amfetamin- és metamfetamin-függőség esetén; csak gyenge bizonyítékokat talált arra, hogy a metil-fenidát csökkentheti az amfetamin- vagy metamfetamin-adagolást. Kevés vagy közepes erősségű bizonyíték volt arra, hogy az RCT-kben használt egyéb gyógyszerek többsége nem jár előnyökkel, ideértve az antidepresszánsokat (bupropion, mirtazapin , szertralin ), antipszichotikumokat ( aripiprazol ), antikonvulzív szereket ( topiramát , baclofen , gabapentin ), naltrexont , vareniklint. , citikolin , ondanszetron , prometa , riluzol , atomoxetin , dextroamfetamin és modafinil .
Viselkedési kezelések
A 2018 szisztematikus áttekintése és hálózati metaanalízis 50 vizsgálatokat, amelyeknek 12 különböző pszichoszociális beavatkozások amfetamin, metamfetamin, vagy a kokain-függőség találtuk, hogy kombinációs terápia mind készenléti irányítási és közösségi megerősítő hozzáállás volt a legnagyobb hatékonyságot (azaz absztinencia ráta) és az elfogadhatóság ( azaz a legalacsonyabb lemorzsolódási arány). Az elemzésben megvizsgált egyéb kezelési módok közé tartozott a monoterápia a vészhelyzetek kezelésével vagy a közösség megerősítésével, a kognitív viselkedésterápia , a 12 lépéses programok , a nem kontingens jutalékalapú terápiák, a pszichodinamikus terápia és az ezekkel kapcsolatos egyéb kombinált terápiák.
Ezenkívül a fizikai gyakorlatok neurobiológiai hatásaival kapcsolatos kutatások azt sugallják, hogy a napi aerob testmozgás, különösen az állóképességi gyakorlat (pl. Maratoni futás ), megakadályozza a kábítószer -függőség kialakulását, és hatékony kiegészítő terápia (azaz kiegészítő kezelés) az amfetamin -függőség kezelésére. A testmozgás jobb kezelési eredményekhez vezet, ha kiegészítő kezelésként alkalmazzák, különösen pszichostimuláns függőségek esetén. Az aerob testmozgás különösen csökkenti a pszichostimuláns önbeadást, csökkenti a kábítószer-keresés visszaállítását (azaz visszaesését), és megnöveli a dopamin receptor D 2 (DRD2) sűrűségét a striatumban . Ez ellentétes a kóros stimulánsok alkalmazásával, amelyek a striatális DRD2 sűrűség csökkenését idézik elő. Az egyik felülvizsgálat megállapította, hogy a testmozgás megakadályozhatja a kábítószer-függőség kialakulását is azáltal, hogy megváltoztatja a ΔFosB vagy c-Fos immunreaktivitást a striatumban vagy a jutalomrendszer más részeiben .
| A neuroplaszticitás vagy viselkedési plaszticitás formája |
Erősítő típusa | Források | |||||
|---|---|---|---|---|---|---|---|
| Ópiátok | Pszichostimulánsok | Magas zsírtartalmú vagy cukros ételek | Nemi közösülés |
Fizikai gyakorlat (aerob) |
környezeti dúsítás |
||
|
ΔFosB expresszió a nucleus accumbens D1 típusú MSN - ekben |
↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |
| Viselkedési plaszticitás | |||||||
| A bevitel fokozása | Igen | Igen | Igen | ||||
| Pszichostimuláns keresztérzékenység |
Igen | Nem alkalmazható | Igen | Igen | Csillapított | Csillapított | |
| Pszichostimuláns önigazgatása |
↑ | ↑ | ↓ | ↓ | ↓ | ||
| Pszichostimuláns kondicionált helypreferencia |
↑ | ↑ | ↓ | ↑ | ↓ | ↑ | |
| A drogkereső magatartás visszaállítása | ↑ | ↑ | ↓ | ↓ | |||
| Neurokémiai plaszticitás | |||||||
|
CREB foszforiláció a nucleus accumbensben |
↓ | ↓ | ↓ | ↓ | ↓ | ||
| Érzékeny dopamin válasz a nucleus accumbensben |
Nem | Igen | Nem | Igen | |||
| Megváltozott striatális dopamin jelzés | ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD2 | ↑ DRD2 | ||
| Megváltozott striatális opioid jelzés | Nincs változás vagy ↑ μ-opioid receptorok |
↑ μ-opioid receptorok ↑ κ-opioid receptorok |
↑ μ-opioid receptorok | ↑ μ-opioid receptorok | Nincs változás | Nincs változás | |
| Változások a striatális opioid peptidekben | ↑ dynorphin Nincs változás: enkephalin |
↑ dinorfin | ↓ enkefalint | ↑ dinorfin | ↑ dinorfin | ||
| Mezokortikolimbikus szinaptikus plaszticitás | |||||||
| A dendritek száma a nucleus accumbensben | ↓ | ↑ | ↑ | ||||
|
A gerinc dendritikus sűrűsége a accumbens magban |
↓ | ↑ | ↑ | ||||
Függőség és elvonás
A kábítószer -tolerancia gyorsan fejlődik az amfetaminnal való visszaélésben (azaz a szabadidős amfetaminhasználatban), ezért a hosszan tartó visszaélés időszakai egyre nagyobb dózisú gyógyszert igényelnek ugyanazon hatás elérése érdekében. A Cochrane által az amfetamint és a metamfetamint kényszeresen használó személyekről való elvonásról szóló áttekintés szerint "amikor a krónikus, erős fogyasztók hirtelen abbahagyják az amfetamin-használatot, sokan arról számolnak be, hogy az időbeli korlátozott elvonási szindróma az utolsó adag bevételét követő 24 órán belül jelentkezik". Ez az áttekintés megállapította, hogy a krónikus, nagy dózist szedő betegeknél az elvonási tünetek gyakoriak, az esetek nagyjából 88% -ában fordulnak elő, és 3-4 hétig is fennállnak, és az első héten egy "ütközési" szakasz következik be. Az amfetamin elvonási tünetek közé tartozhat a szorongás, a kábítószer -vágy , a depressziós hangulat , a fáradtság , az étvágy megnövekedése, a fokozott mozgás vagy a csökkent mozgás , a motiváció hiánya, az álmatlanság vagy álmosság, valamint a világos álmok . A felülvizsgálat azt mutatta, hogy az elvonási tünetek súlyossága pozitívan korrelál az egyén életkorával és függőségének mértékével. Az amfetamin -kezelés terápiás dózisainak abbahagyásából eredő enyhe elvonási tünetek elkerülhetők az adag csökkentésével.
Túladagolás
Az amfetamin túladagolása sokféle tünethez vezethet, de megfelelő ellátással ritkán halálos. A túladagolás tüneteinek súlyossága növekszik az adagolással, és csökken az amfetaminnal szembeni tolerancia miatt. A toleráns személyekről ismert, hogy naponta akár 5 gramm amfetamint isznak, ami nagyjából 100 -szorosa a napi maximális terápiás dózisnak. A mérsékelt és rendkívül nagy túladagolás tüneteit az alábbiakban soroljuk fel; a végzetes amfetamin -mérgezés általában görcsöket és kómát is magában foglal . 2013 -ban az amfetamin, a metamfetamin és az " amfetamin -felhasználási zavarban " szerepet játszó egyéb vegyületek túladagolása becslések szerint 3788 halálesetet eredményezett világszerte ( 3425-4155 haláleset, 95% -os megbízhatóság ).
| Rendszer | Kisebb vagy közepes túladagolás | Súlyos túladagolás |
|---|---|---|
| Szív- és érrendszer |
|
|
|
A központi idegrendszerre rendszer |
|
|
| Mozgásszervi |
|
|
| Légzőrendszer |
|
|
| Vizelési |
|
|
| Egyéb |
|
|
Toxicitás
Rágcsálókban és főemlősökben az amfetamin kellően nagy dózisa dopaminerg neurotoxicitást vagy a dopamin neuronok károsodását okozza, amelyet a dopamin terminális degenerációja, valamint a transzporter és a receptor funkció csökkenése jellemez . Nincs bizonyíték arra, hogy az amfetamin közvetlenül neurotoxikus lenne az emberekben. Azonban a nagy dózisú amfetamin közvetett módon dopaminerg neurotoxicitást okozhat a hiperpirexia , a reaktív oxigénfajok túlzott képződése és a dopamin fokozott autoxidációja következtében . A nagy dózisú amfetamin-expozícióból származó neurotoxicitási állatmodellek azt mutatják, hogy a hiperpirexia (azaz a testhőmérséklet ≥ 40 ° C) előfordulása szükséges az amfetamin által kiváltott neurotoxicitás kialakulásához. Az agyhőmérséklet 40 ° C feletti tartós emelkedése valószínűleg elősegíti az amfetamin által kiváltott neurotoxicitás kialakulását laboratóriumi állatokban azáltal, hogy elősegíti a reaktív oxigénfajok termelődését, megzavarja a sejtfehérje működését és átmenetileg növeli a vér-agy gát permeabilitását.
Pszichózis
Az amfetamin túladagolása stimuláló pszichózist eredményezhet, amely különféle tünetekkel járhat, például téveszmékkel és paranoiával. A Cochrane felülvizsgálata az amfetamin, dextroamfetamin és metamfetamin pszichózis kezeléséről azt állítja, hogy a felhasználók körülbelül 5–15% -a nem gyógyul meg teljesen. Ugyanez a felülvizsgálat szerint van legalább egy olyan vizsgálat, amely azt mutatja, hogy az antipszichotikus gyógyszerek hatékonyan oldják meg az akut amfetamin -pszichózis tüneteit. A pszichózis ritkán fordul elő terápiás alkalmazásból.
Gyógyszerkölcsönhatások
Ismeretes, hogy sokféle anyag kölcsönhatásba lép az amfetaminnal, ami megváltoztatja a hatóanyag hatását vagy az amfetamin, a kölcsönhatásban lévő anyag vagy mindkettő metabolizmusát . Az amfetamint metabolizáló enzimek (pl. CYP2D6 és FMO3 ) gátlói meghosszabbítják annak eliminációs felezési idejét , vagyis hatása tovább tart. Az amfetamin kölcsönhatásba lép a MAO -gátlókkal , különösen a monoamin -oxidáz A inhibitorokkal, mivel mind a MAO -gátlók, mind az amfetamin növelik a plazma katekolamin -szintjét (azaz a norepinefrin és a dopamin); ezért mindkettő egyidejű használata veszélyes. Az amfetamin modulálja a legtöbb pszichoaktív szer aktivitását. Az amfetamin különösen csökkentheti a nyugtatók és depresszánsok hatását, és fokozhatja a stimulánsok és antidepresszánsok hatását . Az amfetamin csökkentheti a vérnyomáscsökkentők és az antipszichotikumok hatását is, mivel befolyásolja a vérnyomást és a dopamint. A cink -kiegészítés csökkentheti az amfetamin minimális hatékony dózisát , ha ADHD kezelésére használják.
Általában nincs jelentős kölcsönhatás, ha az amfetamint étellel fogyasztják, de a gyomor -bélrendszeri tartalom és a vizelet pH -értéke befolyásolja az amfetamin felszívódását és kiválasztását . A savas anyagok csökkentik az amfetamin felszívódását és fokozzák a vizelet kiválasztását, a lúgos anyagok pedig az ellenkezőjét teszik. A pH felszívódásra gyakorolt hatása miatt az amfetamin kölcsönhatásba lép a gyomorsav reduktorokkal, például a protonpumpa -gátlókkal és a H 2 antihisztaminokkal , amelyek növelik a gyomor -bélrendszer pH -ját (azaz kevésbé savasítják).
Gyógyszertan
Farmakodinamika
|
Az amfetamin farmakodinamikája egy dopamin neuronban
|
Az amfetamin viselkedési hatásait azáltal fejti ki, hogy megváltoztatja a monoaminok neuronális szignálként való használatát az agyban, elsősorban a katekolamin -neuronokban az agy jutalmazási és végrehajtási funkciói útvonalaiban. A jutalmazási rendszerben és a végrehajtó működésben részt vevő fő neurotranszmitterek, a dopamin és a norepinefrin koncentrációja drámaian, dózisfüggő módon nő az amfetamin által, mivel ez a hatása a monoamin-transzporterekre gyakorol hatást . Az amfetamin megerősítő és motiváló figyelemfelkeltő hatása elsősorban a mezolimbikus útvonal fokozott dopaminerg aktivitásának köszönhető . Az amfetamin eufórikus és mozgásszervi stimuláló hatása attól függ, hogy milyen mértékben és milyen gyorsan növeli a szinaptikus dopamin- és noradrenalin-koncentrációt a striatumban .
Amfetamin már azonosították hatásos teljes agonista a nyomnyi amin-val kapcsolatos receptornak 1 (TAAR1), egy G- s -kapcsolt és G q -kapcsolt G-fehérjéhez kapcsolt receptor (GPCR) fedezték fel 2001-ben, ami fontos a szabályozása agyi monoaminok . A TAAR1 aktiválása növeli a cAMP termelést az adenilil -cikláz aktiválása révén, és gátolja a monoamin transzporter funkciót. A monoamin autoreceptorok (pl. D 2 rövid , preszinaptikus α 2 és preszinaptikus 5-HT 1A ) ellentétes hatást fejtenek ki, mint a TAAR1, és ezek a receptorok együttesen szabályozó rendszert biztosítanak a monoaminok számára. Nevezetesen, az amfetamin és a nyomelemek nagy kötési affinitással rendelkeznek a TAAR1 -hez, de nem a monoamin autoreceptorokhoz. A képalkotó vizsgálatok azt mutatják, hogy az amfetamin és a nyomelemek által okozott monoamin-visszavétel gátlása helyspecifikus, és a TAAR1 együttes lokalizációjának jelenlététől függ a kapcsolódó monoamin neuronokban.
Amellett, hogy a neuronális monoamin transzporterek , amfetamin is gátolja mind vezikuláris monoamin transzporterek , VMAT1 és VMAT2 , valamint a SLC1A1 , SLC22A3 , és SLC22A5 . Az SLC1A1 gerjesztő aminosav-transzporter 3 (EAAT3), a neuronokban elhelyezkedő glutamát-transzporter, az SLC22A3 egy extraneuronális monoamin-transzporter, amely jelen van az asztrocitákban , és az SLC22A5 egy nagy affinitású karnitin- transzporter. Az amfetamin erőteljesen indukálja a kokain és amfetamin által szabályozott transzkript (CART) génexpressziót , egy neuropeptidet , amely részt vesz a táplálkozási viselkedésben, a stresszben és a jutalmazásban, ami megfigyelhető növekedést idéz elő az idegsejtek fejlődésében és túlélésében in vitro . A CART -receptor még azonosításra vár, de jelentős bizonyíték van arra, hogy a CART egyedi G i /G o -csatolású GPCR -hez kötődik . Az amfetamin nagyon nagy dózisokban is gátolja a monoamin -oxidázokat , ami kevesebb monoamin- és nyomkövető amin -anyagcserét eredményez, és ennek következtében magasabb szinaptikus monoamin -koncentrációkat eredményez. Emberben az egyetlen posztszinaptikus receptor, amelynél az amfetamin ismert módon kötődik, az 5-HT1A receptor , ahol agonistaként működik, alacsony mikromoláris affinitással.
A teljes profil amfetamin rövid távú kábítószer hatásokat emberekben többnyire révén származó megnövekedett celluláris kommunikáció vagy neurotranszmisszió a dopamin , a szerotonin , norepinefrin , epinefrin , hisztamin , CART peptideket , endogén opioidok , adrenokortikotrop hormon , kortikoszteroidok , és glutamát , amelynek hatásai révén kölcsönhatások CART , 5-HT 1A , EAAT3 , TAAR1 , VMAT1 , VMAT2 , és esetleg más biológiai célpontokra . Az amfetamin hét humán karboanhidráz enzimet is aktivál , amelyek közül több az emberi agyban expresszálódik.
Dextroamfetamin hatásosabban agonistája TAAR1 mint levoamphetamine. Következésképpen a dextroamfetamin nagyobb központi idegrendszeri stimulációt okoz, mint a levoamfetamin, nagyjából három -négyszer több, de a levoamfetamin valamivel erősebb kardiovaszkuláris és perifériás hatást fejt ki.
Dopamin
Bizonyos agyi régiókban az amfetamin növeli a dopamin koncentrációját a szinaptikus hasadékban . Az amfetamin bejuthat a preszinaptikus neuronba akár DAT -on keresztül, akár közvetlenül a neuronális membránon keresztül diffundálva. A DAT felvétele következtében az amfetamin versenyképes visszavétel gátlást okoz a transzporterben. A preszinaptikus neuronba való belépéskor az amfetamin aktiválja a TAAR1 -et, amely a protein -kináz A (PKA) és a protein -kináz C (PKC) jelátvitel révén DAT -foszforilációt okoz . Bármelyik proteinkináz által végzett foszforiláció a DAT internalizációját eredményezheti ( nem kompetitív újrafelvétel gátlás), de a PKC által közvetített foszforilezés önmagában a DAT-on keresztül történő dopamin-transzport megfordítását (azaz a dopamin- kiáramlást ) idézi elő . Az amfetaminról is ismert, hogy növeli az intracelluláris kalciumot, ami a DAT foszforilációjához kapcsolódik egy azonosítatlan Ca2+/kalmodulin-függő protein-kináz (CAMK) -függő útvonalon keresztül, ami dopamin-kiáramlást eredményez. Közvetlen aktiválása G-fehérjéhez kapcsolt befelé-egyenirányító kálium-csatorna , TAAR1 csökkenti a tüzelési ráta dopamin neuronok, megakadályozza a hiper-dopaminerg állapotban.
Az amfetamin a preszinaptikus vezikuláris monoamin transzporter , a VMAT2 szubsztrátja is . Az amfetamin felvételét követően a VMAT2 -nél az amfetamin a vezikuláris pH -gradiens összeomlását idézi elő, amelynek eredményeként dopamin -molekulák szabadulnak fel a szinaptikus vezikulákból a citoszolba a dopamin -kiáramláson keresztül a VMAT2 -n keresztül. Ezt követően a citoszolikus dopaminmolekulák a preszinaptikus neuronból a szinaptikus hasadékba kerülnek a DAT -on .
Norepinefrin
A dopaminhoz hasonlóan az amfetamin dózisfüggően növeli a szinaptikus norepinefrin szintjét, amely az epinefrin közvetlen előfutára . A neuronális TAAR1 mRNS -expresszió alapján úgy gondolják, hogy az amfetamin a dopaminhoz hasonlóan hat a norepinefrinre. Más szóval, az amfetamin TAAR1 által közvetített effluxot és nem versenyképes újrafelvétel gátlást indukál a foszforilezett NET-nél , a kompetitív NET újrafelvétel gátlást és a norepinefrin felszabadulást a VMAT2-ből .
Szerotonin
Az amfetamin hasonló, de kevésbé kifejezett hatásokat fejt ki a szerotoninra, mint a dopaminra és a noradrenalinra. Az amfetamin a VMAT2 -n keresztül befolyásolja a szerotonint, és a norepinefrinhez hasonlóan úgy gondolják, hogy TAAR1 -en keresztül foszforilálja a SERT -et . A dopaminhoz hasonlóan az amfetamin alacsony, mikromoláris affinitással rendelkezik az emberi 5-HT1A receptorhoz .
Más neurotranszmitterek, peptidek, hormonok és enzimek
| Enzim | K A ( nM ) | Források |
|---|---|---|
| hCA4 | 94 | |
| hCA5A | 810 | |
| hCA5B | 2560 | |
| hCA7 | 910 | |
| hCA12 | 640 | |
| hCA13 | 24100 | |
| hCA14 | 9150 |
Az akut amfetamin -adagolás emberekben növeli az endogén opioid -felszabadulást a jutalmazó rendszer számos agyi struktúrájában . Kimutatták, hogy az agyban az elsődleges gerjesztő neurotranszmitter , a glutamát extracelluláris szintje emelkedik a striatumban az amfetamin expozíciót követően. Ez az extracelluláris glutamát-növekedés feltehetően az EAAT3 , a glutamát-visszavétel transzporter amfetamin által indukált internalizációja révén következik be a dopamin neuronokban. Az amfetamin szintén indukálja a hisztamin szelektív felszabadulását a hízósejtekből és a kiáramlást a hisztaminerg neuronokból a VMAT2 -n keresztül . Az akut amfetamin adagolás emellett növelheti az adrenokortikotrop hormon és a kortikoszteroidok szintjét a vérplazmában a hipotalamusz -agyalapi mirigy -mellékvese tengely stimulálásával .
2017 decemberében publikálták az első tanulmányt, amely az amfetamin és a humán karboanhidráz enzimek kölcsönhatását értékeli ; az általa vizsgált tizenegy karboanhidráz enzim közül azt találta, hogy az amfetamin hatékonyan aktiválja a hetet, amelyek közül négy erősen expresszálódik az emberi agyban , alacsony nanomoláris aktivitással az alacsony mikromoláris aktiváló hatások révén. A preklinikai kutatások alapján az agyi karboanhidráz aktivációnak kogníciójavító hatásai vannak; de, alapuló klinikai alkalmazása karboanhidráz-gátlók , karboanhidráz aktiválás más szövetekben összefüggésben lehet káros hatások, mint például okuláris aktiválási súlyosbítva glaukóma .
Farmakokinetika
Az amfetamin orális biohasznosulása a gasztrointesztinális pH -tól függően változik; jól felszívódik a bélből, és a dextroamfetamin biológiai hozzáférhetősége jellemzően meghaladja a 75% -ot. Amfetamin egy gyenge bázis, amelynek p K egy 9,9; Következésképpen, amikor a pH bázikus, több gyógyszert a megfelelő lipid oldható szabad bázis formájában, és több keresztül szívódik a lipidben gazdag sejtmembránok a bél epitélium . Ezzel szemben a savas pH azt jelenti, hogy a gyógyszer túlnyomórészt vízben oldódó kationos (só) formában van, és kevesebb felszívódik. A véráramban keringő amfetamin körülbelül 20% -a kötődik a plazmafehérjékhez . A felszívódást követően az amfetamin könnyen eloszlik a test legtöbb szövetében, magas koncentrációban az agy -gerincvelői folyadékban és az agyszövetben.
Az amfetamin-enantiomerek felezési ideje eltérő és a vizelet pH-jától függően változik. Normális vizelet-pH mellett a dextroamfetamin és a levoamfetamin felezési ideje 9-11 óra, illetve 11-14 óra. Az erősen savas vizelet 7 órára csökkenti az enantiomer felezési idejét; erősen lúgos vizelet esetén a felezési idő 34 órára nő. Mindkét izomer sóinak azonnali hatóanyag-leadású és elnyújtott hatóanyag-leadású változatai a plazma csúcskoncentrációját a beadás után 3 órával, illetve 7 órával érik el. Amfetamint megszűnt keresztül vesék , a 30-40% a hatóanyag változatlan formában nem ürül normál vizelet pH. Ha a vizelet pH -ja lúgos, az amfetamin szabad bázis formájában van, így kevesebb ürül ki. Ha a vizelet pH -értéke rendellenes, az amfetamin vizelet -visszanyerése az 1% -tól a 75% -ig terjedhet, leginkább attól függően, hogy a vizelet túl lúgos vagy savas. Orális adagolást követően az amfetamin 3 órán belül megjelenik a vizeletben. Az elfogyasztott amfetamin nagyjából 90% -a eliminálódik 3 nappal az utolsó orális adag után.
A lisdexamfetamin prodrug nem annyira érzékeny a pH -ra, mint az amfetamin, amikor felszívódik a gyomor -bél traktusban; követő felszívódását a véráramba, ez alakítja át a vörösvérsejtek -asszociált enzimek a dextroamfetamin keresztül hidrolízis . A lisdexamfetamin eliminációs felezési ideje általában kevesebb, mint 1 óra.
A CYP2D6 , a dopamin-β-hidroxiláz (DBH), a flavint tartalmazó monooxigenáz 3 (FMO3), a butirát-CoA ligáz (XM-ligáz) és a glicin- N- acetiltranszferáz (GLYAT) azok az enzimek, amelyekről ismert, hogy emberekben metabolizálják az amfetamint vagy metabolitjait. Az amfetamin számos kiválasztott anyagcsere-terméket tartalmaz, beleértve a 4-hidroxi-amfetamint , a 4-hidroxinorefedrint , a 4-hidroxi-fenil-acetont , a benzoesavat , a hippursavat , a norefedrint és a fenilacetont . Ezen metabolitok közül az aktív szimpatomimetikumok a 4-hidroxi-amfetamin , a 4-hidroxinorefedrin és a norefedrin. A fő metabolikus utak közé tartozik az aromás para-hidroxilezés, az alifás alfa- és béta-hidroxilezés, az N- oxidáció, az N- alkilezés és a dezaminálás. Az ismert metabolikus utak, kimutatható metabolitok és metabolizáló enzimek emberekben a következők:
|
Az amfetamin metabolikus útvonalai emberekben
|
Farmakokrobiomika
Az emberi metagenom (azaz az egyén genetikai összetétele és az egyén testében vagy azon belül található mikroorganizmusok) jelentősen eltér az egyének között. Mivel az emberi szervezetben található mikrobiális és vírussejtek teljes száma (több mint 100 billió) jelentősen meghaladja az emberi sejtek számát (több tízezer milliárd), jelentős a kölcsönhatás lehetősége a gyógyszerek és az egyén mikrobiomja között, beleértve: az emberi összetételt megváltoztató gyógyszereket mikrobiom , a gyógyszer metabolizmusa a mikrobiális enzimek által, amely módosítja a gyógyszer farmakokinetikai profilját, és a mikrobiális gyógyszer metabolizmus, amely befolyásolja a gyógyszer klinikai hatékonyságát és toxicitási profilját. Az ezen kölcsönhatásokat tanulmányozó terület farmakokrobiomika néven ismert .
A legtöbb biomolekulához és más orálisan beadott xenobiotikumokhoz (azaz gyógyszerekhez) hasonlóan az amfetamin előrejelzése szerint az emberi gasztrointesztinális mikrobiota (elsősorban a baktériumok) kegyetlen metabolizmuson megy keresztül, mielőtt felszívódik a véráramba . 2019-ben azonosították az első amfetamint metabolizáló mikrobiális enzimet, az emberi bélben gyakran előforduló E. coli törzsből származó tyramin-oxidázt . Ez az enzim az amfetamint, a tiramint és a fenetil-amint nagyjából azonos kötési affinitással metabolizálja vegyületek.
Rokon endogén vegyületek
Az amfetamin szerkezete és funkciója nagyon hasonló az endogén nyomelemekhez, amelyek az emberi testben és agyban termelt, természetben előforduló neuromodulátor molekulák. Ebben a csoportban, a legszorosabban rokon vegyületek fenetil-amin , a kiindulási vegyület az amfetamin, és N -methylphenethylamine , egy izomer amfetamin (azaz, hogy van egy azonos molekuláris képlete). Emberben a fenetil-amint közvetlenül az L-fenilalaninból állítja elő az aromás aminosav-dekarboxiláz (AADC) enzim, amely az L-DOPA- t is dopaminná alakítja . Viszont az N -metil -fenetil -amint a fenetil -aminból metabolizálja a fenil -etanol -amin -N -metiltranszferáz , ugyanaz az enzim, amely a norepinefrint epinefrinre metabolizálja. Az amfetaminhoz hasonlóan mind a fenetilamin, mind az N -metil -fenetil -amin szabályozza a monoamin neurotranszmissziót a TAAR1 -en keresztül ; az amfetaminnal ellentétben mindkét anyagot a monoamin-oxidáz B bontja le , ezért felezési ideje rövidebb, mint az amfetaminé.
Kémia
|
Racém amfetamin
|
Fenil-2-nitropropén (jobb csészék)
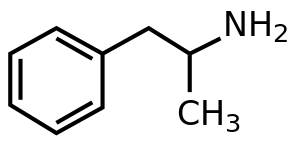
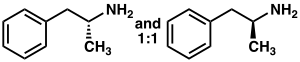
Az amfetamin a C 9 H 13 N kémiai képlettel rendelkező emlős neurotranszmitter fenetil -amin metil -homológja. A szénatom szomszédos primer amin egy sztereogén centrumot , és az amfetamin áll egy racém 1: 1 arányú keveréke a két enantiomer . Ezt a racém keveréket is szét optikai izomerjei: levoamphetamine és dextroamfetamin . Szobahőmérsékleten, a tiszta szabad bázist az amfetamin egy mobil, színtelen, és illékony folyékony egy jellegzetesen erős amin szag, és fanyar, égető íze. Az amfetamin gyakran előállított szilárd sói közé tartozik az amfetamin -adipát, aszpartát, hidroklorid, foszfát, szacharát, szulfát és tannát. A dextroamfetamin -szulfát a legelterjedtebb enantiopure só. Az amfetamin szintén saját szerkezeti osztályának szülővegyülete , amely számos pszichoaktív származékot tartalmaz . A szerves kémia, az amfetamin kitűnő királis ligandum a sztereoszelektív szintézis a 1,1'-bi-2-naftol .
Helyettesített származékok
Az amfetamin helyettesített származékai, vagy "helyettesített amfetaminok" olyan vegyszerek széles skálája, amelyek amfetamint "gerincként" tartalmaznak; kifejezetten ez a kémiai osztály magában foglalja a származékos vegyületeket, amelyek az amfetamin -mag szerkezetében lévő egy vagy több hidrogénatom helyettesítőkkel történő helyettesítésével keletkeznek . Az osztály magában foglalja magát az amfetamint, a stimulánsokat, például a metamfetamint, a szerotoninerg empatogéneket, például az MDMA -t , és a dekongesztánsokat, például az efedrint .
Szintézis
Az első készítmény 1887 -es bejelentése óta számos szintetikus utat fejlesztettek ki az amfetaminhoz. A legális és tiltott amfetamin szintézis leggyakoribb módja a nemfém redukció, amelyet Leuckart-reakciónak neveznek (1. módszer). Első lépésben a fenil -aceton és a formamid közötti reakció , akár további hangyasavat , akár magát a formamidot használva redukálószerként, N -formil -amfetamint eredményez . Ezt a köztiterméket ezután sósavval hidrolizáljuk, majd lúgosítjuk, szerves oldószerrel extraháljuk, töményítjük és desztilláljuk, így a szabad bázist kapjuk. A szabad bázist ezután szerves oldószerben feloldjuk, kénsavat adunk hozzá, és az amfetamin kicsapódik szulfát -sóként.
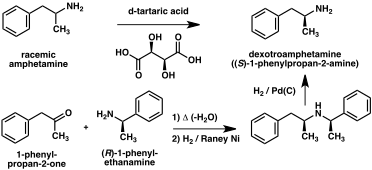
Számos királis felbontást dolgoztak ki az amfetamin két enantiomerjének elválasztására. Így például a racém amfetamin lehet kezelni D- borkősav képeznek diasztereomer sót kapjuk, amelyet frakcionáltan kristályosítjuk, így kapjuk dextroamfetamin. A királis felbontás továbbra is a leggazdaságosabb módszer az optikailag tiszta amfetamin nagy léptékű előállítására. Ezenkívül számos enantioszelektív amfetamin szintézist fejlesztettek ki. Az egyik példában az optikailag tiszta ( R ) -1-fenil-etanamint fenil-acetonnal kondenzálva királis Schiff-bázist kapunk . A kulcslépésben ezt az intermediert katalitikus hidrogénezéssel redukálják , miközben a kiralitás az alfa -szénatomra az aminocsoportba kerül. A benzil -amin kötést hidrogénezéssel hasítva optikailag tiszta dextroamfetamint kapunk.
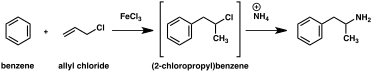
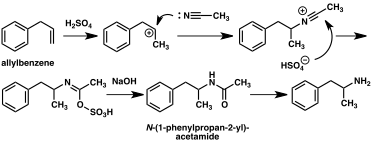
Számos alternatív szintetikus utat fejlesztettek ki az amfetaminhoz klasszikus szerves reakciók alapján. Egy példa erre a Friedel-Crafts- alkilezését benzol által allil-kloridot , így a béta chloropropylbenzene amelyet azután ammóniával reagáltatjuk, racém amfetamin (2. módszer). Egy másik példa a Ritter -reakciót alkalmazza (3. módszer). Ebben az útvonalat, allylbenzene reagáltatjuk acetonitrilben kénsavval, így egy organoszulfát ami viszont kezelünk nátrium-hidroxidot adunk, hogy az amfetamin keresztül acetamid közbenső. Egy harmadik útvonalon kezdődik etil-3-oxo-butanoát , amely egy kettős alkilezést végzünk metil-jodid , majd benzil-kloridot lehet alakítani 2-metil-3-fenil-propánsav -ecetsav. Ez a szintetikus köztitermék átalakítható amfetaminná Hofmann vagy Curtius átrendeződés alkalmazásával (4. módszer).
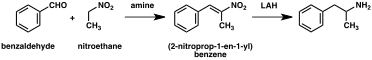
Jelentős számú amfetamin szintézisek jellemzője a csökkentését egy nitrocsoport , imin , oxim , vagy más nitrogéntartalmú funkciós csoportokat . Egy ilyen példában egy Knoevenagel kondenzációs a benzaldehid és nitro-etán hozamok fenil-2-nitro-propén . Ennek a köztiterméknek a kettős kötését és nitrocsoportját redukáljuk katalitikus hidrogénezéssel vagy lítium -alumínium -hidriddel (5. módszer). Egy másik módszer a fenil -aceton ammóniával való reakciója , amin köztitermék képződése, amelyet primer aminná redukálnak hidrogén alkalmazásával palládium katalizátor vagy lítium -alumínium -hidrid felett (6. módszer).
|
|
|
Észlelés a testnedvekben
Az amfetamint gyakran mérik a vizeletben vagy a vérben a sport, a foglalkoztatás, a mérgezési diagnosztika és a kriminalisztika kábítószer -tesztjének részeként . Az olyan technikák, mint az immunvizsgálat , amely az amfetamin teszt leggyakoribb formája, keresztreakcióba léphetnek számos szimpatomimetikus gyógyszerrel. Az amfetaminra jellemző kromatográfiás módszereket alkalmazzák a hamis pozitív eredmények megelőzésére. Királis elválasztási technikák alkalmazhatók a gyógyszer forrásának megkülönböztetésére, legyen szó vényköteles amfetaminról, vényköteles amfetamin prodrugokról (pl. Szelegilin ), levometamfetamint tartalmazó vény nélkül kapható gyógyszerekről vagy tiltott módon előállított helyettesített amfetaminokról. Számos vényköteles gyógyszerek előállítására amfetamin, mint egy metabolit , köztük benzfetamin , klobenzorex , famprofazone , fenproporex , lisdexamfetamine , mezokarb , metamfetamin, prenylamin és szelegilin , többek között. Ezek a vegyületek pozitív eredményeket hozhatnak az amfetaminra vonatkozóan a drogteszteken. Az amfetamin általában csak egy szokásos gyógyszervizsgálattal mutatható ki körülbelül 24 órán keresztül, bár nagy dózis 2-4 napig is kimutatható .
A vizsgálatokhoz egy tanulmány megállapította, hogy az amfetamin és a metamfetamin enzimszaporított immunoassay technikája (EMIT) több hamis pozitív eredményt eredményezhet, mint a folyadékkromatográfia - tandem tömegspektrometria . Az amfetamin és a metamfetamin gázkromatográfiás tömegspektrometriája (GC-MS) a származékképző szerrel ( S )-(-)-trifluor - acetil - prolil- kloriddal lehetővé teszi a metamfetamin kimutatását a vizeletben. Az amfetamin és metamfetamin GC – MS -je a királis származékképző szerrel, Mosher -sav -kloriddal lehetővé teszi mind a dextroamfetamin, mind a dextrometamfetamin kimutatását a vizeletben. Ezért az utóbbi módszer használható olyan mintákon, amelyek pozitív eredményt mutatnak más módszerek segítségével, hogy segítsenek megkülönböztetni a gyógyszer különböző forrásait.
Történelem, társadalom és kultúra
| Anyag | A legjobb becslés |
Alacsony becslés |
Magas becslés |
|---|---|---|---|
| Amfetamin típusú stimulánsok |
34.16 | 13.42 | 55.24 |
| Kannabisz | 192,15 | 165,76 | 234,06 |
| Kokain | 18.20 | 13,87 | 22,85 |
| Eksztázis | 20.57 | 8,99 | 32,34 |
| Ópiátok | 19.38 | 13,80 | 26.15 |
| Opioidok | 34.26 | 27.01 | 44,54 |
Az amfetamint először 1887 -ben Németországban szintetizálta Lazăr Edeleanu román vegyész, aki fenilizopropilaminnak nevezte el ; serkentő hatása 1927 -ig ismeretlen maradt, amikor Gordon Alles önállóan újraszintetizálta, és szimpatomimetikus tulajdonságokkal rendelkezett. Az amfetaminnak 1933 végéig nem volt orvosi haszna, amikor Smith, Kline és French inhalátorként kezdték eladni Benzedrine márkanéven, mint dekongestáns. A benzedrin -szulfátot 3 évvel később vezették be, és különféle egészségügyi állapotok kezelésére használták , többek között a narkolepsziát , az elhízást , az alacsony vérnyomást , az alacsony libidót és a krónikus fájdalmat . A második világháború alatt az amfetamint és a metamfetamint mind a szövetséges, mind a tengelyi erők széles körben használták stimuláló és teljesítménynövelő hatásuk miatt. Amint a kábítószer addiktív tulajdonságai ismertté váltak, a kormányok szigorú ellenőrzést kezdtek alkalmazni az amfetamin értékesítésére. Például az 1970 -es évek elején az Egyesült Államokban az amfetamin az ellenőrzött anyagokról szóló törvény értelmében a II . A kormány szigorú ellenőrzése ellenére az amfetamint legálisan vagy tiltottan használták különböző háttérrel rendelkező emberek, köztük szerzők, zenészek, matematikusok és sportolók.
Az amfetamint még ma is illegálisan szintetizálják titkos laboratóriumokban, és a feketepiacon értékesítik , elsősorban európai országokban. Az Európai Unió (EU) tagállamai közül 2018 -ban 11,9 millió 15–64 éves felnőtt használt életében legalább egyszer amfetamint vagy metamfetamint, 1,7 millió pedig az elmúlt évben. 2012 során körülbelül 5,9 tonna tiltott amfetamint foglaltak le az EU tagállamaiban; Az „utcai ára” tiltott amfetamint az Európai Unión belül mozgott € 6-38 gramm ugyanezen időszak alatt. Európán kívül az amfetamin tiltott piaca sokkal kisebb, mint a metamfetamin és az MDMA piaca.
Jogi státusz
Az Egyesült Nemzetek Pszichotróp anyagokról szóló 1971. évi egyezményének eredményeként az amfetamin a szerződésben meghatározottak szerint a II. Táblázat szerinti szabályozott anyaggá vált mind a 183 államban. Következésképpen a legtöbb országban szigorúan szabályozott. Néhány ország, például Dél -Korea és Japán, még orvosi használatra is betiltotta a helyettesített amfetaminokat. Más országokban, például Kanadában ( I. ütemterv szerinti gyógyszer ), Hollandiában ( I. listás gyógyszer ), az Egyesült Államokban ( II. Ütemterv szerinti gyógyszer ), Ausztráliában ( 8. ütemterv ), Thaiföldön ( 1. kategória kábítószer ) és Egyesült Királyságban ( B osztályú gyógyszer) ), az amfetamin korlátozott nemzeti kábítószer -ütemtervben szerepel, amely lehetővé teszi gyógyszerként történő alkalmazását.
Gyógyszerészeti termékek
Számos jelenleg forgalmazott amfetamin készítmény mindkét enantiomert tartalmazza, beleértve azokat is, amelyeket Adderall, Adderall XR, Mydayis, Adzenys ER, Adzenys XR-ODT , Dyanavel XR, Evekeo és Evekeo ODT márkanév alatt forgalmaznak. Ezek közül az Evekeo (beleértve az Evekeo ODT -t is) az egyetlen olyan termék, amely csak racém amfetamint tartalmaz (amfetamin -szulfát formájában), és ezért az egyetlen, amelynek aktív része pontosan "amfetamin" -nak nevezhető. Dextroamfetamin forgalmazott márkanevek alatt Dexedrine és Zenzedi, az egyetlen enantiornertiszta amfetamin termék jelenleg elérhető. A dextroamfetamin prodrug formája, a lisdexamfetamin szintén elérhető, és Vyvanse márkanéven forgalmazzák. Mivel prodrug, a lisdexamfetamin szerkezetileg különbözik a dextroamfetamintól, és inaktív mindaddig, amíg dextroamfetaminná nem metabolizálódik. A racém amfetamin szabad bázisa korábban Benzedrine, Psychedrine és Sympatedrine volt. A levoamfetamin korábban Cydril néven volt kapható. Sok jelenlegi amfetamin gyógyszerkészítmény só a szabad bázis viszonylag nagy illékonysága miatt. A szabad bázisból álló orális szuszpenziót és az orálisan széteső tabletta (ODT) dózisformákat azonban 2015 -ben, illetve 2016 -ban vezették be. Az alábbiakban felsorolunk néhány jelenlegi márkát és általános megfelelőiket.
| Márka neve |
Egyesült Államok elfogadott neve |
(D: L) arány |
Adagolási forma |
A marketing kezdő dátuma |
Amerikai fogyasztói áradatok |
Források |
|---|---|---|---|---|---|---|
| Adderall | - | 3: 1 (sók) | tabletta | 1996 | GoodRx | |
| Adderall XR | - | 3: 1 (sók) | kapszula | 2001 | GoodRx | |
| Mydayis | - | 3: 1 (sók) | kapszula | 2017 | GoodRx | |
| Adzenys ER | amfetamin | 3: 1 (alap) | felfüggesztés | 2017 | GoodRx | |
| Adzenys XR-ODT | amfetamin | 3: 1 (alap) | ODT | 2016 | GoodRx | |
| Dyanavel XR | amfetamin | 3.2: 1 (alap) | felfüggesztés | 2015 | GoodRx | |
| Evekeo | amfetamin -szulfát | 1: 1 (sók) | tabletta | 2012 | GoodRx | |
| Evekeo ODT | amfetamin -szulfát | 1: 1 (sók) | ODT | 2019 | GoodRx | |
| Dexedrine | dextroamfetamin -szulfát | 1: 0 (sók) | kapszula | 1976 | GoodRx | |
| Zenzedi | dextroamfetamin -szulfát | 1: 0 (sók) | tabletta | 2013 | GoodRx | |
| Vyvanse | lisdexamfetamin -dimesilát | 1: 0 (prodrug) | kapszula | 2007 | GoodRx | |
| tabletta |
| drog | képlet |
molekulatömeg |
amfetamin bázis |
amfetamin bázis egyenlő adagokban |
dózisok mellett egyenlő bázissal tartalommal |
|||||
|---|---|---|---|---|---|---|---|---|---|---|
| (g/mol) | (százalék) | (30 mg -os adag) | ||||||||
| teljes | bázis | teljes | dextro- | lévo- | dextro- | lévo- | ||||
| dextroamfetamin -szulfát | (C 9 H 13 N) 2 • H 2 SO 4 |
368,49
|
270,41
|
73,38%
|
73,38%
|
-
|
22,0 mg
|
-
|
30,0 mg
|
|
| amfetamin -szulfát | (C 9 H 13 N) 2 • H 2 SO 4 |
368,49
|
270,41
|
73,38%
|
36,69%
|
36,69%
|
11,0 mg
|
11,0 mg
|
30,0 mg
|
|
| Adderall |
62,57%
|
47,49%
|
15,08%
|
14,2 mg
|
4,5 mg
|
35,2 mg
|
||||
| 25% | dextroamfetamin -szulfát | (C 9 H 13 N) 2 • H 2 SO 4 |
368,49
|
270,41
|
73,38%
|
73,38%
|
-
|
|||
| 25% | amfetamin -szulfát | (C 9 H 13 N) 2 • H 2 SO 4 |
368,49
|
270,41
|
73,38%
|
36,69%
|
36,69%
|
|||
| 25% | dextroamfetamin -szacharát | (C 9 H 13 N) 2 • C 6 H 10 O 8 |
480,55
|
270,41
|
56,27%
|
56,27%
|
-
|
|||
| 25% | amfetamin -aszpartát -monohidrát | (C 9 H 13 N) • C 4 H 7 NO 4 • H 2 O |
286,32
|
135,21
|
47,22%
|
23,61%
|
23,61%
|
|||
| lisdexamfetamin -dimesilát | C 15 H 25 N 3 O • (CH 4 O 3 S) 2 |
455,49
|
135,21
|
29,68%
|
29,68%
|
-
|
8,9 mg
|
-
|
74,2 mg
|
|
| amfetamin alapú szuszpenzió | C 9 H 13 N |
135,21
|
135,21
|
100%
|
76,19%
|
23,81%
|
22,9 mg
|
7,1 mg
|
22,0 mg
|
|
Megjegyzések
- Kép legenda
Referencia megjegyzések
Hivatkozások
Külső linkek
- "Amfetamin" . Gyógyszerinformációs portál . Egyesült Államok Nemzeti Orvostudományi Könyvtára.
- CID 5826, a PubChem - dextroamfetamin
- CID 32893 , PubChem - Levoamphetamine
- Összehasonlító Toxicogenomics Adatbázis -bejegyzés: Amfetamin
- Összehasonlító Toxicogenomics Adatbázis -bejegyzés: CARTPT