mellrák -Breast cancer
| Mellrák | |
|---|---|
 | |
| Az emlőrák illusztrációja | |
| Különlegesség | Onkológia |
| Tünetek | Csomó a mellben, a mell alakjának megváltozása, bőrgödröcskék, folyadék a mellbimbóból , újonnan kifordított mellbimbó, vörös, pikkelyes bőrfolt a mellen |
| Kockázati tényezők | Női lét, elhízás , mozgáshiány, alkohol, hormonpótló terápia menopauza idején , ionizáló sugárzás , korai életkor az első menstruációnál , gyermekvállalás későn vagy egyáltalán nem, idősebb kor, korábbi mellrák, emlőrák a családban, Klinefelter szindróma |
| Diagnosztikai módszer | Szövetbiopszia Mamográfia |
| Kezelés | Sebészet, sugárterápia , kemoterápia , hormonterápia , célzott terápia |
| Prognózis | Az ötéves túlélési arány ≈85% (USA, Egyesült Királyság) |
| Frekvencia | 2,2 millió érintett (globális, 2020) |
| Halálozások | 685 000 (globális, 2020) |
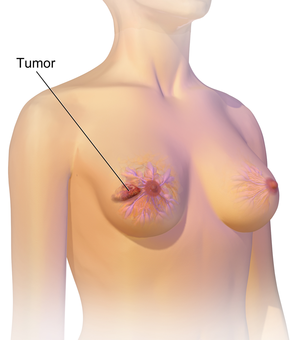
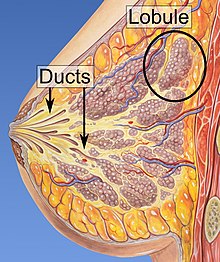
Az emlőrák olyan rák , amely a mellszövetből fejlődik ki . Az emlőrák jelei lehetnek egy csomó a mellben, az emlő alakjának megváltozása, a bőr gödröcskéi , a tej kilökődése , a mellbimbóból kilépő folyadék , az újonnan kifordított mellbimbó vagy egy vörös vagy pikkelyes bőrfolt. Azoknál, akiknél a betegség távolról is elterjedt , előfordulhat csontfájdalom , nyirokcsomó -duzzanat , légszomj vagy sárga bőr .
Az emlőrák kialakulásának kockázati tényezői közé tartozik az elhízás , a testmozgás hiánya , az alkoholizmus , a menopauza alatti hormonpótló terápia , az ionizáló sugárzás , az első menstruáció korai életkora , a késői életkorban vagy egyáltalán nem vállalt gyermekvállalás, az idősebb kor, a korábbi anamnézis mellrák, és a családban előfordult emlőrák. Az esetek körülbelül 5-10%-a öröklött genetikai hajlam eredménye, beleértve többek között a BRCA mutációkat . Az emlőrák leggyakrabban a tejcsatornák nyálkahártyájából és az ezeket tejjel ellátó lebenyekből származó sejtekben alakul ki. A csatornákból kifejlődő rákokat ductalis karcinómáknak , míg a lebenyekből fejlődő rákot lebenyes karcinómáknak nevezik . Az emlőráknak több mint 18 egyéb altípusa van. Egyesek, például a ductalis karcinóma in situ , preinvazív elváltozásokból alakulnak ki . Az emlőrák diagnózisát az érintett szövetből vett biopszia igazolja. A diagnózis felállítása után további vizsgálatokat végeznek annak megállapítására, hogy a rák átterjedt-e a mellen, és mely kezelések a leghatékonyabbak.
A mellrákszűrés előnyeinek és ártalmainak egyensúlya ellentmondásos. Egy 2013-as Cochrane-felülvizsgálat megállapította, hogy nem világos, hogy a mammográfiás szűrés többet árt-e, mint használ, mivel a pozitív eredményt mutató nők nagy része nem szenved ebben a betegségben. Az US Preventive Services Task Force 2009-es felülvizsgálata bizonyítékot talált a 40 és 70 év közötti korosztály előnyeire, és a szervezet kétévente javasolja az 50 és 74 év közötti nők szűrését. A tamoxifen vagy a raloxifen gyógyszerek az emlőrák megelőzésére használhatók azoknál, akiknél nagy a kockázata annak kialakulásának. Mindkét mell műtéti eltávolítása egy másik megelőző intézkedés néhány magas kockázatú nő esetében. Azoknál, akiknél rákot diagnosztizáltak, számos kezelés alkalmazható, beleértve a műtétet, a sugárterápiát , a kemoterápiát , a hormonterápiát és a célzott terápiát . A műtét típusai a mellmegtartó műtéttől a mastectomiáig változnak . Az emlő rekonstrukciója történhet a műtét idején vagy egy későbbi időpontban. Azoknál, akiknél a rák átterjedt a test más részeire, a kezelések többnyire az életminőség és a kényelem javítását célozzák.
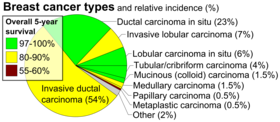
Az emlőrák kimenetele a rák típusától, a betegség mértékétől és a személy életkorától függően változik. Az ötéves túlélési arány Angliában és az Egyesült Államokban 80 és 90% között van. A fejlődő országokban az ötéves túlélési arány alacsonyabb. Világszerte a mellrák a nők körében vezető ráktípus, az összes eset 25%-át teszi ki. 2018-ban 2 millió új esetet és 627 000 halálesetet okozott. Gyakrabban fordul elő a fejlett országokban, és több mint 100-szor gyakoribb a nőknél, mint a férfiaknál .
jelek és tünetek
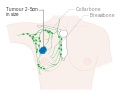
Az emlőrák leggyakrabban csomóként jelenik meg, amely különbözik a mellszövet többi részétől. Az esetek több mint 80%-át akkor fedezik fel, amikor egy személy ujjbeggyel észlel egy ilyen csomót. A legkorábbi emlőrákokat azonban mammográfiás vizsgálat fedezi fel . A hónaljban található nyirokcsomókban található csomók mellrákra is utalhatnak.
Az emlőrák egyéb jelei lehetnek a csomóktól eltérő megvastagodás, az egyik mell nagyobb vagy alacsonyabb lesz, a mellbimbó helyzetének vagy alakjának megváltozása vagy befordulása, a bőr felpörögése vagy begödröcskézése, kiütés a mellbimbón vagy körülötte, váladékozás mellbimbó/bimbók, állandó fájdalom a mell vagy a hónalj egy részén és duzzanat a hónalj alatt vagy a kulcscsont körül. A fájdalom (" mastodynia ") megbízhatatlan eszköz az emlőrák jelenlétének vagy hiányának meghatározásában, de más emlő-egészségügyi problémákra is utalhat .
Az emlőrák másik tünetegyüttese a Paget-féle emlőbetegség . Ez a szindróma ekcémára emlékeztető bőrelváltozások formájában jelentkezik; mint például a mellbimbó bőrének vörössége, elszíneződése vagy enyhe hámlása. Ahogy a Paget-kór előrehalad, a tünetek közé tartozhat bizsergés, viszketés, fokozott érzékenység, égő érzés és fájdalom. A mellbimbóból is váladék keletkezhet. A Paget-kórral diagnosztizált nők körülbelül felének szintén van csomója a mellben.
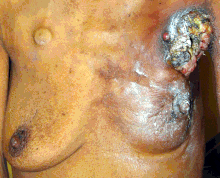
A gyulladásos emlőrák az emlőrák ritka (csak az emlőrák diagnózisának kevesebb mint 5%-ában fordul elő), de agresszív formája, amelyet a mell tetején kialakuló duzzadt, vörös területek jellemeznek. A gyulladásos emlőrák vizuális hatásai a nyirokerek rákos sejtek általi elzáródásának eredménye. Az ilyen típusú emlőrákot gyakrabban diagnosztizálják fiatalabb korú nőknél, elhízott nőknél és afro-amerikai nőknél. Mivel a gyulladásos emlőrák nem csomós formában jelenik meg, néha késhet a diagnózis.
Az emlőszekréciós karcinóma (MSC) a szekréciós karcinómák ritka formája , amely kizárólag az emlőben fordul elő. Általában felnőtteknél alakul ki, de az esetek jelentős százalékában gyermekeket is érint: az MSC az összes gyermekkori emlőrák 80%-át teszi ki. Az MSC elváltozások jellemzően lassan növekvő, fájdalommentes, kis méretű duktális emlődaganatok , amelyek behatoltak a kiindulási csatornáik körüli szövetbe , gyakran átterjednek az őrnyirokcsomókra és/vagy hónaljnyirokcsomókra , de ritkán metasztatizálódnak távoli szövetekbe. Ezek a daganatok jellemzően jellegzetes mikroszkópos jellemzőkkel és tumorsejtekkel rendelkeznek, amelyek kiegyensúlyozott genetikai transzlokációt hordoznak , amelyben az NTRK3 gén egy része az ETV6 gén egy részéhez fuzionálva egy fúziós gént , az ETV6-NTRK3-at alkot . Ez a fúziós gén egy ETV6-NTRK3 nevű kiméra fehérjét kódol . Az ETV6-NTRK3 fehérje NTRK3 része fokozottan szabályozott tirozin kináz aktivitással rendelkezik, amely két jelátviteli útvonalat, a PI3K/AKT/mTOR és MAPK/ERK útvonalat stimulálja , amelyek elősegítik a sejtproliferációt és a túlélést, és ezáltal hozzájárulhatnak az MSC kialakulásához. A konzervatív műtét, a módosított radikális mastectomia és a radikális mastectomia volt a leggyakrabban alkalmazott eljárás a felnőttek kezelésére, míg az egyszerű mastectomiát, az őrszem nyirokcsomó -biopsziával végzett helyi kimetszést és a teljes hónalj disszekciót javasolták az MSC-ben szenvedő gyermekek kezelésére. Minden esetben javasolt a hosszú távú, pl.>20 év feletti ellenőrző vizsgálatok. Az MSC viszonylag ritka esetei, amelyek távoli szövetekre metasztatizáltak, alig vagy egyáltalán nem reagáltak a kemoterápiára és a sugárterápiára. Három metasztatikus betegségben szenvedő beteg részlegesen jól reagált az entrektinibre , egy olyan gyógyszerre, amely gátolja az ETV6-NTRK3 fúziós fehérje tirozin kináz aktivitását. Lassú növekedése és a távoli szövetekbe történő áttétek alacsony aránya miatt az MSC-ben szenvedő betegek 20 éves túlélési aránya 93,16%.
Ritka esetekben, ami kezdetben fibroadenómának ( kemény, mozgatható, nem rákos csomónak) tűnik, valójában egy phyllodes-daganat lehet . A Phyllodes daganatok az emlő strómájában (kötőszövetében) képződnek , és mirigyes és stromaszövetet is tartalmaznak. A Phyllodes-daganatok nem a szokásos értelemben vett szakaszok; mikroszkóp alatti megjelenésük alapján jóindulatúak, határesetek vagy rosszindulatúak.
A rosszindulatú daganatok metasztatikus daganatokat eredményezhetnek – másodlagos (az elsődleges daganatból származó) daganatokat, amelyek a keletkezés helyén túlra terjednek. Az áttétes emlőrák által okozott tünetek a metasztázis helyétől függenek. A metasztázis gyakori helyei a csont, a máj, a tüdő és az agy. Amikor a rák ilyen invazív állapotot ért el, a 4. stádiumú rák kategóriába sorolják, az ilyen állapotú rákok gyakran végzetesek. A 4. stádiumú rák gyakori tünetei közé tartozik a megmagyarázhatatlan fogyás, csont- és ízületi fájdalom, sárgaság és neurológiai tünetek. Ezeket a tüneteket nem specifikus tüneteknek nevezzük, mert sok más betegség megnyilvánulása lehet. Ritkán az emlőrák rendkívül ritka helyekre terjedhet, például a peripancreas nyirokcsomókra, ami epeúti elzáródást okoz, ami diagnosztikai nehézségekhez vezet.
Az emlőbetegségek legtöbb tünete, beleértve a legtöbb csomót is, nem jelenti a mögöttes emlőrákot. A csomók kevesebb, mint 20%-a például rákos, és a jóindulatú emlőbetegségek, mint például a tőgygyulladás és az emlő fibroadenómája , gyakoribb okai az emlőbetegség tüneteinek.
Kockázati tényezők
A kockázati tényezők két csoportra oszthatók:
- módosítható kockázati tényezők (olyan dolgok, amelyeket az emberek maguk is megváltoztathatnak, mint például az alkoholos italok fogyasztása), és
- rögzített kockázati tényezők (olyan dolgok, amelyeken nem lehet változtatni, mint például az életkor és a fiziológiai nem).
Az emlőrák elsődleges kockázati tényezői a nők és az idősebb kor. További lehetséges kockázati tényezők közé tartozik a genetika, a gyermekvállalás hiánya vagy a szoptatás hiánya, bizonyos hormonok magasabb szintje, bizonyos táplálkozási szokások és az elhízás. Egy tanulmány szerint a fényszennyezés kockázati tényezője a mellrák kialakulásának.
Ha minden felnőtt a lehető legegészségesebb életmódot folytatná, beleértve az alkoholtartalmú italok mellőzését , az egészséges testösszetétel fenntartását , a dohányzást , az egészséges táplálkozást és egyéb tevékenységeket, akkor világszerte a mellrákos esetek csaknem negyede megelőzhető lenne. Az emlőrákos esetek fennmaradó háromnegyede nem előzhető meg életmódváltással.
Életmód

Az alkoholtartalmú italok fogyasztása növeli az emlőrák kockázatát , még a nagyon enyhe alkoholfogyasztók körében is (a nők napi egy alkoholos ital kevesebb mint felét isznak). A kockázat a nagyivók körében a legmagasabb. Világszerte minden tizedik emlőrákot az okozza, hogy a nők alkoholos italokat fogyasztanak. Az alkoholtartalmú italok fogyasztása az egyik leggyakoribb módosítható kockázati tényező.
Az elhízás és a mellrák közötti összefüggés minden, csak nem lineáris. A tanulmányok azt mutatják, hogy azok, akik felnőttkorukban gyorsan híznak, nagyobb kockázatnak vannak kitéve, mint azok, akik gyermekkoruk óta túlsúlyosak. Hasonlóképpen, úgy tűnik, hogy a középső részben lévő zsírtöbblet nagyobb kockázatot jelent, mint az alsó testben hordozott túlsúly. Ez azt jelenti, hogy az elfogyasztott étel nagyobb jelentőséggel bír, mint a BMI . A kockázatot növelő táplálkozási tényezők közé tartozik a magas zsírtartalmú étrend és az elhízással összefüggő magas koleszterinszint . Az étrendi jódhiány is szerepet játszhat. A rostokra vonatkozó bizonyítékok nem egyértelműek. Egy 2015-ös áttekintés azt találta, hogy a rostbevitel és az emlőrákkal összefüggésbe hozható vizsgálatok vegyes eredményeket hoztak. 2016-ban kísérleti összefüggést figyeltek meg a serdülőkori alacsony rostbevitel és a mellrák között.
Úgy tűnik, hogy a dohányzás növeli a mellrák kockázatát, minél nagyobb mennyiségben szívják el, és minél korábban kezdték el a dohányzást, annál nagyobb a kockázat. Azoknál, akik tartósan dohányoznak, a relatív kockázat 35%-ról 50%-ra nő.
A fizikai aktivitás hiányát az esetek körülbelül 10%-ához kötik. A hosszan tartó rendszeres ülések magasabb mellrákos halálozási arányt jelentenek. A kockázatot a rendszeres testmozgás sem tagadja, bár csökkenti.
A menopauza kezelésére szolgáló hormonterápia az emlőrák fokozott kockázatával is összefüggésben áll. A hormonális fogamzásgátlók alkalmazása a legtöbb nőnél nem okoz mellrákot; ha van hatása, akkor csekély (nagyságrendileg 0,01% felhasználó-évenként; összehasonlítható az Egyesült Államok anyai halálozási arányával ), átmeneti, és ellensúlyozza a felhasználóknál a petefészek- és méhnyálkahártyarákok jelentősen csökkentett kockázatát. . Azoknál, akiknek családjában előfordult emlőrák, úgy tűnik, hogy a modern orális fogamzásgátlók használata nem befolyásolja az emlőrák kockázatát. Kevésbé biztos, hogy a hormonális fogamzásgátlók növelhetik-e az emlőrák már amúgy is magas arányát azoknál a nőknél, akiknél a BRCA1 vagy BRCA2 emlőrák-érzékenységi gén mutációja van .
A szoptatás csökkenti számos ráktípus, köztük a mellrák kockázatát. Az 1980-as években az abortusz-emlőrák hipotézis azt állította, hogy az indukált abortusz növeli a mellrák kialakulásának kockázatát. Ez a hipotézis kiterjedt tudományos vizsgálat tárgyát képezte, amely arra a következtetésre jutott, hogy sem a vetélések , sem az abortuszok nem járnak együtt a mellrák fokozott kockázatával.
Egyéb kockázati tényezők közé tartozik a sugárzás és a cirkadián zavarok, amelyek a műszakos munkával és a rutin késő esti étkezéssel kapcsolatosak . Számos vegyi anyag is összefüggésbe hozható, beleértve a poliklórozott bifenileket , policiklusos aromás szénhidrogéneket és szerves oldószereket . Bár a mammográfiás sugárzás alacsony dózisú, a becslések szerint a 40-80 éves kor közötti éves szűrés körülbelül 225 halálos esetet okoz. emlőrák egymillió szűrt nőre.
Genetika
Úgy gondolják, hogy az esetek 5-10%-ának elsődleges oka a genetika. Azoknál a nőknél, akiknek anyját 50 éves koruk előtt diagnosztizálták, 1,7-tel, azoknál a nőknél pedig, akiknél 50 évesen vagy azután diagnosztizálták, 1,4-gyel. A nulla, egy vagy két érintett hozzátartozóknál az emlőrák kockázata 80 éves kor előtt 7,8%, 13,3% és 21,1%, a későbbi halálozás pedig 2,3%, 4,2% és 7,6%. Azoknál, akiknek elsőfokú hozzátartozójuk van a betegségben, a mellrák kockázata 40 és 50 év között kétszerese az általános népességnek.
Az esetek kevesebb mint 5%-ában a genetika jelentősebb szerepet játszik az örökletes emlő-petefészekrák szindróma előidézésében . Ide tartoznak azok is, akik a BRCA1 és BRCA2 génmutációt hordozzák . Ezek a mutációk a teljes genetikai befolyás 90%-át teszik ki, és az érintetteknél 60-80%-os az emlőrák kockázata. További jelentős mutációk a p53 ( Li-Fraumeni-szindróma ), PTEN ( Cowden-szindróma ) és STK11 ( Peutz-Jeghers-szindróma ), CHEK2 , ATM , BRIP1 és PALB2 . 2012-ben a kutatók azt mondták, hogy az emlőráknak négy genetikailag elkülönülő típusa van, és mindegyik típusnál a jellegzetes genetikai változások sok rákhoz vezetnek.
Egyéb genetikai hajlamok közé tartozik a mellszövet sűrűsége és a hormonális szint. A sűrű mellszövettel rendelkező nők nagyobb valószínűséggel kapnak daganatokat, és kevésbé valószínű, hogy mellrákot diagnosztizálnak náluk – mivel a sűrű szövet miatt a daganatok kevésbé láthatók a mammográfiás felvételeken. Ezenkívül a természetesen magas ösztrogén- és progeszteronszinttel rendelkező nőknél nagyobb a daganat kialakulásának kockázata.
Egészségi állapot
Az olyan emlőelváltozások, mint az atipikus duktális hiperplázia és az in situ lebenyes karcinóma , amelyek jóindulatú emlőbetegségekben, például fibrocisztás emlőelváltozásokban fordulnak elő , összefüggésben állnak a megnövekedett emlőrák kockázatával.
A diabetes mellitus szintén növelheti az emlőrák kockázatát. Úgy tűnik , hogy az autoimmun betegségek, mint például a lupus erythematosus is növelik a mellrák kialakulásának kockázatát.
A szórványos emlőrák fő okai a hormonszinttel kapcsolatosak. A mellrák kialakulását az ösztrogén segíti elő. Ez a hormon aktiválja a mell fejlődését a pubertás, a menstruációs ciklus és a terhesség alatt. Az ösztrogén és a progeszteron közötti egyensúly felborulása a menstruációs fázis során sejtproliferációt okoz. Ezenkívül az ösztrogén oxidatív metabolitjai növelhetik a DNS-károsodást és a mutációkat. Az ismételt ciklus és a javítási folyamat károsodása egy normál sejtet pre-malignus és végül rosszindulatú sejtté alakíthat mutáció révén. A premalignus stádiumban a stromasejtek magas proliferációja aktiválható ösztrogénnel, hogy támogassa az emlőrák kialakulását. A ligandumkötő aktiválás során az ER szabályozhatja a génexpressziót azáltal, hogy kölcsönhatásba lép az ösztrogén válaszelemekkel a specifikus gének promoterében. Az ösztrogénhiány miatti ER expressziója és aktiválása extracelluláris jelekkel stimulálható. Érdekes módon a számos fehérjéhez, köztük a növekedési faktor receptorokhoz közvetlenül kötődő ER elősegítheti a sejtnövekedéssel és túléléssel kapcsolatos gének expresszióját.
A vér emelkedett prolaktinszintje a mellrák fokozott kockázatával jár. A több mint kétmillió emberrel végzett megfigyeléses kutatás metaanalízise az antipszichotikumok használatának mérsékelt összefüggésére utalt az emlőrákkal, amelyet valószínűleg specifikus szerek prolaktin-indukáló tulajdonságai közvetítenek.
Kórélettan

Az emlőrák, más rákokhoz hasonlóan , egy környezeti (külső) tényező és egy genetikailag fogékony gazdaszervezet közötti kölcsönhatás miatt alakul ki. A normál sejtek annyiszor osztódnak, ahányszor szükséges, és megállnak. Más sejtekhez kötődnek, és a helyükön maradnak a szövetekben. A sejtek akkor válnak rákossá, amikor elveszítik képességüket az osztódás leállítására, más sejtekhez való kapcsolódásra, arra, hogy ott maradjanak, ahol valók, és a megfelelő időben meghaljanak.
A normál sejtek önmegsemmisülnek ( programozott sejthalál ), amikor már nincs rájuk szükség. Addig a sejteket számos fehérjeklaszter és útvonal védi a programozott haláltól. Az egyik védőút a PI3K / AKT útvonal; egy másik a RAS / MEK / ERK útvonal. Néha a gének ezen védőpályák mentén olyan módon mutálódnak, hogy tartósan "bekapcsolják" őket, így a sejt nem képes önmegsemmisíteni, amikor már nincs rá szükség. Ez az egyik olyan lépés, amely más mutációkkal kombinálva rákot okoz. Normális esetben a PTEN fehérje kikapcsolja a PI3K/AKT útvonalat, amikor a sejt készen áll a programozott sejthalálra. Egyes emlőrákoknál a PTEN fehérje génje mutált, így a PI3K/AKT útvonal az "on" pozícióban ragad, és a rákos sejt nem pusztítja el magát.
A mellrákhoz vezethető mutációkat kísérletileg összefüggésbe hozták az ösztrogénexpozícióval. Ezenkívül a G-proteinhez kapcsolt ösztrogénreceptorokat a női reproduktív rendszer különféle rákos megbetegedésével, köztük a mellrákkal is összefüggésbe hozták.
A kóros növekedési faktor jelátvitel a stromasejtek és az epiteliális sejtek közötti kölcsönhatásban elősegítheti a rosszindulatú sejtnövekedést. Az emlő zsírszövetében a leptin túlzott expressziója fokozott sejtproliferációhoz és rák kialakulásához vezet.
Az Egyesült Államokban a mellrákban vagy petefészekrákban szenvedő nők 10-20 százalékának van egy első vagy másodfokú rokona e betegségek valamelyikében. A mellrákos férfiaknál még nagyobb a valószínűsége. Az ilyen rákok kialakulásának családi hajlamát örökletes mell-petefészekrák szindrómának nevezik . Ezek közül a legismertebb, a BRCA mutációk 60 és 85 százalék közötti élethosszig tartó mellrák kockázatot, és 15 és 40 százalék közötti petefészekrák kockázatot jelentenek. Egyes rákkal kapcsolatos mutációk, mint például a p53 , BRCA1 és BRCA2 , a DNS- hibákat korrigáló mechanizmusokban fordulnak elő . Ezek a mutációk vagy öröklődnek, vagy születés után szerezhetők. Feltehetően további mutációkat tesznek lehetővé, amelyek lehetővé teszik az ellenőrizetlen osztódást, a kötődés hiányát és a távoli szervekbe történő áttétet. Azonban erős bizonyítékok vannak a fennmaradó kockázati variációkra, amelyek jóval túlmutatnak a hordozócsaládok közötti örökletes BRCA génmutációkon. Ezt nem megfigyelhető kockázati tényezők okozzák. Ez környezeti és egyéb okokat von maga után, mint a mellrák kiváltó okait. A BRCA1 vagy BRCA2 gének öröklött mutációja megzavarhatja a DNS keresztkötések és a DNS kettős szál szakadások (a kódolt fehérje ismert funkciói) javítását. Ezek a rákkeltő anyagok DNS-károsodást okoznak, például DNS-keresztkötéseket és kettősszál-szakadásokat, amelyek gyakran javítást igényelnek a BRCA1-et és BRCA2-t tartalmazó útvonalakon. A BRCA gének mutációi azonban az összes mellráknak csak 2-3 százalékát teszik ki. Levin et al. azt mondják, hogy a rák nem feltétlenül elkerülhetetlen a BRCA1 és BRCA2 mutációk minden hordozója számára. Az örökletes emlő-petefészekrák szindrómák körülbelül fele ismeretlen géneket foglal magában. Ezenkívül bizonyos látens vírusok csökkenthetik a BRCA1 gén expresszióját és növelhetik az emlődaganatok kockázatát.
A GATA-3 közvetlenül szabályozza az ösztrogénreceptor (ER) és más, az epiteliális differenciálódáshoz kapcsolódó gének expresszióját, és a GATA-3 elvesztése a differenciálódás elvesztéséhez és rossz prognózishoz vezet a rákos sejtek inváziója és metasztázisai miatt.
Diagnózis
Az emlőrák legtöbb típusát könnyű diagnosztizálni az emlő érintett területének mintájának mikroszkópos elemzésével – vagy biopsziával . Ezenkívül vannak olyan típusú emlőrák, amelyek speciális laboratóriumi vizsgálatokat igényelnek.
A két leggyakrabban használt szűrési módszer, az emlők egészségügyi szolgáltató általi fizikális vizsgálata és a mammográfia hozzávetőlegesen valószínűsítheti, hogy egy csomó rák, és más elváltozásokat is kimutathat, például egy egyszerű cisztát . Ha ezek a vizsgálatok nem meggyőzőek, az egészségügyi szolgáltató mintát vehet a csomóban lévő folyadékból mikroszkópos elemzés céljából (ez az eljárás finom tűvel történő aspirációnak vagy finom tűs aspirációnak és citológiának (FNAC) ismert), hogy segítse a diagnózis felállítását. A tűszívás az egészségügyi szolgáltató irodájában vagy klinikán végezhető el. Helyi érzéstelenítőt lehet használni a mellszövet zsibbadására, hogy megakadályozzák a fájdalmat az eljárás során, de nem feltétlenül szükséges, ha a csomó nincs a bőr alatt. Ha tiszta folyadékot talál, a csomó valószínűtlenné teszi, hogy rákos legyen, de a véres folyadékot elküldhetik, hogy mikroszkóp alatt megvizsgálják a rákos sejteket. Az emlők fizikális vizsgálata, a mammográfia és az FNAC együttesen felhasználható az emlőrák jó pontosságú diagnosztizálására.
A biopszia egyéb lehetőségei közé tartozik a magbiopszia vagy a vákuum-asszisztált emlőbiopszia , amelyek olyan eljárások, amelyek során a mellcsomó egy részét eltávolítják; vagy egy excisionális biopszia , amelyben a teljes csomót eltávolítják. Nagyon gyakran az egészségügyi szolgáltató által végzett fizikális vizsgálat, a mammográfia és a különleges körülmények között elvégzendő további vizsgálatok (például ultrahangos képalkotás vagy MRI ) eredményei elegendőek ahhoz, hogy az excisionális biopsziát mint végleges diagnosztikai és elsődleges kezelési módszert indokolják.
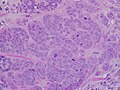
Kimetszett emberi mellszövet 2 cm átmérőjű , szabálytalan, sűrű, fehér színű rákfelülettel , sárga zsírszövetben
Magas fokú invazív ductalis karcinóma minimális tubulusképződéssel, kifejezett pleomorfizmussal és kiemelkedő mitózisokkal , 40-szeres mező
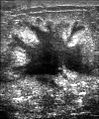
Mammogramok normál mellet (balra) és rákos emlőt (jobbra) mutatnak
Osztályozás
A mellrákokat több osztályozási rendszer szerint osztályozzák. Ezek mindegyike befolyásolja a prognózist és befolyásolhatja a kezelésre adott választ. Az emlőrák leírása optimálisan magában foglalja ezeket a tényezőket.
- Szövetpatológia . Az emlőrákot általában elsősorban szövettani megjelenése alapján osztályozzák . A legtöbb emlőrák a csatornákat vagy lebenyeket bélelő hámból származik, és ezeket a rákot duktális vagy lebenyes karcinómákként osztályozzák . Az in situ karcinóma alacsony fokú rákos vagy rákmegelőző sejtek növekedése egy adott szöveti térben, például az emlőcsatornában, a környező szövetek inváziója nélkül. Ezzel szemben az invazív karcinóma nem korlátozódik a kezdeti szövetre.
- évfolyam . Az osztályozás összehasonlítja az emlőráksejtek megjelenését a normál mellszövet megjelenésével. A normál sejtek egy olyan szervben, mint a mell, differenciálódnak, ami azt jelenti, hogy meghatározott formákat és formákat vesznek fel, amelyek tükrözik a szerv részeként betöltött funkciójukat. A rákos sejtek elvesztik ezt a differenciálódást. Rák esetén azok a sejtek, amelyek rendesen felsorakoznak a tejcsatornákat alkotó módon, szétesnek. A sejtosztódás ellenőrizhetetlenné válik. A sejtmagok kevésbé egységesek. A patológusok jól differenciált (alacsony fokú), közepesen differenciált (közepes fokú) és gyengén differenciált (magas fokú) sejteket írnak le, mivel a sejtek fokozatosan elveszítik a normál emlősejtekben látható jellemzőket. A rosszul differenciált rákok (azok, amelyek szövete a legkevésbé hasonlít a normál mellszövethez) rosszabb prognózisúak.
-
Színpad . Az emlőrák TNM rendszerrel történő stádiummeghatározása a daganat méretén ( T ), azon alapul, hogy a daganat átterjedt-e a hónaljban lévő nyirokcsomókra ( N ) vagy sem, és hogy a daganat m tátetázt - e ( M ) (pl . átterjedt a test távolabbi részére). A nagyobb méret, a csomóponti terjedés és a metasztázis nagyobb stádiumszámmal és rosszabb prognózissal jár. A fő szakaszok a következők:
- A 0. stádium rákmegelőző vagy marker állapot, vagy ductalis carcinoma in situ (DCIS) vagy lebenyes carcinoma in situ (LCIS).
- Az 1–3. szakasz a mellben vagy a regionális nyirokcsomókban található.
- A 4. stádium a „metasztatikus” rák , amely kevésbé kedvező prognózisú, mivel az emlőn és a regionális nyirokcsomókon túlra terjedt.
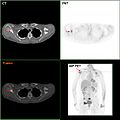
- Ahol rendelkezésre állnak, képalkotó vizsgálatok alkalmazhatók a szakaszolási folyamat részeként bizonyos esetekben az áttétes rák jeleinek keresésére. Mindazonáltal olyan emlőrák esetén, amelynél alacsony az áttétek kockázata, a PET-vizsgálatokkal , CT-vizsgálatokkal vagy csontvizsgálatokkal kapcsolatos kockázatok meghaladják a lehetséges előnyöket, mivel ezek az eljárások jelentős mennyiségű potenciálisan veszélyes ionizáló sugárzásnak teszik ki a személyt.
-
A receptor állapota . Az emlőráksejtek felszínén, citoplazmájában és sejtmagjában receptorok találhatók . A kémiai hírvivők, például a hormonok kötődnek a receptorokhoz , és ez változásokat okoz a sejtben. Az emlőráksejtek három fontos receptorral rendelkezhetnek, de nem is: ösztrogénreceptor (ER), progeszteron receptor (PR) és HER2 . Az ER+ rákos sejtek (vagyis az ösztrogénreceptorral rendelkező rákos sejtek) növekedésük ösztrogéntől függ, ezért kezelhetők olyan gyógyszerekkel, amelyek blokkolják az ösztrogén hatását (pl. tamoxifen ), és általában jobb a prognózisuk. A kezeletlen HER2+ emlőrák általában agresszívebb, mint a HER2-emlőrák, de a HER2+ rákos sejtek reagálnak olyan gyógyszerekre, mint a trastuzumab monoklonális antitest (a hagyományos kemoterápiával kombinálva), és ez jelentősen javította a prognózist. Azokat a sejteket, amelyek nem rendelkeznek e három receptortípus (ösztrogénreceptorok, progeszteronreceptorok vagy HER2) egyikével sem, hármas negatívnak nevezik , bár gyakran expresszálnak más hormonok receptorait, például az androgénreceptort és a prolaktinreceptort .
- DNS vizsgálatok . Különböző típusú DNS-tesztek , beleértve a DNS-mikromátrixokat is, összehasonlították a normál sejteket az emlőrákos sejtekkel. Egy adott emlőrák specifikus változásai többféleképpen is felhasználhatók a rák osztályozására, és segíthetnek az adott DNS-típus leghatékonyabb kezelésének kiválasztásában.
Szűrés
Az emlőrákszűrés az egyébként egészséges nők mellrák-vizsgálatát jelenti annak érdekében, hogy korábbi diagnózist érjenek el, feltéve, hogy a korai felismerés javítja az eredményeket. Számos szűrővizsgálatot alkalmaztak, beleértve a klinikai és önvizsgálatot , a mammográfiát , a genetikai szűrést, az ultrahangot és a mágneses rezonancia képalkotást.
A klinikai vagy önálló emlővizsgálat magában foglalja a mell tapintását csomók vagy egyéb rendellenességek szempontjából. A klinikai emlővizsgálatokat az egészségügyi szolgáltatók végzik, míg a saját emlővizsgálatokat maga a személy. A bizonyítékok nem támasztják alá egyik emlővizsgálati típus hatékonyságát sem, mivel mire egy csomó elég nagy ahhoz, hogy megtalálják, valószínűleg már több éve nő, és így hamarosan elég nagy lesz ahhoz, hogy vizsgálat nélkül is megtalálják. Az emlőrák mammográfiás szűrése röntgensugarak segítségével vizsgálja meg az emlőt a nem jellemző tömegek vagy csomók szempontjából. A szűrés során a mell összenyomódik, és a technikus több szögből készít fényképeket. Az általános mammográfiás vizsgálat az egész emlőről készít fényképeket, míg a diagnosztikai mammográfiás egy adott csomóra vagy területre fókuszál.
Számos nemzeti szerv javasolja a mellrákszűrést. A US Preventive Services Task Force és az American College of Physicians egy átlagos nő számára kétévente javasolja a mammográfiát az 50 és 74 év közötti nők számára, az Európa Tanács pedig az 50 és 69 év közötti nők számára a legtöbb program 2 éves gyakorisággal. , míg az Európai Bizottság 45-75 éves korig 2-3 évente, Kanadában pedig 50-74 éves kor között 2-3 éves gyakorisággal javasolja a mammográfiás vizsgálatot. Az American Cancer Society azt is támogatja, hogy a 40 éves és idősebb nők évente mammográfiát kapjanak. Ezek a munkacsoport jelentései rámutatnak arra, hogy a szükségtelen műtéten és szorongáson túl a gyakoribb mammográfiás vizsgálatok kockázatai közé tartozik a sugárzás által kiváltott emlőrák kismértékű, de jelentős növekedése.
A Cochrane-együttműködés (2013) kijelenti, hogy a legjobb minőségű bizonyítékok sem a rákspecifikus, sem a mammográfiás szűrésből származó bármilyen okból bekövetkező halálozás csökkenését nem mutatják. Ha az elemzéshez kevésbé szigorú vizsgálatokat adunk, az emlőrák okozta halálozás 0,05%-kal csökken (2000 mellrákos halálozás 1-szeres csökkenése 10 év alatt, vagy relatív 15%-os csökkenés a mellrák miatt). A 10 éven át tartó szűrés 30%-kal növeli a túldiagnózis és a túlkezelés arányát (1000-ből 3-14), és több mint felénél lesz legalább egy hamis pozitív teszt. Ez azt a nézetet eredményezte, hogy nem világos, hogy a mammográfiás szűrés több jót vagy kárt okoz-e. Cochrane kijelenti, hogy a mellrák kezelésének közelmúltbeli javulása és az emlőrákszűrésből származó téves pozitív eredmények miatt, amelyek szükségtelen kezeléshez vezetnek, „ezért már nem tűnik előnyösnek a mellrákszűrésen részt venni” bármely életkorban. Nem ismert, hogy az MRI mint szűrési módszer nagyobb ártalmakkal vagy előnyökkel jár-e a standard mammográfiához képest.
Megelőzés
Életmód
A nők csökkenthetik a mellrák kockázatát az egészséges testsúly fenntartásával, az alkoholfogyasztás csökkentésével , a fizikai aktivitás növelésével és a szoptatással . Ezek a módosítások megelőzhetik a mellrákos megbetegedések 38%-át az Egyesült Államokban, 42%-át az Egyesült Királyságban, 28%-át Brazíliában és 20%-át Kínában. A mérsékelt testmozgás, például a tempós séta előnyei minden korcsoportban láthatók, beleértve a posztmenopauzás nőket is. A magas szintű fizikai aktivitás körülbelül 14%-kal csökkenti a mellrák kockázatát. A rendszeres fizikai aktivitást ösztönző és az elhízást csökkentő stratégiáknak más előnyei is lehetnek, például csökkenthető a szív- és érrendszeri betegségek és a cukorbetegség kockázata. Egy 130 957 európai származású nő adatait tartalmazó tanulmány „erős bizonyítékot talált arra, hogy a nagyobb fizikai aktivitás és a kevesebb ülőmunka valószínűleg csökkenti a mellrák kockázatát, és az eredmények általában megegyeznek a mellrák altípusaiban”.
Az Amerikai Rákszövetség és az Amerikai Klinikai Onkológiai Társaság 2016-ban azt tanácsolta, hogy az embereknek zöldségekben, gyümölcsökben, teljes kiőrlésű gabonákban és hüvelyesekben gazdag étrendet kell fogyasztaniuk. A citrusfélék magas bevitele 10%-kal csökkenti a mellrák kockázatát. A tengeri omega-3 többszörösen telítetlen zsírsavak csökkentik a kockázatot. A szója alapú élelmiszerek nagymértékű fogyasztása csökkentheti a kockázatot.
Megelőző műtét
Mindkét emlő eltávolítása bármilyen rák diagnosztizálása vagy gyanús csomó vagy egyéb elváltozás megjelenése előtt (a „profilaktikus bilaterális mastectomia ” vagy „kockázatcsökkentő mastectomia” néven ismert eljárás) mérlegelhető olyan nőknél, akiknél a BRCA1 és BRCA2 mutációt szenvednek. jelentősen megnövekedett kockázattal az emlőrák esetleges diagnózisához. A bizonyítékok nem elég erősek ahhoz, hogy ezt az eljárást bárkinél alátámasszák, kivéve a legnagyobb kockázatnak kitett nőket. A genetikai tanácsadást követően a BRCA-teszt a magas családi kockázattal rendelkezők számára javasolt. Nem ajánlott rutinszerűen. Ennek az az oka, hogy a BRCA-génekben a változásoknak számos formája létezik, az ártalmatlan polimorfizmusoktól a nyilvánvalóan veszélyes kereteltolódásos mutációkig . A legtöbb azonosítható génváltozás hatása bizonytalan. Egy átlagos kockázatú személyen végzett tesztelés különösen nagy valószínűséggel ad egy ilyen határozatlan, haszontalan eredményt. A második emlő eltávolítása emlőrákban szenvedő betegeknél (ellenoldali kockázatcsökkentő mastectomia vagy CRRM) csökkentheti a rák kockázatát a második emlőben, azonban nem világos, hogy a második emlő eltávolítása javítja-e a túlélést azoknál, akiknek mellrákja van. Egyre több nő választja a kockázatcsökkentő műtétet , akiknél pozitív a hibás BRCA1 vagy BRCA2 gén . Ugyanakkor az eljárás átlagos várakozási ideje két év, ami jóval hosszabb az ajánlottnál.
Gyógyszerek
A szelektív ösztrogén receptor modulátorok csökkentik az emlőrák kockázatát, de növelik a thromboembolia és az endometriumrák kockázatát . A halálozás kockázatában nincs általános változás. Ezért nem ajánlottak az emlőrák megelőzésére átlagos kockázatú nőknél, de ajánlott a magas kockázatú és 35 év felettiek számára. Az emlőrák csökkentésének előnyei a kezelés abbahagyása után legalább öt évig fennállnak. ezekkel a gyógyszerekkel való kezelés során. Az aromatáz inhibitorok (például az exemesztán és az anasztrozol ) hatékonyabbak lehetnek a szelektív ösztrogénreceptor-modulátoroknál (például tamoxifen) az emlőrák kockázatának csökkentésében, és nem járnak együtt az endometriumrák és a tromboembólia fokozott kockázatával.
Menedzsment
Az emlőrák kezelése számos tényezőtől függ, beleértve a rák stádiumát és a személy életkorát. A kezelések agresszívebbek, ha a rák előrehaladottabb, vagy nagyobb a kockázata a rák kiújulásának a kezelést követően.
Az emlőrákot általában műtéttel kezelik, amelyet kemoterápia vagy sugárterápia, vagy mindkettő követhet. A multidiszciplináris megközelítés előnyösebb. A hormonreceptor-pozitív rákos megbetegedéseket gyakran hormonblokkoló terápiával kezelik több éven keresztül. Monoklonális antitestek vagy más immunmoduláló kezelések adhatók az emlőrák áttétes és egyéb előrehaladott stádiumaiban előforduló bizonyos esetekben, bár ezt a kezelési kört még tanulmányozzák.
Sebészet

A műtét magában foglalja a daganat fizikai eltávolítását, jellemzően néhány környező szövettel együtt. Egy vagy több nyirokcsomóból biopsziát lehet venni a műtét során; a nyirokcsomó-mintavételt egyre gyakrabban őrnyirokcsomó - biopsziával végzik .
A standard műtétek a következők:
- Mastectomia : Az egész mell eltávolítása.
- Quadrantectomia : A mell egynegyedének eltávolítása.
- Lumpectomia : A mell egy kis részének eltávolítása.
A daganat eltávolítása után, ha a személy kívánja, emlőrekonstrukciós műtét , egyfajta plasztikai műtét végezhető a kezelt hely esztétikai megjelenésének javítása érdekében. Alternatív megoldásként a nők mellprotéziseket használnak a ruha alatti mell szimulálására, vagy lapos mellkast választanak. A mellbimbóprotézis a mastectomiát követően bármikor használható.
Gyógyszer
A műtét után és a műtét mellett alkalmazott gyógyszereket adjuváns terápiának nevezzük . A műtétet megelőző kemoterápiát vagy más típusú terápiát neoadjuváns terápiának nevezik . Az aszpirin csökkentheti a mellrák okozta halálozást, ha más kezelésekkel együtt alkalmazzák.
Jelenleg három fő gyógyszercsoportot használnak az emlőrák adjuváns kezelésére: hormonblokkolók, kemoterápia és monoklonális antitestek.
Hormonális terápia
Egyes emlőrákok növekedéséhez ösztrogénre van szükség. Felületükön ösztrogénreceptorok (ER+) és progeszteronreceptorok (PR+) jelenléte alapján azonosíthatók (ezeket néha együtt hormonreceptoroknak nevezik). Ezek az ER+ rákos megbetegedések olyan gyógyszerekkel kezelhetők, amelyek vagy blokkolják a receptorokat, pl. tamoxifen , vagy pedig egy aromatázgátlóval , például anasztrozollal vagy letrozollal blokkolják az ösztrogéntermelést . A tamoxifen alkalmazása 10 évig javasolt. A tamoxifen növeli a posztmenopauzális vérzés , az endometrium polipok , a hiperplázia és az endometriumrák kockázatát ; A tamoxifen méhen belüli levonorgesztrelt felszabadító rendszerrel történő alkalmazása egy-két év után fokozhatja a hüvelyi vérzést, de némileg csökkenti az endometrium polipokat és a hiperpláziát, de nem feltétlenül az endometriumrákot. A letrozol öt évig ajánlott.
Az aromatáz inhibitorok csak a menopauza utáni nők számára alkalmasak; ebben a csoportban azonban jobbnak tűnnek, mint a tamoxifen. Ennek az az oka, hogy a posztmenopauzás nőkben az aktív aromatáz eltér a premenopauzális nőkben uralkodó formától, és ezért ezek a szerek nem hatékonyak a premenopauzális nők túlnyomórészt aromatázának gátlásában. Aromatáz-gátlók nem adhatók olyan premenopauzás nőknek, akiknek ép petefészek-funkciója van (kivéve, ha ők is petefészkük működését megakadályozó kezelés alatt állnak). A CDK-gátlók endokrin vagy aromatáz terápiával kombinálva is alkalmazhatók .
Kemoterápia
A kemoterápiát túlnyomórészt a 2–4. stádiumú emlőrák esetén alkalmazzák, és különösen előnyös az ösztrogénreceptor-negatív (ER-) betegségekben. A kemoterápiás gyógyszereket kombinációban adják be, általában 3-6 hónapig. Az egyik leggyakoribb kezelési mód, az "AC" néven ismert, a ciklofoszfamidot doxorubicinnel kombinálja . Néha taxán gyógyszert, például docetaxelt adnak hozzá, és ezt a rendszert "CAT" néven ismerik. Egy másik gyakori kezelés a ciklofoszfamid, a metotrexát és a fluorouracil (vagy "CMF"). A legtöbb kemoterápiás gyógyszer úgy fejti ki hatását, hogy elpusztítja a gyorsan növekvő és/vagy gyorsan replikálódó rákos sejteket, akár DNS-károsodást okozva a replikáció során, akár más mechanizmusok révén. A gyógyszerek azonban károsítják a gyorsan növekvő normál sejteket is, ami súlyos mellékhatásokat okozhat. A szívizom károsodása például a doxorubicin legveszélyesebb szövődménye.
Monoklonális antitestek
A trastuzumab , a HER2 elleni monoklonális antitest körülbelül 87%-ra javította az 1–3. stádiumú HER2-pozitív emlőrákok ötéves betegségmentes túlélését (teljes túlélés 95%). Az emlőrákok 25-30%-a túlzottan expresszálja a HER2 gént vagy annak fehérjetermékét, és a HER2 túlzott expressziója emlőrákban a betegség fokozott kiújulásával és rosszabb prognózissal jár. A trastuzumab azonban nagyon drága, és alkalmazása súlyos mellékhatásokat okozhat (a kapó emberek körülbelül 2%-ánál alakul ki jelentős szívkárosodás). Egy másik antitest , a pertuzumab megakadályozza a HER2 dimerizációját, és súlyos betegség esetén trastuzumabbal és kemoterápiával együtt ajánlott .
Célzott terápia
Az elasztránt (Orserdu) 2023 januárjában engedélyezték orvosi használatra az Egyesült Államokban.
Sugárzás
A műtét után sugárterápiát adnak a daganatágy és a regionális nyirokcsomók területére, hogy elpusztítsák a mikroszkopikus daganatsejteket, amelyek esetleg elkerülték a műtétet. Ha intraoperatívan , célzott intraoperatív sugárkezelésként alkalmazzák , jótékony hatással lehet a tumor mikrokörnyezetére is. A sugárterápia végezhető külső sugárkezelésként vagy brachyterápiaként (belső sugárterápia). Hagyományosan sugárterápiát adnak az emlőrák műtétje után . Az emlőrák operációja során sugárkezelés is adható. A sugárzás 50–66%-kal csökkentheti a kiújulás kockázatát (a kockázat 1/2–2/3-a csökkenti), ha a megfelelő dózisban adják be, és elengedhetetlennek tekinthető, ha az emlőrákot csak a csomó eltávolításával kezelik (Lumpectomia vagy széles helyi kimetszés). ). Korai emlőrák esetén a részleges emlőbesugárzás nem biztosítja ugyanazt a rák elleni védekezést az emlőben, mint az egész emlő kezelése, és rosszabb mellékhatásokat okozhat.
Utógondozás
Az emlőrák elsődleges kezelését követő gondozás, más néven „utókezelés”, intenzív lehet, és rendszeres laboratóriumi vizsgálatokat is magában foglalhat tünetmentes embereken, hogy megpróbálják elérni a lehetséges áttétek korábbi kimutatását. Egy áttekintés megállapította, hogy a rendszeres fizikális vizsgálatot és az éves mammográfiát magában foglaló nyomon követési programok a kiújulás korai felismerése, az általános túlélés és az életminőség szempontjából ugyanolyan hatékonyak, mint az intenzívebb, laboratóriumi vizsgálatokból álló programok.
A multidiszciplináris rehabilitációs programok, amelyek gyakran tartalmaznak testmozgást, oktatást és pszichológiai segítséget, rövid távú javulást eredményezhetnek az emlőrákos betegek funkcionális képességeiben, pszichoszociális alkalmazkodásában és társadalmi részvételében.
A felső végtagproblémák, mint a váll- és karfájdalom, gyengeség és mozgáskorlátozottság gyakori mellékhatások sugárterápia vagy mellrák műtét után. Az Egyesült Királyságban végzett kutatások szerint a műtét után 7-10 nappal megkezdett edzésprogram csökkentheti a felső végtagok problémáit.
Prognózis
Prognosztikai tényezők
| Színpad | 5 éves túlélés |
|---|---|
| I. szakasz | 100% |
| szakasz II | 90% |
| szakasz III | 70% |
| szakasz IV | 30% |
Az emlőrák stádiuma az emlőrák hagyományos osztályozási módszereinek legfontosabb összetevője, mivel nagyobb hatással van a prognózisra, mint a többi szempont. A stádium meghatározása figyelembe veszi a méretet, a helyi érintettséget, a nyirokcsomók állapotát és azt, hogy van-e metasztatikus betegség. Minél magasabb a diagnózis stádiuma, annál rosszabb a prognózis. A stádiumot a nyirokcsomók, a mellkasfal, a bőr vagy azon túli betegségek invazivitása, valamint a rákos sejtek agresszivitása emeli. A stádiumot csökkenti a rákmentes zónák jelenléte és a normálishoz közeli sejtviselkedés (osztályozás). A méret nem befolyásolja a stádiumot, kivéve, ha a rák invazív. Például a teljes mellet érintő in situ ductalis carcinoma (DCIS) továbbra is a nulladik stádium, következésképpen kiváló prognózis.
- Az 1. stádiumú rákos megbetegedések (és a DCIS, LCIS) kiváló prognózisúak, és általában lumpectomiával és néha sugárzással kezelik őket.
- A fokozatosan rosszabb prognózisú és a kiújulás kockázatával járó 2. és 3. stádiumú rákos megbetegedések kezelése általában műtéttel (lumpectomia vagy mastectomia nyirokcsomó-eltávolítással vagy anélkül ), kemoterápiával (plusz trastuzumabbal a HER2+ rákos megbetegedések esetén) és néha besugárzással (különösen nagy, többszörös rákos megbetegedések esetén) kezelik. pozitív csomópontok vagy lumpectomia).
- A 4. stádium, az áttétes rák (azaz távoli helyekre terjed) rossz prognózisú, és a műtéttől, a sugárkezeléstől, a kemoterápiától és a célzott terápiáktól kezdve az összes kezelés különböző kombinációival kezelhető.
Az emlőrák fokozatát a mellráksejtek és a normál emlősejtek összehasonlításával értékelik. Minél közelebb vannak a normálishoz a rákos sejtek, annál lassabb a növekedésük és annál jobb a prognózis. Ha a sejtek nem jól differenciálódnak, éretlennek tűnnek, gyorsabban osztódnak, és hajlamosak a terjedésre. A jól differenciált 1-es, a közepes a 2-es, míg a gyenge vagy nem differenciált magasabb osztályzatot kap, 3-as vagy 4-es (az alkalmazott skálától függően). A legszélesebb körben használt osztályozási rendszer a nottinghami rendszer.
A fiatalabb, 40 évnél fiatalabb nők vagy a 80 év feletti nők több tényező miatt általában rosszabb prognózissal rendelkeznek, mint a posztmenopauzás nők. Mellük megváltozhat a menstruációs ciklusukkal, előfordulhat, hogy szoptatnak csecsemők, és nem tudnak a mellükben bekövetkezett változásokról. Ezért a fiatalabb nők általában előrehaladottabb stádiumban vannak, amikor diagnosztizálják. Lehetnek olyan biológiai tényezők is, amelyek hozzájárulnak a betegség kiújulásának nagyobb kockázatához a fiatalabb emlőrákos nőknél.
Pszichológiai vonatkozások
Nem minden emlőrákos ember éli át betegségét egyformán. Az olyan tényezők, mint például az életkor, jelentős hatással lehetnek arra, hogy egy személy hogyan kezeli a mellrák diagnózisát. Az ösztrogénreceptor-pozitív emlőrákban szenvedő premenopauzás nőknek szembe kell nézniük a korai menopauza problémáival , amelyeket az emlőrák kezelésére alkalmazott kemoterápiás kezelések sokasága vált ki, különösen azoknál, amelyek hormonokat használnak a petefészek működésének ellensúlyozására.
A nem áttétes emlőrákban szenvedő nőknél a pszichológiai beavatkozások, például a kognitív viselkedésterápia pozitív hatással lehetnek az olyan kimenetelekre, mint a szorongás, a depresszió és a hangulati zavarok. A fizikai aktivitással kapcsolatos beavatkozások az adjuváns kezelést követően az egészséggel összefüggő életminőségre, szorongásra, fittségre és fizikai aktivitásra is jótékony hatással lehetnek emlőrákos nőknél.
Járványtan
|
nincs adat
<2
2–4
4–6
6–8
8–10
10–12 |
12–14
14–16
16–18
18–20
20–22
>22 |
Világszerte a mellrák a leggyakoribb invazív rák a nők körében. A tüdőrák mellett a mellrák a leggyakrabban diagnosztizált rák, 2018-ban egyenként 2,09 millió esettel. Az emlőrák a nők minden hetedikét (14%) érinti világszerte. (A rák leggyakoribb formája a nem invazív, nem melanómás bőrrák ; a nem invazív rákok általában könnyen gyógyíthatók, nagyon kevés halálesetet okoznak, és rutinszerűen kizárják a rákos statisztikákból.) Az emlőrák az invazív rákos megbetegedések 22,9%-át teszi ki a nők körében. és az összes női rák 16%-a. 2012-ben a nőknél diagnosztizált rákos megbetegedések 25,2%-át tette ki, így ez a leggyakoribb női rák.
2008-ban az emlőrák 458 503 halálesetet okozott világszerte (a nők daganatos megbetegedésének 13,7%-a, a férfiak és nők esetében pedig az összes rákos halálozás 6,0%-a). A tüdőrák, amely a nők rákos megbetegedésével összefüggő halálozások második leggyakoribb oka, a nők daganatos megbetegedésének 12,8%-át okozta (az összes rákos halálozás 18,2%-a férfiak és nők esetében).
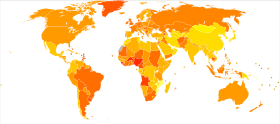
Az emlőrák előfordulási gyakorisága világszerte nagy eltéréseket mutat: a kevésbé fejlett országokban a legalacsonyabb, a fejlettebb országokban a legnagyobb. A világ tizenkét régiójában a 100 000 nőre jutó éves életkor standardizált előfordulási arány a következő: 18 Kelet-Ázsiában, 22 Dél-Közép-Ázsiában és a Szaharától délre fekvő Afrikában, 26 Délkelet-Ázsiában, 26, 28 Észak-Afrikában és Nyugat-Ázsia, 42 Dél- és Közép-Amerikában, 42, 49 Kelet-Európában, 56 Dél-Európában, 73 Észak-Európában, 74 Óceániában, 78 Nyugat-Európában és 90 Észak-Amerikában. Az áttétes emlőrák a mellrákban szenvedő nők 19%-át (Egyesült Államok) és 50%-át (Afrika egyes részei) érinti.
Az 1970-es évek óta világszerte jelentősen megnőtt a megbetegedések száma, ami részben a modern életmódnak tulajdonítható. Az emlőrák erősen összefügg az életkorral, az összes emlőrák mindössze 5%-a fordul elő 40 év alatti nőknél. 2011-ben több mint 41 000 újonnan diagnosztizált emlőrákos esetet regisztráltak Angliában, ezeknek az eseteknek körülbelül 80%-a 50 éves vagy annál idősebb nőknél volt. Az Egyesült Államok 2015-ös statisztikai adatai szerint 2,8 millió nőt érintett a mellrák. Az Egyesült Államokban a mellrák 100 000 nőre jutó, életkorhoz igazított előfordulási gyakorisága az 1970-es évek évi 102 esetéről a 90-es évek végére körülbelül 141-re emelkedett, és azóta csökkent, és 2003 óta 125 körül tart . A 100 000 nőre jutó emlőrák okozta korrigált halálozás csak kis mértékben emelkedett az 1975-ös 31,4-ről 1989-ben 33,2-re, és azóta folyamatosan csökkent 20,5-re 2014-ben.
Több elsődleges daganat
Több primer daganat is kialakulhat különböző helyeken (ellentétben egyetlen tumor terjedésével). Ezek a daganatok előfordulhatnak mindkét emlőben (kétoldali daganatok), egyetlen emlő különböző negyedeiben (multicentrikus rák), vagy egy emlőnegyeden belül különálló daganatokban (multi-fokális rák).
A multicentrikus és multifokális emlőrák (MMBC) előfordulása növekszik, részben a mammográfiás technológia fejlődésének köszönhetően. Az MMBC előfordulási gyakorisága a magas jövedelmű országokban 9 és 75% között van, az alkalmazott kritériumoktól függően. Például Kína arról számolt be, hogy a betegek mindössze 2%-át definiálják MMBC-nek. Ennek az eltérésnek az oka a diagnózis egységességének hiánya. Ezért szabványosított módszert és kritériumokat kell készíteni az MMBC előfordulásának helyes meghatározásához.
A tumorszuppresszor gének, például a BRCA1 és BRCA2 , a PI3K/AKT/mTOR útvonal és a PTEN mutációi összefüggésbe hozhatók több primer emlőrák kialakulásával. A diagnózis ugyanazokkal a módszerekkel történik, mint más emlőrákok.
A mastectomia a multicentrikus emlőrákos betegek standard sebészeti kezelése. A dupla lumpectomia , amelyet emlőkonzervatív terápiaként (BCT) is jelölnek, alternatív és előnyben részesített sebészeti kezelés a korai stádiumú, multicentrikus emlőrákos betegeknél a mastectomiával szemben. A kettős lumpectomiák eljárása a rákos daganatgócok és a környező emlőszövetek műtéti eltávolítását foglalja magában ugyanazon emlő különböző kvadránsaiban. A dupla lumpectomiák előnyei az emlőrekonstrukciós műtétek elkerülése és a minimális mellhegesedés. Mindazonáltal nem előnyös olyan betegek számára, akiknek ugyanazon a mellen belül kettőnél több daganata van, mivel nehézségekbe ütközik az összes rákos sejt eltávolítása. A többszörös primer emlődaganatban szenvedő betegek olyan kezelésekben részesülhetnek, mint a kemoterápia, a sugárterápia és az emlőrekonstrukciós műtét, ugyanazon indikációk szerint, mint más emlőrákos betegek.
Történelem
Láthatósága miatt a mellrák a rák leggyakrabban leírt formája volt az ókori dokumentumokban. Mivel a boncolás ritka volt, a belső szervek rákos megbetegedései lényegében láthatatlanok voltak az ókori orvoslás számára. Az emlőrák azonban a bőrön keresztül is érezhető volt, és előrehaladott állapotában gyakran gombásodási elváltozásokká fejlődött : a daganat elhalt ( belülről elpusztul, amitől a daganat szétszakadni látszott) és a bőrön keresztül kifekélyesedik , sírva fakadt. büdös, sötét folyadék.
A mellrák legrégebbi felfedezett bizonyítéka Egyiptomból származik, és 4200 éves múltra tekint vissza, a hatodik dinasztia idejére . A Qubbet el-Hawa nekropoliszból származó női maradványok vizsgálata kimutatta az áttétek terjedésének tipikus pusztító károsodását. Az Edwin Smith Papyrus nyolc olyan esetet ír le, amikor a mell daganatai vagy fekélyei kauterizálással kezeltek . Az írás azt mondja a betegségről: "Nincs kezelés". Évszázadokon keresztül az orvosok hasonló eseteket írtak le gyakorlatukban, ugyanazzal a következtetéssel. Az ókori orvoslás a görögök idejétől a 17. századig a humoralizmuson alapult, és így azt hitték, hogy a mellrákot általában a szervezetet irányító alapvető folyadékok egyensúlyhiánya okozza, különösen a fekete epe feleslege . Alternatív megoldásként isteni büntetésnek tekintették .
A mellrákos mastectomiát már legalább i.sz. 548 - ban elvégezték, amikor az amidai Aetios udvari orvos javasolta Theodorának . Csak akkor tudták az emlőrák terjedését a hónalj nyirokcsomóihoz kötni, amíg az orvosok jobban megértették a keringési rendszert a 17. században . A 18. század elején Jean Louis Petit francia sebész teljes mastectomiát végzett, amely magában foglalta a hónalji nyirokcsomók eltávolítását , mivel felismerte, hogy ez csökkenti a kiújulást. Petit munkája Bernard Peyrilhe sebész módszereire épült , aki a 17. században ráadásul eltávolította a mell alatti mellizmot , mivel úgy ítélte meg, hogy ez nagymértékben javította a prognózist. De a gyenge eredmények és a betegeket fenyegető jelentős kockázat miatt az orvosok nem osztották az olyan sebészek véleményét, mint Nicolaes Tulp , aki a 17. században azt hirdette, hogy "az egyetlen gyógymód az időben történő műtét". A kiváló sebész, Richard Wiseman a 17. század közepén dokumentálta, hogy 12 mastectomiát követően két beteg halt meg a műtét során, nyolc beteg röviddel a műtét után halt meg progresszív rákban, és a 12 beteg közül csak kettő gyógyult meg. Az orvosok konzervatívan kezelték az emlőrák korai szakaszában felírt kezelést. A betegeket méregtelenítő öblítések , véradás és olyan hagyományos gyógymódok keverékével kezelték , amelyeknek a savasságot kellett volna csökkenteniük, mint például a lúgos arzén .
Amikor 1664-ben Ausztriai Annánál mellrákot diagnosztizáltak, a kezdeti kezelés vérfűlével telített borogatásból állt . Amikor a csomók megnőttek, a király orvosa elkezdte az arzénkenőcsök kezelését . A királyi beteg 1666-ban halt meg szörnyű fájdalomban. Az emlőrák minden sikertelen kezelése új kezelések kereséséhez vezetett, és felpörgette a kábítószerek , gyógynövényszakértők , vegyészek és patikusok által hirdetett és árusított gyógymódok piacát . Az érzéstelenítés és az antiszeptikumok hiánya fájdalmas és veszélyes megpróbáltatássá tette a mastectomiát . A 18. században sokféle anatómiai felfedezést kísértek új elméletek a mellrák okáról és növekedéséről. A nyomozó sebész, John Hunter azt állította, hogy a neurális folyadék emlőrákot okozott. Más sebészek azt javasolták, hogy a tej az emlőcsatornákban rákos növekedéshez vezetett. Az emlőt ért traumákról, mint az emlőszövet rosszindulatú elváltozásainak okozójáról szóló elméletek előrehaladtak. A mell csomóinak és duzzanatainak felfedezése vitákat szült a kemény daganatokról , és arról, hogy a csomók a rák jóindulatú stádiumai-e. Az orvosi vélemények a szükséges azonnali kezelésről eltérőek voltak. Benjamin Bell sebész a teljes mell eltávolítását javasolta, még akkor is, ha csak egy része érintett.
Az emlőrák egészen a 19. századig nem volt gyakori, amikor is a higiénia és a halálos fertőző betegségek elleni védekezés javulása az élettartam drámai megnövekedését eredményezte. Korábban a legtöbb nő túl fiatalon halt meg ahhoz, hogy mellrák alakuljon ki. 1878-ban a Scientific American egyik cikke leírta a nyomással történő történelmi kezelést, amelynek célja helyi ischaemia kiváltása volt olyan esetekben, amikor a műtéti eltávolítás nem volt lehetséges. William Stewart Halsted 1882-ben kezdett el radikális mastectomiákat végezni , amelyet nagyban segített az általános sebészeti technológia fejlődése, például az aszeptikus technika és az érzéstelenítés. A Halsted radikális mastectomia során gyakran eltávolították mindkét mellet, a kapcsolódó nyirokcsomókat és a mögöttes mellkasizmokat. Ez gyakran hosszú távú fájdalomhoz és rokkantsághoz vezetett, de szükségesnek tartották a rák kiújulásának megakadályozásához. A Halsted radikális mastectomia megjelenése előtt a 20 éves túlélési arány mindössze 10% volt; Halsted műtétje ezt az arányt 50%-ra emelte.
Az 1920-as és 1930-as években az emlőrák stádiumbesorolási rendszereit fejlesztették ki annak meghatározására, hogy a rák milyen mértékben fejlődött ki a növekedés és a terjedés révén. Az első esetkontrollos vizsgálatot az emlőrák epidemiológiájáról Janet Lane-Claypon végezte , aki 1926-ban publikált egy összehasonlító tanulmányt 500 mellrákesetről és 500 azonos hátterű és életmódú kontrollcsoportról a brit Egészségügyi Minisztérium számára. Az USA-ban az 1970-es évekig a radikális mastectomia maradt az ellátás standardja, Európában azonban az 1950-es években általánosságban elfogadták a mellkímélő eljárásokat, amelyeket gyakran sugárterápia követett. 1955-ben George Crile Jr. közzétette a Cancer and Common Sense című könyvét , azzal érvelve, hogy a rákos betegeknek meg kell érteniük a rendelkezésre álló kezelési lehetőségeket. Crile közeli barátja lett a környezetvédő Rachel Carsonnak , aki 1960-ban halstedi radikális mastectomián esett át rosszindulatú mellrákja kezelésére. Jerome Urban amerikai onkológus a szuperradikális mastectomiát népszerűsítette, még több szövet felvételével egészen 1963-ig, amikor is a tízéves túlélési arány egyenlőnek bizonyult a kevésbé káros radikális mastectomiával. Carson 1964-ben halt meg, és Crile sokféle cikket publikált, mind a népszerű sajtóban, mind az orvosi folyóiratokban, megkérdőjelezve a halstedi radikális masztektómia széles körben elterjedt használatát. 1973-ban Crile kiadta Amit a nőknek tudniuk kell a mellrák elleni vitáról . Amikor 1974-ben Betty Fordnál mellrákot diagnosztizáltak, a sajtó nyíltan megvitatta a mellrák kezelésének lehetőségeit. Az 1970-es években a metasztázisok új megértése ahhoz vezetett, hogy a rákot szisztémás betegségként és lokalizált betegségként is felfogták, és kímélőbb eljárásokat fejlesztettek ki, amelyek ugyanolyan hatékonynak bizonyultak.
Az 1980-as és 1990-es években nők ezrei, akik sikeresen elvégezték a szokásos kezelést, nagy dózisú csontvelő-transzplantációt követeltek és kaptak , azt gondolva, hogy ez jobb hosszú távú túléléshez vezet. Ez azonban teljesen hatástalannak bizonyult, és a nők 15-20%-a halt meg a brutális bánásmód miatt. A Nurses' Health Study 1995-ös jelentései és a Women's Health Initiative vizsgálat 2002-es következtetései meggyőzően bizonyították, hogy a hormonpótló terápia jelentősen növelte az emlőrák előfordulását.
Társadalom és kultúra
A 20. század előtt a mellráktól féltek, és elcsukló hangon beszéltek róla, mintha szégyen lenne. Mivel a primitív sebészeti technikákkal keveset lehetett biztonságosan elvégezni, a nők inkább csendben szenvedtek, nem pedig ellátást kerestek. Amikor a műtét előrehaladt, és a hosszú távú túlélési arány javult, a nők elkezdték felhívni a figyelmet a betegségre és a sikeres kezelés lehetőségére. Az Amerikai Rákellenes Társaság (később az American Cancer Society ) által az 1930-as és 1940-es években irányított „Női Hadsereg” volt az egyik első szervezett kampány. 1952-ben az első peer-to-peer támogató csoport , a "Reach to Recovery" elnevezésű, megkezdte a mastectomia utáni kórházi látogatásokat olyan nőknél, akik túlélték a mellrákot.
Az 1980-as és 1990-es évek mellrákmozgalma a 20. század nagyobb feminista mozgalmaiból és női egészségmozgalomból fejlődött ki. Ez a politikai és oktatási kampánysorozat, amelyet részben a politikailag és társadalmilag hatékony AIDS-felhívó kampányok inspiráltak, a műtét előtti másodvélemények, a kevésbé invazív sebészeti eljárások, a támogató csoportok és az ellátás egyéb előrelépéseinek széles körű elfogadását eredményezte.
Rózsaszín szalag

A rózsaszín szalag a mellrák tudatosításának legszembetűnőbb szimbóluma. Az olcsón elkészíthető rózsaszín szalagokat néha adománygyűjtésként árulják, hasonlóan a mákhoz az emléknapon . Viselhetik azokat, akiket mellrákkal diagnosztizáltak, vagy olyan termékeket azonosítanak, amelyeket a gyártó el szeretne adni a mellrák iránt érdeklődő fogyasztóknak. Az 1990-es években amerikai székhelyű vállalatok indítottak mellrák tudatosító kampányokat. Ezen ügyekkel kapcsolatos marketingkampányok részeként a vállalatok minden megvásárolt rózsaszín szalagos termékért különféle mellrák-kezdeményezéseket adományoztak.> A Wall Street Journal megjegyezte, "hogy a mellrák által kiváltott erős érzelmek egy vállalat nyereségéhez vezetnek " . Míg sok amerikai vállalat adományozott már meglévő mellrák-kezdeményezésekre, mások, például az Avon , saját mellrákalapítványt hoztak létre rózsaszín szalaggal ellátott termékek hátoldalán.
A rózsaszín szalag viselését vagy kihelyezését a gyakorlat ellenzői egyfajta slacktivizmusként kritizálták , mivel nincs gyakorlati pozitív hatása. Képmutatásként is kritizálták , mert egyesek a rózsaszín szalagot viselik, hogy jó szándékot mutassanak a mellrákos nőkkel szemben, de aztán ellenzik e nők gyakorlati céljait, például a betegjogokat és a környezetszennyezés elleni jogszabályokat . A kritikusok szerint a rózsaszín szalagok jó közérzete és a rózsaszín fogyasztás elvonja a társadalom figyelmét a mellrák megelőzése és gyógyítása terén tett előrelépés hiányáról. A nemi sztereotípiák megerősítése, valamint a nők és melleik tárgyiasítása miatt is kritizálják .< 2002-ben a Breast Cancer Action elindította a "Gondolj, mielőtt rózsaszín" kampányt a rózsaszín mosás ellen, hogy megcélozza azokat a vállalkozásokat, amelyek a mellrákot okozó termékek népszerűsítésére választották a rózsaszín kampányt. , mint például az alkoholos italok.
Mellrák kultúra
2006-os Pink Ribbons, Inc.: Breast Cancer and the Politics of Philanthropy című könyvében Samantha King azt állította, hogy a mellrák súlyos betegségből és egyéni tragédiából a túlélés és a vállalati értékesítés piac által vezérelt iparágává változott. 2010-ben Gayle Sulik azzal érvelt, hogy az emlőrák-kultúra elsődleges célja a mellrák dominanciájának fenntartása, mint a nők kiemelt egészségügyi problémája, annak a látszatának előmozdítása, hogy a társadalom hatékonyan tesz valamit az emlőrák ellen, valamint hogy fenntartsa és terjessze a mellrák kialakulását. a mellrák aktivistáinak társadalmi, politikai és pénzügyi ereje. Ugyanebben az évben Barbara Ehrenreich egy véleménycikket tett közzé a Harper's Magazine- ban , amiben arról panaszkodott, hogy a mellrák kultúrájában az emlőrák-terápiát átmenet rítusának tekintik , nem pedig betegségnek. Ahhoz, hogy beilleszkedjen ebbe a formába, az emlőrákos nőnek normalizálnia és elnőiesítenie kell megjelenését, és minimálisra kell csökkentenie azt a zavart, amelyet egészségügyi problémái okoznak másoknak. A haragot, a szomorúságot és a negativitást el kell hallgattatni. A legtöbb kulturális modellhez hasonlóan a modellnek megfelelő emberek társadalmi státuszt kapnak, ebben az esetben ráktúlélőkként . Azok a nők, akik elutasítják a modellt, kerülik, megbüntetik és megszégyenítik. A kultúrát kritizálják amiatt, hogy kislányként kezeli a felnőtt nőket, ezt bizonyítják a felnőtt nőknek adott „baba” játékok, például a rózsaszín mackók .
Hangsúly
2009-ben Christie Aschwanden amerikai tudományos újságíró bírálta, hogy az emlőrák-szűrésre fektetett hangsúly károsíthatja a nőket azáltal, hogy szükségtelen sugárzásnak, biopsziának és műtétnek vetik alá őket. A diagnosztizált emlőrákok egyharmada magától visszahúzódhat. A mammográfiás szűrés hatékonyan találja meg az életet nem veszélyeztető, tünetmentes emlőrákokat és rákot megelőző daganatokat, még akkor is, ha figyelmen kívül hagyja a súlyos daganatokat. H. Gilbert Welch rákkutató szerint a mammográfiás szűrés az "agyhalott megközelítést alkalmazza, amely szerint az a legjobb teszt, amelyik a legtöbb rákot találja", nem pedig az, amelyik veszélyes rákot talál.
2002-ben megállapították, hogy az emlőrák nagy láthatósága miatt a statisztikai eredményeket félre lehet értelmezni, például azt az állítást, hogy minden nyolcadik nőnél diagnosztizálnak mellrákot élete során – ez az állítás attól az irreális feltételezéstől függ, hogy egyetlen nő sem fog meghalni más betegségben 95 éves kora előtt. 2010-re Európában az emlőrák túlélési aránya 91% volt egy évesen és 65% 5 évesen. Az USA-ban a lokalizált emlőrák ötéves túlélési aránya 96,8%, míg a metasztázisok esetében csak 20,6%. Mivel az emlőrák prognózisa ebben a stádiumban viszonylag kedvező volt, összehasonlítva más rákos megbetegedések prognózisával, a mellrák, mint halálok a nők körében az összes rákos halálozás 13,9%-át tette ki. A nők rák okozta halálozásának második leggyakoribb oka a tüdőrák volt, amely a férfiak és nők körében világszerte a leggyakoribb rák. A javuló túlélési arány az emlőrákot a világ legelterjedtebb rákjává tette. 2010-ben a becslések szerint világszerte 3,6 millió nőnél diagnosztizáltak mellrákot az elmúlt öt évben, míg a tüdőrákot csak 1,4 millió férfi vagy női túlélő élte.
Egészségügyi különbségek az emlőrákban
Etnikai különbségek vannak az emlőrák halálozási arányában, valamint az emlőrák kezelésében. Az emlőrák a legelterjedtebb rák, amely az Egyesült Államok valamennyi etnikai csoportjában a nőket érinti. Az emlőrák előfordulása a 45 éves és idősebb fekete nők körében magasabb, mint az azonos korcsoportba tartozó fehér nők körében. A 60–84 éves fehér nőknél magasabb az emlőrák előfordulási aránya, mint a fekete nőknél. Ennek ellenére a fekete nők minden életkorban nagyobb valószínűséggel halnak meg mellrákban.
Az emlőrák kezelése nagymértékben javult az elmúlt években, de a fekete nők még mindig kisebb valószínűséggel kapnak kezelést, mint a fehér nők. Az olyan kockázati tényezők, mint a társadalmi-gazdasági státusz, a késői stádiumú vagy a mellrák diagnózisakor, a tumoraltípusok genetikai különbségei, az egészségügyi ellátáshoz való hozzáférés különbségei mind hozzájárulnak ezekhez az egyenlőtlenségekhez. A mellrákos megbetegedések közötti különbségeket befolyásoló társadalmi-gazdasági tényezők közé tartozik a szegénység, a kultúra, valamint a társadalmi igazságtalanság. A spanyol nőknél a mellrák előfordulása alacsonyabb, mint a nem spanyol nőknél, de gyakran később diagnosztizálják, mint a nagyobb daganatokkal rendelkező fehér nőknél.
A fekete nőknél általában fiatalabb korban diagnosztizálják a mellrákot, mint a fehér nőknél. A fekete nők diagnosztizálásának medián életkora 59 év, szemben a fehér nők 62 évével. A mellrák előfordulása a fekete nők körében 1975 óta évi 0,4%-kal, az ázsiai/csendes-óceáni szigetországi nők körében pedig évi 1,5%-kal nőtt 1992 óta. Az előfordulási arány stabil volt a nem spanyol ajkú fehér, spanyolajkú és őslakos nők esetében. Az ötéves túlélési arány a fekete nőknél 81%, a fehér nőknél 92%. A kínai és japán nők túlélési aránya a legmagasabb.
A szegénység az emlőrákkal kapcsolatos egyenlőtlenségek fő hajtóereje. Az alacsony jövedelmű nők kevésbé valószínű, hogy részt vesznek emlőrákszűrésen, és így nagyobb valószínűséggel diagnosztizálják őket a késői stádiumban. Az, hogy valamennyi etnikai csoporthoz tartozó nők méltányos egészségügyi ellátásban részesüljenek, beleértve az emlőszűrést, pozitívan befolyásolhatja ezeket az egyenlőtlenségeket.
Terhesség
A korai terhesség csökkenti a mellrák későbbi kialakulásának kockázatát. A mellrák kockázata is csökken a nők számának növekedésével. A mellrák a terhességet követő 5-10 évben gyakoribbá válik, de azután kevésbé gyakori, mint az általános népesség körében. Ezeket a rákos megbetegedéseket szülés utáni emlőráknak nevezik, és rosszabb kimenetelűek, beleértve a betegségek távoli terjedésének és a halálozásnak a kockázatát. A terhesség alatt vagy röviddel azután talált egyéb rákos megbetegedések megközelítőleg ugyanolyan arányban jelennek meg, mint más rákos megbetegedések hasonló korú nőknél.
Az új rák diagnosztizálása terhes nőknél nehéz, részben azért, mert a tüneteket általában a terhességgel kapcsolatos normális kellemetlenségnek tekintik. Ennek eredményeként a rákot jellemzően az átlagosnál valamivel későbbi stádiumban fedezik fel sok terhes vagy nemrégiben terhes nőnél. Egyes képalkotó eljárások, mint például az MRI-k (mágneses rezonancia képalkotás), a CT-vizsgálatok , az ultrahangok és a magzatvédő mammográfiák biztonságosnak tekinthetők a terhesség alatt; néhány más, például a PET-vizsgálat nem.
A kezelés általában ugyanaz, mint a nem terhes nők esetében. A sugárzást azonban általában kerülni kell a terhesség alatt, különösen, ha a magzati dózis meghaladja a 100 cGy-t. Egyes esetekben a kezelések egy részét vagy az összes kezelést elhalasztják a születés után, ha a rákot a terhesség késői szakaszában diagnosztizálják. Nem ritka a korai szülés a kezelés megkezdésének felgyorsítása érdekében. A műtétet általában biztonságosnak tekintik a terhesség alatt, de néhány más kezelés, különösen bizonyos kemoterápiás gyógyszerek, amelyeket az első trimeszterben adtak, növelik a születési rendellenességek és a terhesség elvesztésének (spontán vetélések és halvaszületések) kockázatát . A tervezett abortusz nem szükséges, és nem növeli az anya túlélésének vagy gyógyulásának valószínűségét.
A sugárkezelések megzavarhatják az anya azon képességét, hogy szoptassa a babát, mivel csökkenti az emlő tejtermelő képességét, és növeli a tőgygyulladás kockázatát . Ezenkívül, amikor a születés után kemoterápiát adnak, sok gyógyszer átjut az anyatejen a babához, ami károsíthatja a babát.
Az emlőrákot túlélők jövőbeni terhességét illetően gyakran félnek a rák kiújulásától. Másrészt, sokan még mindig úgy tekintik, hogy a terhesség és a szülői lét a normalitás, a boldogság és az élet beteljesülése.
Hormonok
Fogamzásgátló
Az emlőrákot túlélőknél a nem hormonális fogamzásgátlási módszereket, például a réz intrauterin eszközt (IUD) kell első vonalbeli lehetőségként alkalmazni. A progesztogén alapú módszerek, például a depot medroxiprogeszteron-acetát , a progesztogént tartalmazó IUD vagy a csak progesztogén tabletták rosszul vizsgálták, de lehetséges, hogy megnövekszik a rák kiújulásának kockázata, de alkalmazhatók, ha a pozitív hatások meghaladják ezt a lehetséges kockázatot.
Menopauza hormonpótlás
Az emlőrákot túlélőknél ajánlott először a nem hormonális lehetőségeket mérlegelni a menopauza okozta hatások esetén, mint például a biszfoszfonátokat vagy a szelektív ösztrogén receptor modulátorokat (SERM) a csontritkulás, és a hüvelyi ösztrogént a helyi tünetek esetén. A mellrák utáni szisztémás hormonpótló terápia megfigyeléses vizsgálatai általában megnyugtatóak. Ha az emlőrák után hormonpótlásra van szükség, a csak ösztrogén terápia vagy a progesztogént tartalmazó intrauterin eszközzel végzett ösztrogénterápia biztonságosabb megoldás lehet, mint a kombinált szisztémás terápia.
Kutatás
A kezeléseket klinikai vizsgálatok során értékelik. Ez magában foglalja az egyes gyógyszereket, a gyógyszerek kombinációit, valamint a sebészeti és sugárkezelési technikákat. A vizsgálatok új típusú célzott terápiát , rákvakcinákat , onkolitikus viroterápiát , génterápiát és immunterápiát foglalnak magukban .
A legújabb kutatásokról évente beszámolnak olyan tudományos üléseken, mint az Amerikai Klinikai Onkológiai Társaság , a San Antonio Breast Cancer Symposium és a St. Gallen Onkológiai Konferencia a svájci St. Gallenben. Ezeket a tanulmányokat szakmai társaságok és más szervezetek felülvizsgálják, és iránymutatásként fogalmazzák meg az egyes kezelési csoportok és kockázati kategóriák számára.
A fenretinidet , egy retinoidot is tanulmányozzák a mellrák kockázatának csökkentésére. Különösen a ribociklib és az endokrin terápia kombinációi képezték klinikai vizsgálatok tárgyát.
Egy 2019-es áttekintés mérsékelten bizonyos bizonyítékokat talált arra vonatkozóan, hogy az emlőrákműtét előtt adott antibiotikum segített megelőzni a műtéti hely fertőzését (SSI) . További vizsgálatok szükségesek a leghatékonyabb antibiotikum protokoll és alkalmazás meghatározásához azonnali emlőrekonstrukción áteső nőknél.
Krioabláció
2014-től kezdődően a krioablációt tanulmányozzák, hogy kiderüljön, helyettesítheti-e a lumpectomiát kis rákos megbetegedések esetén. A 2 centiméternél kisebb daganatos betegeknél kísérleti bizonyítékok állnak rendelkezésre. Olyanoknál is alkalmazható, akiknél a műtét nem lehetséges. Egy másik áttekintés szerint a krioabláció ígéretesnek tűnik a kis méretű korai emlőrák esetében.
Mellrák sejtvonalak
Az emlőkarcinómákkal kapcsolatos jelenlegi ismeretek egy része emlőrákból származó sejtvonalakon végzett in vivo és in vitro vizsgálatokon alapul . Ezek korlátlan forrást biztosítanak a homogén önreplikálódó anyaghoz, amely mentes a szennyező stromasejtektől , és gyakran könnyen tenyészthető egyszerű szabványos tápközegben . Az első leírt emlőrák sejtvonalat, a BT-20-at 1958-ban hozták létre. Azóta, és az ezen a területen végzett folyamatos munka ellenére, a kapott állandó sejtvonalak száma feltűnően alacsony (körülbelül 100). Valójában az elsődleges daganatokból származó mellrák sejtvonalak tenyésztésére tett kísérletek nagyrészt sikertelenek voltak. Ezt a gyenge hatékonyságot gyakran az életképes daganatsejtek környező sztrómájukból történő extrakciójával kapcsolatos technikai nehézségek okozták. A legtöbb rendelkezésre álló emlőrák sejtvonal metasztatikus daganatokból, főként pleurális folyadékgyülemekből származik . Az effúziók általában nagyszámú disszociált, életképes tumorsejtet eredményeztek, amelyek fibroblasztokkal és egyéb tumoros sztrómasejtekkel csekély mértékben vagy egyáltalán nem szennyezettek. A jelenleg használt BCC vonalak közül sokat az 1970-es évek végén hozták létre. Közülük nagyon kevés, nevezetesen az MCF-7 , a T-47D , az MDA-MB-231 és az SK-BR-3 az összes olyan absztrakt több mint kétharmadát teszik ki, amelyek az említett emlőrák sejtvonalakkal kapcsolatos tanulmányokról számolnak be, amint azt egy Medline alapú felmérés.
Molekuláris markerek
Metabolikus markerek
Klinikailag a mellrákban a leghasznosabb metabolikus markerek az ösztrogén- és progeszteronreceptorok, amelyeket a hormonterápiára adott válasz előrejelzésére használnak. Az emlőrák új vagy potenciálisan új markerei közé tartozik a BRCA1 és BRCA2 az emlőrák kialakulásának magas kockázatának kitett személyek azonosítására, a HER-2 és az SCD1 a terápiás sémákra adott válasz előrejelzésére, valamint az urokináz plazminogén aktivátor , a PA1-1 és az SCD1 a prognózis értékelésére. .
Más állatok
- Emlődaganat emlőrák miatt más állatokban
- Az emlőrák metasztázisának egérmodellei
Hivatkozások
Külső linkek
|
Könyvtári források a mellrákról |