Calmodulin - Calmodulin
| Calmodulin | |||||||
|---|---|---|---|---|---|---|---|

| |||||||
| Azonosítók | |||||||
| Szimbólum | Bütyök | ||||||
| EKT | 1OSA | ||||||
| UniProt | P62158 | ||||||
| |||||||

Calmodulin ( CaM ) (rövidítése cal cium- Modul ated Prote a ) egy többfunkciós közbenső kalcium-kötő messenger expresszált fehérjét minden eukarióta sejtekben . Ez a Ca 2+ másodlagos hírvivő intracelluláris célpontja , és a Ca 2+ megkötése szükséges a kalmodulin aktiválásához. Miután a kalmodulin a Ca 2+ -hoz kötődött, a kalcium -jelátviteli út részeként működik, módosítva kölcsönhatásait különböző célfehérjékkel, például kinázzal vagy foszfatázzal .
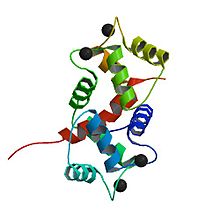
Szerkezet
A kalmodulin egy kicsi, nagyon konzervált fehérje, amely 148 aminosav hosszú (16,7 kDa). A fehérjének két megközelítőleg szimmetrikus gömb alakú doménje van (az N- és a C-domén), amelyek mindegyike pár EF kézmotívumot tartalmaz, amelyeket rugalmas linkerrégió választ el, összesen négy Ca 2+ kötőhelyet, kettőt mindegyik gömbös doménben. Ca 2+ -mentes állapotban a négy EF -kezet alkotó hélixek kompakt helyzetben összeomlanak, és a központi linker rendezetlen; Ca 2+ telített állapotban az EF-kézi csavarok nyitott tájolásúak, nagyjából merőlegesek egymásra, és a központi linker kiterjesztett alfa-hélixet képez a kristályszerkezetben, de oldatban nagyrészt rendezetlen marad. A C-domén nagyobb kötési affinitással rendelkezik a Ca 2+ -hoz, mint az N-domén.
A kalmodulin szerkezetileg nagyon hasonlít a troponin C -hez , egy másik Ca 2+ -kötő fehérjéhez, amely négy EF -kéz motívumot tartalmaz. A troponin C azonban további alfa-hélixet tartalmaz N-terminálisán, és konstitutívan kötődik célpontjához, a troponin I-hez . Ezért nem azonos a célfelismerés sokféleségével, mint a kalmodulin.
A rugalmasság fontossága a kalmodulinban
A Calmodulin képes felismerni a célfehérjék hatalmas skáláját, nagyrészt strukturális rugalmasságának köszönhető. A központi linker domén rugalmassága mellett az N- és C-domének nyitott-zárt konformációs cikluson mennek keresztül Ca 2+ -kötött állapotban. A kalmodulin nagy szerkezeti változékonyságot is mutat, és jelentős konformációs ingadozásokon megy keresztül, amikor a célokhoz kötődik. Ezenkívül a kalmodulin és legtöbb célpontja közötti kötődés túlnyomórészt hidrofób jellege lehetővé teszi a célfehérje -szekvenciák széles körének felismerését. Ezek a jellemzők együtt lehetővé teszik, hogy a kalmodulin felismerjen mintegy 300 célfehérjét, amelyek különböző CaM-kötő szekvencia-motívumokat mutatnak.
Gépezet
A Ca 2+ EF-kezek általi megkötése az N- és C-domén megnyílását okozza, ami kiteszi a hidrofób célkötő felületeket. Ezek a felületek kölcsönhatásba lépnek a célfehérjék komplementer, nem poláris szegmenseivel, amelyek jellemzően terjedelmes hidrofób aminosavak csoportjaiból állnak, amelyeket 10-16 poláris és/vagy bázikus aminosav választ el. A kalmodulin rugalmas központi doménje lehetővé teszi, hogy a fehérje körülvegye a célpontot, bár ismertek más kötési módok is. A kalodulin „kanonikus” célpontjai, mint például a miozin könnyűlánc-kinázok és a CaMKII , csak a Ca 2+ -hoz kötött fehérjéhez kötődnek , míg egyes fehérjék, például a NaV-csatornák és az IQ-motívumú fehérjék szintén kötődnek a kalmodulinhoz. Ca 2+ . A kalmodulin kötődése konformációs átrendeződést indukál a célfehérjében a „kölcsönösen indukált illeszkedés” révén, ami a célfehérje funkciójának megváltozásához vezet.
A kalmodulin által megkötött kalcium jelentős kooperativitást mutat , így a kalmodulin szokatlan példája a monomer (egyláncú) kooperatív-kötő fehérjéknek. Ezenkívül a célkötés megváltoztatja a kalmodulin Ca 2+ -ionok iránti kötődési affinitását , ami összetett alloszterikus kölcsönhatást tesz lehetővé a Ca 2+ és a célkötési kölcsönhatások között . A célkötődésnek a Ca 2+ affinitásra gyakorolt hatása feltételezhető, hogy lehetővé teszi a kalmodulinhoz konstitutívan kötődő fehérjék, például a kis vezetőképességű Ca 2+ -aktivált kálium (SK) csatornák Ca 2+ aktiválását .
Bár a kalmodulin elsősorban Ca 2+ -kötő fehérjeként működik, más fémionokat is koordinál. Például tipikus Mg 2+ (0,5 - 1,0 mM) sejten belüli koncentráció és nyugalmi Ca 2+ (100 nM) koncentráció jelenlétében a kalmodulin Ca 2+ kötőhelyei legalább részben telítettek Mg 2+ -al . Ezt az Mg 2+ -ot a jelzéses események által generált magasabb Ca 2+ koncentráció váltja ki. Hasonlóképpen, a Ca 2+ -ot más fémionok, például a háromértékű lantanidok is kiszoríthatják, amelyek még erősebben kapcsolódnak a kalmodulin kötődési zsebeihez, mint a Ca 2+ . Bár az ilyen ionok torzítják a kalmodulin szerkezetét, és in vitro szűkösségük miatt általában nem fiziológiailag relevánsak , mindazonáltal széles körű tudományos felhasználást láttak a kalmodulin szerkezetének és működésének riportereiként.
Szerep az állatokban
A kalmodulin számos kulcsfontosságú folyamatot közvetít, például gyulladást , anyagcserét , apoptózist , simaizom-összehúzódást , intracelluláris mozgást, rövid- és hosszú távú memóriát , valamint az immunválaszt . A kalcium részt vesz az intracelluláris jelzőrendszerben azáltal, hogy diffúz másodlagos hírvivőként működik a kezdeti ingerekhez. Ezt úgy teszi meg, hogy különböző célpontokat köt a sejtbe, beleértve számos enzimet , ioncsatornát , aquaporinokat és más fehérjéket. A kalmodulin számos sejttípusban expresszálódik, és különböző szubcelluláris helyekkel rendelkezik, beleértve a citoplazmát , az organellákon belül , vagy a plazmához vagy az organellák membránjához kapcsolódik, de mindig intracellulárisan található. A kalmodulin által megkötött fehérjék nagy része nem képes önmagában megkötni a kalciumot, és kalcium -érzékelőt és jelátalakítót használ. A kalmodulin felhasználhatja az endoplazmatikus retikulum és a szarkoplazmatikus retikulum kalciumraktárait is . A kalmodulin transzláció utáni módosításokon, például foszforilezésen , acetilezésen , metilezésen és proteolitikus hasításon eshet át , amelyek mindegyike képes módosítani a hatását.
Konkrét példák
Szerepe a simaizmok összehúzódásában
A kalmodulin fontos szerepet játszik a gerjesztő összehúzódás (EC) összekapcsolásában és a kereszthíd-ciklus megindításában a simaizomzatban , ami végül simaizom-összehúzódást okoz. A simaizmok összehúzódásának aktiválásához a miozin könnyű lánc fejét foszforilezni kell. Ezt a foszforilezést miozin könnyű lánc (MLC) kináz végzi . Ezt az MLC kinázt egy kalmodulin aktiválja, amikor megköti a kalcium, így a simaizmok összehúzódása a kalcium jelenlététől függ, a kalmodulin megkötése és az MLC kináz aktiválása révén.
Egy másik módja annak, hogy a kalmodulin befolyásolja az izomösszehúzódást, a Ca 2+ mozgásának szabályozása mind a sejt-, mind a szarkoplazmatikus retikulum membránon keresztül. A Ca 2+ csatornákat , például a szarkoplazmatikus retikulum ryanodin receptorát , a kalciumhoz kötődő kalmodulin gátolhatja, ezáltal befolyásolva a sejt teljes kalciumszintjét. A kalciumszivattyúk kivonják a kalciumot a citoplazmából, vagy tárolják az endoplazmatikus retikulumban, és ez a szabályozás segít szabályozni számos folyamatot.
Ez a kalmodulin nagyon fontos funkciója, mert közvetve szerepet játszik minden fiziológiai folyamatban, amelyet a simaizom -összehúzódás befolyásol, például az emésztést és az artériák összehúzódását (ami segít a vér elosztásában és a vérnyomás szabályozásában ).
Szerep az anyagcserében
Calmodulin fontos szerepet játszik az aktiválási foszforiláz kináz , ami végső soron glükózzá történő lehasítás glikogén által glikogén foszforiláz .
A kalmodulin szintén fontos szerepet játszik a lipid anyagcserében, mivel befolyásolja a kalcitonint . A kalcitonin egy polipeptid hormon, amely csökkenti a vér Ca 2+ szintjét és aktiválja a G fehérje kaszkádokat, ami cAMP képződéshez vezet. A kalcitonin hatása blokkolható a kalmodulin hatásának gátlásával, ami arra utal, hogy a kalmodulin döntő szerepet játszik a kalcitonin aktiválásában.
Szerep a rövid és hosszú távú memóriában
A Ca 2+ /kalmodulin-függő protein-kináz II (CaMKII) kulcsfontosságú szerepet játszik a szinaptikus plaszticitás egyik típusában, amelyet hosszú távú potenciálásnak (LTP) neveznek, és amely megköveteli a kalcium /kalmodulin jelenlétét. A CaMKII hozzájárul az AMPA receptor foszforilációjához , ami növeli az AMPA receptorok érzékenységét. Továbbá a kutatások azt mutatják, hogy a CaMKII gátlása zavarja az LTP -t.
Szerep a növényekben

Míg az élesztőknek csak egyetlen CaM génjük van, a növények és a gerincesek CaM gének evolúciósan konzervált formáját tartalmazzák. A különbség a növények és állatok között a Ca 2+ jelzésben az, hogy a növények az evolúciósan konzervált formában kívül a CaM kiterjesztett családját is tartalmazzák. A kalmodulinok alapvető szerepet játszanak a növények fejlődésében és a környezeti ingerekhez való alkalmazkodásban.
A kalcium kulcsfontosságú szerepet játszik a sejtfal és a sejtmembránrendszer szerkezeti integritásában. A magas kalciumszint azonban mérgező lehet a növény sejtenergia -anyagcseréjére, és így a Ca 2+ -koncentráció a citoszolban szubmikromoláris szinten marad, ha a citoszolos Ca 2+ -ot eltávolítják akár az apoplasztból , akár az intracelluláris organellák lumenéből . A megnövekedett beáramlás és kiáramlás következtében létrejövő Ca 2+ impulzusok sejtjelekként hatnak a külső ingerekre, például hormonokra, fényre, gravitációra, abiotikus stressztényezőkre és a kórokozókkal való kölcsönhatásokra.
A növények CaM-hez kapcsolódó fehérjéket (CML) tartalmaznak, a tipikus CaM fehérjék mellett. A CML -ek körülbelül 15% -os aminosav -hasonlóságot mutatnak a tipikus CaM -ekkel. Az Arabidopsis thaliana körülbelül 50 különböző CML gént tartalmaz, ami azt a kérdést vonja maga után, hogy ezek a különböző fehérjék milyen célokat szolgálnak a sejtműködésben. Minden növényfaj ezt a diverzitást mutatja a CML génekben. A különböző CaM-ek és CML-ek affinitásukban különböznek a CaM-szabályozott enzimek kötéséhez és aktiválásához in vivo . A CaM vagy a CML -ek szintén megtalálhatók a különböző organellerekben.
A növények növekedése és fejlődése
Az Arabidopsis -ban a DWF1 fehérje enzimatikus szerepet játszik a brassinoszteroidok , szteroid hormonok bioszintézisében a növényekben, amelyek szükségesek a növekedéshez. A CaM és a DWF1 között kölcsönhatás lép fel, és a DWF1, amely nem képes megkötni a CaM -et, nem képes szabályos növekedési fenotípust előállítani a növényekben. Ezért a CaM elengedhetetlen a DWF1 funkcióhoz a növények növekedésében.
A CaM -kötő fehérjékről ismert, hogy szabályozzák a növények reprodukciós fejlődését. Például a dohányban lévő CaM-kötő protein-kináz a virágzás negatív szabályozójaként működik. Ezek a CaM-kötő fehérje-kinázok azonban a dohány hajtáscsúcs- merisztémájában is jelen vannak, és ezeknek a kinázoknak a magas koncentrációja a merisztémában késleltetett átmenetet okoz a növény virágzásában.
Az S -lókusz receptor kináz (SRK) egy másik protein kináz, amely kölcsönhatásba lép a CaM -mel. SRK részt vesz a ön-inkompatibilitás válaszok, így az a pollen-bibe kölcsönhatások Brassica .
Az Arabidopsis -ban található CaM -célok a pollenfejlesztésben és a megtermékenyítésben is részt vesznek. A Ca 2+ transzporterek elengedhetetlenek a pollencsövek növekedéséhez. Ezért állandó Ca 2+ gradienst tartanak fenn a pollencső csúcsán, hogy meghosszabbodjanak a megtermékenyítés során. Hasonlóképpen, a CaM elengedhetetlen a pollencső csúcsánál is, ahol elsődleges szerepe a pollencső növekedésének irányítása.
Kölcsönhatás a mikrobákkal
A csomók kialakulása
A Ca 2+ jelentős szerepet játszik a hüvelyesek csomóinak kialakulásában. A nitrogén nélkülözhetetlen elem a növényekben és sok hüvelyes növényben, amelyek nem képesek a nitrogént önállóan megkötni, szimbiotikusan párosodnak a nitrogént rögzítő baktériumokkal, amelyek a nitrogént ammóniává redukálják. Ez a hüvelyes- Rhizobium kölcsönhatás létrehozása megköveteli a Nod faktort, amelyet a Rhizobium baktériumok termelnek . A Nod faktort a hüvelyesek csomóképződésében részt vevő gyökérszőrsejtek ismerik fel. A különböző természetű Ca 2+ válaszok a Nod -faktor felismerésében vesznek részt. Ca 2+ fluxus van a gyökérszőr végén, amelyet kezdetben a Ca 2+ ismétlődő ingadozása követ a citoszolban, és Ca 2+ tüske is előfordul a mag körül. A DMI3, amely a Ca 2+ spiking aláírástól lefelé eső Nod faktor jelző funkciók alapvető génje , felismerheti a Ca 2+ aláírást. Ezenkívül a Medicago és a Lotus számos CaM és CML génjét csomókban fejezik ki.
Kórokozó védelem
A növények által a kórokozók ellen alkalmazott védekezési stratégiák széles skálája közül a Ca 2+ jelzés egyre gyakoribb. A szabad Ca 2+ szint a citoplazmában nő a patogén fertőzés hatására. Az ilyen jellegű Ca 2+ aláírások általában aktiválják a növény védelmi rendszerét a védekezéssel kapcsolatos gének és a túlérzékeny sejthalál indukálásával. A CaM-ek, a CML-ek és a CaM-kötő fehérjék a növényvédelmi jelátviteli utak nemrégiben azonosított elemei. A dohányban , babban és paradicsomban található számos CML gén reagál a kórokozókra. A CML43 egy CaM-hez kapcsolódó fehérje, amelyet az APR134 génből izolálva az Arabidopsis betegség-rezisztens leveleiben génexpressziós elemzés céljából gyorsan indukálnak, amikor a leveleket Pseudomonas syringae-vel oltják . Ezek a gének megtalálhatók a paradicsomban is ( Solanum lycopersicum ). Az APR134 -ből származó CML43 szintén kötődik a Ca 2+ ionokhoz in vitro, ami azt mutatja, hogy a CML43 és az APR134 tehát részt vesz a Ca 2+ -függő jelátvitelben a növényi bakteriális kórokozókra adott immunválasz során. A Arabidopsis thaliana CML9 expresszióját gyorsan kiváltják a fitopatogén baktériumok, a flagellin és a szalicilsav. A szójabab SCaM4 és SCaM5 expressziója transzgenikus dohányban és Arabidopsisban a kórokozórezisztenciához kapcsolódó gének aktiválódását okozza, és emellett fokozott rezisztenciát eredményez a kórokozó fertőzés széles spektrumával szemben. Ugyanez nem igaz a szójabab SCaM1 és SCaM2 esetében, amelyek erősen konzervált CaM -izoformák. Az At BAG6 fehérje CaM-kötő fehérje, amely csak Ca 2+ hiányában kötődik a CaM-hez, és nem jelenlétében. A BAG6 -nál felelős a programozott sejthalál túlérzékenységi válaszáért a kórokozó fertőzés terjedésének megakadályozása vagy a kórokozó növekedés korlátozása érdekében. A CaM -kötő fehérjék mutációi súlyos hatásokhoz vezethetnek a növények kórokozó fertőzésekkel szembeni védekező válaszában. A ciklikus nukleotid-kapucsatornák (CNGC-k) funkcionális fehérjecsatornák a plazmamembránban, amelyek átfedésben lévő CaM-kötőhelyekkel kétértékű kationokat szállítanak, mint például a Ca 2+ . Azonban a CNGC -k pozicionálásának pontos szerepe ezen a növényvédelmi úton még mindig nem világos.
Abiotikus stresszválasz növényekben
Az intracelluláris Ca 2+ szint változását jelként használják a mechanikai ingerekre, ozmotikus és sós kezelésekre, valamint a hideg- és hősokkokra adott különböző válaszokra. A különböző gyökérsejt -típusok különböző Ca 2+ -válaszokat mutatnak az ozmotikus és sós igénybevételre, és ez magában foglalja a Ca 2+ -minták sejtes sajátosságait . A külső stressz hatására a CaM aktiválja a glutamát -dekarboxilázt (GAD), amely katalizálja az L -glutamát GABA -vé való átalakulását . A GABA szintézis szigorú ellenőrzése fontos a növények fejlődése szempontjából, és ezért a megnövekedett GABA szint alapvetően befolyásolhatja a növények fejlődését. Ezért a külső stressz befolyásolhatja a növények növekedését és fejlődését, és a CaM részt vesz az útban, amely szabályozza ezt a hatást.
Növényi példák
Cirok
A növényi cirok jól bevált modell szervezet, és alkalmazkodhat a forró és száraz környezethez. Emiatt modellként használják a kalmodulin növényekben betöltött szerepének tanulmányozására. A cirok palántákat tartalmaz, amelyek glicinben gazdag RNS -kötő fehérjét , SbGRBP -t expresszálnak. Ez a fehérje modulálható úgy, hogy meleget használunk stresszorként. Egyedülálló elhelyezkedése a sejtmagban és a citoszolban demonstrálja a kölcsönhatást a kalmodulinnal, amely Ca 2+ használatát igényli . Azáltal, hogy a növényt sokoldalú stresszhatásoknak teszi ki, különböző fehérjéket okozhat, amelyek lehetővé teszik a növényi sejtek számára, hogy tolerálják a környezeti változásokat, és elnyomják őket. Ezek a modulált stresszfehérjék kölcsönhatásba lépnek a CaM -mel. A CaMBP gének kifejezve a cirok ábrázolja, mint a „modell termés” kutatása a tolerancia hő- és szárazság stressz .
Arabidopsis
Egy Arabidopsis thaliana vizsgálatban több száz különböző fehérje bizonyította a növények CaM -hez való kötődésének lehetőségét.
Családtagok
- Calmodulin 1 ( CALM1 )
- Calmodulin 2 ( CALM2 )
- Calmodulin 3 ( CALM3 )
- kalmodulin 1 pszeudogén 1 ( CALM1P1 )
- Calmodulin-szerű 3 ( CALML3 )
- Calmodulin-szerű 4 ( CALML4 )
- Calmodulin-szerű 5 ( CALML5 )
- Calmodulin-szerű 6 ( CALML6 )
Más kalcium-kötő fehérjék
A kalmodulin a kalciumkötő fehérjék két fő csoportjának egyikébe tartozik, az EF kézfehérjéknek. A másik csoport, az annexinek , megkötik a kalciumot és a foszfolipideket, például a lipokortint . Sok más fehérje megköti a kalciumot, bár a kalcium megkötése nem tekinthető fő funkciójuknak a sejtben.
Lásd még
- Proteopedia oldal a Calmodulinhoz és konformációs változásához
- Fehérje kináz
- Ca 2+ /kalmodulin-függő protein-kináz
Hivatkozások
Külső linkek
- "Myelin-asszociált glikoprotein" . A hónap molekulája . RCSB PDB. 2020. július. Archiválva az eredetiből 2010-05-29 . Letöltve 2021-06-19 .
- Nelson M, Chazin W. "A Calmodulin honlapja" . EF-Hand Calcium-Binding Proteins Data Library . Vanderbilt Egyetem . Letöltve: 2008-03-22 .
- Ikura M (2000). "Calmodulin cél adatbázis" . Journal of Structural and Functional Genomics . Ontario Cancer Institute, Torontói Egyetem. 1 (1): 8–14. doi : 10.1023/a: 1011320027914 . PMID 12836676 . S2CID 23097597 . Letöltve: 2008-03-22 .
- Calmodulin az amerikai National Library of Medicine orvosi tárgyszórendszere (mm)
- InterPro : IPR015754