Méhnyakrák - Cervical cancer
| Méhnyakrák | |
|---|---|
 | |
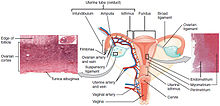
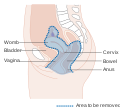
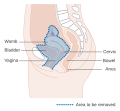
| A méhnyakrák elhelyezkedése és példa a normális és kóros sejtekre | |
| Kiejtés | |
| Különlegesség | Onkológia |
| Tünetek |
Korai : nincs Később : hüvelyi vérzés , kismedencei fájdalom , fájdalom a közösülés során |
| Szokásos kezdet | 10-20 év felett |
| Típusok | Pikkelysömör , adenokarcinóma , mások |
| Okoz | Humán papillomavírus fertőzés (HPV) |
| Rizikó faktorok | Dohányzás , gyenge immunrendszer , fogamzásgátló tabletták , fiatal korban való szexkezdés, sok szexuális partner vagy sok szexpartnerrel rendelkező partner |
| Diagnosztikai módszer | Nyaki szűrés, majd biopszia |
| Megelőzés | Rendszeres méhnyakszűrést, HPV-vakcinák , a szexuális közösülés a kondomok , szexuális önmegtartóztatás |
| Kezelés | Sebészet , kemoterápia , sugárterápia , immunterápia |
| Prognózis |
Ötéves túlélési arány : 68% (USA) 46% ( India ) |
| Frekvencia | 604 127 új eset (2020) |
| Halálozások | 341 831 (2020) |
A méhnyakrák egy rákos eredő méhnyak . Ennek oka a sejtek rendellenes növekedése , amelyek képesek behatolni vagy elterjedni a test más részeire. Kezdetben általában nem észlelnek tüneteket. A későbbi tünetek közé tartozhat a kóros hüvelyi vérzés , a kismedencei fájdalom vagy a nemi közösülés során fellépő fájdalom . Bár a szex utáni vérzés nem lehet komoly, méhnyakrák jelenlétére is utalhat.
A humán papillomavírus fertőzés (HPV) az esetek több mint 90% -át okozza; a legtöbb HPV -fertőzésben szenvedő embernél azonban nem alakul ki méhnyakrák. További kockázati tényezők közé tartozik a dohányzás , a gyenge immunrendszer , a fogamzásgátló tabletták , a fiatal nemi élet megkezdése és a sok szexuális partner, de ezek kevésbé fontosak. A méhnyakrák jellemzően a rák előtti változásokból alakul ki 10-20 év alatt. A méhnyakrákos esetek mintegy 90% -a laphámrák , 10% -a adenokarcinóma , és kis számban más típusúak. A diagnózis általában méhnyak szűréssel, majd biopsziával történik . Ezután orvosi képalkotást végeznek annak megállapítására, hogy a rák elterjedt -e vagy sem.
A HPV-vakcinák a víruscsalád két-hét magas kockázatú törzse ellen védenek, és a méhnyakrák akár 90% -át is megakadályozhatják. Mivel a rák kockázata továbbra is fennáll, az irányelvek a rendszeres Pap -tesztek folytatását javasolják . A megelőzés egyéb módjai közé tartozik, hogy kevés vagy egyáltalán nincs szexuális partner, és óvszer . A méhnyakrák szűrése a Pap -teszt vagy az ecetsav segítségével azonosíthatja a rák előtti elváltozásokat, amelyek kezelése megakadályozhatja a rák kialakulását. A kezelés állhat műtét , kemoterápia és sugárterápia valamilyen kombinációjából . Az ötéves túlélési arány az Egyesült Államokban 68%. Az eredmények azonban nagyban függenek attól, hogy a rákot milyen korán észlelik.
Világszerte a méhnyakrák a rák negyedik leggyakoribb oka és a nők negyedik leggyakoribb rákos halálának oka. 2012 -ben becslések szerint 528 000 méhnyakrákos eset fordult elő, 266 000 halálesettel. Ez a rákos megbetegedések és halálozások összességének 8% -a. A méhnyakrák körülbelül 70% -a és a halálozások 90% -a a fejlődő országokban fordul elő . Az alacsony jövedelmű országokban a rákos halálozás egyik leggyakoribb oka. A fejlett országokban a méhnyak -szűrési programok széles körű alkalmazása drámaian csökkentette a méhnyakrák arányát. Az orvosi kutatások során a leghíresebb halhatatlanná vált sejtvonalat , HeLa néven Henrietta Lacks nevű nő méhnyakrák sejtjeiből fejlesztették ki .
jelek és tünetek
A méhnyakrák korai stádiuma teljesen mentes lehet a tünetektől . A hüvelyi vérzés , az érintkezési vérzés (az egyik leggyakoribb forma a nemi közösülés utáni vérzés), vagy (ritkán) a hüvelyi tömeg rosszindulatú daganat jelenlétére utalhat. Továbbá, mérsékelt fájdalom a közösülés során és a hüvelyváladék a méhnyakrák tünetei. Előrehaladott betegség esetén áttétek lehetnek a hasban , a tüdőben vagy máshol.
A fejlett méhnyakrák tünetei a következők lehetnek: étvágytalanság , súlycsökkenés, fáradtság, medencefájdalom, hátfájás, lábfájdalom, duzzadt lábak, erős hüvelyi vérzés, csonttörések és (ritkán) vizelet- vagy ürülékhüvely a hüvelyből. A zuhanyozás vagy a kismedencei vizsgálat utáni vérzés a méhnyakrák gyakori tünete.
Okoz
A HPV bizonyos típusainak fertőzése a méhnyakrák legnagyobb kockázati tényezője, ezt követi a dohányzás. A HIV -fertőzés szintén kockázati tényező. A méhnyakrák minden oka azonban nem ismert, és számos más tényező is szerepet játszik.
Humán papillómavírus
A 16. és 18. típusú HPV okozza a méhnyakrákos megbetegedések 75% -át világszerte, míg a 31 -es és a 45 -ös további 10% -ot.
Azok a nők, akik szexelnek olyan férfiakkal, akiknek sok más szexuális partnere van, vagy nők, akiknek sok szexuális partnere van, nagyobb kockázatot jelentenek.
Az ismert 150-200 HPV-típus közül 15 a magas kockázatú típusok közé tartozik (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 és 82) , három valószínű magas kockázatú (26, 53 és 66), 12 pedig alacsony kockázatú (6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 és CP6108).
A genitális szemölcsöket , amelyek a hámsejtek jóindulatú daganatának egyik formája , szintén a HPV különböző törzsei okozzák. Ezek a szerotípusok azonban általában nem kapcsolódnak a méhnyakrákhoz. Gyakori a több törzs egyidejű alkalmazása, beleértve azokat is, amelyek méhnyakrákot okozhatnak, valamint szemölcsöket. Általában úgy vélik, hogy a HPV -fertőzés szükséges a méhnyakrák kialakulásához.
Dohányzó
Az aktív és passzív cigaretta dohányzás növeli a méhnyakrák kockázatát. A HPV-fertőzött nők körében a jelenlegi és a korábbi dohányosok nagyjából kétszer-háromszorosa az invazív rák előfordulásának. A passzív dohányzás is fokozott kockázattal jár, de kisebb mértékben.
A dohányzást összefüggésbe hozták a méhnyakrák kialakulásával is. A dohányzás számos módon növelheti a nők kockázatát, amelyek lehetnek közvetlen és közvetett módszerek a méhnyakrák kiváltására. A rákos megbetegedés közvetlen módja a dohányos, nagyobb esélye van a méhnyakon belüli intraepithelialis neoplasia (CIN3) előfordulására, amely méhnyakrák kialakulásának lehetőségével jár. Amikor a CIN3 elváltozások rákhoz vezetnek, a legtöbbjükben a HPV vírus segít, de ez nem mindig van így, ezért tekinthető a méhnyakrák közvetlen kapcsolatának. Úgy tűnik, hogy a nagy dohányzás és a hosszú távú dohányzás nagyobb kockázatot jelent a CIN3 elváltozások kialakulására, mint a könnyebb dohányzás vagy egyáltalán nem dohányzás. Bár a dohányzást összefüggésbe hozták a méhnyakrákkal, elősegíti a HPV kialakulását, amely az ilyen típusú rák fő oka. Ezenkívül nemcsak a HPV kialakulásában segít, hanem abban az esetben is, ha a nő már HPV-pozitív, még nagyobb a valószínűsége a méhnyakrák megbetegedésének.
Szájon át szedhető fogamzásgátló
Az orális fogamzásgátlók hosszú távú alkalmazása növeli a méhnyakrák kockázatát a HPV-ben szenvedő nőknél. Azoknál a nőknél, akik 5–9 éve használnak orális fogamzásgátlót, az invazív rák előfordulási gyakorisága körülbelül háromszorosa, és azoknak, akik 10 évig vagy tovább használták, körülbelül négyszerese a kockázat.
Többes terhesség
A sok terhesség növeli a méhnyakrák kockázatát. A HPV-fertőzött nők körében azok a nők, akiknek hét vagy több teljes terhessége volt, körülbelül négyszer nagyobb a rák kockázata a terhesség nélküli nőkhöz képest, és kétszer-háromszor nagyobb a kockázata azoknak a nőknek, akiknek egy vagy két teljes idejű terhessége volt. terhességek.
Diagnózis
Biopszia
A Pap -teszt szűrővizsgálatként használható , de a méhnyakrák esetek akár 50% -ában hamis negatív eredményt ad. További aggodalmak a Pap -tesztek elvégzésének költségei, amelyek megfizethetetlenné teszik őket a világ számos területén.
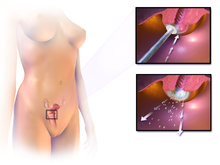
A méhnyakrák vagy a rák előtti diagnózis megerősítéséhez a méhnyak biopsziája szükséges. Ezt gyakran kolposzkópiával , a méhnyak nagyított szemrevételezésével végzik, amelyet híg ecetsav (pl. Ecet ) oldat segítségével segítenek kiemelni a méhnyak felszínén található rendellenes sejtek, vizuális kontrasztot biztosítva a normál szövetek mahagóni barnával történő festésével. Lugol jódja. A méhnyak biopsziájához használt orvosi eszközök közé tartozik a lyukasztó csipesz . A diagnózis részét képezi a kolposzkópiás lenyomat, a betegség súlyosságának vizuális ellenőrzésen alapuló becslése. További diagnosztikai és kezelési eljárások a hurok elektromos kivágási eljárása és a méhnyak konizációja , amelyben a méhnyak belső bélését eltávolítják, hogy kórosan megvizsgálják. Ezeket akkor kell elvégezni, ha a biopszia megerősíti a súlyos méhnyaki intraepithelialis neoplaziát .

Gyakran a biopszia előtt az orvos orvosi képalkotást kér, hogy kizárja a női tünetek egyéb okait. Képalkotó módszereket, például ultrahangot , CT -vizsgálatot és MRI -t használtak a váltakozó betegségek, a daganat terjedésének és a szomszédos szerkezetekre gyakorolt hatás keresésére. Jellemzően heterogén tömegként jelennek meg a méhnyakon.
Az olyan beavatkozások, mint például az eljárás közbeni zenehallgatás és az eljárás monitoron történő megtekintése, csökkenthetik a vizsgálattal kapcsolatos szorongást.
Rákellenes elváltozások
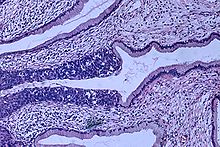
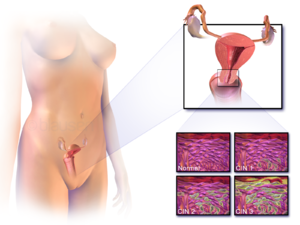
A méhnyakon belüli intraepithelialis neoplaziát, amely a méhnyakrák lehetséges előfutára, gyakran diagnosztizálják a méhnyakbiopsziák patológus általi vizsgálata során . Premalignus dysplasticus elváltozások esetén a cervicalis intraepithelialis neoplasia osztályozást alkalmazzák.
A méhnyakrák -prekurzor elváltozások elnevezése és szövettani osztályozása sokszor változott a 20. század folyamán. Az Egészségügyi Világszervezet osztályozási rendszere leírta a léziókat, enyhe, közepes vagy súlyos diszpláziát vagy in situ karcinómát (CIS) nevezett el . A cervicalis intraepithelialis neoplasia (CIN) kifejezést azért fejlesztették ki, hogy hangsúlyozzák az elváltozások spektrumát ezekben az elváltozásokban, és elősegítsék a kezelés szabványosítását. Az enyhe diszpláziát CIN1 -nek, a mérsékelt diszpláziát CIN2 -nek, a súlyos diszpláziát és a CIS -t CIN3 -nak minősíti. A közelmúltban a CIN2 és a CIN3 egyesült a CIN2/3 -ba. Ezeket az eredményeket jelentheti egy patológus egy biopsziából.
Ezeket nem szabad összetéveszteni a Bethesda rendszerben a Pap -teszt ( citopatológia ) eredményeivel. A Bethesda eredményei között szerepel: Alacsony fokú laphám intraepithelialis lézió (LSIL) és magas fokú laphám intraepithelialis lézió (HSIL). Az LSIL Pap megfelelhet a CIN1 -nek, a HSIL pedig a CIN2 -nek és a CIN3 -nak, de ezek különböző tesztek eredményei, és a Pap -teszt eredményeinek nem kell egyezniük a szövettani eredményekkel.
Rák altípusok

Az invazív méhnyakrák szövettani altípusai: Az endocervicalis adenocarcinoma a méhnyakrák szövettani típusainak 20-25% -át teszi ki. A méhnyak gyomor típusú nyálkahártya-adenokarcinóma egy ritka típusú rák, agresszív viselkedéssel. Ez a fajta rosszindulatú daganat nem kapcsolódik a magas kockázatú humán papillomavírushoz (HPV).
- Pikkelysmr (kb. 80-85%)
- adenokarcinóma (az Egyesült Királyságban a méhnyakrák körülbelül 15% -a)
- Adenoszkvaz karcinóma
- Kissejtes karcinóma
- Neuroendokrin tumor
- Üveges sejtes karcinóma
- Villoglandularis adenokarcinóma
A méhnyakon ritkán előforduló nem karcinóma rosszindulatú daganatok közé tartozik a melanoma és a limfóma . A Nemzetközi Nőgyógyászati és Szülészeti Szövetség (FIGO) szakasza nem foglalja magában a nyirokcsomók érintettségét, ellentétben a TNM stádiumával a legtöbb más rák esetében. A sebészeti úton kezelt esetekben a patológustól kapott információk felhasználhatók egy külön kóros szakasz kijelölésére, de nem helyettesítik az eredeti klinikai szakaszt.
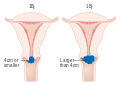
Staging
A méhnyakrákot a FIGO rendszer állítja színpadra, amely klinikai vizsgálaton, nem pedig sebészeti leleteken alapul. Lehetővé teszi, hogy csak ezeket a diagnosztikai vizsgálatokat lehessen használni a stádium meghatározásához: tapintás, ellenőrzés, kolposzkópia , endocervikális küretta , hiszteroszkópia , cisztoszkópia , proktoszkópia , intravénás urográfia , valamint a tüdő és a csontváz röntgenvizsgálata és a méhnyak konizációja .
Megelőzés
Szűrés

A méhnyakrák rákos megbetegedések Papanicolaou teszttel (Pap-teszt) történő ellenőrzése drámaian csökkentette a méhnyakrák eseteinek és halálozásának számát. A folyadék alapú citológia csökkentheti a nem megfelelő minták számát. A három-öt évente elvégzett Pap-szűrés megfelelő nyomon követéssel akár 80%-kal is csökkentheti a méhnyakrák előfordulását. A kóros eredmények a rák előtti elváltozások jelenlétére utalhatnak , lehetővé téve a vizsgálatot és az esetleges megelőző kezelést, az úgynevezett kolposzkópiát . Az alacsony fokú elváltozások kezelése hátrányosan befolyásolhatja a későbbi termékenységet és terhességet. A nőket szűrésre ösztönző személyes meghívók hatékonyan növelik annak valószínűségét. Az oktatási anyagok szintén növelik annak valószínűségét, hogy a nők szűrésre mennek, de nem olyan hatékonyak, mint a meghívók.
A 2010 -es európai iránymutatások szerint a szűrés megkezdésének életkora 20 és 30 év között van, de előnyösen nem 25 vagy 30 éves kor előtt, és függ a népesség betegségterheitől és a rendelkezésre álló erőforrásoktól.
Az Egyesült Államokban a szűrést 21 évesen ajánlott elkezdeni, függetlenül attól, hogy egy nő hány éves korában kezdett szexelni, vagy más kockázati tényezők. A pap -tesztet háromévente kell elvégezni 21 és 65 év között. 65 év feletti nőknél a szűrést meg lehet szakítani, ha az elmúlt 10 évben nem észleltek kóros szűrési eredményeket, és nem volt CIN2 vagy magasabb kórtörténet. A HPV -oltás állapota nem változtatja meg a szűrési arányokat.
Számos ajánlott lehetőség létezik a 30-65 évesek szűrésére. Ez magában foglalja a méhnyak -citológiát 3 évente, a HPV -vizsgálatot 5 évente vagy a HPV -vizsgálatot a citológiával együtt 5 évente. A szűrés 25 éves kor előtt nem előnyös, mivel a megbetegedések aránya alacsony. A szűrés nem előnyös a 60 évnél idősebb nőknél, ha korábban negatív eredményeket mutattak. Az Amerikai Klinikai Onkológiai Társaság útmutatója az erőforrások rendelkezésre állásának különböző szintjeire ajánl.
A pap -tesztek nem voltak olyan hatékonyak a fejlődő országokban. Ennek részben az az oka, hogy ezen országok közül soknak szegény az egészségügyi infrastruktúrája, túl kevés a képzett és képzett szakember a Pap-tesztek megszerzéséhez és értelmezéséhez, a tájékozatlan nők, akik eltévednek a nyomon követésben, és hosszú az átfutási idő az eredmények eléréséhez. Az ecetsav és a HPV DNS -teszt vizuális ellenőrzését kipróbálták, bár vegyes sikerrel.
Akadályvédelem
A gátló védelem vagy a spermicid gél használata nemi közösülés során csökken, de nem szünteti meg a fertőzés átvitelének kockázatát, bár az óvszer védelmet nyújthat a nemi szemölcsök ellen. Emellett védelmet nyújtanak más nemi úton terjedő fertőzések, például a HIV és a Chlamydia ellen is , amelyek a méhnyakrák kialakulásának nagyobb kockázatával járnak.
Oltás
Három HPV -vakcina ( Gardasil , Gardasil 9 és Cervarix ) körülbelül 93% -kal, illetve 62% -kal csökkenti a méhnyak és a perineum rákos vagy rákmegelőző elváltozásainak kockázatát . A vakcinák 92% és 100% között hatékonyak a HPV 16 és 18 ellen legalább 8 évig.
A HPV vakcinákat általában 9-26 éves kor között adják be, mivel a vakcina a leghatékonyabb, ha a fertőzés bekövetkezése előtt adják be. A hatékonyság időtartama és az, hogy szükség lesz -e emlékeztetőre, nem ismert. A vakcina magas ára aggodalomra ad okot. Több ország is fontolóra vette (vagy fontolgatja) a HPV elleni védőoltás finanszírozására irányuló programokat. Az Amerikai Klinikai Onkológiai Társaság útmutatója ajánlásokat tartalmaz az erőforrások rendelkezésre állásának különböző szintjeire vonatkozóan.
2010 óta Japánban a fiatal nők ingyen jogosultak a méhnyakrák elleni védőoltásra. 2013 júniusában a japán Egészségügyi, Munkaügyi és Jóléti Minisztérium elrendelte, hogy az oltás beadása előtt az egészségügyi intézményeknek tájékoztatniuk kell a nőket arról, hogy a minisztérium nem ajánlja. A vakcina azonban továbbra is ingyenesen elérhető azoknak a japán nőknek, akik úgy döntenek, hogy elfogadják az oltást.
Táplálás
Az A-vitamin alacsonyabb kockázattal jár, mint a B12-vitamin , a C - vitamin , az E-vitamin és a béta-karotin .
Kezelés
A méhnyakrák kezelése világszerte eltérő, nagyrészt a radikális kismedencei sebészetben jártas sebészek hozzáférésének és a fejlett országokban a termékenységet megtakarító terápia megjelenésének köszönhetően. A méhnyakrák kevésbé előrehaladott stádiumaiban jellemzően vannak olyan kezelési lehetőségek, amelyek lehetővé teszik a termékenység fenntartását, ha a beteg kívánja. Mivel a méhnyakrák sugárérzékeny, a sugárzás minden olyan szakaszban alkalmazható, ahol nincsenek sebészeti lehetőségek. A sebészeti beavatkozásnak jobb eredményei lehetnek, mint a radiológiai módszereknek. Ezenkívül a kemoterápia alkalmazható a méhnyakrák kezelésére, és hatékonyabbnak bizonyult, mint önmagában a sugárzás. A bizonyítékok azt mutatják, hogy a kemoradioterápia növelheti a teljes túlélést és csökkentheti a betegség kiújulásának kockázatát, összehasonlítva önmagában a sugárterápiával. A perioperatív ellátási módszerek, például a „gyorsított műtét” vagy a „javított helyreállítási programok” csökkenthetik a sebészeti stresszt és javíthatják a nőgyógyászati rákműtét utáni helyreállítást.
A mikroinvazív rák (IA stádium) kezelhető méheltávolítással (az egész méh eltávolítása, beleértve a hüvely egy részét ). Az IA2 stádiumban a nyirokcsomókat is eltávolítják. Az alternatívák közé tartoznak a helyi sebészeti beavatkozások, például hurkos elektromos kimetszési eljárás vagy kúpbiopszia . Egy szisztematikus felülvizsgálat arra a következtetésre jutott, hogy további bizonyítékokra van szükség ahhoz, hogy megalapozzák a döntéseket a méhnyakrákos nők különböző műtéti technikáiról az IA2 stádiumban.
Ha a kúpbiopszia nem hoz egyértelmű margókat (a biopsziára vonatkozó megállapítások azt mutatják, hogy a daganatot rákmentes szövet veszi körül, ami arra utal, hogy az összes daganatot eltávolították), akkor a trachelektómia még egy lehetséges kezelési lehetőség azoknak a nőknek, akik meg akarják őrizni termékenységüket . Ez megpróbálja sebészeti úton eltávolítani a rákot, miközben megőrzi a petefészkeket és a méhet, konzervatívabb műtétet biztosítva, mint a méheltávolítás. Életképes lehetőség azoknak az I. stádiumú méhnyakrákos betegeknek, akik nem terjedtek el; ez azonban még nem tekinthető az ellátás színvonalának, mivel kevés orvos járatos ebben az eljárásban. Még a legtapasztaltabb sebész sem ígérheti meg, hogy a trachelectomia csak sebészeti mikroszkópos vizsgálat után végezhető el, mivel a rák terjedésének mértéke ismeretlen. Ha a sebész nem tudja mikroszkóposan megerősíteni a nyakszövet tiszta szegélyeit, miután a nő általános érzéstelenítés alatt van a műtőben, akkor még szükség lehet méheltávolításra. Ez csak akkor végezhető el ugyanazon művelet során, ha a nő előzetesen beleegyezett. Az 1B stádiumú rákok és egyes 1A stádiumú rákos megbetegedések esetleges rákos nyirokcsomókra való átterjedésének kockázata miatt a sebésznek el kell távolítania néhány nyirokcsomót a méh környékéről a kóros értékeléshez.
A radikális trachelectomia elvégezhető hason vagy hüvelyben, és a vélemények ellentmondanak, melyik a jobb. A radikális hasi trachelectomia limfadenektómiával általában csak két-három napos kórházi tartózkodást igényel, és a legtöbb nő nagyon gyorsan (körülbelül hat hét) gyógyul. A szövődmények ritkák, bár a műtét után teherbe eső nők hajlamosak a koraszülésre és az esetleges késői vetélésre. Általában legalább egy évet kell várni, mielőtt a műtét után teherbe akar esni. A maradék méhnyakban való visszatérés nagyon ritka, ha a rákot a trachelectomiával megszüntették. A nőknek azonban ajánlott éber megelőzést és utógondozást gyakorolniuk, beleértve a Pap-szűrést/ kolposzkópiát , szükség szerint a fennmaradó alsó méhszegmens biopsziájával (3-4 havonta legalább 5 éven keresztül), hogy figyelemmel kísérjék az esetleges kiújulást. minimalizálja a HPV -vel való új expozíciót a biztonságos szexuális gyakorlatokon keresztül mindaddig, amíg valaki aktívan nem akar teherbe esni.
A korai stádiumok (IB1 és IIA kevesebb, mint 4 cm) radikális méheltávolítással, nyirokcsomók eltávolításával vagy sugárterápiával kezelhetők . A sugárkezelést külső sugárkezelésként alkalmazzák a medencére és brachyterápiát (belső sugárzás). Azok a műtéttel kezelt nők, akiknél a patológiás vizsgálat során nagy kockázatú jellemzőket találtak, sugárkezelést kapnak kemoterápiával vagy anélkül, hogy csökkentsék a visszaesés kockázatát. A Cochrane felülvizsgálata közepes bizonyosságú bizonyítékokat talált arra vonatkozóan, hogy a sugárzás csökkenti a betegség progressziójának kockázatát az IB stádiumú méhnyakrákos betegeknél, összehasonlítva a további kezeléssel. Azonban kevés bizonyítékot találtak a teljes túlélésre gyakorolt hatására.
A nagyobb korai stádiumú daganatok (IB2 és IIA több mint 4 cm) kezelhetők sugárterápiával és ciszplatin -alapú kemoterápiával, méheltávolítással (ami akkor általában adjuváns sugárkezelést igényel ) vagy ciszplatin kemoterápiával, majd méheltávolítással. Amikor a ciszplatin jelen van, úgy gondolják, hogy ez a legaktívabb egyetlen szer a periodikus betegségekben. A platina-alapú kemoterápia kemoradiációhoz való hozzáadása nemcsak a túlélést javítja, hanem csökkenti a kiújulás kockázatát a korai stádiumú méhnyakrákban (IA2-IIA) szenvedő nőknél. Egy Cochrane -felülvizsgálat bizonyítékok hiányát találta az elsődleges méheltávolítás előnyeiről és ártalmairól, összehasonlítva a méhnyakrák elsődleges kemoradioterápiájával az IB2 stádiumban.
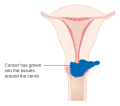
Az előrehaladott stádiumú daganatokat (IIB-IVA) sugárkezeléssel és ciszplatin-alapú kemoterápiával kezelik. 2006. június 15-én az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatósága jóváhagyta két kemoterápiás gyógyszer, a hycamtin és a cisplatin kombinációjának alkalmazását a késői stádiumú (IVB) méhnyakrák-kezelésben részesülő nők esetében. A kombinált kezelés jelentős neutropenia , anaemia és thrombocytopenia mellékhatások kockázatával jár.
Nincs elegendő bizonyíték arra, hogy a szokásos ellátást követő rákellenes gyógyszerek segítenek -e a lokálisan előrehaladott méhnyakrákos nőknek tovább élni.
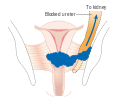
Ahhoz, hogy a műtét gyógyító hatású legyen, a teljes daganatot el kell távolítani, és a mikroszkóp alatt végzett vizsgálat során nem találnak rákot az eltávolított szövet szélén. Ezt az eljárást exenteration néven ismerik.
Nem áll rendelkezésre bizonyíték arra vonatkozóan, hogy a nyomon követési megközelítés bármilyen formája jobb vagy rosszabb a túlélés meghosszabbítása, az életminőség javítása vagy a kezelés miatt felmerülő problémák kezelésének irányítása szempontjából, és a sugárterápia esetén a rosszabbodás idővel. Egy 2019 -es felülvizsgálat nem talált ellenőrzött vizsgálatokat a hüvelyi vérzéssel kapcsolatos beavatkozások hatékonyságával és biztonságosságával kapcsolatban előrehaladott méhnyakrákban szenvedő nőknél.
A tiszotumab -vedotint (Tivdak) 2021 szeptemberében engedélyezték orvosi használatra az Egyesült Államokban.
Prognózis
Színpad
A prognózis a rák stádiumától függ. A túlélési esély közel 100% a méhnyakrák mikroszkopikus formáiban szenvedő nőknél. Kezeléssel az ötéves relatív túlélési arány az invazív méhnyakrák legkorábbi szakaszában 92%, és az összes (minden stádiumban együtt) ötéves túlélési arány körülbelül 72%. Ezek a statisztikák javíthatók, ha az újonnan diagnosztizált nőkre alkalmazzák, szem előtt tartva, hogy ezek az eredmények részben az öt évvel ezelőtti kezelés állapotán alapulhatnak, amikor a vizsgált nőket először diagnosztizálták.
A kezeléssel az I. stádiumú rákos nők 80–90% -a és a II. Stádiumú betegek 60–75% -a él 5 évvel a diagnózis után. A túlélési arány 30–40% -ra csökken a III. Stádiumú rákos nőknél és 15% -ra vagy kevesebbre a IV. Stádiumú rákos betegeknél öt évvel a diagnózis után. A korai szakaszában észlelt visszatérő méhnyakrák sikeresen kezelhető műtéttel, sugárzással, kemoterápiával vagy a három kombinációjával. Az invazív méhnyakrákban szenvedő nők körülbelül 35% -a tartós vagy visszatérő betegségben szenved a kezelés után.
Ország szerint
Az Egyesült Államokban a fehér nők esetében az ötéves túlélés 69%, a fekete nőknél 57%.
A rendszeres szűrés azt jelentette, hogy a rákmegelőző elváltozásokat és a korai stádiumú méhnyakrákokat időben felismerték és kezelték. A számok azt mutatják, hogy a méhnyakrák évente 5000 életet ment meg az Egyesült Királyságban a méhnyakrák megelőzésével. Az Egyesült Királyságban évente körülbelül 1000 nő hal meg méhnyakrákban. Minden északi országban van méhnyakrák-szűrő program. A Pap tesztet az 1960 -as években integrálták az északi országok klinikai gyakorlatába.
Afrikában az eredmények gyakran rosszabbak, mivel a diagnózis gyakran a betegség utolsó szakaszában történik. Az afrikai országok nyilvánosan elérhető méhnyakrák-megelőzési és -tervezési területeinek átfogó felülvizsgálatában a tervek inkább a túlélést hangsúlyozták, mint a HPV korai diagnózisát és megelőzését.
Járványtan
|
nincs adat
<2.4
2,4-4,8
4.8-7.2
7,2-9,6
9,6-12
12-14,4 |
14,4-16,8
16.8-19.2
19,2-21,6
21,6–24
24–26,4
> 26.4 |
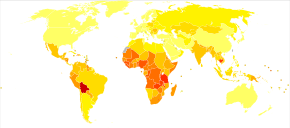
Világszerte a méhnyakrák a rák negyedik leggyakoribb oka és a rákos halálozás a nők körében. 2018 -ban becslések szerint 570 000 méhnyakrákos eset fordult elő, több mint 300 000 halálesettel. Ez a második leggyakoribb oka a nőspecifikus ráknak az emlőrák után , amely a teljes rákos esetek és a nők összes rákos halálozásának körülbelül 8% -át teszi ki. A méhnyakrák körülbelül 80% -a fejlődő országokban fordul elő. Ez a leggyakrabban észlelt rák a terhesség alatt, minden 100 000 terhesség esetén 1,5-12.
Ausztrália
Ausztráliában 2005 -ben 734 méhnyakrák volt. A méhnyakrák diagnosztizált nők száma évente átlagosan 4,5% -kal csökkent a szervezett szűrés 1991 -es kezdete (1991–2005) óta. A rendszeres, évente kétszer elvégzett Pap-tesztek akár 90% -kal is csökkenthetik a méhnyakrák előfordulását Ausztráliában, és évente 1200 ausztrál nőt menthetnek meg a betegségtől. Az előrejelzések szerint az elsődleges HPV -tesztprogram sikere miatt 2028 -ra évente kevesebb, mint négy új eset lesz 100 000 nőre.
Kanada
Kanadában 2008 -ban becslések szerint 1300 nőnél diagnosztizálnak méhnyakrákot, és 380 -an halnak meg.
India
Indiában növekszik a méhnyakrákos betegek száma, de összességében csökken az életkorhoz igazított arány. Az óvszerek használata a női populációban javította a méhnyakrákos nők túlélését.
Európai Únió
Az Európai Unióban 2004 -ben évente mintegy 34 000 új esetet és több mint 16 000 méhnyakrák okozta halálesetet regisztráltak.
Egyesült Királyság
A méhnyakrák a 12. leggyakoribb rák a nők körében az Egyesült Királyságban (2011-ben körülbelül 3100 nőnél diagnosztizálták ezt a betegséget), és a rákos halálozások 1% -át teszi ki (2012-ben körülbelül 920-an haltak meg). 1988 és 1997 között 42% -os csökkentéssel az NHS által végrehajtott szűrőprogram nagy sikert aratott, és a legkockázatosabb korosztályt (25–49 év) 3 évente, az 50–64 éveseket pedig 5 évente vizsgálta.
Egyesült Államok
Az Egyesült Államokban 2019 -ben becslések szerint 13 170 új méhnyakrák és 4250 méhnyakrákos haláleset fordul elő. A diagnózis átlagos életkora 50 év. Az új esetek aránya az Egyesült Államokban 7,3 volt 100 000 nőre, a 2012 és 2016 közötti arányok alapján A méhnyakrákos halálesetek megközelítőleg 74% -kal csökkentek az elmúlt 50 évben, nagyrészt a széles körben elterjedt Pap -szűrés miatt. A méhnyakrák megelőzésének és kezelésének közvetlen közvetlen orvosi költségeit a HPV vakcina bevezetése előtt 6 milliárd dollárra becsülték.
Történelem
- I. E. 400 - Hippokratész megjegyezte, hogy a méhnyakrák gyógyíthatatlan.
- 1925 - Hinselmann feltalálta a kolposzkópot .
- 1928 - Papanicolaou kifejlesztette a Papanicolaou technikát.
- 1941 - Papanicolaou és Traut: Elkezdődött a Pap teszt szűrése.
- 1946 - Aylesbury spatulát fejlesztettek ki a méhnyak lekaparására, és összegyűjtötték a mintát a Pap -teszthez.
- 1951-Az első sikeres in vitro sejtvonal, a HeLa , Henrietta Lacks méhnyakrák biopsziájából .
- 1976 - Harald zur Hausen és Gisam HPV DNS -t találtak a méhnyakrákban és a genitális szemölcsökben; Hausen később Nobel -díjat kapott munkájáért.
- 1988 - Fejlesztették a Bethesda rendszert a Pap -eredmények jelentésére.
- 2006 - Az FDA jóváhagyta az első HPV vakcinát .
- 2015 - A HPV vakcina bizonyítottan védelmet nyújt a fertőzések ellen több testrészen.
- 2018-Bizonyíték a HPV vakcinával történő egyadagos védelemre.
A 20. század elején dolgozó epidemiológusok megállapították, hogy a méhnyakrák nemi úton terjedő betegségként viselkedik. Összefoglalva:
- A méhnyakrák gyakori a női szexmunkásoknál .
- Ritka volt apácáknál , kivéve azokat, akik szexuálisan aktívak voltak, mielőtt beléptek a kolostorba (Rigoni 1841 -ben).
- Gyakoribb volt azoknak a férfiaknak a második feleségében, akiknek első felesége méhnyakrákban halt meg.
- Ritka volt a zsidó nőknél.
- 1935-ben Syverton és Berry felfedezték az RPV (nyúl papillomavírus) és a nyulak bőrrákja közötti kapcsolatot (a HPV fajspecifikus, ezért nem terjedhet nyulakra).
Ezek a történelmi megfigyelések arra utaltak, hogy a méhnyakrákot nemi úton terjedő ágens okozhatja. A kezdeti kutatások az 1940 -es és 1950 -es években a méhnyakrákot a smegmának tulajdonították (pl. Heins et al. 1958). Az 1960 -as és 1970 -es években gyanították, hogy a betegség oka a herpes simplex vírus . Összefoglalva, a HSV -t valószínű oknak tekintették, mivel ismert, hogy túlél a női reproduktív traktusban, és szexuális úton terjed az ismert kockázati tényezőkkel, például a hajlamossággal és az alacsony társadalmi -gazdasági státusszal. Herpes vírusok is részt vesznek más rosszindulatú betegségek, beleértve a Burkitt-limfóma , nazofaringeális karcinóma , Marek-féle betegség és a Lucke vese adenokarcinoma. A HSV -t nyaki daganatsejtekből nyertük.
A humán papillomavírus (HPV) elektronmikroszkópos leírását 1949-ben, a HPV-DNS-t 1963-ban ismertették. A méhnyakrákos szövetekben csak az 1980-as években azonosították a HPV-t. Azóta bebizonyosodott, hogy a HPV gyakorlatilag minden méhnyakrákban szerepet játszik. A specifikus vírus altípusok a HPV 16, 18, 31, 45 és mások.
A munkát, amit a közepén indították el 1980-as évek a HPV vakcina kifejlesztése, párhuzamosan a kutatók a Georgetown University Medical Center, a University of Rochester , a University of Queensland Ausztráliában és az Egyesült Államokban a National Cancer Institute . 2006 -ban az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) jóváhagyta az első megelőző HPV -vakcinát, amelyet a Merck & Co. Gardasil kereskedelmi néven forgalmazott .
Novemberben 2020-ban a World Health Organization , alatt támogatást kapott az Egészségügyi Világszervezet Közgyűlése , meghatározott stratégiát, hogy megszüntesse a méhnyakrák 2050 A stratégia magában foglalja a vakcinázást 90% lány a 15 éves korában, a szűrés nők 70% -a szerint az életkor 35 éves korukban, majd 45 éves korukig, és a nők 90% -át kezelik méhnyak -betegséggel.
Társadalom és kultúra
Ausztrália
Ausztráliában az őslakos nők több mint ötször nagyobb valószínűséggel halnak meg méhnyakrákban, mint a nem őslakos nők, ami arra utal, hogy az őslakos nők kevésbé valószínű, hogy rendszeres Pap-tesztet végeznek. Számos tényező akadályozhatja az őslakos nőket abban, hogy rendszeresen részt vegyenek a méhnyak szűrésén, beleértve az érzékenységet a téma őslakos közösségekben történő megvitatásában, zavarban, szorongásban és félelemben. A szűrési szolgáltatásokhoz való hozzáférés nehézségei (például szállítási nehézségek), valamint a női háziorvosok, a képzett Pap -teszt szolgáltatók és a képzett női őslakos egészségügyi dolgozók hiánya szintén problémát jelent.
Az Ausztrál Méhnyakrák Alapítvány (ACCF), amelyet 2008 -ban alapítottak, "Ausztráliában és a fejlődő országokban" elősegíti a nők egészségét a méhnyakrák kiküszöbölésével és a méhnyakrákos és kapcsolódó egészségügyi problémákkal küzdő nők kezelésének lehetővé tételével. " Ian Frazer , a Gardasil méhnyakrák elleni vakcina egyik fejlesztője az ACCF tudományos tanácsadója. Janette Howardot , az akkori ausztrál miniszterelnök, John Howard feleségét 1996-ban diagnosztizálták méhnyakrákkal, és először 2006-ban beszélt nyilvánosan a betegségről.

Egyesült Államok
Egy 2007 -es amerikai nők körében végzett felmérés szerint 40% hallott HPV -fertőzésről, és kevesebb, mint fele tudta, hogy méhnyakrákot okoz. Az 1975 és 2000 között végzett longitudinális vizsgálat során azt találták, hogy az alacsonyabb társadalmi-gazdasági népszámlálási csoportba tartozó embereknél magasabb volt a késői stádiumú rákdiagnózis és magasabb a megbetegedési arány. A stádium ellenőrzése után még mindig voltak különbségek a túlélési arányokban.
Hivatkozások
További irodalom
- Arbyn M, Castellsagué X, de Sanjosé S, Bruni L, Saraiya M, Bray F, Ferlay J (2011. december). "A méhnyakrák világméretű terhe 2008 -ban" . Az onkológia évkönyvei . 22 (12): 2675–86. doi : 10.1093/annonc/mdr015 . PMID 21471563 .
- Chuang LT, Temin S, Camacho R, Dueñas-Gonzalez A, Feldman S, Gultekin M, et al. (2016. október). "Invazív méhnyakrákos nők kezelése és gondozása: Amerikai Klinikai Onkológiai Társaság Resource-Stratified Clinical Practice Guideline" . Journal of Global Oncology . 2 (5): 311–340. doi : 10.1200/JGO.2016.003954 . PMC 5493265 . PMID 28717717 .
- Peto J, Gilham C, Fletcher O, Matthews FE (2004). "A méhnyakrák -járvány, amelyet a szűrés megakadályozott az Egyesült Királyságban". Lancet . 364 (9430): 249–56. doi : 10.1016/S0140-6736 (04) 16674-9 . PMID 15262102 . S2CID 11059712 .
- Pimenta JM, Galindo C, Jenkins D, Taylor SM (2013. november). "A méhnyak -adenokarcinóma globális terheinek becslése és a profilaktikus humán papillomavírus -oltás lehetséges hatása" . BMC rák . 13. (1): 553. doi : 10.1186/1471-2407-13-553 . PMC 3871005 . PMID 24261839 .
- Bhatla N, Aoki D, Sharma DN, Sankaranarayanan R (2018. október). "A méhnyakrák" . International Journal of Gynecology and Obstetrics . 143 Suppl 2: 22–36. doi : 10.1002/ijgo.12611 . PMID 30306584 .
Külső linkek
| Osztályozás | |
|---|---|
| Külső erőforrások |