DNS -DNA

| Egy sorozat része |
| Genetika |
|---|
 |
A dezoxiribonukleinsav ( / d iːˈ ɒ k s ɪ ˌ r aɪ b oʊ nj uː ˌ k l iː ɪ k , - ˌ k l eɪ -/ ( figyelj ;![]() DNS ) ) egy polimer , amely két polinukleotid láncból áll másik kettős hélixet alkotnak . A polimer genetikai utasításokat hordoz az összes ismert szervezet és számos vírus fejlődéséhez, működéséhez, növekedéséhez és szaporodásához . A DNS és a ribonukleinsav (RNS) nukleinsavak . A fehérjék , lipidek és összetett szénhidrátok ( poliszacharidok ) mellett a nukleinsavak a makromolekulák négy fő típusának egyike, amelyek nélkülözhetetlenek az összes ismert életformához .
DNS ) ) egy polimer , amely két polinukleotid láncból áll másik kettős hélixet alkotnak . A polimer genetikai utasításokat hordoz az összes ismert szervezet és számos vírus fejlődéséhez, működéséhez, növekedéséhez és szaporodásához . A DNS és a ribonukleinsav (RNS) nukleinsavak . A fehérjék , lipidek és összetett szénhidrátok ( poliszacharidok ) mellett a nukleinsavak a makromolekulák négy fő típusának egyike, amelyek nélkülözhetetlenek az összes ismert életformához .
A két DNS-szálat polinukleotidnak nevezik, mivel egyszerűbb monomer egységekből, úgynevezett nukleotidokból állnak . Mindegyik nukleotid négy nitrogéntartalmú nukleobázis ( citozin [C], guanin [G], adenin [A] vagy timin [T]) egyikéből , egy dezoxiribóz nevű cukorból és egy foszfátcsoportból áll . A nukleotidok láncban kapcsolódnak egymáshoz kovalens kötésekkel (úgynevezett foszfodiészter kötés ) az egyik nukleotid cukra és a következő foszfátja között, ami egy váltakozó cukor-foszfát gerincet eredményez . A két különálló polinukleotid szál nitrogéntartalmú bázisait a bázispárosítási szabályok szerint (A-val T-vel és C-vel G-vel) hidrogénkötésekkel kötik össze , így kettős szálú DNS-t hoznak létre. A komplementer nitrogénbázisok két csoportra oszthatók, a pirimidinekre és a purinokra . A DNS-ben a pirimidinek a timin és a citozin; a purinok adenin és guanin.
A kettős szálú DNS mindkét szála ugyanazt a biológiai információt tárolja . Ez az információ megismétlődik, amikor a két szál elválik. A DNS nagy része (embereknél több mint 98%-a) nem kódoló , ami azt jelenti, hogy ezek a szakaszok nem szolgálnak mintául a fehérjeszekvenciákhoz . A DNS két szála ellentétes irányban fut egymással, és így antiparallel . Mindegyik cukorhoz a négyféle nukleobázis (vagy bázis ) egyike kapcsolódik . E négy nukleobázis szekvenciája a gerinc mentén kódolja a genetikai információkat. Az RNS- szálakat DNS-szálak templátként történő felhasználásával hozzák létre egy transzkripciónak nevezett folyamat során , ahol a DNS-bázisokat a megfelelő bázisokra cserélik, kivéve a timin (T) esetét, amelyet az RNS uracilt (U) helyettesít. A genetikai kód alatt ezek az RNS-szálak meghatározzák a fehérjékben található aminosavak sorrendjét a transzlációnak nevezett folyamat során .
Az eukarióta sejtekben a DNS kromoszómáknak nevezett hosszú struktúrákba szerveződik . A tipikus sejtosztódás előtt ezek a kromoszómák megkettőződnek a DNS-replikáció során, így minden egyes leánysejt számára teljes kromoszómakészletet biztosítanak. Az eukarióta szervezetek ( állatok , növények , gombák és protisták ) DNS-ük nagy részét a sejtmagban tárolják nukleáris DNS- ként , és néhányat a mitokondriumban mitokondriális DNS -ként vagy a kloroplasztiszokban kloroplasztisz DNS- ként . Ezzel szemben a prokarióták ( baktériumok és archaeák ) csak a citoplazmában , körkörös kromoszómákban tárolják DNS-üket . Az eukarióta kromoszómákon belül a kromatin fehérjék, például a hisztonok tömörítik és rendezik a DNS-t. Ezek a tömörítő szerkezetek irányítják a DNS és más fehérjék közötti kölcsönhatásokat, segítve annak szabályozását, hogy a DNS mely részei íródnak át.
Tulajdonságok

A DNS egy hosszú polimer , amely ismétlődő egységekből, úgynevezett nukleotidokból áll . A DNS szerkezete a hossza mentén dinamikus, képes szűk hurokba és más formákba tekeredni. Minden fajban két spirális láncból áll, amelyeket hidrogénkötések kötnek egymáshoz . Mindkét lánc ugyanazon tengely körül van tekercselve, és azonos 34 ångströms (3,4 nm ) osztással . A láncpár sugara 10 Å (1,0 nm). Egy másik tanulmány szerint más oldatban mérve a DNS-lánc 22-26 Å (2,2-2,6 nm) széles, egy nukleotidegység pedig 3,3 Å (0,33 nm) hosszúságú volt.
A DNS általában nem egyetlen szálként létezik, hanem egy szálpárként, amelyek szorosan össze vannak tartva. Ez a két hosszú szál kettős spirál alakjában tekeredik egymás körül . A nukleotid tartalmazza a molekula gerincének egy szegmensét (amely összetartja a láncot), és egy nukleobázist (amely kölcsönhatásba lép a hélix másik DNS-szálával). A cukorhoz kapcsolódó nukleobázist nukleozidnak , a cukorhoz és egy vagy több foszfátcsoporthoz kapcsolódó bázist pedig nukleotidnak nevezzük . A több kapcsolt nukleotidot tartalmazó biopolimert (mint a DNS-ben) polinukleotidnak nevezzük .
A DNS-szál gerincét váltakozó foszfát- és cukorcsoportok alkotják . A DNS-ben lévő cukor 2-dezoxiribóz , amely egy pentóz (öt szénatomos ) cukor. A cukrokat foszfátcsoportok kötik össze, amelyek foszfodiészter kötéseket képeznek a szomszédos cukorgyűrűk harmadik és ötödik szénatomja között . Ezeket 3'-végű (három elsődleges vég) és 5'-végű (öt fővégű) szénatomként ismerjük , és a fő szimbólumot arra használjuk, hogy megkülönböztessük ezeket a szénatomokat a bázis szénatomjaitól, amelyekhez a dezoxiribóz glikozidos kötést képez. .
Ezért minden DNS-szálnak általában van az egyik vége, amelyen egy foszfátcsoport kapcsolódik a ribóz 5' szénatomjához (az 5' foszforil), a másik vége pedig egy szabad hidroxilcsoport kapcsolódik a ribóz 3' szénatomjához. ribóz (a 3′ hidroxilcsoport). A 3′ és 5′ szénatomok orientációja a cukor-foszfát gerinc mentén irányítottságot (néha polaritásnak neveznek) biztosít minden DNS-szálnak. A nukleinsav kettős hélixben az egyik szál nukleotidjainak iránya ellentétes a másik szálban lévő nukleotidok irányával: a szálak antiparallelek . A DNS-szálak aszimmetrikus végeiről azt mondják, hogy iránya öt elsődleges vég (5') és három elsődleges vég (3'), az 5'-vég egy terminális foszfátcsoport, a 3'-vég pedig egy terminális hidroxilcsoport. Az egyik fő különbség a DNS és az RNS között a cukor, a DNS-ben lévő 2-dezoxiribózt a rokon pentózcukor- ribóz helyettesíti az RNS-ben.
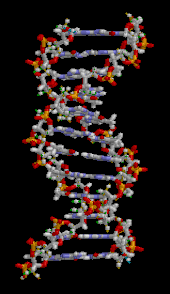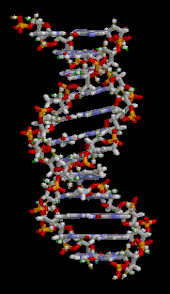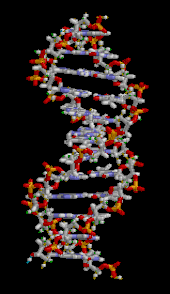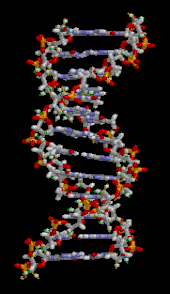
A DNS kettős hélixet elsősorban két erő stabilizálja: a nukleotidok közötti hidrogénkötések és az aromás nukleobázisok közötti bázisok egymásra épülő kölcsönhatásai . A DNS-ben található négy bázis az adenin ( A ), citozin ( C ), guanin ( G ) és timin ( T ). Ez a négy bázis kapcsolódik a cukor-foszfáthoz, hogy a teljes nukleotidot képezze, amint az adenozin-monofoszfát esetében látható . Az adenin a timinnel, a guanin pedig a citozinnal párosul, AT és GC bázispárokat képezve .
Nukleobázis osztályozás
A nukleobázisok két típusba sorolhatók: purinok , A és G , amelyek kondenzált öt- és hattagú heterociklusos vegyületek , és pirimidinek , a hattagú C és T gyűrűk . Az ötödik pirimidin-nukleobázis, az uracil ( U ) általában a timin helyét foglalja el az RNS-ben, és abban különbözik a timintől, hogy a gyűrűjében nincs metilcsoport . Az RNS és a DNS mellett számos mesterséges nukleinsav analógot hoztak létre a nukleinsavak tulajdonságainak tanulmányozására vagy a biotechnológiában való felhasználásra.
Nem kanonikus alapok
Módosított bázisok fordulnak elő a DNS-ben. Ezek közül elsőként az 5-metil-citozint ismerték fel , amelyet 1925-ben találtak meg a Mycobacterium tuberculosis genomjában . E nem kanonikus bázisok bakteriális vírusokban ( bakteriofágokban ) való jelenlétének oka a baktériumokban jelenlévő restrikciós enzimek elkerülése . Ez az enzimrendszer legalább részben molekuláris immunrendszerként működik, amely megvédi a baktériumokat a vírusfertőzésektől. A leggyakoribb és módosított DNS-bázisok, a citozin és az adenin bázisok módosításai létfontosságú szerepet játszanak a génexpresszió epigenetikai szabályozásában növényekben és állatokban.
Számos nem kanonikus bázisról ismert, hogy a DNS-ben előfordul. Ezek többsége a kanonikus bázisok és az uracil módosítása.
- Módosított Adenine
- N6-karbamoil-metil-adenin
- N6-metiladenin
- Módosított guanin
- 7-Deazaguanin
- 7-Metil-guanin
- Módosított citozin
- N4-metilcitozin
- 5-karboxilcitozin
- 5-Formilcitozin
- 5-glikozil-hidroxi-metil-citozin
- 5-hidroxicitozin
- 5-metilcitozin
- Módosított timidin
- α-glutamitimidin
- α-putreszcinil-timin
-
Uracil és módosításai
- J alap
- Uracil
- 5-dihidroxi-pentauracil
- 5-hidroxi-metil-dezoxiuracil
- Mások
- Dezoxiarcheozin
- 2,6-Diaminopurin (2-aminoadenin)
Barázdák

Iker spirális szálak alkotják a DNS gerincét. Egy másik kettős spirál található, amely a szálak közötti tereket vagy hornyokat követi. Ezek az üregek a bázispárokkal szomszédosak, és kötőhelyet biztosíthatnak . Mivel a szálak nem szimmetrikusan helyezkednek el egymáshoz képest, a hornyok mérete nem egyenlő. A fő horony 22 ångströms (2,2 nm), míg a mellékhorony 12 Å (1,2 nm) széles. A főhorony nagyobb szélessége miatt az alapok élei jobban hozzáférhetők a főhoronyban, mint a mellékhoronyban. Ennek eredményeként a fehérjék, például a transzkripciós faktorok , amelyek képesek kötődni a kettős szálú DNS-ben lévő specifikus szekvenciákhoz, általában érintkezésbe lépnek a bázisok oldalával, amelyek a fő barázdában láthatók. Ez a helyzet a sejten belüli DNS szokatlan konformációiban változik (lásd alább) , de a nagyobb és kisebb barázdákat mindig úgy nevezik el, hogy tükrözzék a szélességbeli különbségeket, amelyek akkor látszódnának, ha a DNS-t visszacsavarnák a szokásos B formába .
Alappárosítás

|

|
A DNS kettős hélixben az egyik szálon lévő nukleobázis mindegyik típusa csak egyfajta nukleobázishoz kötődik a másik szálon. Ezt komplementer bázispárosításnak nevezzük . A purinok hidrogénkötést képeznek pirimidinekhez, az adenin két hidrogénkötésben csak a timinhez, a citozin pedig három hidrogénkötésben csak a guaninhoz kötődik. A kettős hélixen keresztül egymáshoz kötődő két nukleotid elrendezését (a hat szénatomos gyűrűtől a hat szénatomos gyűrűig) Watson-Crick bázispárnak nevezik. A magas GC-tartalmú DNS stabilabb, mint az alacsony GC -tartalmú DNS. A Hoogsteen bázispár (hidrogén köti össze a 6 szénatomos gyűrűt az 5 szénatomos gyűrűvel) a bázispárosítás ritka változata. Mivel a hidrogénkötések nem kovalensek , viszonylag könnyen megszakadhatnak és újra összekapcsolhatók. A kettős hélixben lévő DNS két szála így cipzárszerűen széthúzható, akár mechanikai erővel, akár magas hőmérséklettel . Ennek a bázispár-komplementaritásnak köszönhetően a DNS-hélix kétszálú szekvenciájában minden információ megkettőződik minden szálon, ami létfontosságú a DNS-replikációban. Ez a reverzibilis és specifikus kölcsönhatás a komplementer bázispárok között kritikus fontosságú a DNS minden funkciója szempontjából az organizmusokban.
ssDNS vs. dsDNS
Ahogy fentebb megjegyeztük, a legtöbb DNS-molekula valójában két polimer szál, amelyeket nem kovalens kötések kötnek össze helikálisan; ezt a kétszálú (dsDNS) struktúrát nagyrészt a szálon belüli bázishalmozási kölcsönhatások tartják fenn, amelyek a G,C veremeknél a legerősebbek. A két szál szétválhat – ez az olvadásnak nevezett folyamat – és két egyszálú DNS (ssDNS) molekulát képezhet. Az olvadás magas hőmérsékleten, alacsony sótartalom és magas pH mellett történik (alacsony pH esetén a DNS is megolvaszt, de mivel a DNS a savas depurináció miatt instabil, ezért ritkán alkalmazzák az alacsony pH-t).
A dsDNS forma stabilitása nemcsak a GC -tartalomtól függ (% G,C bázispár), hanem a szekvenciától (mivel a halmozás szekvencia-specifikus) és a hossztól is (a hosszabb molekulák stabilabbak). A stabilitás többféleképpen mérhető; elterjedt módszer az olvadási hőmérséklet (más néven T m érték), amely az a hőmérséklet, amelyen a kétszálú molekulák 50%-a egyszálú molekulákká alakul; Az olvadáspont az ionerősségtől és a DNS koncentrációjától függ. Ennek eredményeként a GC bázispárok százalékos aránya és a DNS kettős hélix teljes hossza határozza meg a két DNS-szál közötti kapcsolat erősségét. A magas GC -tartalmú hosszú DNS-hélixek erősebb kölcsönhatású szálakkal rendelkeznek, míg a magas AT- tartalmú rövid hélixek gyengén kölcsönható szálakkal rendelkeznek. A biológiában a DNS kettős hélix azon részei, amelyeknek könnyen szét kell válniuk, mint például a TATAAT Pribnow-doboz egyes promóterekben , általában magas AT- tartalommal rendelkeznek , így a szálak könnyebben széthúzhatók.
Laboratóriumban ennek a kölcsönhatásnak az erőssége úgy mérhető, hogy megtaláljuk a hidrogénkötések felének megszakításához szükséges T m olvadási hőmérsékletet. Amikor a DNS kettős hélixben az összes bázispár megolvad, a szálak szétválnak, és az oldatban két teljesen független molekulaként léteznek. Ezeknek az egyszálú DNS-molekuláknak nincs egységes alakja, de egyes konformációk stabilabbak, mint mások.
Összeg

Emberben a teljes női diploid nukleáris genom sejtenként 6,37 gigabázispárra (Gbp) terjed ki, 208,23 cm hosszú és 6,51 pikogramm (pg) tömegű. A férfi értékek 6,27 Gbp, 205,00 cm, 6,41 pg. Minden DNS polimer több száz millió nukleotidot tartalmazhat, például az 1. kromoszómában . Az 1-es kromoszóma a legnagyobb emberi kromoszóma , körülbelül 220 millió bázispárral .85 mm hosszú, ha kiegyenesítjük.
Az eukariótákban a nukleáris DNS mellett mitokondriális DNS (mtDNS) is található, amely a mitokondriumok által használt bizonyos fehérjéket kódol. Az mtDNS általában viszonylag kicsi a nukleáris DNS-hez képest. Például az emberi mitokondriális DNS zárt körkörös molekulákat képez, amelyek mindegyike 16 569 DNS-bázispárt tartalmaz, és minden ilyen molekula általában a mitokondriális gének teljes készletét tartalmazza. Minden emberi mitokondrium átlagosan körülbelül 5 ilyen mtDNS-molekulát tartalmaz. Minden emberi sejt körülbelül 100 mitokondriumot tartalmaz, ami emberi sejtenként körülbelül 500 mtDNS-molekulát tartalmaz. A sejtenkénti mitokondriumok mennyisége azonban sejttípusonként is változik, és egy petesejt 100 000 mitokondriumot tartalmazhat, ami legfeljebb 1 500 000-nek felel meg . a mitokondriális genom másolatai (amelyek a sejt DNS-ének legfeljebb 90%-át teszik ki).
Értelem és antiszensz
Egy DNS-szekvenciát "érzéki" szekvenciának nevezünk, ha megegyezik a fehérjévé transzlálódó hírvivő RNS másolatéval. Az ellenkező szálon lévő szekvenciát "antiszensz" szekvenciának nevezik. Mind a szensz, mind az antiszensz szekvenciák létezhetnek ugyanazon DNS-szál különböző részein (vagyis mindkét szál tartalmazhat szensz és antiszensz szekvenciákat is). Mind a prokariótákban, mind az eukariótákban antiszensz RNS szekvenciák keletkeznek, de ezeknek az RNS-eknek a funkciója nem teljesen világos. Az egyik javaslat szerint az antiszensz RNS-ek részt vesznek a génexpresszió szabályozásában az RNS-RNS bázispárosodáson keresztül.
Néhány DNS-szekvencia prokariótákban és eukariótákban, illetve több plazmidban és vírusban elmossa a különbséget a szensz és antiszensz szálak között, mivel átfedő génjeik vannak . Ezekben az esetekben egyes DNS-szekvenciák kettős feladatot látnak el, az egyik fehérjét kódolják, ha az egyik szál mentén olvassák, és egy második fehérjét, ha az ellenkező irányba olvassák a másik szál mentén. Baktériumokban ez az átfedés szerepet játszhat a géntranszkripció szabályozásában, míg a vírusokban az átfedő gének növelik a kis vírusgenomban kódolható információ mennyiségét.
Szupertekercselés
A DNS-t kötélszerűen meg lehet csavarni a DNS szuperspirálozásnak nevezett folyamatban . Ha a DNS "lazított" állapotban van, egy szál általában 10,4 bázispáronként egyszer körbeveszi a kettős hélix tengelyét, de ha a DNS megcsavarodik, a szálak szorosabban vagy lazábban feltekerednek. Ha a DNS a hélix irányába csavarodik, ez pozitív szupertekercselést jelent, és a bázisok szorosabban össze vannak tartva. Ha az ellenkező irányba csavarodnak, akkor ez negatív szupertekercselés, és az alapok könnyebben válnak szét. A természetben a legtöbb DNS enyhe negatív szuperspirálással rendelkezik, amelyet a topoizomeráznak nevezett enzimek vezetnek be . Ezekre az enzimekre azért is szükség van, hogy enyhítsék a DNS-szálakba bevitt csavarodási feszültségeket olyan folyamatok során, mint a transzkripció és a DNS-replikáció .
Alternatív DNS-struktúrák
A DNS számos lehetséges konformációban létezik , beleértve az A-DNS-t , a B-DNS -t és a Z-DNS- formákat, bár csak a B-DNS-t és a Z-DNS-t figyelték meg közvetlenül működő organizmusokban. A DNS által felvett konformáció a hidratációs szinttől, a DNS-szekvenciától, a szupertekercselés mennyiségétől és irányától, a bázisok kémiai módosításaitól, a fémionok típusától és koncentrációjától, valamint az oldatban lévő poliaminok jelenlététől függ.
Az A-DNS röntgendiffrakciós mintázatairól és a B-DNS- ről szóló első közzétett jelentések Patterson-függvényeken alapuló elemzéseket használtak , amelyek csak korlátozott mennyiségű szerkezeti információt szolgáltattak a DNS orientált rostjairól. Alternatív elemzést javasoltak Wilkins és munkatársai. 1953-ban a nagymértékben hidratált DNS-szálak in vivo B-DNS röntgendiffrakciós-szórási mintázataira a Bessel-függvények négyzetében . Ugyanebben a folyóiratban James Watson és Francis Crick bemutatta a DNS röntgendiffrakciós mintázatának molekuláris modellezési elemzését, amely azt sugallja, hogy a szerkezet kettős hélix.
Bár a B-DNS forma a legelterjedtebb a sejtekben előforduló körülmények között, ez nem egy jól meghatározott konformáció, hanem rokon DNS-konformációk családja, amelyek a sejtekben jelen lévő magas hidratációs szintek mellett fordulnak elő. Megfelelő röntgendiffrakciós és szórási mintázataik a jelentős mértékű rendezetlenséggel rendelkező molekuláris parakristályokra jellemzőek.
A B-DNS-hez képest az A-DNS forma egy szélesebb jobb oldali spirál, sekély, széles mellékhoronnyal és keskenyebb, mélyebb major horonnyal. Az A forma nem fiziológiás körülmények között fordul elő részben dehidratált DNS-mintákban, míg a sejtben DNS és RNS szálak hibrid párosításaiban, valamint enzim-DNS komplexekben képződhet. Azon DNS-szakaszok, amelyekben a bázisokat metilációval kémiailag módosították, nagyobb konformációváltozáson eshetnek át, és felvehetik a Z formát . Itt a szálak a spirális tengely körül balos spirálban forognak, a gyakoribb B alak ellentéte. Ezeket a szokatlan struktúrákat specifikus Z-DNS-kötő fehérjék ismerhetik fel, és részt vehetnek a transzkripció szabályozásában.
Alternatív DNS-kémia
Az exobiológusok évek óta javasolják egy árnyékbioszféra létezését , a Föld feltételezett mikrobiális bioszféráját, amely gyökeresen eltérő biokémiai és molekuláris folyamatokat alkalmaz, mint a jelenleg ismert élet. Az egyik javaslat az volt, hogy létezzenek olyan életformák, amelyek foszfor helyett arzént használnak a DNS-ben . 2010-ben jelentettek be egy jelentést a GFAJ-1 baktérium lehetőségéről , bár a kutatást vitatták, és a bizonyítékok arra utalnak, hogy a baktérium aktívan megakadályozza az arzén beépülését a DNS-vázba és más biomolekulákba.
Quadruplex szerkezetek

A lineáris kromoszómák végein a DNS speciális régiói, az úgynevezett telomerek találhatók . Ezeknek a régióknak az a fő funkciója, hogy lehetővé tegyék a sejt számára a kromoszómavégek replikációját a telomeráz enzim segítségével , mivel azok az enzimek, amelyek normálisan replikálják a DNS-t, nem tudják lemásolni a kromoszómák szélső 3′-végeit. Ezek a speciális kromoszóma-sapkák segítenek megvédeni a DNS-végeket, és megakadályozzák, hogy a sejt DNS-javító rendszerei javítandó károsodásként kezeljék azokat. Az emberi sejtekben a telomerek általában egyszálú DNS hosszúságú részei, amelyek egy egyszerű TTAGGG szekvencia több ezer ismétlődését tartalmazzák.
Ezek a guaninban gazdag szekvenciák stabilizálhatják a kromoszómavégeket azáltal, hogy négybázisú egységekből álló halmazokból álló struktúrákat alakítanak ki, nem pedig a szokásos bázispárokat, amelyek más DNS-molekulákban találhatók. Itt négy guaninbázis, úgynevezett guanin-tetrad lapos lemezt alkot. Ezek a lapos, négyalapú egységek aztán egymásra helyezve egy stabil G-quadruplex szerkezetet alkotnak. Ezeket a struktúrákat a bázisok szélei közötti hidrogénkötés és az egyes négybázisú egységek közepén egy fémion kelátképzése stabilizálja . Más szerkezetek is kialakíthatók, a négy alapból álló központi készlet vagy egyetlen, az alapok köré hajtogatott szálból, vagy több különböző párhuzamos szálból származik, amelyek mindegyike egy-egy alapot ad a központi szerkezethez.
Ezeken a halmozott struktúrákon kívül a telomerek nagy hurokstruktúrákat is alkotnak, amelyeket telomer huroknak vagy T-huroknak neveznek. Itt az egyszálú DNS egy hosszú körben tekergőzik, amelyet telomerkötő fehérjék stabilizálnak. A T-hurok legvégén az egyszálú telomer DNS-t a kettős szálú DNS régiójában tartja a telomer szál, amely megszakítja a kettős spirális DNS-t, és a két szál egyikéhez bázispárosodik. Ezt a háromszálú szerkezetet eltolási huroknak vagy D-huroknak nevezik .

|

|
| Egyetlen ág | Több ág |
Elágazó DNS
A DNS-ben a kopás akkor fordul elő, ha nem komplementer régiók vannak az egyébként komplementer kettős DNS-szál végén. Azonban elágazó DNS előfordulhat, ha a DNS harmadik szálát bevezetik, és olyan szomszédos régiókat tartalmaz, amelyek képesek hibridizálni a már meglévő kettős szál kopott régióival. Bár az elágazó DNS legegyszerűbb példája csak három DNS-szálat tartalmaz, további szálakat és több ágat tartalmazó komplexek is lehetségesek. Az elágazó DNS felhasználható a nanotechnológiában geometriai formák megalkotására, lásd alább a technológiai felhasználásokról szóló részt.
Mesterséges alapok
Számos mesterséges nukleobázist szintetizáltak, és sikeresen beépítették a Hachimoji DNS- nek nevezett nyolcbázisú DNS-analógba . Az S, B, P és Z névre keresztelt mesterséges bázisok előre megjósolható módon képesek kötődni egymáshoz (S–B és P–Z), fenntartják a DNS kettős hélix szerkezetét, és átíródnak RNS-re. Létezésük arra utal, hogy semmi különös nincs a Földön kialakult négy természetes nukleobázisban. Másrészt a DNS szorosan kapcsolódik az RNS- hez , amely nemcsak a DNS átirataként működik, hanem molekuláris gépként is ellát számos feladatot a sejtekben. Ebből a célból szerkezetté kell hajtani. Kimutatták , hogy az összes lehetséges struktúra létrehozásához legalább négy bázis szükséges a megfelelő RNS - hez , és ennél nagyobb szám is lehetséges , de ez ellenkezik a legkisebb erőfeszítés természetes elvével .
Savasság
A DNS foszfátcsoportjai a foszforsavhoz hasonló savas tulajdonságokat adnak, és erős savnak tekinthető . Normál sejt pH-n teljesen ionizálódik, protonokat szabadítva fel , amelyek negatív töltést hagynak maguk után a foszfátcsoportokon. Ezek a negatív töltések megvédik a DNS-t a hidrolízis általi lebomlástól azáltal, hogy taszítják a nukleofileket , amelyek hidrolizálhatják.
Makroszkópos megjelenés
A sejtekből kivont tiszta DNS fehér, szálkás csomókat képez.
Kémiai módosítások és megváltozott DNS-csomagolás

|

|

|
| citozin | 5-metilcitozin | timin |
Alapmódosítások és DNS-csomagolás
A gének expresszióját befolyásolja, hogy a DNS hogyan csomagolódik a kromoszómákba, a kromatin nevű szerkezetbe . Bázismódosítások is szerepet játszhatnak a csomagolásban, ahol az alacsony vagy egyáltalán nem génexpresszióval rendelkező régiók általában magas szintű citozinbázisokat tartalmaznak . A DNS-csomagolás és annak a génexpresszióra gyakorolt hatása a hisztonfehérje magjának kovalens módosításával is bekövetkezhet, amely körül a DNS-t a kromatin szerkezete tekeredik, vagy a kromatin-remodelling komplexek által végrehajtott átépüléssel (lásd Kromatin remodeling ). Ezenkívül áthallás van a DNS-metiláció és a hisztonmódosítás között, így ezek összehangoltan befolyásolhatják a kromatin- és a génexpressziót.
Például a citozin metilációja 5-metilcitozint termel , amely fontos a kromoszómák X-inaktiválásához . A metiláció átlagos szintje élőlényenként eltérő – a Caenorhabditis elegans féregből hiányzik a citozin metilációja, míg a gerinceseknél magasabb, DNS-ük akár 1%-a is tartalmaz 5-metilcitozint. Az 5-metilcitozin fontossága ellenére dezaminálódhat, és timinbázist hagyhat maga után, így a metilezett citozinok különösen hajlamosak a mutációkra . Az egyéb bázismódosítások közé tartozik az adenin metilációja a baktériumokban, az 5-hidroxi-metil-citozin jelenléte az agyban , és az uracil glikozilációja a "J-bázis" előállítására kinetoplasztidokban .
Kár
A DNS-t sokféle mutagén károsíthatja , amelyek megváltoztatják a DNS-szekvenciát . A mutagének közé tartoznak az oxidálószerek , alkilezőszerek , valamint a nagy energiájú elektromágneses sugárzások , például az ultraibolya fény és a röntgensugárzás . A keletkezett DNS-károsodás típusa a mutagén típusától függ. Például az UV-fény károsíthatja a DNS-t azáltal, hogy timin dimereket termel , amelyek keresztkötések pirimidinbázisok között. Másrészt az oxidálószerek, mint például a szabad gyökök vagy a hidrogén-peroxid, többféle károsodást okoznak, beleértve a bázismódosulásokat, különösen a guanozin esetében, és a kettős szálú töréseket. Egy tipikus emberi sejt körülbelül 150 000 bázist tartalmaz, amelyek oxidatív károsodást szenvedtek. Ezen oxidatív elváltozások közül a legveszélyesebbek a kettős szál törések, mivel ezek nehezen javíthatók, és pontmutációkat , inszerciókat , deléciókat a DNS-szekvenciából és kromoszómális transzlokációkat okozhatnak . Ezek a mutációk rákot okozhatnak . A DNS-javító mechanizmusokban rejlő korlátok miatt, ha az emberek elég sokáig élnének, végül mindannyian rákos megbetegedést okoznának. Gyakran előfordulnak olyan DNS-károsodások is, amelyek a normális sejtfolyamatok következtében, amelyek reaktív oxigénfajtákat termelnek, a sejtvíz hidrolitikus aktivitása stb. miatt, szintén gyakran előfordulnak. Bár ezeknek a sérüléseknek a többsége helyreáll, bármely sejtben megmaradhat bizonyos DNS-károsodás a javítási folyamatok ellenére. Ezek a fennmaradó DNS-károsodások az életkorral felhalmozódnak az emlős posztmitózisos szöveteiben. Úgy tűnik, hogy ez a felhalmozódás az öregedés egyik alapvető oka.
Sok mutagén illeszkedik két szomszédos bázispár közötti térbe, ezt interkalációnak nevezik . A legtöbb interkalátor aromás és planáris molekula; ilyen például az etidium-bromid , az akridinek , a daunomicin és a doxorubicin . Ahhoz, hogy egy interkalátor elférjen a bázispárok között, a bázisoknak el kell válniuk, és a kettős hélix feltekercselésével el kell torzítani a DNS-szálakat. Ez gátolja mind a transzkripciót, mind a DNS-replikációt, toxicitást és mutációkat okozva. Ennek eredményeként a DNS interkalátorok rákkeltőek lehetnek , a talidomid esetében pedig teratogén anyagok . Mások, mint például a benzo[ a ]pirén-diol-epoxid és az aflatoxin , DNS-adduktumokat képeznek, amelyek replikációs hibákat okoznak. Ennek ellenére a DNS transzkripciót és replikációt gátló képességük miatt más hasonló toxinokat is alkalmaznak a kemoterápiában a gyorsan növekvő rákos sejtek gátlására .
Biológiai funkciók

A DNS általában lineáris kromoszómákként fordul elő az eukariótákban , és körkörös kromoszómák a prokariótákban . A sejtben lévő kromoszómakészlet alkotja a genomját ; az emberi genom körülbelül 3 milliárd bázispár DNS-ből áll, amelyek 46 kromoszómába rendeződnek. A DNS által hordozott információ a DNS-darabok szekvenciájában, az úgynevezett génekben tárolódik . A génekben a genetikai információ átvitele komplementer bázispárosítással történik. Például a transzkripció során, amikor egy sejt egy génben lévő információt használja fel, a DNS-szekvencia a DNS és a megfelelő RNS-nukleotidok közötti vonzás révén egy komplementer RNS-szekvenciává másolódik. Általában ezt az RNS-másolatot használják fel egy megfelelő fehérjeszekvencia létrehozására a transzlációnak nevezett folyamatban , amely az RNS-nukleotidok közötti azonos kölcsönhatástól függ. Alternatív módon egy sejt lemásolhatja genetikai információit a DNS-replikációnak nevezett folyamatban . E funkciók részleteivel más cikkek foglalkoznak; itt a hangsúly a DNS és más, a genom működését közvetítő molekulák közötti kölcsönhatásokon van.
Gének és genomok
A genomi DNS-t szorosan és rendezetten csomagolják a DNS-kondenzációnak nevezett folyamatban , hogy illeszkedjen a sejt kis térfogatához. Az eukariótákban a DNS a sejtmagban található , kis mennyiségben a mitokondriumokban és a kloroplasztiszokban . A prokariótákban a DNS egy szabálytalan alakú testben található a citoplazmában, amelyet nukleoidnak neveznek . A genomban lévő genetikai információ a génekben található, és egy szervezetben ezen információk teljes halmazát genotípusának nevezzük . A gén egy öröklődési egység , és egy olyan DNS-régió, amely egy szervezet egy adott jellemzőjét befolyásolja. A gének tartalmaznak egy nyitott leolvasási keretet , amely átírható, és szabályozó szekvenciákat , például promótereket és enhanszereket , amelyek szabályozzák a nyitott leolvasási keret transzkripcióját.
Sok fajban a genom teljes szekvenciájának csak egy kis része kódol fehérjét. Például az emberi genomnak csak körülbelül 1,5%-a áll fehérjét kódoló exonokból , az emberi DNS több mint 50%-a pedig nem kódoló ismétlődő szekvenciákból áll . Az eukarióta genomokban oly sok nem kódoló DNS jelenlétének okai és a fajok közötti rendkívüli különbségek a genomméretben vagy a C-értékben egy régóta fennálló rejtvényt képviselnek, amelyet " C-érték rejtélynek " neveznek . Azonban néhány olyan DNS-szekvencia, amely nem kódol fehérjét, továbbra is kódolhat funkcionális , nem kódoló RNS- molekulákat, amelyek részt vesznek a génexpresszió szabályozásában .
Egyes nem kódoló DNS-szekvenciák szerkezeti szerepet játszanak a kromoszómákban. A telomerek és centromerek jellemzően kevés gént tartalmaznak, de fontosak a kromoszómák működése és stabilitása szempontjából. Az emberekben a nem kódoló DNS bőséges formája a pszeudogének , amelyek a mutáció által letiltott gének másolatai. Ezek a szekvenciák általában csak molekuláris kövületek , bár alkalmanként nyers genetikai anyagként szolgálhatnak új gének létrehozásához a génduplikáció és - divergencia folyamata révén .
Átírás és fordítás
A gén olyan DNS-szekvencia, amely genetikai információkat tartalmaz, és befolyásolhatja egy szervezet fenotípusát . Egy génen belül egy DNS-szál mentén a bázisok szekvenciája határoz meg egy hírvivő RNS- szekvenciát, amely azután egy vagy több fehérjeszekvenciát határoz meg. A gének nukleotidszekvenciái és a fehérjék aminosavszekvenciái közötti kapcsolatot a transzláció szabályai határozzák meg , gyűjtőnéven genetikai kód . A genetikai kód hárombetűs „szavakból”, úgynevezett kodonokból áll , amelyeket három nukleotid szekvenciájából (pl. ACT, CAG, TTT) alkotnak.
A transzkripció során egy gén kodonjait az RNS polimeráz a hírvivő RNS-be másolja . Ezt az RNS-másolatot azután egy riboszóma dekódolja, amely beolvassa az RNS-szekvenciát a hírvivő RNS bázispárosításával az aminosavakat hordozó RNS átviteléhez. Mivel 4 bázis van a 3 betűs kombinációkban, 64 lehetséges kodon van (4 3 kombináció). Ezek a húsz standard aminosavat kódolják , így a legtöbb aminosav egynél több lehetséges kodont ad. Három „stop” vagy „nonszensz” kodon is létezik, amelyek a kódoló régió végét jelzik; ezek a TAG, TAA és TGA kodonok (UAG, UAA és UGA az mRNS-en).
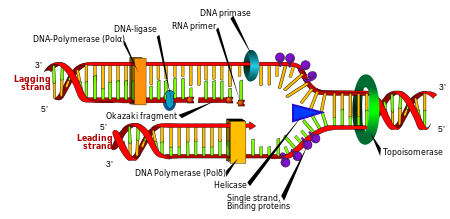
Replikáció
A sejtosztódás elengedhetetlen a szervezet növekedéséhez, de amikor egy sejt osztódik, meg kell replikálnia a DNS-t a genomjában, hogy a két leánysejtnek ugyanaz a genetikai információja legyen, mint a szülőjének. A DNS kétszálú szerkezete egyszerű mechanizmust biztosít a DNS-replikációhoz . Itt a két szál elválik, majd mindegyik szál komplementer DNS- szekvenciáját egy DNS-polimeráz nevű enzim hozza létre újra . Ez az enzim úgy állítja elő a komplementer szálat, hogy megtalálja a megfelelő bázist komplementer bázispárosítással, és az eredeti szálhoz köti. Mivel a DNS-polimerázok csak 5′-3′ irányban képesek kiterjeszteni egy DNS-szálat, különböző mechanizmusokat alkalmaznak a kettős hélix antiparallel szálainak másolására. Ily módon a régi szálon lévő bázis határozza meg, hogy melyik bázis jelenjen meg az új szálon, és a sejt a DNS tökéletes másolatával végez.
Extracelluláris nukleinsavak
A meztelen extracelluláris DNS (eDNS), amelynek nagy része sejthalál során szabadul fel, szinte mindenütt jelen van a környezetben. Koncentrációja a talajban elérheti a 2 μg/L-t, a természetes vízi környezetben pedig a 88 μg/L-t is. Az eDNS-nek számos lehetséges funkciót javasoltak: részt vehet a horizontális géntranszferben ; tápanyagot biztosíthat; és pufferként működhet az ionok vagy antibiotikumok toborzásához vagy titrálásához. Az extracelluláris DNS funkcionális extracelluláris mátrix komponensként működik számos baktériumfaj biofilmjében . Felismerési faktorként működhet bizonyos sejttípusok kötődésének és eloszlásának szabályozásában a biofilmben; hozzájárulhat a biofilm kialakulásához; és hozzájárulhat a biofilm fizikai erejéhez és a biológiai stresszel szembeni ellenállásához.
A sejtmentes magzati DNS az anya vérében található, és szekvenálásával rengeteg információ meghatározható a fejlődő magzatról.
Környezeti DNS néven az eDNS-t fokozottan használják a természettudományokban az ökológia felmérésére , a fajok vízben, levegőben vagy szárazföldön való mozgásának és jelenlétének nyomon követésére, valamint egy terület biológiai sokféleségének felmérésére.
Neutrophil extracelluláris csapdák
A neutrofil extracelluláris csapdák (NET-ek) extracelluláris rostok hálózatai, amelyek elsősorban DNS-ből állnak, és lehetővé teszik a neutrofilek , a fehérvérsejtek egy fajtája számára, hogy elpusztítsák az extracelluláris kórokozókat, miközben minimalizálják a gazdasejtek károsodását.
Kölcsönhatások fehérjékkel
A DNS minden funkciója a fehérjékkel való kölcsönhatástól függ. Ezek a fehérjekölcsönhatások lehetnek nem specifikusak, vagy a fehérje specifikusan kötődhet egyetlen DNS-szekvenciához. Az enzimek DNS-hez is kötődhetnek, és ezek közül különösen fontosak azok a polimerázok, amelyek a DNS-bázisszekvenciát másolják a transzkripció és a DNS-replikáció során.
DNS-kötő fehérjék

A DNS-t megkötő strukturális fehérjék jól ismert példái a nem specifikus DNS-fehérje kölcsönhatásoknak. A kromoszómákon belül a DNS-t szerkezeti fehérjékkel komplexekben tartják. Ezek a fehérjék a DNS-t kromatinnak nevezett kompakt szerkezetbe szervezik . Az eukariótákban ez a szerkezet magában foglalja a DNS-hez való kötődést egy kis bázikus fehérjékből álló komplexhez, az úgynevezett hisztonokhoz , míg a prokariótákban többféle fehérje is részt vesz. A hisztonok egy nukleoszómának nevezett korong alakú komplexet alkotnak , amely két teljes duplaszálú DNS-t tartalmaz a felülete körül. Ezek a nem specifikus kölcsönhatások a hisztonok bázikus csoportjain keresztül jönnek létre, amelyek ionos kötéseket hoznak létre a DNS savas cukor-foszfát gerincéhez, és így nagymértékben függetlenek a bázisszekvenciától. Ezeknek a bázikus aminosav-maradékoknak a kémiai módosításai közé tartozik a metilezés , foszforiláció és acetilezés . Ezek a kémiai változások megváltoztatják a DNS és a hisztonok közötti kölcsönhatás erősségét, így a DNS többé-kevésbé hozzáférhetővé válik a transzkripciós faktorok számára , és megváltoztatja a transzkripció sebességét. A kromatinban lévő egyéb nem specifikus DNS-kötő fehérjék közé tartoznak a nagy mobilitású fehérjék, amelyek meghajlított vagy torz DNS-hez kötődnek. Ezek a fehérjék fontosak a nukleoszómák hajlításában és a kromoszómákat alkotó nagyobb struktúrákba rendezésében.
A DNS-kötő fehérjék külön csoportját alkotják azok a DNS-kötő fehérjék, amelyek specifikusan kötődnek az egyszálú DNS-hez. Emberben a replikációs protein A a család legjobban érthető tagja, és olyan folyamatokban használják, ahol a kettős hélix szétválik, beleértve a DNS-replikációt, a rekombinációt és a DNS-javítást. Úgy tűnik, hogy ezek a kötőfehérjék stabilizálják az egyszálú DNS-t, és megvédik azt a szárhurkok kialakulásától vagy a nukleázok általi lebontástól .

Ezzel szemben más fehérjék úgy fejlődtek ki, hogy bizonyos DNS-szekvenciákhoz kötődjenek. Ezek közül a legintenzívebben tanulmányozottak a különböző transzkripciós faktorok , amelyek a transzkripciót szabályozó fehérjék. Mindegyik transzkripciós faktor egy adott DNS-szekvencia-készlethez kötődik, és aktiválja vagy gátolja azoknak a géneknek a transzkripcióját, amelyekben ezek a szekvenciák a promotereikhez közel vannak. A transzkripciós faktorok ezt kétféleképpen teszik meg. Először is képesek megkötni a transzkripcióért felelős RNS-polimerázt, akár közvetlenül, akár más mediátor fehérjéken keresztül; ez lokalizálja a polimerázt a promoternél, és lehetővé teszi a transzkripció megkezdését. Alternatív megoldásként a transzkripciós faktorok megköthetik azokat az enzimeket , amelyek módosítják a hisztonokat a promoternél. Ez megváltoztatja a DNS-templát hozzáférhetőségét a polimeráz számára.
Mivel ezek a DNS-célpontok az egész szervezet genomjában előfordulhatnak, az egyik típusú transzkripciós faktor aktivitásában bekövetkező változások több ezer gént érinthetnek. Következésképpen ezek a fehérjék gyakran célpontjai azoknak a jelátviteli folyamatoknak, amelyek szabályozzák a környezeti változásokra adott válaszokat vagy a sejtdifferenciálódást és -fejlődést. Ezeknek a transzkripciós faktoroknak a DNS-sel való kölcsönhatásainak specifitása abból fakad, hogy a fehérjék többszörösen érintkeznek a DNS-bázisok széleivel, lehetővé téve számukra, hogy „olvassák” a DNS-szekvenciát. A legtöbb ilyen alap-kölcsönhatás a fő horonyban történik, ahol az alapok a leginkább hozzáférhetők.
DNS-módosító enzimek
Nukleázok és ligázok
A nukleázok olyan enzimek , amelyek elvágják a DNS-szálakat a foszfodiészter kötések hidrolízisének katalizálásával . A DNS-szálak végéről nukleotidokat hidrolizáló nukleázokat exonukleázoknak nevezzük , míg az endonukleázokat a szálakon belül vágják el. A molekuláris biológiában leggyakrabban használt nukleázok a restrikciós endonukleázok , amelyek meghatározott szekvenciáknál elvágják a DNS-t. Például a bal oldalon látható EcoRV enzim felismeri a 6 bázisból álló 5′-GATATC-3′ szekvenciát, és bevágást végez a vízszintes vonalon. A természetben ezek az enzimek megvédik a baktériumokat a fágfertőzéstől azáltal , hogy megemésztik a fág DNS-t, amikor az belép a baktériumsejtbe, és a restrikciós módosító rendszer részeként működnek . A technológiában ezeket a szekvencia-specifikus nukleázokat a molekuláris klónozásban és a DNS-ujjlenyomat-vételben használják .
A DNS-ligáznak nevezett enzimek újra kapcsolódhatnak a vágott vagy törött DNS-szálakhoz. A ligázok különösen fontosak a késleltetett szálú DNS-replikációban, mivel a replikációs villában keletkezett rövid DNS-szegmenseket a DNS-templát teljes másolatává kapcsolják össze. Használják DNS-javításban és genetikai rekombinációban is .
Topoizomerázok és helikázok
A topoizomerázok nukleáz és ligáz aktivitással rendelkező enzimek. Ezek a fehérjék megváltoztatják a DNS szuperspirálozásának mértékét . Ezen enzimek némelyike úgy működik, hogy elvágja a DNS-hélixet, és hagyja az egyik szakaszt forogni, ezáltal csökkenti a szupertekercselés szintjét; az enzim ezután lezárja a DNS-törést. Ezen enzimek más típusai képesek egy DNS-hélixet levágni, majd egy második DNS-szálat átvezetni ezen a törésen, mielőtt újra csatlakoznának a hélixhez. A topoizomerázokra számos DNS-t érintő folyamathoz szükség van, például a DNS-replikációhoz és a transzkripcióhoz.
A helikázok olyan fehérjék, amelyek egyfajta molekuláris motor . A nukleozid-trifoszfátokban , túlnyomórészt adenozin-trifoszfátban (ATP) lévő kémiai energiát használják fel a bázisok közötti hidrogénkötések megszakítására és a DNS kettős hélix egyszálra történő széttekerésére. Ezek az enzimek nélkülözhetetlenek a legtöbb olyan folyamathoz, ahol az enzimeknek hozzá kell férniük a DNS-bázisokhoz.
Polimerázok
A polimerázok olyan enzimek , amelyek polinukleotid láncokat szintetizálnak nukleozid-trifoszfátokból . Termékeik szekvenciáját a meglévő polinukleotid láncok alapján hozzák létre – ezeket templátoknak nevezzük . Ezek az enzimek úgy működnek, hogy ismételten hozzáadnak egy nukleotidot a növekvő polinukleotid lánc végén lévő 3'- hidroxilcsoporthoz . Ennek következtében minden polimeráz 5′-3′ irányban működik. Ezen enzimek aktív helyén a bejövő nukleozid-trifoszfát bázispárok a templáthoz kötődnek: ez lehetővé teszi a polimerázok számára, hogy pontosan szintetizálják templátjuk komplementer szálát. A polimerázokat az általuk használt sablon típusa szerint osztályozzák.
A DNS-replikáció során a DNS-függő DNS-polimerázok DNS-polinukleotid-láncok másolatait készítik. A biológiai információk megőrzéséhez elengedhetetlen, hogy a bázisok szekvenciája minden másolatban pontosan komplementer legyen a templátszál bázissorrendjével. Számos DNS-polimeráz rendelkezik lektori aktivitással. Itt a polimeráz felismeri a szintézisreakció időnkénti hibáit azáltal, hogy hiányzik a bázispárosodás az össze nem illő nukleotidok között. Ha eltérést észlel, egy 3′ és 5′ közötti exonukleáz aktivitás aktiválódik, és eltávolítjuk a nem megfelelő bázist. A legtöbb szervezetben a DNS-polimerázok egy repliszómának nevezett nagy komplexben működnek, amely több kiegészítő alegységet, például DNS-bilincset vagy helikázokat tartalmaz .
Az RNS-függő DNS-polimerázok a polimerázok egy speciális osztálya, amelyek egy RNS-szál szekvenciáját DNS-be másolják. Ide tartozik a reverz transzkriptáz , amely egy vírus enzim, amely részt vesz a sejtek retrovírusok általi fertőzésében , és a telomeráz , amely a telomerek replikációjához szükséges. Például a HIV reverz transzkriptáz egy enzim az AIDS-vírus replikációjához. A telomeráz szokatlan polimeráz, mivel szerkezetének részeként saját RNS-templátot tartalmaz. Telomereket szintetizál a kromoszómák végén. A telomerek megakadályozzák a szomszédos kromoszómák végeinek összeolvadását, és megvédik a kromoszómavégeket a károsodástól.
A transzkripciót egy DNS-függő RNS-polimeráz végzi , amely a DNS-szál szekvenciáját RNS-be másolja. A gén átírásának megkezdéséhez az RNS-polimeráz egy DNS-szekvenciához, úgynevezett promoterhez kötődik, és elválasztja a DNS-szálakat. Ezután a génszekvenciát egy hírvivő RNS átiratba másolja, amíg el nem éri a DNS terminátornak nevezett régióját , ahol megáll és leválik a DNS-ről. A humán DNS-függő DNS-polimerázokhoz hasonlóan az RNS-polimeráz II , az emberi genom legtöbb génjét átíró enzim egy nagy fehérjekomplex részeként működik, több szabályozó és járulékos alegységből.
Genetikai rekombináció

|

|
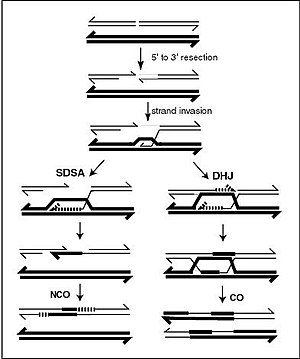
A DNS-spirál általában nem lép kölcsönhatásba a DNS más szegmenseivel, és az emberi sejtekben a különböző kromoszómák még külön területeket is elfoglalnak a sejtmagban, amelyeket " kromoszómaterületeknek " neveznek. A különböző kromoszómák fizikai szétválasztása fontos ahhoz, hogy a DNS az információ stabil tárházaként működjön, mivel azon kevés alkalmak egyike, amikor a kromoszómák kölcsönhatásba lépnek, az ivaros szaporodás során végbemenő kromoszómális keresztezés , amikor genetikai rekombináció történik. A kromoszómális keresztezés az, amikor két DNS-hélix elszakad, felcserél egy szakaszt, majd újra egyesül.
A rekombináció lehetővé teszi a kromoszómák számára, hogy genetikai információkat cseréljenek, és új génkombinációkat hoznak létre, ami növeli a természetes szelekció hatékonyságát , és fontos lehet az új fehérjék gyors evolúciójában. A genetikai rekombináció részt vehet a DNS-javításban is, különösen a sejt válaszában a kettős szál törésére.
A kromoszómális keresztezés leggyakoribb formája a homológ rekombináció , ahol a két érintett kromoszóma nagyon hasonló szekvenciát mutat. A nem homológ rekombináció károsíthatja a sejteket, mivel kromoszómális transzlokációkat és genetikai rendellenességeket okozhat. A rekombinációs reakciót a rekombinázok néven ismert enzimek , például a RAD51 katalizálják . A rekombináció első lépése az endonukleáz vagy a DNS károsodása által okozott kettős szálú törés . A részben a rekombináz által katalizált lépések sorozata azután a két hélix legalább egy Holliday-csomópont általi összekapcsolásához vezet , amelyben mindegyik hélixben egyetlen szál szegmense a másik hélixben lévő komplementer szálhoz kapcsolódik. A Holliday junction egy tetraéderes csomópont, amely a kromoszómapár mentén mozgatható, felcserélve az egyik szálat a másikra. A rekombinációs reakciót azután leállítják a csatlakozási pont hasításával és a felszabadult DNS újraligálásával. Csak a hasonló polaritású DNS-szálak cserélik ki a DNS-t a rekombináció során. Kétféle hasítás létezik: kelet-nyugati és észak-déli hasítás. Az észak-déli hasítás mindkét DNS-szálat bemetszette, míg a kelet-nyugati hasításnál az egyik DNS-szál érintetlen. A Holliday junction kialakulása a rekombináció során lehetővé teszi a genetikai sokféleséget, a gének kromoszómákon történő cseréjét és a vad típusú vírusgenomok expresszióját.
Evolúció
A DNS tartalmazza azokat a genetikai információkat, amelyek lehetővé teszik az élet minden formája működését, növekedését és szaporodását. Nem világos azonban, hogy az élet 4 milliárd éves története során a DNS mennyi ideig látta el ezt a funkciót, mivel a feltételezések szerint a legkorábbi életformák RNS-t használhattak genetikai anyagként. Az RNS a korai sejtmetabolizmus központi részeként működhetett, mivel genetikai információkat is továbbíthat, és a ribozimek részeként katalízist végezhet . Ez az ősi RNS-világ , ahol a nukleinsavat mind a katalízishez, mind a genetikához használták volna, befolyásolhatta a jelenlegi, négy nukleotid bázison alapuló genetikai kód kialakulását . Ez megtörténik, mivel egy ilyen organizmusban a különböző bázisok száma kompromisszum a replikációs pontosságot növelő kis számú bázis és a ribozimek katalitikus hatékonyságát növelő nagyszámú bázis között. Azonban nincs közvetlen bizonyíték az ősi genetikai rendszerekre, mivel a legtöbb fosszíliából lehetetlen a DNS kinyerése, mivel a DNS egymillió évnél rövidebb ideig fennmarad a környezetben, és az oldatban lassan rövid darabokra bomlik. Régebbi DNS-re vonatkozó állítások születtek, leginkább egy életképes baktérium izolálásáról szóló jelentés egy 250 millió éves sókristályból, de ezek az állítások ellentmondásosak.
A DNS építőkövei ( adenin , guanin és rokon szerves molekulák ) földönkívüli módon keletkezhettek a világűrben . Az élet összetett DNS- és RNS- vegyületeit , köztük az uracilt , a citozint és a timint , szintén laboratóriumban hozták létre a világűrben tapasztaltakhoz hasonló körülmények között , kiindulási vegyszerek, például a meteoritokban található pirimidin felhasználásával . A pirimidin, akárcsak a policiklusos aromás szénhidrogének (PAH), a világegyetem legszénben gazdagabb vegyi anyaga , vörös óriásokban vagy csillagközi kozmikus por- és gázfelhőkben keletkezhetett .
2021 februárjában a tudósok először számoltak be a DNS szekvenálásáról állati maradványokból , ez esetben egy több mint egymillió éves mamutból , amely az eddigi legrégebbi szekvenált DNS.
Felhasználás a technológiában
Génmanipuláció
Módszereket fejlesztettek ki DNS-tisztításra az organizmusokból, például fenol-kloroformos extrakciót , és laboratóriumi manipulációt, például restrikciós emésztést és polimeráz láncreakciót . A modern biológia és biokémia intenzíven használja ezeket a technikákat a rekombináns DNS-technológiában. A rekombináns DNS egy ember által létrehozott DNS-szekvencia, amelyet más DNS-szekvenciákból állítottak össze. Vírusvektor segítségével plazmidok formájában vagy megfelelő formátumban organizmusokká transzformálhatók . Az előállított géntechnológiával módosított szervezetek felhasználhatók olyan termékek előállítására, mint például a rekombináns fehérjék , felhasználhatók az orvosi kutatásban , vagy termeszthetők a mezőgazdaságban .
DNS profilalkotás
A törvényszéki tudósok a bűncselekmény helyszínén talált vérben , spermában , bőrben , nyálban vagy hajban található DNS-t használhatják egy egyén, például az elkövető egyező DNS-ének azonosítására. Ezt a folyamatot hivatalosan DNS-profilalkotásnak nevezik , más néven DNS-ujjlenyomatnak . A DNS-profilalkotás során az ismétlődő DNS változó szakaszainak hosszát, például a rövid tandem ismétlődéseket és a miniszatelliteket hasonlítják össze az emberek között. Ez a módszer általában rendkívül megbízható technika a megfelelő DNS azonosítására. Az azonosítás azonban bonyolult lehet, ha a helyszín több személy DNS-ével szennyezett. A DNS-profilalkotást 1984-ben Sir Alec Jeffreys brit genetikus fejlesztette ki , és először a törvényszéki tudományban alkalmazták Colin Pitchfork elítélésére az 1988-as Enderby-gyilkossági ügyben.
A törvényszéki tudomány fejlődése és az a képesség, hogy a vér, a bőr, a nyál vagy a haj apró mintáiból genetikai egyezést kapjunk, számos eset újbóli vizsgálatához vezetett. Most olyan bizonyítékok tárhatók fel, amelyek tudományosan lehetetlenek voltak az eredeti vizsgálat idején. A kettős veszélyre vonatkozó törvény egyes helyeken történő eltörlésével együtt ez lehetővé teszi az olyan ügyek újbóli megnyitását, amelyekben a korábbi tárgyalások nem szolgáltattak elegendő bizonyítékot az esküdtszék meggyőzéséhez. A súlyos bûncselekményekkel vádolt személyeknek DNS-mintát kell adniuk a megfeleltetés céljából. A legkézenfekvőbb védekezés a kriminalisztikai úton nyert DNS-egyezésekkel szemben az az állítás, hogy a bizonyítékok keresztszennyeződése történt. Ez aprólékos, szigorú kezelési eljárásokat eredményezett az új súlyos bűncselekmények esetében.
A DNS-profilalkotást sikeresen alkalmazzák a tömeges balesetek áldozatainak, súlyos balesetek holttesteinek vagy testrészeinek, valamint a tömeges háborús sírokban elszenvedett egyéni áldozatok azonosítására is, a családtagokkal való párosítás révén.
A DNS-profilalkotást a DNS-apasági vizsgálatok során is használják annak meghatározására, hogy valaki egy gyermek biológiai szülője vagy nagyszülője, és a származási valószínűség jellemzően 99,99%, ha az állítólagos szülő biológiai rokonságban áll a gyermekkel. A normál DNS-szekvenálási módszerek a születés után történnek, de vannak új módszerek az apaság tesztelésére, amikor az anya még várandós.
DNS enzimek vagy katalitikus DNS
A dezoxiribozimeket , más néven DNS-enzimeket vagy katalitikus DNS-t először 1994-ben fedezték fel. Ezek többnyire egyszálú DNS-szekvenciák, amelyeket véletlenszerű DNS-szekvenciák nagy készletéből izoláltak kombinatorikus megközelítéssel, amelyet in vitro szelekciónak vagy ligandumok szisztematikus evolúciójának exponenciális dúsítással (SELEX) neveznek. . A DNS-enzimek különféle kémiai reakciókat katalizálnak, beleértve az RNS-DNS hasítást, az RNS-DNS ligálást, az aminosavak foszforilációját-defoszforilációját, a szén-szén kötés képződését stb. A DNS-enzimek akár 100 000 000 000-szeresére is növelhetik a kémiai reakciók katalitikus sebességét, mint a reakció kb. A DNS-enzimek legszélesebb körben tanulmányozott osztálya az RNS-hasító típusok, amelyeket különböző fémionok kimutatására és terápiás szerek tervezésére használnak. Számos fémspecifikus DNS-enzimről számoltak be, köztük a GR-5 DNS-enzimről (ólom-specifikus), a CA1-3 DNS-enzimről (réz-specifikus), a 39E DNS-enzimről (uranil-specifikus) és a NaA43-DNAzimről (nátrium-specifikus). A NaA43 DNS-enzimet, amely a jelentések szerint több mint 10 000-szer szelektív a nátriumra, mint a többi fémionra, valós idejű nátrium-érzékelő létrehozására használták a sejtekben.
Bioinformatika
A bioinformatika magában foglalja a biológiai adatok tárolására, adatbányászatára , keresésére és manipulálására szolgáló technikák kifejlesztését, beleértve a DNS- nukleinsavszekvencia -adatokat is. Ezek széles körben alkalmazott fejlesztésekhez vezettek a számítástechnikában , különösen a karakterlánc-kereső algoritmusokban , a gépi tanulásban és az adatbáziselméletben . A karakterlánc-kereső vagy egyező algoritmusokat, amelyek egy nagyobb betűsorozaton belül találják meg a betűsorozat előfordulását, speciális nukleotidszekvenciák keresésére fejlesztették ki. A DNS-szekvencia más DNS-szekvenciákkal illeszthető a homológ szekvenciák azonosítása és az azokat megkülönböztető specifikus mutációk lokalizálása érdekében. Ezeket a technikákat, különösen a többszörös szekvencia-illesztést , a filogenetikai kapcsolatok és a fehérjefunkciók tanulmányozására használják . A teljes genomnyi DNS-szekvenciát reprezentáló adatkészleteket, például a Human Genome Project által előállítottakat , nehéz használni a gének és a szabályozó elemek helyét az egyes kromoszómákon azonosító megjegyzések nélkül. A fehérjét vagy RNS-t kódoló génekhez kapcsolódó jellegzetes mintázatú DNS-szekvencia régiók azonosíthatók génkereső algoritmusokkal, amelyek lehetővé teszik a kutatók számára, hogy még az izolálás előtt előre jelezzék bizonyos géntermékek jelenlétét és lehetséges funkcióit egy szervezetben. kísérletileg. Teljes genomokat is össze lehet hasonlítani, ami rávilágíthat egy adott organizmus evolúciós történetére, és lehetővé teszi összetett evolúciós események vizsgálatát.
DNS nanotechnológia

A DNS-nanotechnológia a DNS és más nukleinsavak egyedi molekuláris felismerési tulajdonságait használja fel, hogy hasznos tulajdonságokkal rendelkező, önszerveződő elágazó DNS-komplexeket hozzon létre. A DNS-t tehát inkább szerkezeti anyagként használják, mint biológiai információhordozóként. Ez kétdimenziós periodikus rácsok létrehozásához vezetett (mind csempe alapú, mind a DNS origami módszert alkalmazva), valamint háromdimenziós struktúrák poliéderek formájában . Nanomechanikai eszközöket és algoritmikus önösszeállítást is bemutattak, és ezeket a DNS-struktúrákat más molekulák, például arany nanorészecskék és sztreptavidin fehérjék elrendezésének temperálására használták. A DNS és más nukleinsavak képezik az aptamerek , szintetikus oligonukleotid ligandumok alapját specifikus célmolekulák számára, amelyeket számos biotechnológiai és orvosbiológiai alkalmazásban használnak.
Történelem és antropológia
Mivel a DNS idővel összegyűjti a mutációkat, amelyek aztán öröklődnek, történelmi információkat tartalmaz, és a DNS-szekvenciák összehasonlításával a genetikusok következtetni tudnak az organizmusok evolúciós történetére, törzsfejlődésére . A filogenetika ezen területe az evolúciós biológia hatékony eszköze . Ha egy fajon belüli DNS-szekvenciákat hasonlítanak össze, a populációgenetikusok megismerhetik bizonyos populációk történetét. Ezt fel lehet használni az ökológiai genetikától az antropológiáig terjedő vizsgálatokban .
Információ tárolása
A DNS mint információtároló eszköz óriási potenciállal rendelkezik, mivel sokkal nagyobb tárolási sűrűséggel rendelkezik, mint az elektronikus eszközök. A magas költségek, a lassú olvasási és írási idő ( memória késleltetése ) és a nem megfelelő megbízhatóság azonban megakadályozta a gyakorlati alkalmazását.
Történelem

A DNS-t először Friedrich Miescher svájci orvos izolálta , aki 1869-ben mikroszkopikus méretű anyagot fedezett fel az eldobott sebészeti kötszerek gennyében . Mivel a sejtek magjában lakott, "nukleinnek" nevezte. 1878-ban Albrecht Kossel izolálta a "nuklein" nem fehérje komponensét, a nukleinsavat, majd izolálta annak öt elsődleges nukleobázisát .
1909-ben Phoebus Levene azonosította az RNS (akkori nevén "élesztő nukleinsav") bázis-, cukor- és foszfát nukleotid egységét. 1929-ben Levene dezoxiribóz cukrot azonosított a „csecsemőmirigy-nukleinsavban” (DNS). Levene azt javasolta, hogy a DNS négy nukleotid egységből áll, amelyek a foszfátcsoportokon keresztül kapcsolódnak egymáshoz ("tetranukleotid hipotézis"). Levene szerint a lánc rövid, és az alapok rögzített sorrendben ismétlődnek. 1927-ben Nyikolaj Kolcov azt javasolta, hogy az öröklött tulajdonságokat egy "óriás örökletes molekulán" keresztül örököljék, amely "két tükörszálból áll, amelyek félig konzervatív módon replikálódnak, mindegyik szálat sablonként használva". 1928-ban Frederick Griffith kísérletében felfedezte, hogy a Pneumococcus "sima" formájának tulajdonságai átvihetők ugyanazon baktériumok "durva" formájára, ha az elölt "sima" baktériumokat összekeverik az élő "durva" formával . Ez a rendszer adta az első egyértelmű javaslatot, hogy a DNS genetikai információt hordoz.
1933-ban, amikor szűz tengeri sünök tojásait tanulmányozta, Jean Brachet azt javasolta, hogy a DNS a sejtmagban található , és az RNS kizárólag a citoplazmában van jelen . Akkoriban úgy gondolták, hogy az "élesztő nukleinsav" (RNS) csak növényekben fordul elő, míg a "csecsemőmirigy-nukleinsav" (DNS) csak állatokban. Az utóbbiról azt gondolták, hogy egy tetramer, amelynek funkciója a sejt pH-értékének pufferelése.
1937-ben William Astbury elkészítette az első röntgendiffrakciós mintákat, amelyek azt mutatták, hogy a DNS szabályos szerkezetű.
1943-ban Oswald Avery munkatársaival, Colin MacLeoddal és Maclyn McCartyval együtt a DNS-t azonosították az átalakító elvként , alátámasztva Griffith javaslatát ( Avery–MacLeod–McCarty kísérlet ). Erwin Chargaff kidolgozott és közzétett olyan megfigyeléseket, amelyek ma Chargaff-szabályok néven ismertek , és kijelentik, hogy bármely szervezet DNS-ében a guanin mennyiségének meg kell egyeznie a citozinnal , az adenin mennyisége pedig a timinnel . 1951 végén Francis Crick James Watsonnal kezdett együtt dolgozni a Cambridge-i Egyetem Cavendish Laboratóriumában . A DNS öröklődésben betöltött szerepét 1952-ben erősítették meg, amikor Alfred Hershey és Martha Chase a Hershey–Chase kísérletben kimutatta, hogy a DNS a T2 enterobaktérium fág genetikai anyaga .
1952 májusában Raymond Gosling , a Rosalind Franklin felügyelete alatt dolgozó végzős hallgató röntgendiffrakciós képet készített , amelyet " Photo 51 " -nek neveztek , a DNS magas hidratációs szintjén. Ezt a fényképet Maurice Wilkins adta Watsonnak és Cricknek , és kulcsfontosságú volt a DNS megfelelő szerkezetének megállapításához. Franklin azt mondta Cricknek és Watsonnak, hogy a gerincnek kívül kell lennie. Azelőtt Linus Paulingnak, valamint Watsonnak és Cricknek hibás modelljeik voltak, amelyekben a láncok belül, a talpak pedig kifelé mutattak. A DNS-kristályok tércsoportjának Franklin általi azonosítása felfedte Cricknek, hogy a két DNS-szál ellentétes volt . 1953 februárjában Linus Pauling és Robert Corey egy olyan modellt javasoltak nukleinsavak számára, amelyek három összefonódó láncot tartalmaznak, a foszfátokkal a tengely közelében, a bázisokkal pedig kívül. Watson és Crick elkészítette modelljét, amelyet ma már a DNS kettős hélixének első helyes modelljeként fogadtak el . 1953. február 28-án Crick félbeszakította a vendégek ebédidejét a cambridge-i The Eagle pubban , hogy bejelentse, hogy Watsonnal "felfedezték az élet titkát".
A Nature folyóirat 1953. április 25-i száma öt cikkből álló sorozatot közölt a Watson és Crick kettős hélix szerkezetű DNS-ről és az azt alátámasztó bizonyítékokról. A szerkezetről a " NUKLEINSAVAK MOLEKULÁRIS SZERKEZETE A dezoxiribóz nukleinsav szerkezete " című levélben számoltak be , amelyben azt mondták: "Nem kerülte el figyelmünket, hogy az általunk feltételezett specifikus párosítás azonnal egy lehetséges másoló mechanizmusra utal a genetikai sejtek számára. anyag." Ezt a levelet Franklin és Gosling levele követte, amely saját röntgendiffrakciós adataik és eredeti elemzési módszerük első publikációja volt. Ezután Wilkins és két kollégája levele következett, amely az in vivo B-DNS röntgensugarak elemzését tartalmazza, és alátámasztotta a Watson és Crick szerkezet in vivo jelenlétét.
1962-ben, Franklin halála után Watson, Crick és Wilkins közösen kapták meg az élettani és orvosi Nobel-díjat . Nobel-díjat csak élő díjazottak kapnak. Folytatódik a vita arról, hogy ki kapjon elismerést a felfedezésért.
1957-ben egy nagy hatású előadásában Crick lefektette a molekuláris biológia központi dogmáját , amely megjövendölte a DNS, az RNS és a fehérjék közötti kapcsolatot, és megfogalmazta az "adapter hipotézist". A replikációs mechanizmus végső megerősítése, amelyre a kettős spirális szerkezet utalt, 1958-ban a Meselson–Stahl-kísérlet révén történt . Crick és munkatársai további munkái kimutatták, hogy a genetikai kód nem átfedő bázishármasokon, úgynevezett kodonokon alapult , lehetővé téve Har Gobind Khorana , Robert W. Holley és Marshall Warren Nirenberg megfejtését a genetikai kódon. Ezek az eredmények a molekuláris biológia születését jelentik .
Lásd még
- Autoszóma – A nemi kromoszómától eltérő bármely kromoszóma
- Krisztallográfia – A kristályszerkezetek tudományos vizsgálata
- A DNS-nap – Április 25-én ünnepeljük az ünnepet
- DNS microarray – Szilárd felülethez tapadt mikroszkopikus DNS-foltok gyűjteménye
- DNS szekvenálás – A nukleinsavszekvencia meghatározásának folyamata
- Genetikai rendellenesség – Egészségügyi probléma, amelyet a genom egy vagy több rendellenessége okoz
- Genetikai genealógia – DNS-vizsgálat a kapcsolatokra következtetni
- Haplotípus – Egy szülőtől származó gének csoportja
- Meiosis – Az ivarsejtek termelésére használt ivaros szaporodó szervezetek sejtosztódásának típusa
- Nukleinsav jelölés – Univerzális jelölés, amely az A, C, G és T római karaktereket használja a négy DNS-nukleotid megnevezésére
- Nukleinsav-szekvencia – Nukleotidok egymásutánja egy nukleinsavban
- Riboszomális DNS – a DNS specifikus régiója, amely a riboszómális RNS-t kódolja
- Southern blot – DNS-elemző technika
- Röntgenszórási technikák – a roncsolásmentes analitikai technikák családja
- Xeno nukleinsav – vegyületcsoport
Hivatkozások
További irodalom
- Berry A, Watson J (2003). DNS: az élet titka . New York: Alfred A. Knopf. ISBN 0-375-41546-7.
- Calladine CR, Drew HR, Luisi BF, Travers AA (2003). A DNS megértése: a molekula és működése . Amszterdam: Elsevier Academic Press. ISBN 0-12-155089-3.
- Carina D, Clayton J (2003). 50 éves DNS . Basingstoke: Palgrave Macmillan. ISBN 1-4039-1479-6.
- Judson HF (1979). A teremtés nyolcadik napja: A biológia forradalmának alkotói (2. kiadás). Cold Spring Harbor Laboratory Press. ISBN 0-671-22540-5.
- Olby RC (1994). A kettős spirálhoz vezető út: a DNS felfedezése . New York: Dover Publications. ISBN 0-486-68117-3.Először 1974 októberében publikálta MacMillan, Francis Crick előszavával; a végleges DNS-tankönyv, amelyet 1994-ben, kilenc oldalas utószóval átdolgoztak.
- Olby R (2003. január). "Csendes debütálás a kettős spirál számára" . Természet . 421 (6921): 402–05. Bibcode : 2003Natur.421..402O . doi : 10.1038/nature01397 . PMID 12540907 .
- Olby RC (2009). Francis Crick: Életrajz . Plainview, NY: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-798-3.
- Micklas D (2003). DNS-tudomány: Első tanfolyam . Cold Spring Harbor Press. ISBN 978-0-87969-636-8.
- Ridley M (2006). Francis Crick: a genetikai kód felfedezője . Ashland, OH: Eminent Lives, Atlas Books. ISBN 0-06-082333-X.
- Rosenfeld I (2010). DNS: Grafikus útmutató a világot megrázó molekulához . Columbia University Press. ISBN 978-0-231-14271-7.
- Schultz M, Cannon Z (2009). Az élet dolgai: Grafikus útmutató a genetikához és a DNS-hez . Hill és Wang. ISBN 978-0-8090-8947-5.
- Stent GS , Watson J (1980). The Double Helix: Személyes beszámoló a DNS szerkezetének felfedezéséről . New York: Norton. ISBN 0-393-95075-1.
- Watson J (2004). DNS: Az élet titka . Random House. ISBN 978-0-09-945184-6.
- Wilkins M (2003). A kettős hélix harmadik embere Maurice Wilkins önéletrajza . Cambridge, Anglia: University Press. ISBN 0-19-860665-6.
Külső linkek
|
Könyvtári források a DNS- ről |
- DNS Curlie -nél
- DNS-kötőhely előrejelzése fehérjén
- DNA the Double Helix Game A Nobel-díj hivatalos webhelyéről
- DNS elektronmikroszkóp alatt
- Dolan DNA Oktatóközpont
- Kettős hélix: 50 éves DNS , természet
- Proteopedia DNS
- Proteopedia Forms_of_DNS
- ENCODE threads explorer ENCODE kezdőlap a Nature- nél
- Double Helix 1953–2003 Nemzeti Biotechnológiai Oktatási Központ
- Genetikai oktatási modulok tanároknak – DNS a Beginning Study Guide- ból
- PDB A hónap DNS molekulája
- "Támot találtak az öröklődés kémiájához . " The New York Times , 1953. június. Az első amerikai újság tudósítása a DNS-struktúra felfedezéséről
- DNS a kezdetektől Egy másik DNS-oktatóközpont webhely a DNS-ről, a génekről és az öröklődésről Mendeltől az emberi genom projektig.
- Francis Crick személyes papírjainak nyilvántartása 1938–2007 a Mandeville Special Collections Library-ben, Kaliforniai Egyetem, San Diego
- Hét oldalas, kézzel írott levél, amelyet Crick küldött 12 éves fiának, Michaelnek 1953-ban, és leírja a DNS szerkezetét. Lásd: Crick érme kalapács alá kerül , Nature, 2013. április 5.