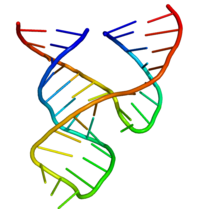
Hammerhead ribozim - Hammerhead ribozyme
A kalapácsfejű ribozim egy RNS -motívum, amely katalizálja a reverzibilis hasítási és ligációs reakciókat egy RNS -molekula egy adott helyén. Ez az egyik a katalitikus RNS -ek ( ribozimek ) közül, amelyekről ismert, hogy a természetben előfordulnak. Modellrendszerként szolgál az RNS szerkezetének és tulajdonságainak kutatásához , és célzott RNS -hasítási kísérletekhez használják, némelyiket javasolt terápiás alkalmazásokkal. A kalapácsfejű cápához a korai másodlagos szerkezet diagramok hasonlóságáról nevezték el, a kalapácsfejű ribozimeket eredetileg a növényi vírusszerű RNS-ek két osztályában fedezték fel: a műholdas RNS-ekben és a viroidokban . Később kiderült, hogy széles körben elterjedtek az élet számos formájában.
Az önhasítási reakciók, amelyeket először 1986-ban jelentettek, egy gördülő kör replikációs mechanizmus részét képezik . A kalapácsfej szekvencia elegendő az önhasadáshoz, és konzervált háromdimenziós harmadlagos szerkezet kialakításával működik.
Katalízis
Természetes állapotában a kalapácsfejű RNS -motívum az RNS egyetlen szála. Bár a hasítás fehérje enzimek hiányában megy végbe, maga a kalapácsfejű RNS természetes állapotában nem katalizátor , mivel a reakció elfogyasztja (azaz önhasadást végez), és ezért nem képes katalizálni a többszörös forgalmat.
A transz-hatású kalapácsfej konstrukciókat úgy lehet kialakítani, hogy két kölcsönhatásba lépő RNS-szálból álljanak, és az egyik szál egy kalapácsfejű ribozimot alkot, amely a másik szálat hasítja. A lehasított szálat feleslegben lehet szállítani, és a többszörös forgalom kimutatható és kimutatható, hogy engedelmeskedik Michaelis-Menten kinetikájának , ami a fehérje enzim kinetikájára jellemző . Az ilyen konstrukciókat jellemzően in vitro kísérletekhez használják, és a "kalapácsfejű RNS" kifejezés a gyakorlatban a gyakrabban használt "kalapácsfejű ribozim " szinonimájává vált .
A minimálisan transz-ható kalapácsfejű ribozim szekvencia, amely katalitikusan aktív, három bázispáros szárból áll, amelyek a 15 konzervált (többnyire változatlan) nukleotid központi magját határolják , amint az látható. A konzervált központi bázisok, néhány kivételtől eltekintve, elengedhetetlenek a ribozim katalitikus aktivitásához. Az ilyen kalapácsfej ribozim konstrukciókat mutatnak in vitro a fluktuációja ( k cat ) körülbelül 1 molekula / perc, és a K m nagyságrendű 10 nanomól.
A kalapácsfejű ribozim vitathatatlanul a legjobban jellemzett ribozim. Kis mérete, alaposan vizsgált hasítási kémiája, ismert kristályszerkezete és biológiai relevanciája miatt a kalapácsfejű ribozim különösen alkalmas az RNS-katalízis alapvető természetének biokémiai és biofizikai vizsgálatára.
A kalapácsfejű ribozimok fontos szerepet játszhatnak terápiás szerként; mint enzimek, amelyek szabott RNS -szekvenciákat szabnak , bioszenzorok , valamint funkcionális genomikai és génkutatási alkalmazások .
Faj eloszlás
| Hammerhead ribozim HH9 | |
|---|---|
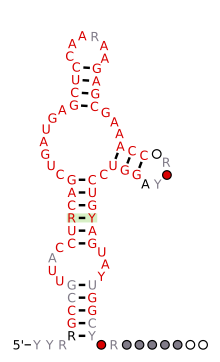 A HH9 ribozim várható másodlagos szerkezete és szekvencia -megőrzése a gyíktól az emberi genomig konzerválva
| |
| Azonosítók | |
| Szimbólum | HH9 |
| Rfam | RF02275 |
| Egyéb adatok | |
| RNS típus | Gén ; ribozim |
| Domain (ek) | Eukaryota |
| ÍGY | SO: 0000380 |
| PDB struktúrák | PDBe |
1986 -ban az első kalapácsfejű ribozimokat találták az RNS növényi kórokozókban, például viroidokban és vírusos műholdakban. Egy évvel később egy kalapácsfejű ribozimról is beszámoltak a gőte genomok műhold DNS -ében. Ennek a ribozimnak az új példáit találtuk a nem rokon organizmusok genomjaiban, mint például a skisztoszómák, a barlangtücskök, az Arabidopsis thaliana és néhány emlős, például a rágcsálók és a platypus. 2010 -ben azt találták, hogy a kalapácsfejű ribozim a bakteriális és eukariális genomok széles skálájában fordul elő, sőt emberben is. Hasonló jelentések megerősítették és kiterjesztették ezeket a megfigyeléseket, bemutatva a kalapácsfejű ribozimot, mint mindenütt jelenlévő katalitikus RNS -t minden életbirodalomban.
Az eukarióta genomokban úgy tűnik, hogy a kimutatott kalapácsfejű ribozimok közül sok a rövid, egymással tarkított retroelemekhez (SINE -k) kapcsolódik, kivéve a feltűnően konzervált kalapácsfejek családját, amely minden amnióta genomjában megtalálható . Ezek a kalapácsfejű ribozimok (az úgynevezett HH9 és HH10) néhány specifikus gén intronjaiban fordulnak elő, és rámutatnak a biológiai szerep megőrzésére az mRNS előtti bioszintézis során
A katalízis kémiája
A kalapácsfejű ribozim egy nagyon egyszerű kémiai reakciót hajt végre, amely az RNS szubsztrát szálának megszakadását eredményezi, különösen a C17 hasítási hely nukleotidjában. Bár az RNS -hasítást gyakran hidrolízisnek nevezik , az alkalmazott mechanizmus valójában nem jár víz hozzáadásával . A hasítási reakció inkább izomerizáció, amely a kapcsoló foszfodiészter kötés átrendeződéséből áll . Ugyanaz a reakció kémiailag, amely véletlenszerű bázis által közvetített RNS-bomlás esetén is előfordul , azzal a különbséggel, hogy erősen helyspecifikus, és a sebesség 10 000-szeres vagy annál nagyobb.
Hasítás foszfodiészter izomerizációval

A hasítási reakció egy foszfodiészter- izomerizációs reakció, amelyet a hasítási hely ribóz 2'-hidroxil-protonjának a 2'-oxigénből történő absztrakciójával indítanak el , amely azután „in-line” vagy S N 2 (P) támadó nukleofil lesz . ) -szerű reakció, bár nem ismert, hogy ezt a protont eltávolítják -e a kalapácsfej hasítási reakció kémiai lépése előtt vagy alatt. (A hasítási reakció technikailag nem bimolekuláris , hanem ugyanúgy viselkedik, mint egy valódi S N 2 (P) reakció; a konfiguráció megfordításán megy keresztül, miután egy asszociatív átmeneti állapotot hoz létre, amely egy pentakoordinált oxifoszfánból áll.) A támadás és a távozás a csoport oxigénjei mind a két axiális pozíciót foglalják el a trigonális bipiramidális átmeneti állapot szerkezetében, mint egy S N 2-szerű reakciómechanizmushoz szükséges.
Ennek a hasítási reakciómechanizmusnak az eredményeképpen az 5'-termék 2 ', 3'-ciklikus foszfátvéggel rendelkezik, és a 3'-termék 5'-OH véggel rendelkezik, mint az RNS nem enzimatikus lúgos hasítása. A reakció ezért reverzibilis, mivel az ollózó foszfát továbbra is foszfodiészter marad, és így szubsztrátként működhet a kalapácsfejű RNS által közvetített ligáláshoz, anélkül, hogy szükség lenne ATP-re vagy hasonló exogén energiaforrásra. A kalapácsfejű ribozim katalizált reakció, ellentétben az RNS formailag azonos, nem enzimatikus lúgos hasításával, egy erősen szekvencia-specifikus hasítási reakció, amelynek tipikus forgási sebessége körülbelül 1 molekula szubsztrát enzimmolekulánként percenként, pH 7,5 mellett 10 mM Mg 2+ (úgynevezett „standard reakciókörülmények” a minimális kalapácsfejű RNS-szekvenciához), az adott kalapácsfejű ribozimkonstrukció szekvenciájától függően. Ez körülbelül 10 000-szeres sebességnövekedést jelent az RNS nem enzimatikus hasítása során.
A kétértékű fémionokra vonatkozó követelmény
Eredetileg minden ribozimről azt tartották, hogy metallo-enzimek . Feltételezték, hogy az olyan kétértékű fémionoknak, mint az Mg 2+ , két szerepe van: az RNS megfelelő hajtogatásának elősegítése és a katalitikus mag kialakítása. Mivel az RNS önmagában nem tartalmazott elegendő variációt a funkcionális csoportokban, úgy vélték, hogy a fémionok szerepet játszanak az aktív helyen, amint az a fehérjékről is ismert volt. Az Mg2+ -ion javasolt mechanizmusa a következő volt: a 2'-OH-csoport deprotonálása a magnézium-víz-hidroxikomplex által, amelyet a foszfát-hasítási helyen a pro-R oxigén köt, majd a kapott 2'-nukleofil támadás alkaoxid a hasító foszfáton, amely pentakoordinátás foszfát köztiterméket képez. Az utolsó lépés az 5 'kilépő csoport távozása, és 2', 3'-ciklikus foszfátot kapunk, fordított konfigurációval.
Feltételeztük, hogy hexahidrátot magnézium- ionokat , amelyek egyensúlyban vannak a magnézium-hidroxid , játszhat a szerepét általános sav és általános bázissal , olyan módon analóg módon játszott két hisztidin a RNáz A . A kétértékű fémionok további szerepét is javasolták az átmeneti állapot elektrosztatikus stabilizálása formájában .
Nem metallo-enzim
1998 -ban felfedezték, hogy a kalapácsfejű ribozim, valamint a VS ribozim és a hajtűs ribozim nem igényel fémionok jelenlétét a katalízishez, feltéve, hogy elegendő mennyiségű egyértékű kation van jelen az RNS hajtogatásához. Ez a felfedezés azt sugallta, hogy maga az RNS ahelyett, hogy inert, passzív állványként szolgálna kémiailag aktív kétértékű fémionok megkötésére, maga is szorosan részt vesz a katalízis kémiájában. Az alábbiakban ismertetett legfrissebb szerkezeti eredmények valóban megerősítik, hogy két invariáns nukleotid, a G12 és a G8, összhangban vannak a kalapácsfej hasítási reakció általános bázisa és általános savjaival.
Szigorúan véve tehát a kalapácsfejű ribozim nem lehet metallo-enzim.
Elsődleges és másodlagos szerkezet

Minimális ribozim
Az önhasítási reakcióhoz szükséges minimális kalapácsfej-szekvencia körülbelül 13 konzervált vagy változatlan "mag" nukleotidot tartalmaz, amelyek többsége nem vesz részt a kanonikus Watson-Crick bázispárok kialakításában . A magrégiót az I., II. És III. Szárak szegélyezik, amelyek általában kanonikus Watson-Crick bázispárokból állnak, de egyébként nincsenek korlátozva a sorrend tekintetében. A minimális kalapácsfejű ribozimek katalitikus áramlási sebessége ~ 1/perc (0,1/perc és 10/perc közötti tartomány általában megfigyelhető, a nem konzervált szekvenciáktól és a három spirális szár hosszától függően) magas Mg 2 standard reakciókörülmények között + (~ 10 mM), pH 7,5 és 25 ° C. A kalapácsfejű ribozimokkal végzett kísérleti munkák nagy része minimális konstrukciót használt.
I. típusú, II. És III. Típusú kalapácsfejű RNS
| Hammerhead ribozim (I. típus) | |
|---|---|
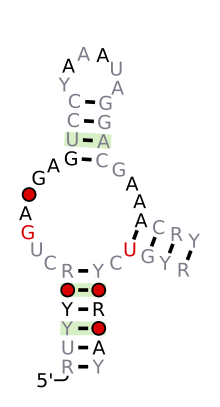 A Hammerhead_1 várható másodlagos szerkezete és szekvencia -megőrzése
| |
| Azonosítók | |
| Szimbólum | Kalapácsfej_1 |
| Rfam | RF00163 |
| Egyéb adatok | |
| RNS típus | Gén ; ribozim |
| Domain (ek) | Viroidok ; Eukaryota |
| ÍGY | SO: 0000380 |
| PDB struktúrák | PDBe |
| Kalapácsfejű ribozim (III. Típus) | |
|---|---|
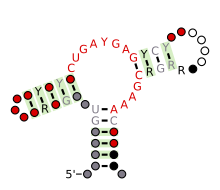 A Hammerhead ribozim (III. Típus) várható másodlagos szerkezete és szekvencia -megőrzése
| |
| Azonosítók | |
| Szimbólum | Kalapácsfej_3 |
| Rfam | RF00008 |
| Egyéb adatok | |
| RNS típus | Gén ; ribozim |
| Domain (ek) | Viroidok ; Eukaryota |
| ÍGY | SO: 0000380 |
| PDB struktúrák | PDBe |
Szerkezetileg a kalapácsfejű ribozim három bázispáros hélixből áll, amelyeket konzervált szekvenciák rövid linkerei választanak el. Ezeket a spirálokat I., II. És III. A kalapácsfejű ribozimek három típusba sorolhatók, amelyek alapján az 5 'és a 3' spirál hélix található. Ha a szekvencia 5 'és 3' vége hozzájárul az I szárhoz, akkor ez az I. típusú kalapácsfejű ribozim, a II. típusú, a III. szárhoz pedig III. típusú kalapácsfejű ribozim. A három lehetséges topológiai típus közül az I. típusú a prokarióták, az eukarióták és az RNS növényi kórokozók genomjában található, míg a II.
Teljes hosszúságú ribozim
A teljes hosszúságú kalapácsfejű ribozim az I. és II. Szárban található további szekvenciaelemekből áll, amelyek lehetővé teszik további harmadlagos érintkezések kialakulását. A harmadlagos kölcsönhatások stabilizálják a ribozim aktív konformációját, ami akár 1000-szer nagyobb hasítási sebességet eredményez, mint a megfelelő minimális kalapácsfejű szekvenciáké.
Harmadlagos szerkezet
Minimális
A minimális kalapácsfejű ribozimot kimerítően tanulmányozták biokémikusok és enzimológusok, valamint röntgenkristály-kutatók, NMR-spektroszkópok és a biofizikai technikák más gyakorlói. Az első részletes háromdimenziós szerkezeti információ a kalapácsfejű ribozimról 1994-ben jelent meg egy kalapácsfejű ribozim röntgenkristályszerkezete formájában, amely DNS-szubsztrát-analóghoz van kötve, és amelyet a Nature , Pley, Flaherty és McKay publikált . Ezt követően, egy minden-RNS minimális kalapácsfej ribozim szerkezet tette közzé Scott, Finch és Klug a Cell 1995 elején.
A minimális kalapácsfejű ribozim három bázispáros hélixből áll, amelyeket a kristályszerkezetben bemutatott konzervált szekvenciájú rövid linkerek választanak el . Ezeket a spirálokat I., II. És III. A konzervált uridin-fordulat az I hélixet a II. Hélixhez kapcsolja, és általában a CUGA szekvenciát tartalmazza. A II. És III. Hélixet GAAA szekvencia köti össze. A hasítási reakció a III és az I spirál között megy végbe, és általában C.
A teljes hosszúságú ribozim szerkezete azt mutatja, hogy kiterjedt kölcsönhatások vannak a II.
Szerkezet-funkció
Annak ellenére, hogy a minimális kalapácsfejű kristályban lévő kalapácsfejű ribozimkatalízist figyelték meg, amelyben a kristályrácsos tömörítés szükségszerűen korlátozza mindhárom szegélyezett spirális szár disztális végének globális helyzetét, számos biokémiai kísérlet célja az átmeneti állapot kölcsönhatásának vizsgálata és a katalízis kémiája összeegyeztethetetlennek tűnt a kristályszerkezetekkel.
Például a minimális kalapácsfejű ribozim G5, G8, G12 és C3 változatlan magmaradványait olyan törékenynek találták, hogy akár egyetlen exociklusos funkcionális csoport megváltoztatása ezen nukleotidok bármelyikénél a katalitikus aktivitás drámai csökkenését vagy megszűnését eredményezi , mégis úgy tűnt, hogy ezek közül csak néhány képez hidrogénkötést ezeknek a nukleotidbázisoknak a Watson-Crick felületét érintő minimális kalapácsfejű szerkezetek bármelyikében, kivéve a G-5 kölcsönhatást a termék szerkezetében.
Egy különösen feltűnő és csak a közelmúltban megfigyelt példa a G8 és G12 volt, amelyeket a sav/bázis katalízis lehetséges résztvevőinek azonosítottak. Miután bebizonyosodott, hogy a kalapácsfejű RNS nem igényel kétértékű fémionokat a katalízishez, fokozatosan nyilvánvalóvá vált, hogy az RNS-nek, és nem passzívan kötött kétértékű fémionoknak, közvetlen kémiai szerepet kell játszania a kalapácsfejű ribozim bármely sav-bázis kémiájában. aktív oldal. Teljesen homályos volt azonban, hogy a G12 és G8 hogyan tudná ezt elérni, tekintettel a minimális kalapácsfejű ribozim eredeti szerkezetére.
További aggodalmak közé tartozott az NMR -jellemzés során szintén észlelt NOE a hasított kalapácsfejű ribozim U4 és U7 között , ami azt sugallta, hogy ezeknek a nukleotidbázisoknak közel kell közelíteniük egymáshoz, mint körülbelül 6 Å, bár az U7 közeli megközelítése U4 -hez nem tűnt lehetséges a kristályszerkezetből. Végül, amint azt korábban tárgyaltuk, az eredeti struktúrákban a támadó nukleofil, a C17 2'-OH nem volt olyan helyzetben, amely alkalmas a szomszédos ollózó foszfát elleni in-line támadásra .
Talán a leginkább aggasztóak voltak azok a kísérletek, amelyek azt javasolták, hogy az A-9 és az ollózó foszfátoknak körülbelül 4 Å távolságon belül kell lenniük egymástól az átmeneti állapotban, kettős foszforotioát-helyettesítés és lágyfémion-mentő kísérletek alapján; ezeknek a foszfátoknak a távolsága a minimális kalapácsfejű kristályszerkezetben körülbelül 18 Å volt, és nem volt egyértelmű mechanizmus a közeli megközelítéshez, ha a Stem II és Stem I A-alakú hélixeket merev testekként kezelték. Összességében ezek az eredmények azt sugallták, hogy meglehetősen nagyszabású konformációs változásnak kellett történnie ahhoz, hogy elérjék az átmeneti állapotot a minimális kalapácsfejű ribozim szerkezeten belül.
Ezen okok miatt a két kísérletsorozat (biokémiai és kristálytani) nemcsak ellentmondásosnak tűnt, hanem teljesen és reménytelenül összeegyeztethetetlennek, ami jelentős ellentmondást keltett a területen. Soha nem született meggyőző bizonyíték egyik kísérleti eredmény elutasítására sem, bár sok ellenkező állítás hangzott el mindegyik mellett.
Teljes hossz
2006-ban 2,2 Å felbontású kristályszerkezetet kaptunk a teljes hosszúságú kalapácsfejű ribozimból. Ez az új struktúra (a jobb oldalon látható) úgy tűnik, hogy megoldja a korábbi aggodalmakat aggasztóan. Különösen a C17 alkalmas in-line támadásra, és a változatlan C3, G5, G8 és G12 aminosavak mind részt vesznek a katalízis szempontjából lényeges kölcsönhatásokban. Ezenkívül az A9 és az ollózó foszfátok egymástól 4,3 Å távolságra vannak, összhangban azzal az elképzeléssel, hogy módosítva ezek a foszfátok egyetlen tiofil fémionhoz kötődhetnek. A szerkezet azt is feltárja, hogy két invariáns aminosav, a G-12 és a G-8 hogyan helyezkednek el az aktív helyen, összhangban a korábban javasolt szerepükkel a sav/bázis katalízisben. G12 hidrogénkötési távolságon belül van a C17 2'-O-jától, a hasítási reakció nukleofiljétől és a G8 hidrogénkötések ribózjától a kilépő 5'-O csoporthoz. (lásd alább), míg a G8 nukleotid bázisa Watson-Crick párost alkot az invariáns C3-mal. Ez az elrendezés lehetővé teszi, hogy azt sugalljuk, hogy G12 az általános bázis a hasítási reakcióban, és hogy G8 általános savként funkcionálhat, összhangban a korábbi biokémiai megfigyelésekkel. A G5 hidrogén kötődik a C17 furanóz oxigénjéhez, segítve annak pozícionálását az in-line támadásban. Az U4 és U7 a G8 és C3 közötti bázispárképződés következtében most úgy vannak elhelyezve, hogy a bázisaik közötti NOE könnyen megmagyarázható.
A teljes hosszúságú kalapácsfejű ribozim kristályszerkezete tehát egyértelműen foglalkozik az összes fő aggodalommal, amelyek összeegyeztethetetlennek tűntek a minimális kalapácsfejű ribozim korábbi kristályszerkezeteivel.
Szerkezet és katalízis

A tercier kölcsönhatások a teljes hosszúságú kalapácsfejű ribozimban stabilizálják az aktív konformációt. A nukleofil, a hasítási hely nukleotidjának 2'-oxigénje, a C17, szinte tökéletesen illeszkedik az in-line támadáshoz (az S N 2 (P) reakció). A G12 ennek a nukleofilnek a hidrogénkötési távolságán belül helyezkedik el, és ezért képes lenne elvonni egy protont a 2'-oxigéntől, ha maga G12 deprotonálódik. A G8 2'-OH hidrogénkötést képez az 5'-kilépő csoport oxigénjéhez, és ezért potenciálisan protont szolgáltathat, mivel negatív töltés halmozódik fel az A1.1 ribóz 5'-oxigénjén.
A legvalószínűbb magyarázat az, hogy a G12, deprotonált formában, az általános bázis, és a G8 ribózja az általános sav. A kalapácsfejű ribozim látszólagos kinetikus pKa értéke 8,5, míg a guanozin pKa értéke körülbelül 9,5. Lehetséges, hogy a G12 pKa értéke 9,5 -ről 8,5 -re zavar a kalapácsfejű katalitikus magban; ez a hipotézis jelenleg intenzív vizsgálat tárgyát képezi.
Ha a G8 invariáns C8 -ra változik, a kalapácsfejű katalízis megszűnik. Azonban a G8C + C3G kettős mutáns, amely fenntartja a teljes hosszúságú kalapácsfejben található G8-C3 bázispárt, helyreállítja a katalitikus aktivitás nagy részét. Megfigyelték, hogy a G8 2'-OH-ja is elengedhetetlen a katalízishez; a G8 dezoxi-G8-ra történő cseréje nagymértékben csökkenti a katalízis sebességét, ami arra utal, hogy a 2'-OH valóban döntő fontosságú a katalitikus mechanizmus szempontjából.
Az A9 és az ollózó foszfátok közeli megközelítése megköveteli a pozitív töltés magas koncentrációjának jelenlétét. Valószínűleg ez a megfigyelés forrása, hogy kétértékű fémionokra van szükség alacsony ionerősségnél, de el lehet hagyni nagyobb koncentrációjú egyértékű kationok esetén.
A reakció tehát valószínűleg magában foglalja a 2'-proton kivonását a C17-ből, majd a szomszédos foszfát elleni nukleofil támadást. Amint az ollózó foszfor és az 5'-O kilépő csoport közötti kötés elkezd megszakadni, a G8 ribózjából proton kerül táplálásra, amely ezután valószínűleg újraprotonálódik egy vízmolekula rovására, amely megfigyeli, hogy hidrogénkötést köt hozzá a kristályszerkezetben .
Terápiás alkalmazások
A módosított kalapácsfejű ribozimokat terápiás szerként tesztelik. A mutáns SOD1 mRNS -sel komplementer szekvenciákat tartalmazó szintetikus RNS -eket és a kalapácsfejű katalitikus szerkezet kialakításához szükséges szekvenciákat vizsgálják az amiotrófiás laterális szklerózis lehetséges terápiájaként . Folyamatban van a munka annak kiderítésére is, hogy felhasználhatók -e a HIV -rezisztens T -sejtek tervezésére. A módosított kalapácsfejű ribozim adenovírusok hatásosnak bizonyultak a rák kezelésében mind in vitro, mind in vivo.
A transz -hasító kalapácsfejű ribozimok terápiás alkalmazását súlyosan akadályozta alacsony szintű in vivo aktivitása . A transz -hasító kalapácsfejű ribozimok valódi katalitikus potenciálja visszanyerhető in vivo, és a terápiás származékok valószínűleg kiegészítik más nukleinsav hibridizáló terápiás stratégiákat. Már léteznek olyan kalapácsfejű ribozimok, amelyek közel állnak a klinikai alkalmazáshoz.
Hivatkozások
Külső linkek
- Bill Scott laboroldala a kalapácsfejű ribozimról
- Marcos de la Peña laboroldala a kalapácsfejű ribozimról
- Oldal az I. típusú kalapácsfejhez az Rfam -nál
- Oldal a II . Típusú kalapácsfejhez az Rfam -nál
- Oldal a III . Típusú kalapácsfejhez az Rfam -nál
- Oldal a Hammerhead HH9 számára az Rfam -nál
- Oldal a Hammerhead HH10 számára az Rfam -nál