Idiopátiás multicentrikus Castleman-betegség - Idiopathic multicentric Castleman disease
| Idiopátiás multicentrikus Castleman-betegség | |
|---|---|
| Más nevek | Óriás nyirokcsomó-hyperplasia, lymphoid hamartoma, angiofollicularis nyirokcsomó-hyperplasia |
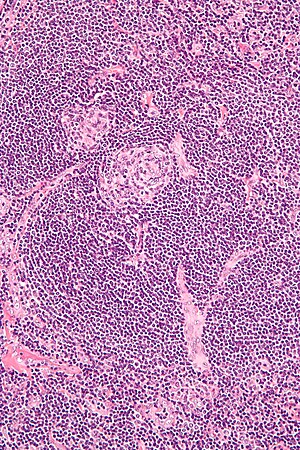 | |
| A nyirokcsomó-biopszia mikrográfiája, amely a Castleman-kórnak megfelelő hyaline vaszkuláris tulajdonságokat mutat | |
| Különlegesség | Hematológia, immunológia, reumatológia, patológia |
| Diagnosztikai módszer | Betegelőzmények, fizikális vizsgálat, laboratóriumi vizsgálatok, orvosi képalkotás, hisztopatológia alapján |
| Frekvencia | évente körülbelül 1500-1800 új eset az Egyesült Államokban |
Az idiopátiás multicentrikus Castleman-betegség (iMCD) a Castleman-kór egyik altípusa (más néven óriás nyirokcsomó-hiperplázia , limfoid hamartoma vagy angiofollikuláris nyirokcsomó-hiperplázia ), a limfoproliferatív rendellenességek csoportja, amelyet nyirokcsomó-megnagyobbodás jellemez, a megnövekedett mikroszkópos elemzésének jellemző tulajdonságai. nyirokcsomó szövet, valamint számos tünet és klinikai eredmény.
Az iMCD-ben szenvedőknél a nyirokcsomók több régióban megnagyobbodtak, és gyakran influenzaszerű tüneteik, rendellenes vérvizsgálati eredményeik vannak, és létfontosságú szervek, például a máj, a vesék és a csontvelő működési zavarai vannak.
Az iMCD jellemzői gyakran megtalálhatók az autoimmun betegségeknél és a rákos megbetegedéseknél, de az alapbetegség mechanizmusa nem ismert. Az iMCD kezelése különféle gyógyszerek alkalmazását foglalhatja magában, beleértve az immunszuppresszánsokat és a kemoterápiát.
A Castleman-kór Dr. Benjamin Castleman nevéhez fűződik , aki először 1956-ban írta le a betegséget. A Castleman-kór együttműködési hálózata a legnagyobb, a betegségre összpontosító szervezet, amely kutatással, tudatossággal és a betegek támogatásával foglalkozik.
jelek és tünetek
Az iMCD-ben szenvedő betegek megnagyobbodott nyirokcsomókat tapasztalhatnak több nyirokcsomó régióban; szisztémás tünetek (láz, éjszakai izzadás, nem szándékos fogyás, fáradtság); a máj és / vagy a lép megnagyobbodása ; extravaszkuláris folyadék felhalmozódása a végtagokban ( ödéma ), a hasban ( ascites ) vagy a tüdő bélésében ( pleurális effúzió ); tüdő tünetei, például köhögés és légszomj; és a bőr megállapításai, például a cseresznye hemangioma .
Okoz
Az iMCD oka nem ismert, és nem határoztak meg kockázati tényezőket. Genetikai variánsokat figyeltek meg Castleman-betegség esetén; azonban egyetlen genetikai változatot sem validáltak betegségkeltõként.
A HHV-8-hoz társított MCD -vel ellentétben az iMCD-t nem kontrollálatlan HHV-8 fertőzés okozza.
Gépezet
Az iMCD betegség mechanizmusát nem írták le teljes körűen. Ismeretes, hogy az interleukin-6 (IL-6) , az immunsejteket stimuláló molekula, szerepet játszik az iMCD egyes eseteiben. Az iMCD-ben szenvedő betegeknél mért IL-6 szintek a betegség aktivitásának megfelelő változásával nőnek és csökkennek, az IL-6-tal kezelt egereknél kialakulnak az iMCD jellemzői, és az IL-6 útvonal blokkolása a siltuximab és a tocilizumab gyógyszerekkel hatékonyan kezel néhány beteget iMCD. Sok iMCD-ben szenvedő beteg azonban nem igazolja az IL-6 megemelkedett szintjét, és az IL-6 szintje nincs szoros összefüggésben az anti-IL-6 gyógyszerek kezelésére adott reakcióval. Azokban az esetekben, amikor az IL-6 szerepet játszik, az emelkedett IL-6 szint kiváltó oka és az IL-6 termeléséért felelős sejtek továbbra sem ismertek.
Számos elméleti mechanizmust javasoltak az iMCD-re a meglévő kutatások alapján, és megfigyelték az iMCD és más olyan betegségek közötti hasonlóságot, amelyek hasonló klinikai leletekkel és nyirokcsomó-szövettanokkal rendelkeznek
- Autoimmun - Az immunrendszer olyan antitesteket termelhet, amelyek baktériumok és vírusok helyett a szervezet egészséges sejtjeit célozzák meg. Az önirányított antitesteket általában olyan autoimmun betegségeknél észlelik, mint a szisztémás lupus erythematous lupus és a rheumatoid arthritis .
- Autoinflammatorikus - A mutáció egy gént szabályozó gyulladásos rendszerek hozzájárulhat káros aktiválását a gyulladásos útvonalra in betegek IMCD.
- Neoplasztikus - Az érett sejtekben kialakuló genetikai mutációk ( szomatikus mutációk) a kóros sejtek túlnövekedését okozhatják, mint például a rákos megbetegedésekben, például a limfómában .
- Kórokozó - A humán herpeszvírus 8 (HHV-8) az ismert kórokozó a HHV-8-hoz társuló MCD-ben, amelynek tünetei és eredményei nagyon hasonlóak az iMCD-hez. Míg az iMCD-t definíció szerint nem a HHV-8 okozza, ismeretlen vírus okozhatja a betegséget.
Nem jelentettek olyan eseteket, amikor az UCD átalakult iMCD-vé.
Diagnózis
Az iMCD-t a bizonyítékokon alapuló konszenzusos diagnosztikai kritériumok alapján diagnosztizálják, amelyek alapos értékelést igényelnek, beleértve a beteg előzményeit , fizikai vizsgálatot , laboratóriumi vizsgálatokat , radiológiai képalkotást és a megnagyobbodott nyirokcsomóból származó biopsziás szövet mikroszkópos elemzését (szövettan) . Az iMCD diagnosztizálásához klinikai rendellenességek, más betegségek kizárása és egy nyirokcsomó-biopszia szükséges, amely a Castleman-kórnak megfelelő tulajdonságokkal rendelkezik. A nyirokcsomó biopszia önmagában nem elegendő a diagnózis felállításához.
Laboratóriumi vizsgálatok
A laboratóriumi vizsgálatok kimutathatják a megemelkedett C-reaktív fehérjét , csökkent hemoglobinszintet ( vérszegénység ), alacsony albuminszintet , emelkedett kreatininszintet , megnövekedett immunglobulin szintet és kóros (emelkedett vagy csökkent) trombocitaszámot . A betegek emelhetik a gyulladásban szerepet játszó molekulák ( citokinek ) szintjét is , mint például az Interleukin 6 (IL-6) és az érrendszeri endothel növekedési faktor (VEGF) .
Orvosi képalkotás
A radiológiai képalkotás több régióban megmutatja a megnagyobbodott nyirokcsomókat, amelyek jellemzően 18F-fluorodoxi-glükóz (FDG) vannak, a pozitronemissziós tomográfián (PET) .
Társult betegségek
Az iMCD-t általában a POEMS- szindrómában szenvedő betegeknél észlelik , de nem világos, hogy az iMCD ezeknél a betegeknél független betegségfolyamatként vagy a POEMS-szindróma megnyilvánulásaként jelentkezik-e. Az iMCD-ben szenvedő betegeknél fokozott a kockázata a szilárd daganatoknak és a vérráknak. Esetenként az iMCD-ben szenvedő betegeknél limfocita interstitialis pneumonitis van .
TAFRO-szindróma
IMCD betegek t hrombocytopenia, egy nasarca, mielo f ibrosis, r enal diszfunkció, és o rganomegaly szindróma (TAFRO szindróma) úgy tekintjük, hogy egy külön klinikai altípusa IMCD. A betegeknél a tünetek gyakran gyorsan előrehaladnak, és gyakran súlyos szervműködési zavarok alakulnak ki náluk. A TAFRO-szindrómával nem rendelkező iMCD-betegekhez képest a TAFRO-szindrómában szenvedő iMCD-es betegeknél nagyobb valószínűséggel jelentkeznek súlyos hasi fájdalmak, alacsony vérlemezkeszint, progresszív veseműködési zavar és normális vagy enyhén emelkedett immunoglobulin szint. Míg a TAFRO-szindrómás iMCD-t először japán betegeknél írták le 2010-ben, a TAFRO-szindrómás iMCD-es eseteket azóta számos más országban nem japán betegeknél jelentették.
Osztályozás
A Castleman-kór legalább 3 különféle rendellenesség csoportját írja le - Unicentrikus Castleman-betegség (UCD), a humán herpeszvírus 8-hoz társuló multicentrikus Castleman-betegség (HHV-8-hoz társuló MCD) és az idiopátiás multicentrikus Castleman-betegség (iMCD) . A betegség helyes altípusának meghatározása fontos, mivel a három rendellenesség jelentősen eltér a tünetek, a klinikai eredmények, a betegség mechanizmusa, a kezelési megközelítés és a prognózis szempontjából.
- Unicentrikus Castleman-betegségben a megnagyobbodott nyirokcsomók jellegzetes mikroszkópos leletekkel csak egyetlen nyirokcsomó-régióban vannak jelen.
- A Castleman-betegség multicentrikus altípusaiban a megnagyobbodott nyirokcsomók jellegzetes leletekkel több nyirokcsomó régióban vannak. A Castleman-betegség multicentrikus változatait a betegség ismert okai tovább osztályozzák.
- A HHV-8-hoz társult MCD-t az emberi herpeszvírus 8 (HHV-8) kontrollálatlan fertőzése okozza.
- Idiopátiás multicentrikus Castleman-betegség (iMCD) esetén a betegség oka ismeretlen ( idiopátiás ). Az iMCD diagnosztizálásához a HHV-8 tesztjének negatívnak kell lennie.
Idiopátiás multicentrikus Castleman-betegség
IMCD tovább lehet különböztetni a jelenléte kapcsolatos betegségek, mint például a p olyneuropathy, o rganomegaly, e ndocrinopathy, m onoclonal fehérje, s kin megváltoztatja szindróma (POEMS szindróma), vagy különálló klinikai jellemzők, mint például a t hrombocytopenia, egy nasarca, mielo f ibrosis, r enal diszfunkció, és o rganomegaly szindróma (TAFRO szindróma).
Diagnosztikai kritériumok
Az iMCD diagnosztizálása megköveteli: mindkét fő kritérium jelenlétét, a megnagyobbodott nyirokcsomók több régióját, amint azt az orvosi képalkotás bizonyítja; legalább két kisebb kritérium megléte, amelyek közül legalább az egyiknek rendellenes laboratóriumi vizsgálatnak kell lennie; az iMCD-t utánzó betegségek kizárása.
1. fő kritérium: a megnagyobbodott nyirokcsomók több régiója
A radiológiai képalkotásnak meg kell mutatnia a megnagyobbodott nyirokcsomókat több régióban.
2. fő kritérium: a nyirokcsomó-biopszia mikroszkópos elemzése az iMCD-vel összhangban
A megnagyobbodott nyirokcsomóból származó biopsziás szövet mikroszkópos megjelenésének (szövettanának) bizonyítania kell a Castleman-kórnak megfelelő tulajdonságok konstellációját. Az iMCD-hez három jellegzetes szövettani jellemző kapcsolódik:
- Hypervascularis - visszafejlődött csíraközpontok , follikuláris dendritikus sejt előtérbe, hypervascularity a interfolikkuláris régiókban, és prominens köpeny zóna egy „hagymahéj” megjelenését.
- Plasmacyticus - megnövekedett tüszők száma nagy hiperplasztikus csíraközpontokkal és lapszerű plazmacytosis (megnövekedett plazma sejtek száma ).
- Vegyes - mind a hipervaszkuláris, mind a plazmacytás jellemzők.
Az iMCD leggyakrabban plazmacytás tulajdonságokat mutat be; azonban az iMCD nyirokcsomókban hipervaszkuláris tulajdonságok, vagy mind a hipervaszkuláris, mind a plazmacytikus jellemzők keveréke is megfigyelhető. Az iMCD altípusának klinikai haszna a szövettani jellemzők alapján bizonytalan, mivel a szövettani altípusok nem következetesen jósolják a betegség súlyosságát vagy a kezelésre adott választ.
Az iMCD diagnosztizálásához a HHV-8 fertőzés markerének késleltetett nukleáris antigénnel (LANA-1) történő festésnek negatívnak kell lennie.
Kisebb szempontok
A betegeknek a következő 11 kisebb kritérium közül legalább kettőt meg kell tapasztalniuk, amelyek közül legalább egy rendellenes laboratóriumi vizsgálat.
Laboratóriumi tesztek:
- Megnövekedett C-reaktív fehérje vagy eritrocita ülepedési sebesség
- Alacsony hemoglobinszint (vérszegénység)
- Kóros (alacsony vagy magas) vérlemezkeszám
- Alacsony albuminszint
- Emelt kreatininszint
- Az immunglobulinok szintjének emelkedése (hipergammaglobulinémia)
Klinikai szolgáltatások:
- Influenzaszerű tünetek
- A máj és / vagy a lép megnagyobbodása
- Folyadék felhalmozódása (ödéma, ascites, pleurális folyadékgyülem)
- Bőrleletek, például cseresznye hemangiómák vagy héjas papulák
- Limfocita intersticiális tüdőgyulladás
Kizárandó betegségek
A diagnózis megköveteli olyan betegségek kizárását, amelyek hasonló klinikai leletekkel és hasonló megjelenéssel járhatnak a megnagyobbodott nyirokcsomó szövetének mikroszkópos elemzésénél. Az iMCD diagnózisában kizárandó betegségek közé tartoznak a fertőző betegségek, például a HHV-8-hoz társuló MCD , az Epstein-Barr vírus mononukleózis és a reaktív lymphadenopathia ; autoimmun betegségek, például szisztémás lupus erythematosus és reumás ízületi gyulladás ; és rákos megbetegedések, beleértve a limfómát , a mielóma multiplexet és az elsődleges nyirokcsomó- plazmacitómát .
Kezelés
Az iMCD ritkasága miatt a kezelésre vonatkozó adatok korlátozottak, és megfigyelési esetsorok, esetjelentések és egyetlen randomizált klinikai vizsgálat kombinációján alapulnak. Az UCD-vel ellentétben, amelynél a műtét a legtöbb beteg számára választott és gyógyító kezelés, a műtét nem hatékony az iMCD-ben. Sebészeti kezelés helyett különféle gyógyszereket alkalmaznak a betegség súlyossága és a beteg korábbi kezelésekre adott válasza alapján. A siltuximab , az IL-6-ot megcélzó monoklonális antitest , az egyetlen gyógyszer, amelyet az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) hagyott jóvá az iMCD kezelésében; az irodalomban azonban más gyógyszerek sikeres alkalmazásáról számoltak be.
2018-ban az iMCD-vel kapcsolatos első, bizonyítékokon alapuló konszenzusos kezelési irányelveket a szakterület nemzetközi szakértői csoportja tette közzé. Az iMCD kezelési algoritmusának létrehozása mellett ezek a kezelési irányelvek meghatározták a betegség súlyosságának és a kezelésre adott válasz közös meghatározásait.
Az iMCD súlyosságának értékelése
Az iMCD-ben szenvedő betegeket az alább felsorolt 5 kritérium alapján súlyos vagy nem súlyos betegségnek minősítik. Az alábbi kritériumok közül 2 vagy több beteget súlyos betegségűnek, míg a kritériumok 0–1 besorolású betegeit nem súlyos betegségnek minősítik.
- Keleti Szövetkezeti Onkológiai Csoport (ECOG) teljesítményállapota ≥ 2
- Becsült glomeruláris szűrési sebesség (eGFR) <30 vagy kreatinin> 3,0 mg / dl
- Anasarca és / vagy ascites és / vagy pleura effúzió és / vagy pericardialis effúzió
- Hemoglobin ≤ 8,0 g / dl
- Tüdő érintettség (pl. Intersticiális tüdőgyulladás dyspnoával)
Kezelési válasz
Az iMCD-ben szenvedő betegek kezelését a tünetek változása, az érintett nyirokcsomók mérete és laboratóriumi vizsgálatok alapján értékelik. Minden kategóriát teljes válaszként, részleges válaszként, stabil betegségként vagy progresszív betegségként osztályoznak. Az általános kezelési választ a legalacsonyabb kategóriás osztály határozza meg. Például egy teljes laboratóriumi válasz, egy részleges tüneti válasz és egy teljes nyirokcsomó-válasz esetén a beteg részleges válasz általános kezelési választ kap . A kritériumok leírását és a válaszok osztályozását lásd alább.
Laboratóriumi vizsgálatok
A laboratóriumi vizsgálatok a következők mindegyikét tartalmazzák: C-reaktív fehérje, Hemoglobin, Albumin és eGFR.
- Teljes válasz - Minden laboratóriumi érték normál tartományon belül
- Részleges válasz -> 50% az összes laboratóriumi értékben
- Stabil betegség - Minden laboratóriumi érték <50% javulás és <25% romlás között van
- Progresszív betegség -> 25% -kal súlyosbodik bármely laboratóriumi értékben
Tünetek
Négy tünetet értékeltek az Országos Rákkutató Intézet mellékhatásainak közös terminológiai kritériumai (4. verzió) segítségével: fáradtság, étvágytalanság, láz és testtömeg
- Teljes válasz - normalizálás a betegség előtti kiindulási értékre
- Részleges válasz - Mind a 4 tünet javulása, de nem a betegség előtti kiindulási értékhez képest
- Stabil betegség - Legalább 1 (de nem az összes) tünet javulása
- Progresszív betegség - Legalább 1 tünet súlyosbodása 2 vagy több értékelésnél
Nyirokcsomó
A nyirokcsomók kezelési válaszát radiológiai képalkotással értékelik, és teljes válaszként, részleges válaszként, stabil betegségként és progresszív betegségként osztályozzák a módosított Cheson-kritériumok alapján.
Kezelési algoritmus
Az iMCD kezelési algoritmusa elsősorban a betegség súlyosságán és a kezelésre adott válaszon alapul. A kezelés visszavonása miatt a relapszus magas aránya miatt az iMCD-s betegek többségét korlátlan ideig kezelik gyógyszerekkel.
Nem súlyos betegség
A siltuximab, egy IL-6 blokkoló, ajánlott kezelés minden nem súlyos iMCD-ben szenvedő beteg számára, függetlenül a mért IL-6 szinttől. A tocilizumabot , az IL-6 útvonalat is megcélzó gyógyszert általában a siltuximab alternatívájaként alkalmazzák, amikor a siltuximab nem érhető el. Kortikoszteroidok adhatók az anti-IL-6 terápiához a klinikai megjelenéstől függően. A Rituximab , a B-sejteket célzó gyógyszer elsősorban másodlagos terápiaként ajánlott azoknak a betegeknek, akik nem reagálnak a siltuximabra vagy a tocilizumabra, de a megfelelő betegeknél első vonalbeli szerként alkalmazható.
Azoknál a nem súlyos betegségben szenvedő betegeknél, akik nem reagálnak a siltuximabra, a tocilizumabra és a rituximabra, a kezelési ajánlások nincsenek pontosan meghatározva. A citotoxikus kemoterápiákról beszámoltak arról, hogy remissziót váltanak ki nem súlyos iMCD-ben szenvedő betegeknél; azonban a citotoxikus kemoterápiák alkalmazása jelenleg nem ajánlott nem súlyos iMCD esetén a relapszus nagy valószínűsége és a súlyos mellékhatások profilja miatt. Alternatív megoldásként immunmodulátorokat, például talidomidot, ciklosporin A-t, szirolimust, bortezomibot és anakinrát ajánlunk hasonló válaszarányuk és kedvezőbb hosszú távú mellékhatás-profiljuk miatt.
Súlyos betegség
Az összes súlyos iMCD-ben szenvedő beteg számára ajánlott kezdeti kezelés a nagy dózisú szteroidok kombinációja egy anti-IL-6 ágenssel, például siltuximabbal vagy tocilizumabbal, függetlenül a mért IL-6 szinttől. Azoknál a betegeknél, akik ezzel a kezeléssel azonnal javulnak, a szteroidok lassan csökkenhetnek, de az anti-IL-6 szert a végtelen ideig folytatni kell a kezelés visszavonásával járó magas relapszus arány miatt. A súlyos iMCD-vel járó szövődmények magas kockázata miatt, ha a betegek súlyos dózisban szteroidokkal és anti-IL-6 terápiákkal súlyosbodnak vagy nem javulnak, ajánlott a citotoxikus kemoterápiás kezelések. Életveszélyes betegségben szenvedő betegeknél, különösen a TAFRO-szindrómában szenvedőknél korszerű intézkedésekre lehet szükség, például légzés támogatására mechanikus lélegeztetőgéppel vagy veseelégtelenség esetén dialízissel történő kezelésre .
A betegség állapotának javulását követően az anti-IL-6 ágenssel vagy immunszuppresszáns gyógyszerrel fenntartó terápiát általában a végtelenségig folytatjuk, mivel az ilyen gyógyszerek visszavonása visszaeséshez vezethet.
Utánkövetés
Az iMCD-ben szenvedő betegeknél szükség van a kezelésre adott válasz és a betegség progressziójának rutinszerű értékelésére. Javasoljuk, hogy az utólátogatások tartalmazzák a tünetek kiértékelését, fizikális vizsgálatot, laboratóriumi vizsgálatokat és radiológiai képalkotást.
Prognózis
Az iMCD egyes betegeknél akut életveszélyes betegségként, másoknál krónikus betegségként jelentkezhet. Néhány betegnél régóta stabil a betegség, míg mások súlyos betegség fellángolásait szenvedik, amelyek javulhatnak a kezeléssel. A sikeres kezelés szabályozza az iMCD-vel kapcsolatos tüneteket és szervi diszfunkciókat, javítja a tüneteket és a szervi diszfunkciókat a betegség fellángolása során, és megakadályozza a jövőbeni betegség fellángolását.
Az iMCD-s betegek nemrégiben végzett vizsgálatában megfigyelt túlélés 2 év alatt 92%, 5 évkor 76% és 10 év után 59% volt.
Járványtan
Évente körülbelül 1500-1800 új iMCD-es esetet diagnosztizálnak az Egyesült Államokban. Az iMCD bármely életkorban előfordulhat, de a bemutatáskor a medián életkor körülbelül 50 éves. A nőknél kissé megnő az iMCD előfordulása.
Az Egyesült Államokon kívül nem publikáltak epidemiológiai vizsgálatokat a Castleman-betegségről; azonban még nem tettek közzé olyan adatokat, amelyek bizonyítanák a Castleman-betegség fokozott vagy csökkent előfordulását bizonyos régiókban vagy etnikumokon.
Történelem
A Castleman-kórt először Dr. Benjamin Castleman írta le 1956-ban. A Castleman-betegség világnapját 2018-ban hozták létre, és minden évben július 23-án tartják.
Kultúra
A Castleman Disease Collaborative Network 2012-ben alakult, és ez a legnagyobb szervezet, amely a Castleman-kórra összpontosít. Ez egy globális együttműködési hálózat, amely részt vesz a kutatásban, a tudatosságban és a betegek támogatásában.
Hivatkozások
| Osztályozás |
|---|
