Vezet - Lead
 | ||||||||||||||||||||||||||
| Vezet | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Kiejtés |
/ L ɛ d / ( led ) |
|||||||||||||||||||||||||
| Megjelenés | metálszürke | |||||||||||||||||||||||||
| Szabványos atomtömeg A r, std (Pb) | [206,14 , 207.94 ] hagyományos: 207,2 ± 1,1 | |||||||||||||||||||||||||
| Ólom a periódusos rendszerben | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Atomi szám ( Z ) | 82 | |||||||||||||||||||||||||
| Csoport | 14. csoport (szénatomcsoport) | |||||||||||||||||||||||||
| Időszak | 6. időszak | |||||||||||||||||||||||||
| Blokk | p-blokk | |||||||||||||||||||||||||
| Elektron konfiguráció | [ Xe ] 4f 14 5d 10 6s 2 6p 2 | |||||||||||||||||||||||||
| Elektronok héjonként | 2, 8, 18, 32, 18, 4 | |||||||||||||||||||||||||
| Fizikai tulajdonságok | ||||||||||||||||||||||||||
| Fázis az STP -n | szilárd | |||||||||||||||||||||||||
| Olvadáspont | 600,61 K (327,46 ° C, 621,43 ° F) | |||||||||||||||||||||||||
| Forráspont | 2022 K (1749 ° C, 3180 ° F) | |||||||||||||||||||||||||
| Sűrűség ( rt közelében ) | 11,34 g/cm 3 | |||||||||||||||||||||||||
| amikor folyadék ( mp ) | 10,66 g/cm 3 | |||||||||||||||||||||||||
| Fúziós hő | 4,77 kJ/mol | |||||||||||||||||||||||||
| A párolgás hője | 179,5 kJ/mol | |||||||||||||||||||||||||
| Moláris hőkapacitás | 26,650 J/(mol · K) | |||||||||||||||||||||||||
Gőznyomás
| ||||||||||||||||||||||||||
| Atomi tulajdonságok | ||||||||||||||||||||||||||
| Az oxidációs állapotok | −4, −2, −1, +1, +2 , +3, +4 ( amfoter oxid) | |||||||||||||||||||||||||
| Elektronegativitás | Pauling skála: 2,33 (+4), 1,87 (+2) | |||||||||||||||||||||||||
| Ionizációs energiák | ||||||||||||||||||||||||||
| Atomi sugár | empirikus: 175 óra | |||||||||||||||||||||||||
| Kovalens sugár | 146 ± 5 óra | |||||||||||||||||||||||||
| Van der Waals sugara | 202 óra | |||||||||||||||||||||||||
| Az ólom spektrális vonalai | ||||||||||||||||||||||||||
| Egyéb tulajdonságok | ||||||||||||||||||||||||||
| Természetes előfordulás | ősi | |||||||||||||||||||||||||
| Kristályszerkezet | lapcentrált köbös (FCC) | |||||||||||||||||||||||||
| A vékony rúd hangsebessége | 1190 m/s ( szobahőmérsékleten ) (lágyítva) | |||||||||||||||||||||||||
| Hőtágulás | 28,9 µm/(m⋅K) (25 ° C -on) | |||||||||||||||||||||||||
| Hővezető | 35,3 W/(m⋅K) | |||||||||||||||||||||||||
| Elektromos ellenállás | 208 nΩ⋅m (20 ° C -on) | |||||||||||||||||||||||||
| Mágneses rendezés | diamágneses | |||||||||||||||||||||||||
| Moláris mágneses fogékonyság | −23,0 × 10 −6 cm 3 /mol (298 K -on) | |||||||||||||||||||||||||
| Young modulusa | 16 GPa | |||||||||||||||||||||||||
| Nyírási modulus | 5,6 GPa | |||||||||||||||||||||||||
| Kompressziós modulus | 46 GPa | |||||||||||||||||||||||||
| Poisson arány | 0,44 | |||||||||||||||||||||||||
| Mohs keménység | 1.5 | |||||||||||||||||||||||||
| Brinell keménység | 38-50 MPa | |||||||||||||||||||||||||
| CAS -szám | 7439-92-1 | |||||||||||||||||||||||||
| Történelem | ||||||||||||||||||||||||||
| Felfedezés | Közel -Kelet (i. E. 7000 ) | |||||||||||||||||||||||||
| Szimbólum | "Pb": latin plumbumból | |||||||||||||||||||||||||
| Az ólom fő izotópjai | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Az izotópok gyakorisága nagymértékben változik mintánként | ||||||||||||||||||||||||||
Lead egy kémiai elem a szimbólum Pb (a latin plumbum ) és atomi száma 82. Ez egy nehézfém , amely sűrűbb , mint a leggyakoribb anyagok. Az ólom puha és képlékeny , valamint viszonylag alacsony olvadáspontú . Frissen vágva az ólom ezüstös, kék színnel; ez elhomályosítja a tompa szürke színű, ha levegőnek kitéve. Az ólom rendelkezik a legnagyobb atomszámmal minden stabil elem közül, és három izotópja a nehezebb elemek nukleáris bomlási láncának végpontja .
Az ólom viszonylag nem reagáló, átmenet utáni fém . Gyenge fémes jellegét amfoter jellege illusztrálja ; az ólom és az ólom -oxidok savakkal és bázisokkal reagálnak , és kovalens kötéseket hoznak létre . Az ólomvegyületek általában a +2 oxidációs állapotban találhatók, nem pedig a széncsoport könnyebb tagjaival közös +4 állapotban . A kivételek többnyire a szerves vegyületekre korlátozódnak . A csoport könnyebb tagjaihoz hasonlóan az ólom hajlamos önmagához kötődni ; láncokat és sokszögletű szerkezeteket alkothat.
Mivel az ólom könnyen kinyerhető érceiből , a Közel -Kelet őskori emberei tisztában voltak vele . A Galena az ólom fő érce, amely gyakran ezüstöt hordoz. Az ezüst iránti érdeklődés elősegítette az ólom széles körű kitermelését és felhasználását az ókori Rómában . Az ólomtermelés Róma bukása után csökkent, és az ipari forradalomig nem érte el az összehasonlítható szintet . 2014 -ben az ólom éves globális termelése mintegy tízmillió tonna volt, ennek több mint a fele újrahasznosításból származott. Az ólom nagy sűrűsége, alacsony olvadáspontja, hajlékonysága és az oxidációhoz való viszonylagos tehetetlensége teszi hasznossá. Ezek a tulajdonságok, kombinálva a relatív bőségét és alacsony költségű, eredményezett széles körű használatára a építési, vízvezeték, akkumulátorok , golyók és a lövés , súlyok, forraszanyagok , pewters , olvasztható ötvözetek , fehér festékek , ólmozott benzint , és a sugárzás árnyékolása .
A 19. század végén felismerték az ólom toxicitását , és használatát azóta számos alkalmazásban megszüntették. Sok ország azonban továbbra is engedélyezi az emberek ólomnak kitett termékek értékesítését, beleértve bizonyos típusú festékeket és golyókat. Az ólom neurotoxin, amely felhalmozódik a lágy szövetekben és a csontokban; károsítja az idegrendszert és zavarja a biológiai enzimek működését , neurológiai rendellenességeket, például agykárosodást és viselkedési problémákat okozva. Az ólom az általános egészségi állapotra, a szív- és érrendszerre és a vesére is hatással van.
Fizikai tulajdonságok
Atom
Egy ólomatom 82 elektronot tartalmaz , elektronkonfigurációban [ Xe ] 4f 14 5d 10 6s 2 6p 2 . Az ólom első és második ionizációs energiájának összege - a két 6p elektron eltávolításához szükséges teljes energia - közel van az ón , az ólom felső szomszédja a széncsoporthoz . Ez szokatlan; Az ionizációs energiák általában leesnek egy csoporton, amikor az elem külső elektronjai távolodnak a magtól , és kisebb orbitálok jobban védik őket.
Az ionizációs energiák hasonlóságát a lantanid összehúzódása okozza - az elem sugarainak csökkenése a lantánról (57. számú atom) a lutéciumra (71), és az elemek viszonylag kis sugara a hafniumtól (72). Ez annak köszönhető, hogy a lantanid 4f elektronok rosszul árnyékolják a sejtmagot . Az ólom első négy ionizációs energiájának összege meghaladja az ónét, ellentétben azzal, amit a periodikus tendenciák előre jeleznének. A relatív hatások , amelyek a nehezebb atomokban válnak jelentőssé, hozzájárulnak ehhez a viselkedéshez. Az egyik ilyen hatás az inert páros hatás : az ólom 6s elektronjai vonakodnak részt venni a kötésben, így a kristályos ólom legközelebbi atomjai közötti távolság szokatlanul hosszú.
Az ólom könnyebb széncsoportú rokonai stabil vagy metastabil allotrópokat képeznek a tetraéderesen koordinált és kovalensen kötött gyémánt köbös szerkezettel. Külső s- és p- pályájuk energiaszintjei elég közel vannak ahhoz, hogy lehetővé tegyék négy hibrid sp 3 pályára való keveredést . Az ólomban az inert páros hatás növeli az elkülönülést az s- és a p-pályája között, és a rést nem tudja leküzdeni az az energia, amelyet a hibridizációt követően extra kötések szabadítanának fel. A gyémánt köbös szerkezet helyett az ólom fémes kötéseket képez , amelyekben csak a p-elektronok delokalizálódnak és osztoznak a Pb 2+ ionok között. Ennek következtében az ólom arcközpontú köbös szerkezetű, mint a hasonló méretű kétértékű fémek, a kalcium és a stroncium .
Tömeges
A tiszta ólom fényes, ezüstös megjelenésű, kék színnel. Nedves levegővel érintkezve megfakul, és tompa megjelenést kölcsönöz, amelynek árnyalata az uralkodó körülményektől függ. Az ólom jellemző tulajdonságai közé tartozik a nagy sűrűség , a képlékenység, a hajlékonyság és a korrózióállóság a passziválás miatt .
Az ólom szorosan csomagolt, arcközpontú köbös szerkezete és nagy atomtömege 11,34 g/cm 3 sűrűséget eredményez , ami nagyobb, mint a közönséges fémeké, mint a vas (7,87 g/cm 3 ), a réz (8,93 g/cm 3) ) és cink (7,14 g/cm 3 ). Ez a sűrűség az idióma eredete, mint az ólom lufi . Néhány ritkább fém sűrűbb: a volfrám és az arany egyaránt 19,3 g/cm 3 , és az ozmium - az ismert legsűrűbb fém - sűrűsége 22,59 g/cm 3 , ami majdnem kétszerese az óloménak.
Az ólom nagyon puha fém, Mohs -keménysége 1,5; körömmel karcolható. Elég képlékeny és kissé képlékeny. Az ólom ömlesztett modulusa - a könnyű összenyomhatóság mértéke - 45,8 GPa . Ehhez képest az alumíniumé 75,2 GPa; réz 137,8 GPa; és lágyacél 160–169 GPa. Az ólom szakítószilárdsága (12–17 MPa) alacsony (az alumíniumé 6 -szor nagyobb, a rézé 10 -szeres, az enyhe acélé 15 -ször nagyobb); kis mennyiségű réz vagy antimon hozzáadásával erősíthető .
Az ólom olvadáspontja - 327,5 ° C -on (621,5 ° F) - nagyon alacsony a legtöbb fémhez képest. A forráspontja 1749 ° C (3180 ° F) az a legalacsonyabb a szén-dioxid-csoport elemei. Az ólom elektromos ellenállása 20 ° C -on 192 nanoohm -méter, ami majdnem nagyságrenddel magasabb, mint más ipari fémeké (réz15,43 nΩ · m ; Arany20,51 nΩ · m ; és alumínium at24,15 nΩ · m ). Az ólom szupravezető 7,19 K -nál alacsonyabb hőmérsékleten ; ez az összes I. típusú szupravezető közül a legmagasabb kritikus hőmérséklet , és az elemi szupravezetők közül a harmadik legmagasabb.
Az izotópok gyakorisága nagymértékben változik mintánként
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomtömeg A r, standard (Pb) | [206,14 , 207.94 ] hagyományos: 207,2 ± 1,1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Izotópok
A természetes ólom négy stabil izotópból áll, amelyek tömege 204, 206, 207 és 208, valamint öt rövid élettartamú radioizotópból. Az izotópok nagy száma összhangban van az ólom atomszámával . Az ólom varázslatos számú protonnal rendelkezik (82), amelyhez a nukleáris héjmodell pontosan megjósol egy különösen stabil magot. Az ólom-208 126 neutront tartalmaz, ez egy másik varázsszám, ami megmagyarázhatja, hogy az ólom-208 miért rendkívül stabil.
Magas atomszámával az ólom a legnehezebb elem, amelynek természetes izotópjait stabilnak tekintik; az ólom-208 a legsúlyosabb stabil mag. (Ez a megkülönböztetés korábban esett bizmut , amelynek atomszáma 83, amíg a csak primordiális izotópja , bizmut-209, találtak 2003 bomlani nagyon lassan.) A négy stabil izotópok ólom elméletileg alávetni alfa-részecske , hogy izotópjai higany energia felszabadulásával, de ezt egyiküknél sem figyelték meg; előre jelzett felezési idők tartománya 10 35 , hogy 10 189 éve (legalább 10 25 -szer a jelenlegi kor az univerzum).
A stabil izotópok közül három található a négy fő bomlási lánc közül háromban : az ólom-206, az ólom-207 és az ólom-208 az urán-238, az urán-235 és a tórium-232 végső bomlástermékei. Ezeket a bomlási láncokat urán-, aktinium- és tóriumláncnak nevezik. Izotópkoncentrációjuk egy természetes kőzetmintában nagymértékben függ e három urán- és tórium -izotóp jelenlététől. Például az ólom-208 relatív bősége a normál minták 52% -ától a tóriumércek 90% -áig terjedhet; ezért az ólom szabványos atomtömege csak egy tizedesjegy pontossággal van megadva. Az idő múlásával az ólom-206 és az ólom-207 és az ólom-204 aránya növekszik, mivel az előbbi kettőt a nehezebb elemek radioaktív bomlása egészíti ki, míg az utóbbit nem; ez lehetővé teszi az ólom -ólom társkeresést . Ahogy az urán ólommá bomlik, relatív mennyiségük változik; ez az urán -ólom kormeghatározás alapja . Az ólom-207 magmágneses rezonanciát mutat , ezt a tulajdonságot használták vegyületeinek oldott és szilárd halmazállapotú tanulmányozására, beleértve az emberi testet is.

A stabil izotópokon kívül, amelyek szinte minden természetes ólmot alkotnak, néhány radioaktív izotóp nyomai is megtalálhatók . Az egyik az ólom-210; bár felezési ideje mindössze 22,3 év, de kis mennyiség fordul elő a természetben, mert az ólom-210-et egy hosszú bomlási sorozat állítja elő, amely urán-238-mal kezdődik (ami már több milliárd éve jelen van a Földön). Az ólom-211, –212 és –214 jelen vannak az urán-235, a tórium-232 és az urán-238 bomlási láncaiban, így mindhárom ólomizotóp nyomai természetesen megtalálhatók. Az ólom-209 apró nyomai a rádium-223, a természetes urán-235 egyik leányterméke és a neptunium-237 bomlási láncának nagyon ritka klaszterbomlásából származnak , amelyek nyomai az uránércekben történő neutronfelvétel során keletkeznek . Az ólom-210 különösen hasznos a minták életkorának azonosításában az ólom-206-hoz viszonyított arány mérésével (mindkét izotóp egyetlen bomlási láncban van jelen).
Összesen 43 ólomizotópot szintetizáltak, tömegszáma 178–220. Lead-205 a legstabilabb radioizotóp felezési ideje kb 1,73 × 10 7 éve. A második legstabilabb az ólom-202, amelynek felezési ideje körülbelül 52.500 év, hosszabb, mint bármely természetes radioizotóp.
Kémia

A nedves levegőnek kitett ömlesztett ólom különböző összetételű védőréteget képez. Az ólom (II) -karbonát gyakori alkotóeleme; a szulfát vagy klorid városi vagy tengeri környezetben is jelen lehet. Ez a réteg az ömlesztett ólmot hatékonyan kémiailag semlegesíti a levegőben. A finom porú ólom, mint sok fém esetében, piroforikus , és kékesfehér lánggal ég.
A fluor szobahőmérsékleten reagál az ólommal, ólom (II) -fluoridot képezve . A klórral való reakció hasonló, de melegítést igényel, mivel a kapott kloridréteg csökkenti az elemek reaktivitását. Az olvadt ólom reagál a kalkogénekkel , és ólom (II) kalkogenideket kap.
Az ólomfém ellenáll a kén- és foszforsavnak, de nem a sósavnak vagy salétromsavnak ; az eredmény az oldhatatlanságtól és a terméksó későbbi passziválásától függ. A szerves savak, például az ecetsav , oxigén jelenlétében oldják az ólmot. A koncentrált lúgok feloldják az ólmot és plumbitokat képeznek .
Szervetlen vegyületek
Az ólom két fő oxidációs állapotot mutat: +4 és +2. A négyértékű állapot gyakori a széncsoportban. A kétértékű állapot a szén és a szilícium esetében ritka , a germánium esetében kicsi, az ón esetében fontos (de nem uralkodó), és az ólom esetében a két oxidációs állapot közül a legfontosabb. Ez a relativisztikus hatásoknak tulajdonítható , különösen az inert páros hatásnak , amely akkor nyilvánul meg, ha az ólom és az oxid , halogenid vagy nitrid anionok között nagy a különbség az elektronegativitás között , ami az ólom jelentős részleges pozitív töltéséhez vezet. Ennek eredményeként az ólom 6s pályájának erősebb összehúzódása következik be, mint a 6p orbitális esetében, így inkább inert az ionos vegyületekben. Az inert páros hatás kevésbé alkalmazható azokra a vegyületekre, amelyekben az ólom kovalens kötéseket képez hasonló elektronegativitású elemekkel, például a szerves vegyületekben lévő szénnel. Ezekben a 6s és 6p pályák hasonló méretűek maradnak, és az sp 3 hibridizáció továbbra is energetikailag kedvező. Az ólom, mint a szén, túlnyomórészt négyértékű ilyen vegyületekben.
Viszonylag nagy különbség van az ólom (II) 1,87 -es és 2,33 -as ólom (IV) elektronegativitása között. Ez a különbség azt jelzi, hogy a +4 oxidációs állapot stabilitásának növekedési tendenciája megfordul a széncsoporton belül; Összehasonlításképpen az ón +2 oxidációs állapotban 1,80, +4 állapotban 1,96.
Ólom (II)
Az ólom (II) vegyületek az ólom szervetlen kémiájára jellemzőek. Még erős oxidálószerek , mint a fluor- és a klóratom az ólomból, így csak a Pbf 2 és PbCl 2 . Az ólom (II) -ionok általában színtelenek az oldatban, és részben hidrolizálódnak, így Pb (OH) + és végül [Pb 4 (OH) 4 ] 4+ képződnek (amelyben a hidroxil -ionok áthidaló ligandumként működnek ), de nem redukálószerek mint az ón (II) ionok. A Pb 2+ ion vízben való jelenlétének azonosítására szolgáló technikák általában az ólom (II) -klorid kicsapódásán alapulnak híg sósav segítségével. Mivel a klorid -só vízben rosszul oldódik, nagyon híg oldatokban az ólom (II) -szulfid kicsapódását úgy érjük el, hogy hidrogén -szulfidot buborékoltatunk át az oldaton.
Az ólom-monoxid két polimorfban létezik , a litload α-PbO (piros) és a maszkotikus β-PbO (sárga), ez utóbbi csak 488 ° C körül stabil. A Litharge az ólom leggyakrabban használt szervetlen vegyülete. Nincs ólom (II) -hidroxid; az ólom (II) sók oldatának pH -értékének növelése hidrolízishez és kondenzációhoz vezet. Az ólom általában nehezebb kalkogénekkel reagál. Az ólom -szulfid félvezető , fényvezető és rendkívül érzékeny infravörös sugárzás -érzékelő . A másik két kalkogenid, az ólom -szelenid és az ólom -tellurid szintén fényvezető. Szokatlanok, hogy színük világosabbá válik a csoportban.
Az ólom-dihalogenidek jól jellemezhetők; ide tartozik a diastatid és a kevert halogenidek, például a PbFCl. Az utóbbi relatív oldhatatlansága hasznos alapot képez a fluor gravimetriás meghatározásához. A difluorid volt az első szilárd ionos vezető vegyület, amelyet felfedeztek (1834 -ben, Michael Faraday ). A többi dihalid bomlik ultraibolya vagy látható fény hatására, különösen a diiodid. Sok ólom (II) pszeudohalogenid ismert, mint például a cianid , cianát és tiocianát . Ólom (II) képezi kiterjedt különböző halogenid koordinációs komplexek , mint például a [PbCl 4 ] 2- , [PbCl 6 ] 4- , és a [Pb 2 Cl 9 ] n 5 n - lánc anion.
Az ólom (II) -szulfát nem oldódik vízben, mint más nehéz kétértékű kationok szulfátjai . Az ólom (II) -nitrát és az ólom (II) -acetát nagyon jól oldódik, és ezt használják ki más ólomvegyületek szintézisében.
Ólom (IV)
Kevés szervetlen ólom (IV) vegyület ismert. Csak erősen oxidáló oldatokban képződnek, és normál körülmények között általában nem léteznek. Az ólom (II) oxid további oxidációkor vegyes oxidot eredményez, Pb 3 O 4 . Ez van leírva, mint ólom (II, IV) -oxid , vagy szerkezetileg 2PbO · PbO 2 , és a legismertebb vegyes vegyérték ólom vegyületet. Az ólom -dioxid erős oxidálószer, amely képes sósavat klórgázzá oxidálni. Ez azért van, mert a várható PbCl 4 , ami az előállítandó instabil, és spontán módon bomlik PbCl 2 és Cl 2 . Az ólom -monoxidhoz hasonlóan az ólom -dioxid képes plumbate anionok képzésére . Az ólom -diszulfid és az ólom -diszenidid csak magas nyomáson stabil. Az ólom -tetrafluorid , sárga kristályos por, stabil, de kevésbé, mint a difluorid . Az ólom -tetraklorid (sárga olaj) szobahőmérsékleten bomlik, az ólom -tetrabromid még kevésbé stabil, és az ólom -tetraiodid léte megkérdőjelezhető.

Egyéb oxidációs állapotok
Néhány ólomvegyület formális oxidációs állapotban létezik, nem +4 vagy +2. Az ólom (III) közbenső termékként (II) és ólom (IV) között nyerhető nagyobb organolead komplexekben; ez az oxidációs állapot nem stabil, mivel mind az ólom (III) ion, mind az azt tartalmazó nagyobb komplexek gyökök . Ugyanez vonatkozik az ólomra (I) is, amely az ilyen radikális fajokban megtalálható.
Számos vegyes ólom (II, IV) oxid ismert. Ha a PbO 2 -t levegőn hevítik, akkor Pb 12 O 19 lesz 293 ° C -on, Pb 12 O 17 351 ° C -on, Pb 3 O 4 374 ° C -on, végül PbO 605 ° C -on. További szeszkvi-oxidot , Pb 2 O 3 -t nyerhetünk nagy nyomáson, több nem sztöchiometrikus fázissal együtt. Sokuk hibás fluoritszerkezeteket mutat , amelyekben egyes oxigénatomokat üres helyek váltanak fel: A PbO -nak tekinthető ilyen szerkezetűnek, és nincs minden alternatív oxigénatomréteg.
Negatív oxidációs állapotok fordulhatnak elő Zintl-fázisokként , szabad ólom-anionokként, mint például a Ba 2 Pb-ben, ólom formálisan ólom (-IV), vagy oxigénérzékeny gyűrű alakú vagy poliéderes klaszterionokban, mint például a trigonális bipiramidális Pb 5 2− ion, ahol két ólomatom ólom (−I) és három ólom (0). Ilyen anionok esetén mindegyik atom poliédercsúcson áll, és mindegyik kovalens kötéshez két elektronot ad az sp 3 hibrid pályájuk pereme mentén , a másik kettő külső magányos pár . Készíthetők folyékony ammóniában az ólom nátrium -redukciójával .
Organolead
Az ólom többszörös kötésű láncokat képezhet , ezt a tulajdonságot megosztja a széncsoport könnyebb homológjaival . Ennek képessége sokkal kisebb, mert a Pb – Pb kötés energiája több mint három és félszer alacsonyabb, mint a C – C kötésé. Az ólom önmagában akár három nagyságrendű fém -fém kötést is létrehozhat. A szén esetében az ólom szerves vegyületeket képez, amelyek hasonlóak, de általában kevésbé stabilak, mint a tipikus szerves vegyületek (mivel a Pb – C kötés meglehetősen gyenge). Ezáltal az ólom fémorganikus kémiája sokkal kevésbé széles körű, mint az óné. Az ólom túlnyomórészt szerves (IV) vegyületeket képez, még akkor is, ha szervetlen ólom (II) -reagensekkel kezdjük; nagyon kevés szerves (II) vegyület ismert. A leginkább jellemzett kivételek a Pb [CH (SiMe 3 ) 2 ] 2 és a Pb ( η 5 -C 5 H 5 ) 2 .
A legegyszerűbb szerves vegyület , a metán ólomanalógja a plumbane . Plumbane a fém ólom és az atomi hidrogén közötti reakcióban nyerhető . Két egyszerű származékai, tetramethyllead és tetraethyllead , a legjobb ismert ólom- vegyületek. Ezek a vegyületek viszonylag stabilak: a tetraetil -terhelés csak akkor kezd bomlani, ha felmelegszik, vagy ha napfénynek vagy ultraibolya fénynek van kitéve. Fém -nátriummal az ólom könnyen ekvimoláris ötvözetet képez, amely alkil -halogenidekkel reagálva fémorganikus vegyületeket, például tetraetil -szilíciumot képez . Számos szerves vegyület oxidáló jellegét hasznosítják ki: az ólom -tetra -acetát fontos laboratóriumi reagens a szerves szintézis oxidációjához. A benzinhez adott tetraetil -alkoholt nagyobb mennyiségben állították elő, mint bármely más fémorganikus vegyületet. Más szerves vegyületek vegyileg kevésbé stabilak. Sok szerves vegyület esetében nem létezik ólom -analóg.
Eredete és előfordulása
| Atomi szám |
Elem | Relatív összeg |
|---|---|---|
| 42 | Molibdén | 0,798 |
| 46 | Palladium | 0,440 |
| 50 | Ón | 1.146 |
| 78 | Platina | 0,417 |
| 80 | Higany | 0,127 |
| 82 | Vezet | 1 |
| 90 | Tórium | 0,011 |
| 92 | Uránium | 0,003 |
Űrben
Az ólom részecske-bősége a Naprendszerben 0,121 ppb (rész / milliárd). Ez a szám két és félszer magasabb, mint a platina , nyolcszor több, mint a higany, és tizenhétször több, mint az arany. Az ólom mennyisége az univerzumban lassan növekszik, mivel a legtöbb nehezebb atom (amelyek mindegyike instabil) fokozatosan bomlik ólommá. Az ólommennyiség a Naprendszerben 4,5 milliárd évvel ezelőtti kialakulása óta körülbelül 0,75%-kal nőtt. A Naprendszer bőségi táblázata azt mutatja, hogy az ólom, viszonylag magas atomszáma ellenére, elterjedtebb, mint a legtöbb más, 40 -nél nagyobb atomszámú elem.
Az ősi ólom-amely az ólom-204, az ólom-206, az ólom-207 és az ólom-208 izotópokat tartalmazza-többnyire a csillagokban előforduló ismétlődő neutronbefogási folyamatok eredményeként jött létre. A rögzítés két fő módja az s- és r-folyamat .
Az s-folyamatban (s jelentése "lassú") a rögzítéseket évek vagy évtizedek választják el egymástól, lehetővé téve a kevésbé stabil magok béta-bomlását . Egy stabil tallium-203 mag képes elfogni egy neutront, és tallium-204-vé válni; ez béta-bomláson megy keresztül, hogy stabil ólom-204-et kapjon; egy másik neutron befogásakor ólom-205-vé válik, amelynek felezési ideje körülbelül 15 millió év. A további rögzítések eredményeként az ólom-206, az ólom-207 és az ólom-208 keletkezik. Egy másik neutron befogásakor az ólom-208 ólom-209-vé válik, amely gyorsan bizmut-209-re bomlik. Egy másik neutron befogásakor a bizmut-209-ből bizmut-210 lesz, és ez a béta polónium-210-re bomlik, amely az alfa ólom-206-ra bomlik. A ciklus tehát az ólom-206, ólom-207, ólom-208 és bizmut-209-nél ér véget.

Az r-folyamatban (r jelentése "gyors") a rögzítés gyorsabban történik, mint a magok. Ez nagy neutronsűrűségű környezetben fordul elő, például szupernóva vagy két neutroncsillag egyesülése . Az érintett neutron fluxus nagyságrendileg 10 22 neutron lehet négyzetcentiméterenként másodpercenként. Az r-folyamat nem képez annyi ólmot, mint az s-folyamat. Hajlamos megállni, ha a neutronban gazdag magok elérik a 126 neutront. Ezen a ponton a neutronok teljes héjban helyezkednek el az atommagban, és egyre nehezebb több energiát befogadni. Amikor a neutronáram lecsökken, ezek a béta -atommagok az ozmium, az irídium és a platina stabil izotópjaira bomlanak .
A földön
Az ólmot a Goldschmidt -osztályozás szerint kalkofilnak minősítik , vagyis általában kénnel kombinálva található meg. Ritkán fordul elő natív , fémes formájában. Sok ólomásvány viszonylag könnyű, és a Föld történelme során a kéregben maradt, ahelyett, hogy mélyebbre süllyedne a Föld belsejében. Ez az ólom viszonylag magas kéregbősége , 14 ppm; a kéreg 38. leggyakoribb eleme.
A fő ólomtartalmú ásvány a galena (PbS), amely főleg cinkércekben található. A legtöbb más ólomásvány valamilyen módon kapcsolódik a galenához; a boulangerit , Pb 5 Sb 4 S 11 , galenából származó vegyes szulfid; az anglesite , a PbSO 4 , a galéna oxidációjának terméke; és a ceruszit vagy fehér ólomérc, a PbCO 3 , a galena bomlásterméke. Az arzén , ón, antimon, ezüst, arany, réz és bizmut gyakori szennyeződések az ólomásványokban.

A világ vezető erőforrásai meghaladják a két milliárd tonnát. Jelentős betétek találhatók Ausztráliában, Kínában, Írországban, Mexikóban, Peruban, Portugáliában, Oroszországban és az Egyesült Államokban. A globális tartalékok - a gazdaságilag kivitelezhető erőforrások - 2016 -ban 88 millió tonna volt, ebből Ausztrália 35 millió, Kína 17 millió, Oroszország 6,4 millió.
Az ólom tipikus háttérkoncentrációja nem haladja meg a 0,1 μg/m 3 légkört; 100 mg/kg talajban; és 5 μg/l édes- és tengervízben.
Etimológia
A modern angol lead szó germán eredetű; származik a Közel-angol LEED és óangol ólom (az Macron felett „e” jelezvén, hogy a magánhangzó hangot, hogy a levél hosszú). Az óangol szó származik a feltételezett rekonstruált proto-germán * lauda- ( „vezető”). A nyelvi elmélet szerint ez a szó több, azonos jelentésű germán nyelvben utódokat szült.
A protogermán * lauda- eredetéről nincs egyetértés . Az egyik hipotézis azt sugallja, hogy a protoindoeurópai * lAudh- ('ólom'; a magánhangzó nagybetűzése megegyezik a makronnal). Egy másik hipotézis azt sugallja, hogy a proto-kelta * ɸloud-io- („ólom”) -ból kölcsönözték . Ez a szó a latin plumbumhoz kapcsolódik , amely az elem kémiai szimbólumát Pb -nek adta . A * ɸ felhő-io- szóról feltételezik, hogy a protogermán * bliwa- (ami egyben ólmot is jelent) eredete , innen ered a német Blei .
A kémiai elem neve nem rokon az azonos írásmódú igével, amely a protogermán * layijan- ('vezetni') szóból származik .
Történelem
Őstörténet és korai történelem
Fémes vezető gyöngyök nyúlik vissza, 7000-6500 BCE találtak kisázsiai , és képviselheti az első példa fém olvasztására . Abban az időben az ólomnak kevés (ha volt) alkalmazása volt lágysága és fénytelen megjelenése miatt. Az ólomtermelés elterjedésének fő oka az ezüsttel való összekapcsolódás volt, amelyet galen (egy gyakori ásványi ásvány) égetésével nyerhetnek. Az ókori egyiptomiak voltak az elsők, akik ólomásványokat használtak a kozmetikumokban, ez az alkalmazás elterjedt az ókori Görögországban és azon túl is; az egyiptomiak ólmot használhattak halászhálók, mázak , poharak, zománcok és dísztárgyak süllyesztőihez. A Termékeny Félhold különböző civilizációi íróanyagként, pénznemként és építőanyagként használták az ólmot. Az ólmot az ókori kínai királyi udvarban stimulánsként , valutaként és fogamzásgátlóként használták ; az Indus -völgyi civilizáció és a mezoamerikaiak amulettek készítésére használták; és a keleti és déli afrikai nép ólmot használt a huzalhúzás során .
Klasszikus korszak
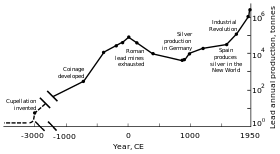
Mivel az ezüstöt széles körben használták dekorációs anyagként és csereközegként, ólomlerakódásokat i. E. 3000 -től kezdtek Kis -Ázsiában megmunkálni; később ólomlelőhelyeket fejlesztettek ki az Égei -tengeren és Laurionban . Ez a három régió együttesen uralta a bányászott ólom termelését, amíg kb. I. E. 1200. Ie 2000 körül a föníciaiak betéteket dolgoztak az Ibériai -félszigeten ; i. e. 1600 -ig ólombányászat létezett Cipruson , Görögországban és Szardínia területén .
Róma területi terjeszkedése Európában és a Földközi -tengeren, valamint a bányászat fejlődése miatt a klasszikus korszak legnagyobb ólomtermelőjévé vált , és a becsült éves kibocsátás elérte a 80 000 tonnát. Elődeikhez hasonlóan a rómaiak is többnyire ezüstolvasztás melléktermékeként kaptak ólmot. Ólombányászat Közép -Európában, Nagy -Britanniában , a Balkánon , Görögországban , Anatóliában és Spanyolországban történt , ez utóbbi a világ termelésének 40% -át adja.
Az ólomtablettákat általában betűk anyagául használták. Az ókori Júdeában lapos homokformába öntött ólomkoporsókat használtak felcserélhető motívumokkal . Az ólomból hevedereket készítettek az ie 5. századból. A római korban bőségesen használtak ólomhevedereket, amelyek 100 és 150 méter közötti távolságban voltak hatékonyak. A kartalegói és római hadseregek zsoldosaként használt baleári parittyások híresek voltak lőtávolságukról és pontosságukról.
Az ólmot vízvezetékek készítésére használták a Római Birodalomban ; a fém latin szója, plumbum , az angol "plumbing" szó eredete. Könnyű munkája és korrózióállósága biztosította széles körű használatát más alkalmazásokban, beleértve a gyógyszereket, a tetőfedést, a valutát és a hadviselést. Az akkori írók, mint az idősebb Cato , Columella és az idősebb Plinius , ólom (vagy ólombevonatú) edényeket ajánlottak a borhoz és az ételekhez hozzáadott édesítőszerek és tartósítószerek előállításához. Az ólom kellemes ízt kölcsönzött az "ólomcukor" (ólom (II) acetát) képződése miatt, míg a réz vagy bronz edények keserű ízt kölcsönözhettek a verdigris képződése révén .
Ez a fém volt a leggyakrabban használt anyag a klasszikus ókorban, és helyénvaló a (római) ólomkorra hivatkozni. Az ólom a rómaiak számára az volt, ami nekünk a műanyag.
Heinz Eschnauer és Markus Stoeppler
"Bor - egy enológiai mintabank ", 1992
Vitruvius római szerző beszámolt az ólom egészségügyi veszélyeiről, és a modern írók azt sugallják, hogy az ólommérgezésnek nagy szerepe volt a Római Birodalom hanyatlásában. Más kutatók bírálták az ilyen állításokat, rámutatva például, hogy nem minden hasi fájdalmat okoz ólommérgezés. Régészeti kutatások szerint a római ólomcsövek növelték az ólomszinteket a csapvízben, de ez a hatás "valószínűtlen, hogy valóban ártalmas lett volna". Amikor ólommérgezés történt, az áldozatokat "szaturninek" nevezték, sötétnek és cinikusnak, az istenek kísérteties atyja, Szaturnusz után . Egyesülés szerint az ólmot tartották minden fém atyjának. Státusza a római társadalomban alacsony volt, mivel könnyen beszerezhető és olcsó volt.
Zavar az ónnal és az antimonnal
A klasszikus korszakban (sőt a 17. századig) az ón gyakran nem volt megkülönböztethető az ólomtól : a rómaiak ólom plumbum nigrum ("fekete ólom"), és ón plumbum candidum ("fényes ólom") néven. Az egyesület az ólom és ón látható más nyelveken: a szó olovo a cseh fordításban „vezető”, de az orosz, a rokon олово ( olovo ) segítségével „ón”. A zűrzavar növelése érdekében az ólom szoros kapcsolatban állt az antimonnal: mindkét elem általában szulfidként (galena és stibnit ) fordul elő , gyakran együtt. Plinius helytelenül írta, hogy a stibnit ólmot ad a hevítéshez, az antimon helyett. Az olyan országokban, mint Törökország és India, az eredetileg perzsa halál név vagy antimon -szulfidra vagy ólom -szulfidra vonatkozott, és néhány nyelven, például oroszul, az antimonnak ( сурьма ) adta a nevét .
A középkor és a reneszánsz
Az ólombányászat Nyugat -Európában a Nyugat -Római Birodalom bukása után visszaesett , és az arab Ibéria volt az egyetlen régió, amely jelentős termelést produkált. A legnagyobb ólomtermelés Dél- és Kelet -Ázsiában történt, különösen Kínában és Indiában, ahol az ólombányászat gyorsan nőtt.

Európában az ólomtermelés a 11. és a 12. században kezdett növekedni, amikor ismét tetőfedéshez és csővezetékekhez használták. A 13. századtól kezdve ólmot használtak ólomüveg készítéséhez . Az alkímia európai és arab hagyományaiban az ólmot ( az európai hagyomány szimbóluma ) tisztátalan nemesfémnek tekintették, amely alkotóelemei leválasztásával, tisztításával és kiegyensúlyozásával tiszta és romolhatatlan aranysá alakítható át. Ebben az időszakban az ólmot egyre inkább használták a bor hamisítására . Az ilyen borok használatát 1498 -ban egy pápai bika megtiltotta a keresztény szertartásokban való használatnak , de továbbra is beszívódott, és tömeges mérgezésekhez vezetett egészen a 18. század végéig. Az ólom kulcsfontosságú anyag volt a nyomda egyes részein , és az ólomport általában belélegezték a nyomdai munkások, ólommérgezést okozva. Annak ellenére, hogy drágább, mint a vas, az ólom lett a lőfegyverek golyóinak gyártásának fő anyaga is. Kevésbé károsította a vasfegyverek csöveit, nagyobb volt a sűrűsége (ami lehetővé tette a sebesség jobb megtartását), és alacsonyabb olvadáspontja megkönnyítette a golyók előállítását, mivel fatüzeléssel készíthetők. Az ólmot velencei ceruse formájában széles körben használták a kozmetikumokban a nyugat -európai arisztokrácia, mivel a fehérített arcokat a szerénység jelének tekintették. Ez a gyakorlat később fehér parókákra és szemceruzákra is kiterjedt, és csak a 18. század végén elhalványult a francia forradalommal . Hasonló divat jelent meg Japánban a 18. században, amikor a gésák megjelentek , és ez a gyakorlat még a 20. században is folytatódott. A nők fehér arca "japán nőként képviselte nőies erényét", az ólmot általában a fehérítőben használják.
![]()
Európán és Ázsián kívül
Az Újvilágban az ólomtermelést nem sokkal az európai telepesek érkezése után rögzítették. A legkorábbi feljegyzés 1621 -ből származik a Virginia -i angol kolóniában , tizennégy évvel az alapítás után. Ausztráliában az első bánya, amelyet gyarmatosítók nyitottak a kontinensen, ólombánya volt, 1841 -ben. Afrikában az ólombányászatról és olvasztásról a Benue -árokban és az alsó Kongói -medencében ismertek , ahol az ólmot használták az európaiakkal folytatott kereskedelemhez. században, jóval az afrikai tülekedés előtt .

Ipari forradalom
A 18. század második felében Nagy -Britannia, majd később a kontinentális Európa és az Egyesült Államok élte át az ipari forradalmat . Ez volt az első alkalom, hogy az ólomtermelés aránya meghaladta Rómaét. Nagy-Britannia volt a vezető termelő, aki a 19. század közepére elvesztette ezt a státuszát a bányák kimerülésével és az ólombányászat fejlődésével Németországban, Spanyolországban és az Egyesült Államokban. 1900-ra az Egyesült Államok volt a vezető a globális ólomtermelésben, és más nem európai országok-Kanada, Mexikó és Ausztrália-jelentős termelést kezdtek; Európán kívüli termelés meghaladta a belföldi termelést. A nagy részét a kereslet a vezetést származott vízvezeték és festészettel vezető festékek voltak rendszeres használata. Ebben az időben több (munkásosztály) ember volt kitéve a fém- és ólommérgezési eseteknek. Ez vezetett az ólombevitel hatásainak kutatásához. Az ólom füst formájában veszélyesebbnek bizonyult, mint szilárd fémként. Az ólommérgezés és a köszvény összekapcsolódott; Alfred Baring Garrod brit orvos megjegyezte, hogy köszvényes betegeinek egyharmada vízvezeték -szerelő és festő. Az ólom krónikus lenyelésének hatásait, beleértve a mentális zavarokat is, a 19. században is tanulmányozták. Az első törvényeket, amelyek az ólommérgezés csökkentését célozták a gyárakban, az 1870 -es és 1880 -as években hozták meg az Egyesült Királyságban.

Modern kor
A 19. század végén és a 20. század elején további bizonyítékokat találtak az emberre gyakorolt fenyegetésről. A kárt okozó mechanizmusokat jobban megértették, az ólomvakítást dokumentálták, és az elemet fokozatosan megszüntették az Egyesült Államokban és Európában. Az Egyesült Királyság 1878 -ban vezette be a kötelező gyári ellenőrzéseket, és 1898 -ban kinevezte az első gyári orvosi felügyelőt; ennek eredményeképpen 1900-ról 1944-re 25-szörös csökkenést jelentettek az ólommérgezési incidensekben. A legtöbb európai ország 1930 -ra betiltotta az ólomfestéket - amelyet általában átlátszatlansága és vízállósága miatt használnak - a belső terekben.
Az utolsó jelentős emberi ólom -expozíció az volt, hogy a tetraetil -olvadékot a benzinhez adták ütésgátló szerként . Ez a gyakorlat 1921 -ben indult az Egyesült Államokban . 2000 -ig az Egyesült Államokban és az Európai Unióban fokozatosan megszűnt .
Az 1970 -es években az Egyesült Államok és a nyugat -európai országok jogszabályokat vezettek be az ólom -légszennyezés csökkentésére. A hatás jelentős volt: míg az Egyesült Államokban a Centers for Disease Control and Prevention által 1976–1980 között végzett tanulmány kimutatta, hogy a lakosság 77,8% -ának emelkedett a vér ólomszintje , 1991–1994 között ugyanez az intézet az ilyen magas szintű emberek aránya 2,2%-ra csökkent. A 20. század végére az ólomból készült fő termék az ólom -sav akkumulátor volt .
1960 és 1990 között a nyugati blokk ólomkibocsátása mintegy 31%-kal nőtt. A világ ólomtermelésének részesedése a keleti blokk részéről 1950-től 1990-ig 10% -ról 30% -ra nőtt, a Szovjetunió volt a világ legnagyobb termelője az 1970-es évek közepén és az 1980-as években, Kína pedig megkezdte a jelentős ólomtermelést század végén. Az európai kommunista országokkal ellentétben Kína a 20. század közepéig nagyrészt iparilag nem iparosodott; 2004 -ben Kína megelőzte Ausztráliát, mint a legnagyobb ólomtermelő. Akárcsak az európai iparosítás idején, az ólom negatív hatással volt az egészségre Kínában.
Termelés
2014 -től az ólomtermelés világszerte növekszik, mivel ólom -sav akkumulátorokban használják. A termelésnek két fő kategóriája van: elsődleges bányászott ércekből és másodlagos hulladékból. 2014 -ben 4,58 millió tonna származott az elsődleges termelésből, és 5,64 millió tonna a másodlagos termelésből. A bányászott ólomkoncentrátum első három gyártója abban az évben Kína, Ausztrália és az Egyesült Államok volt. Az első három finomított ólomtermelő Kína, az Egyesült Államok és India volt. Az International Resource Panel „s Metal Stocks in Society jelentés 2010-ben a teljes mennyiségű ólom használata, felhalmozva, dobni vagy szétszóródik a környezetbe, globális szinten, 8 kg egy főre jutó. Ennek nagy része a fejlettebb országokban van (20–150 kg fejenként), nem pedig a kevésbé fejlett országokban (1–4 kg / fő).
Az elsődleges és másodlagos ólomgyártási folyamatok hasonlóak. Néhány elsődleges termelési üzem most ólomhulladékkal egészíti ki tevékenységét, és ez a tendencia a jövőben valószínűleg növekedni fog. Megfelelő technikák mellett a másodlagos eljárásokkal nyert ólom megkülönböztethetetlen az elsődleges eljárásokkal nyert ólomtól. Az építőipari ólomhulladék általában meglehetősen tiszta, és újraolvasztás nélkül újraolvasztják, bár néha finomításra van szükség. A másodlagos ólomtermelés tehát energiaigényét tekintve olcsóbb, mint az elsődleges termelés, gyakran 50% -kal vagy annál többel.
Elsődleges
A legtöbb ólomérc alacsony százalékban tartalmaz ólmot (a gazdag ércek tipikus tartalma 3–8%), amelyet koncentrálni kell a kitermeléshez. A kezdeti feldolgozás során az érceket jellemzően zúzás, sűrű közeg elválasztás , őrlés , habhabosítás és szárítás éri. A kapott koncentrátumot, amelynek ólomtartalma 30–80 tömeg% (rendszeresen 50–60%), ezután (tisztátalan) ólomfémmé alakítják.
Ennek két fő módja van: kétlépcsős folyamat, amely pörkölést, majd kohó-kivonást foglal magában, külön edényekben; vagy közvetlen eljárás, amelyben a koncentrátum kivonása egyetlen edényben történik. Ez utóbbi lett a leggyakoribb útvonal, bár az előbbi még mindig jelentős.
| Ország | Teljesítmény (ezer tonna) |
|---|---|
|
|
2400 |
|
|
500 |
|
|
335 |
|
|
310 |
|
|
250 |
|
|
225 |
|
|
135 |
|
|
80 |
|
|
76 |
|
|
75 |
|
|
41 |
|
|
41 |
|
|
40 |
|
|
40 |
|
|
35 |
|
|
33 |
|
|
33 |
| Más országok | 170 |
Kétlépcsős folyamat
Először a szulfid -koncentrátumot levegőn pörkölik , hogy oxidálják az ólom -szulfidot:
- 2 PbS (ek) + 3 O 2 (g) → 2 PbO (k) + 2 SO 2 (g) ↑
Mivel az eredeti koncentrátum nem tiszta ólom -szulfid, a pörkölés nemcsak a kívánt ólom (II) -oxidot, hanem az ólom és az ércben lévő egyéb fémek oxidjainak, szulfátjainak és szilikátjainak keverékét eredményezi. Ezt a tisztátalan ólom -oxidot kokszolással égetett kohóban redukálják (ismét tisztátalan) fémké:
- 2 PbO (k) + C (s) → 2 Pb (s) + CO 2 (g) ↑
A szennyeződések többnyire arzén, antimon, bizmut, cink, réz, ezüst és arany. Általában pirometallurgiai eljárások során távolítják el őket . Az olvadékot visszarendező kemencében kezelik levegővel, gőzzel és kénnel, amely oxidálja a szennyeződéseket, kivéve az ezüstöt, az aranyat és a bizmutot. Az oxidált szennyeződések az olvadék tetejére úsznak, és lehámozzák. A fémes ezüstöt és aranyat eltávolítják és gazdaságosan visszanyerik a Parkes -eljárással , amelyben cinket adnak az ólomhoz. Az ólomban nem elegyedő cink feloldja az ezüstöt és az aranyat. A cinkoldatot el lehet választani az ólomtól, és ezüstöt és aranyat lehet kinyerni. Az ezüstmentesített ólom a Betterton – Kroll eljárással felszabadul a bizmutból , fémes kalciummal és magnéziummal kezelve . A keletkező bizmut -lerakódás lehámozható.
A pirometallurgiai eljárások alternatívájaként nagyon tiszta ólom nyerhető az olvasztott ólom elektrolitikus feldolgozásával a Betts -eljárással . Anódok szennyezett ólom és katódok tiszta ólom helyezünk elektrolit az ólom -fluoro-szilikát (PbSiF 6 ). Az elektromos potenciál alkalmazása után az anódon lévő szennyezett ólom feloldódik, és a lemezekre kerül a katódra, így a szennyeződések többsége oldatban marad. Ez egy költséges eljárás, és ezért többnyire a magas szennyeződést tartalmazó veretlen fémek finomítására szolgál.
Közvetlen folyamat
Ebben a folyamatban közvetlenül ólomkoncentrátumokból nyernek ólomtartalmat és salakot . Az ólom -szulfid -koncentrátumot kemencében megolvasztják és oxidálják, ólom -monoxidot képezve. Szénet (koksz vagy széngáz ) adunk az olvadt töltethez folyósítószerekkel együtt . Az ólom -monoxid ezáltal fémes ólommá redukálódik, az ólom -monoxidban gazdag salak közepette.
Ha a bemenet ólomban gazdag, akkor az eredeti ólom akár 80% -át is meg lehet szerezni veretlenként; a fennmaradó 20% ólom -monoxidban gazdag salakot képez. Alacsony minőségű takarmány esetén az összes ólom magas ólomtartalmú salakgá oxidálható. A fémes ólmot a magas ólomtartalmú (25–40%) salakból nyerik tovább merített tüzelőanyag-égetéssel vagy befecskendezéssel, redukcióval elektromos kemencével, vagy mindkettő kombinációjával.
Alternatívák
Folytatódik a tisztább, kevésbé energiaigényes ólomkitermelési folyamat kutatása; jelentős hátránya, hogy vagy túl sok ólom veszik el hulladékként, vagy az alternatívák magas kéntartalmat eredményeznek a keletkező ólomfémben. Hidrometallurgiai extrakció, amelyben anódok szennyezett ólom merítjük elektrolit , és tiszta ólom lerakódik a katód, olyan technika, amely lehet a potenciális, de jelenleg nem gazdaságos, kivéve azokban az esetekben, ahol a villamos energia nagyon olcsó.
Másodlagos
Az elsődleges termelés lényeges részét képező olvasztást gyakran kihagyják a másodlagos termelés során. Csak akkor hajtják végre, ha a fém ólom jelentős oxidáción ment keresztül. A folyamat hasonló az elsődleges termelés akár egy nagyolvasztó , vagy egy forgó kemence , azzal a lényeges különbséggel, hogy a nagyobb változékonyság a hozamok: nagyolvasztók termelnek kemény ólom (10% antimon), míg reverberatory és forgókemence kemencék előállított félkemény ólom ( 3-4% antimon). Az ISASMELT eljárás egy újabb olvasztási módszer, amely kiterjesztheti az elsődleges termelést; az elhasznált ólom-savas elemekből (amelyek ólom-szulfátot és ólom-oxidokat tartalmaznak) származó paszta szulfátját lúggal kezelve távolítják el, majd szénszilárd kemencében kezelik, oxigén jelenlétében, amely szennyezett ólmot eredményez, antimonnal leggyakoribb szennyeződés. A másodlagos ólom finomítása hasonló az elsődleges ólom finomításához; egyes finomítási folyamatok kihagyhatók az újrahasznosított anyagtól és annak lehetséges szennyeződésétől függően.
Az újrahasznosítható ólomforrások közül az ólom -sav akkumulátorok a legfontosabbak; az ólomcső, a lemez és a kábelköpeny is jelentős.
Alkalmazások
A közhiedelemmel ellentétben a fa ceruza ceruzavezetői soha nem készültek ólomból. Amikor a ceruza csomagolt grafit íróeszközként keletkezett, az adott grafit -típust plumbago -nak (szó szerint ólom- vagy ólomintának ) nevezték el .
Elemi forma
Az ólomfém számos hasznos mechanikai tulajdonsággal rendelkezik, beleértve a nagy sűrűséget, az alacsony olvadáspontot, a rugalmasságot és a relatív tehetetlenséget. E fémek némelyikében sok fém felülmúlja az ólmot, de általában kevésbé gyakoriak, és nehezebben nyerhetők ki a szülőércekből. Az ólom toxicitása bizonyos felhasználások esetén fokozatosan megszűnt.
Az ólmot a középkorban való feltalálásuk óta golyókhoz használják. Olcsó; alacsony olvadáspontja azt jelenti, hogy a kézi lőfegyverek és a sörétes fegyverek minimális műszaki felszereléssel önthetők; és sűrűbb, mint más közönséges fémek, ami lehetővé teszi a sebesség jobb megtartását. Továbbra is a golyók fő anyaga, más fémekkel ötvözve keményítőként. Aggodalmak merültek fel azzal kapcsolatban, hogy a vadászathoz használt ólomgolyók károsíthatják a környezetet.
Az ólom nagy sűrűségét és korrózióállóságát számos kapcsolódó alkalmazásban kihasználták. Vitorlás csónakban ballasztként használják ; sűrűsége lehetővé teszi, hogy kis térfogatot felvegyen és minimálisra csökkentse a vízállóságot, ezáltal ellensúlyozva a szél dőlésszerű hatását a vitorlákra. Ezt alkalmazzák a búvárkodás Ólomöv hogy ellensúlyozza a búvár felhajtóerő. 1993 -ban 600 tonna ólommal stabilizálták a pisai ferde torony bázisát . Korrózióállósága miatt az ólmot védőburkolatként használják a víz alatti kábelekhez.
Az ólomnak sok felhasználása van az építőiparban; ólom lapokat használnak, mint az építészeti fémek a tetőfedő anyag, burkolat , villogó , ereszcsatornák és ereszcsatorna ízületek, és a tető mellvédek. Az ólmot továbbra is használják szobrokban és szobrokban, beleértve a páncélzatokat is . Régebben gyakran használták az autók kerekeinek kiegyensúlyozására ; környezetvédelmi okokból ezt a felhasználást fokozatosan megszüntetik más anyagok javára.
Ólmot adnak a rézötvözetekhez, például sárgarézhez és bronzhoz, hogy javítsák a megmunkálhatóságot és kenési tulajdonságaikat. Mivel az ólom gyakorlatilag oldhatatlan a rézben, az ólom szilárd gömböcskéket képez az ötvözet tökéletlenségeiben, például szemcsehatáron . Alacsony koncentrációban, valamint kenőanyagként is működik, a gömbök akadályozzák a szálképződést az ötvözet megmunkálása során, ezáltal javítva a megmunkálhatóságot. A csapágyakban nagyobb ólomkoncentrációjú rézötvözeteket használnak . Az ólom kenést biztosít, a réz pedig a teherhordó támaszt.
Az ólom nagy sűrűsége, atomszáma és alakíthatósága képezi az alapját annak, hogy az ólmot gátként használják, amely elnyeli a hangot, a rezgést és a sugárzást. Az ólomnak nincs természetes rezonanciafrekvenciája; ennek eredményeként a lemez-ólmot hangtompító rétegként használják a hangstúdiók falaiban, padlóiban és mennyezetében. Az orgonacsövek gyakran ólomötvözetből készülnek, és különböző mennyiségű ónnal keverve szabályozzák az egyes csövek hangját. Az ólom sűrűsége és magas csillapítási együtthatója miatt a nukleáris tudományban és a röntgenszobákban bevált védőanyag a sugárzás ellen . Olvadt ólom óta használják, mint a hűtőfolyadék számára ólom-ra hűtjük gyorsreaktorok .
A 21. század elején a legnagyobb ólomhasználat az ólom -sav akkumulátorokban történik. Az akkumulátorokban lévő ólom nem érintkezik közvetlenül az emberekkel, így kevesebb a toxicitási probléma. Az ólomakkumulátor -gyártó üzemekben dolgozók ki vannak téve ólompornak, és belélegezhetik azt.} Az akkumulátorban az ólom, ólom -dioxid és kénsav közötti reakció megbízható feszültségforrást biztosít . Ólom -sav akkumulátorokat tartalmazó szuperkondenzátorokat telepítettek kilowatt- és megawatt -skálájú alkalmazásokba Ausztráliában, Japánban és az Egyesült Államokban a frekvenciaszabályozás, a napkiegyenlítés és -eltolás, a szélcsillapítás és más alkalmazások területén. Ezeknek az akkumulátoroknak alacsonyabb az energia sűrűsége és a töltés-kisütés hatékonysága, mint a lítium-ion akkumulátoroknak , de lényegesen olcsóbbak.
Az ólmot nagyfeszültségű tápkábelekben használják burkolóanyagként, hogy megakadályozzák a víz diffúzióját a szigetelésbe; ez a felhasználás csökken, mivel az ólom fokozatosan megszűnik. Néhány országban a környezetre veszélyes hulladék mennyiségének csökkentése érdekében fokozatosan megszüntetik használatát az elektronikai forrasztáshoz is . Az ólom a három fém egyike, amelyet a múzeumi anyagok Oddy -tesztjében használnak , és segít a szerves savak, aldehidek és savas gázok kimutatásában.
Vegyületek
Amellett, hogy az ólomfémek fő alkalmazási területe, az ólom-sav akkumulátorok az ólomvegyületek fő fogyasztói is. Az ezekben az eszközökben alkalmazott energiatárolási/felszabadítási reakció ólom -szulfátot és ólom -dioxidot tartalmaz :
-
Pb (s) + PbO
2(s) + 2 H
2ÍGY
4(aq) → 2 PbSO
4(s) + 2 H
2O (l)
Az ólomvegyületek egyéb felhasználási területei nagyon speciálisak és gyakran elhalványulnak. Az ólom-alapú színezőanyagokat kerámiamázakban és üvegben használják, különösen a vörös és sárga árnyalatokhoz. Míg Európában és Észak -Amerikában fokozatosan megszűnik az ólomfestékek használata, a kevésbé fejlett országokban, például Kínában, Indiában vagy Indonéziában továbbra is használatban vannak. Az ólom -tetra -acetátot és az ólom -dioxidot oxidálószerként használják a szerves kémiában. Az ólmot gyakran használják az elektromos vezetékek polivinil -klorid bevonatában. Gyertyatartók kezelésére használható, hogy hosszabb, egyenletesebb égést biztosítson. Mérgezősége miatt az európai és észak -amerikai gyártók alternatívákat, például cinket használnak. Ólom üveg áll 12-28% ólom-oxid , a változó optikai jellemzőit és csökkenti az átviteli ionizáló sugárzás, egy ingatlan használt régi televíziók és számítógép-monitorok katódsugárcsövek . Az ólom alapú félvezetőket, például az ólom-telluridot és az ólom-szelenidet fotovoltaikus cellákban és infravörös detektorokban használják.
Biológiai hatások
| Veszélyek | |
|---|---|
| GHS piktogramok |
  
|
| GHS Jelszó | Veszély |
| H302 , H332 , H351 , H360Df , H373 , H410 | |
| P201 , P261 , P273 , P304 , P340 , P312 , P308 , P313 , P391 | |
| NFPA 704 (tűzgyémánt) | |
Az ólomnak nincs megerősített biológiai szerepe, és nincs bizonyított biztonságos ólom -expozíciós szint. Egy 2009 -es kanadai -amerikai tanulmány arra a következtetésre jutott, hogy az ólom még olyan szinten is, amely kevés vagy egyáltalán nem jelent kockázatot, "káros mentális egészségügyi következményeket" okozhat. Elterjedtségét az emberi szervezetben - 120 mg felnőtt átlagban - mindazonáltal csak a cink (2500 mg) és a vas (4000 mg) haladja meg a nehézfémek között. Az ólomsókat nagyon hatékonyan szívja fel a szervezet. Kis mennyiségű ólom (1%) tárolódik a csontokban; a többi az expozíciót követő néhány héten belül kiválasztódik a vizelettel és a széklettel. Az ólomnak csak mintegy harmadát választja ki egy gyermek. A folyamatos expozíció az ólom bioakkumulációját eredményezheti.
Toxicitás
Az ólom erősen mérgező fém (belélegezve vagy lenyelve), amely az emberi test szinte minden szervét és rendszerét érinti. Abban a levegőben a 100 mg / m 3 , akkor azonnal veszélyes az élet és az egészség . A legtöbb bevitt ólom felszívódik a véráramba. Toxicitásának elsődleges oka az, hogy hajlamos az enzimek megfelelő működésének megzavarására. Ez úgy történik, hogy a számos enzimben található szulfhidril -csoportokhoz kötődik , vagy más fémeket utánoz és kiszorít, amelyek sok enzimatikus reakcióban kofaktorként működnek . Az ólommal kölcsönhatásba lépő alapvető fémek közé tartozik a kalcium, a vas és a cink. A magas kalcium- és vasszint általában védelmet nyújt az ólommérgezéssel szemben; az alacsony szint fokozott érzékenységet okoz.
Hatások
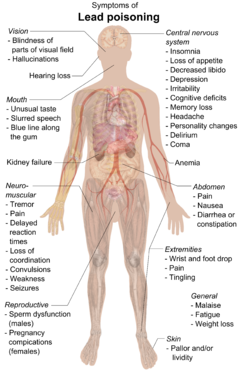
Az ólom súlyos károsodást okozhat az agyban és a vesékben, és végül halált is okozhat. A kalcium utánzásával az ólom átjuthat a vér -agy gáton . Ez rontja a mielin burkát neuronok , csökkenti számuk zavarja neurotranszmisszió útvonalakat, és csökkenti a neuronális növekedést. Az emberi szervezetben az ólom gátolja a porfobilinogén szintetázt és a ferrochelatázt , megakadályozva mind a porfobilinogén képződést , mind a vas beépülését a protoporfirin IX -be , ami a hem szintézisének utolsó lépése . Ez hatástalan hem -szintézist és microcytás anaemiát okoz .
Az ólommérgezés tünetei közé tartozik a nephropathia , a kólika -szerű hasi fájdalmak, esetleg az ujjak, a csukló vagy a bokák gyengesége. Az alacsony vérnyomás emelkedése, különösen középkorú és idősebb embereknél, nyilvánvaló lehet, és vérszegénységet okozhat . Számos, többnyire keresztmetszeti tanulmány összefüggést talált a megnövekedett ólom-expozíció és a csökkent pulzusszám-változékonyság között. Terhes nőknél az ólom magas expozíciója vetélést okozhat. A krónikus, magas szintű expozíció csökkentette a férfiak termékenységét.
Egy gyermek fejlődő agyban, ólom gátolja a szinapszis kialakulását a agykéregben , neurokémiai fejlesztés (beleértve a neurotranszmitterek), és a szervezet a ioncsatornák . A korai gyermekkori expozíciót összefüggésbe hozták az alvászavarok fokozott kockázatával és a túlzott nappali álmossággal a későbbi gyermekkorban. A magas vérszint a lányok késői pubertásával jár. A tetraetil -ólom benzinben való elégetéséből származó levegőben lévő ólom expozíciójának növekedését és csökkenését a 20. században összefüggésbe hozták a bűnözési szintek történelmi növekedésével és csökkenésével, ez a hipotézis nem általánosan elfogadott.
Expozíciós források
Az ólom expozíció globális probléma, mivel az ólombányászat és -olvasztás, valamint az akkumulátorgyártás/ártalmatlanítás/újrahasznosítás sok országban gyakori. Az ólom belélegzéssel, lenyeléssel vagy a bőrön keresztül jut be a szervezetbe. Szinte minden belélegzett ólom felszívódik a szervezetbe; lenyelés esetén az arány 20–70%, a gyermekek nagyobb százalékban szívják fel, mint a felnőttek.
A mérgezés jellemzően ólommal szennyezett élelmiszer vagy víz lenyelése, és ritkábban szennyezett talaj, por vagy ólomalapú festék véletlen lenyelése után következik be. A tengervízből származó termékek ólmot tartalmazhatnak, ha a közeli ipari vizek érintik őket. A gyümölcsök és zöldségek szennyezõdhetnek a magas ólomtartalommal azokban a talajokban, amelyekben termesztették. A talaj szennyezõdhet a csövekben ólomból felhalmozódó részecskék, ólomfesték és az ólmozott benzin maradék kibocsátása révén.
Az ólom használata vízcsövekhez problémát jelent olyan területeken, ahol lágy vagy savas víz van . A kemény víz oldhatatlan rétegeket képez a csövekben, míg a lágy és savas víz feloldja az ólomcsöveket. Az oldott szén -dioxid a szállított vízben oldható ólom -bikarbonát képződését eredményezheti ; az oxigénezett víz ugyanúgy feloldhatja az ólmot, mint az ólom (II) -hidroxid . Az ilyen víz ivása idővel egészségügyi problémákat okozhat az oldott ólom toxicitása miatt. Minél keményebb a víz, annál több kalcium -hidrogén -karbonátot és szulfátot fog tartalmazni, és annál többet fognak a csövek belseje ólom -karbonát vagy ólom -szulfát védőréteggel bevonni.
Az alkalmazott ólom-alapú festék lenyelése a gyermekek legnagyobb expozíciós forrása: közvetlen forrás a régi festett ablakpárkányok rágása. Alternatív megoldásként, ahogy a felhordott száraz festék romlik, lehámlik, porrá porlik, majd kézzel-szájjal való érintkezés vagy szennyezett élelmiszer, víz vagy alkohol segítségével belép a szervezetbe. Bizonyos otthoni jogorvoslatok lenyelése ólomnak vagy vegyületeinek való kitettséget eredményezhet.
A belélegzés a második fő expozíciós út, amely a dohányosokat és különösen az ólommal kapcsolatos foglalkozásokon dolgozókat érinti. A cigarettafüst egyéb mérgező anyagok mellett radioaktív ólom-210-et is tartalmaz .
A bőr expozíciója jelentős lehet azok számára, akik szerves ólomvegyületekkel dolgoznak. A szervetlen ólom esetében a bőr felszívódásának mértéke alacsonyabb.
Kezelés
Az ólommérgezés kezelése általában a dimerkaprol és a szukcimer beadását jelenti . Akut esetekben szükség lehet dinátrium -kalcium -edetát , kalcium -kelát és etilén -diamin -tetraecetsav ( EDTA ) dinátrium -sójának használatára . Nagyobb affinitással rendelkezik az ólomhoz, mint a kalcium, ennek eredményeként ólom -kelát keletkezik a cserével, és kiválasztódik a vizelettel, ártalmatlan kalciumot hagyva maga után.
Környezeti hatások

Az ólom és termékeinek kitermelése, előállítása, felhasználása és ártalmatlanítása jelentős szennyeződést okozott a Föld talajában és vizeiben. Az ólom légköri kibocsátása az ipari forradalom idején volt a legmagasabb, és az ólmozott benzin időszak a huszadik század második felében volt. Az ólomkibocsátások természetes forrásokból (azaz a természetben előforduló ólom koncentrációjából), az ipari termelésből, égetésből és újrafeldolgozásból, valamint a korábban eltemetett ólom mozgósításából származnak. Az ólom megemelkedett koncentrációja megmarad a talajban és az üledékekben a posztindusztriális és városi területeken; az ipari kibocsátások, beleértve a szénégetésből származó kibocsátásokat is, a világ számos részén, különösen a fejlődő országokban folytatódnak.
Az ólom felhalmozódhat a talajokban, különösen a magas szervesanyag tartalmú talajokban, ahol több száz -ezer évig marad. A környezeti ólom felveheti a versenyt más, a növények felületén található fémekkel, amelyek potenciálisan gátolják a fotoszintézist, és elég magas koncentrációban, negatívan befolyásolva a növények növekedését és túlélését. A talaj és a növények szennyeződése a mikroorganizmusokat és állatokat érintő tápláléklánc felemelkedéséhez vezethet. Állatokban az ólom számos szervben mérgező, károsítja az ideg-, vese- , reproduktív, vérképzőszervi és kardiovaszkuláris rendszereket lenyelés, belélegzés vagy bőrfelszívódás után. A halak felvételi ólom a vízből és az üledékből egyaránt; a táplálékláncban való bioakkumuláció veszélyt jelent a halakra, madarakra és tengeri emlősökre.
Az antropogén ólom magában foglalja a lövést és a süllyesztőket . Ezek az ólomtermelési helyek mellett a legerősebb ólomszennyezési források. Az ólmot 2017 -ben betiltották a lövöldözésre és süllyesztőkre az Egyesült Államokban, bár ez a tilalom csak egy hónapig volt érvényben, és hasonló tilalmat fontolgatnak az Európai Unióban is.
A környezetben lévő ólom meghatározására szolgáló analitikai módszerek közé tartozik a spektrofotometria , a röntgenfluoreszcencia , az atomspektroszkópia és az elektrokémiai módszerek . Specifikus ionszelektív elektródát fejlesztettek ki az S, S'-metilén-bisz (N, N-diizobutil- ditiokarbamát ) ionofór alapján . Az ólommérgezés fontos biomarker vizsgálata a δ-aminolevulininsav szintje a plazmában, a szérumban és a vizeletben.
Korlátozás és helyreállítás

A nyolcvanas évek közepére jelentősen csökkent az ólom felhasználása az iparban. Az Egyesült Államokban a környezetvédelmi előírások csökkentették vagy megszüntették az ólom használatát nem akkumulátoros termékekben, beleértve a benzint, festékeket, forraszanyagokat és vízrendszereket. A szenes tüzelésű erőművekbe részecskeszabályozó berendezéseket telepítettek az ólomkibocsátás rögzítésére. 1992 -ben az Egyesült Államok Kongresszusa megkövetelte a Környezetvédelmi Ügynökségtől, hogy csökkentse az ország gyermekeinek ólomszintjét. Az ólomhasználatot tovább csökkentette az Európai Unió 2003. évi veszélyes anyagok korlátozásáról szóló irányelve . Az ólomlerakódás jelentős csökkenése következett be Hollandiában az ólomlövés vadászatra és sportlövészetre történő 1993. évi nemzeti tilalma után: az 1990 -es 230 tonnáról 1995 -ben 47,5 tonnára.
Az Egyesült Államokban a munkahelyi fém ólmot, szervetlen ólomvegyületeket és ólomszappanokat tartalmazó ólom megengedett expozíciós határértékét 8 órás munkanapon 50 μg/m 3 -ra, a vér ólomszintjét pedig 5 μg / 100 g vér 2012 -ben. Az ólom továbbra is káros mennyiségben fordulhat elő a kőedényekben, a vinilben (például a csövekhez és az elektromos vezetékek szigeteléséhez) és a kínai sárgarézben. A régi házak még tartalmazhatnak ólomfestéket. A fehér ólomfestéket kivonták az értékesítésből az iparosodott országokban, de más pigmentek, például a sárga ólom -kromát speciális felhasználása továbbra is megmarad. A régi festék eltávolítása csiszolással por keletkezik, amely belélegezhető. Az ólomcsökkentési programokat néhány hatóság felhatalmazta olyan ingatlanokra, ahol kisgyermekek élnek.
Az ólomhulladék a joghatóságtól és a hulladék jellegétől függően háztartási hulladékként kezelhető (az ólom -csökkentési tevékenységek megkönnyítése érdekében), vagy potenciálisan veszélyes hulladék, amely speciális kezelést vagy tárolást igényel. Az ólom a lőhelyeken kerül a környezetbe, és számos ólomkezelési gyakorlatot dolgoztak ki az ólomszennyezés ellen. Az ólomvándorlás fokozható savas talajokban; ennek ellensúlyozása érdekében tanácsos a talajt mésszel kezelni, hogy semlegesítse a talajt és megakadályozza az ólom kioldódását.
Kutatást végeztek arról, hogyan ólmot a Biosystems biológiai módon: halszálka kutatják képességükre bioremediate vezetést a szennyezett talajt. Az Aspergillus versicolor gomba hatékonyan felszívja az ólomionokat az ipari hulladékokból, mielőtt a víztestekbe kerül. Számos baktériumot vizsgáltak azon képességükön, hogy képesek eltávolítani az ólmot a környezetből, beleértve a szulfátcsökkentő baktériumokat, a Desulfovibrio és a Desulfotomaculum baktériumokat is, amelyek mind vizes oldatokban rendkívül hatékonyak.
Lásd még
- Thomas Midgley Jr. - felfedezte, hogy a tetraetil -alkohol hozzáadása a benzinhez megakadályozza a belső égésű motorok "kopogását"
Megjegyzések
Hivatkozások
Bibliográfia
![]() Ezt a cikket 2019 -ben elküldték a WikiJournal of Science -nek külső tudományos szakértői értékelés céljából ( lektorok jelentései ). A frissített tartalmat újra integrálták a Wikipédia oldalára CC-BY-SA-3.0 licenc alapján ( 2018 ). A nyilvántartás felülvizsgált változata:
Mikhail Boldyrev; et al. (2018. július 3.). "Lead: tulajdonságok, előzmények és alkalmazások" (PDF) . WikiJournal of Science . 1. cikk (2) bekezdés: 7. doi : 10.15347/WJS/2018.007 . ISSN 2470-6345 . Wikidata Q56050531 .
Ezt a cikket 2019 -ben elküldték a WikiJournal of Science -nek külső tudományos szakértői értékelés céljából ( lektorok jelentései ). A frissített tartalmat újra integrálták a Wikipédia oldalára CC-BY-SA-3.0 licenc alapján ( 2018 ). A nyilvántartás felülvizsgált változata:
Mikhail Boldyrev; et al. (2018. július 3.). "Lead: tulajdonságok, előzmények és alkalmazások" (PDF) . WikiJournal of Science . 1. cikk (2) bekezdés: 7. doi : 10.15347/WJS/2018.007 . ISSN 2470-6345 . Wikidata Q56050531 .
- Acton, QA, szerk. (2013). Problémák a globális környezetben - szennyezés és hulladékkezelés: 2012 -es kiadás . Tudományos kiegészítések . ISBN 978-1-4816-4665-9.
- Mérgező Anyagok és Betegségek Nyilvántartó Ügynöksége . "Információ a közösség számára: ólomtoxicitás" (MP4 webcast, 82 MB) . Letöltve: 2017. február 11 .
- Toxikus Anyagok és Betegségek Nyilvántartó Ügynöksége (2017). "Ólomtoxicitás. Mik az amerikai szabványok az ólomszintekre vonatkozóan?" . Letöltve: 2018. június 12 .
- Alsfasser, R. (2007). Moderne anorganische Chemie [ Modern szervetlen kémia ] (németül). Walter de Gruyter. ISBN 978-3-11-019060-1.
- Amerikai Geofizikai Unió (2017). "Az emberi tevékenység 2000 éve szennyezi az európai levegőt" . Eos Science News.
- Amstock, JS (1997). Üveg kézikönyve az építőiparban . McGraw-Hill Professional . ISBN 978-0-07-001619-4.
- Anderson, J. (1869). "Fémek képlékenysége és rugalmassága" . Scientific American . 21 (22): 341–43. doi : 10.1038/scientificamerican11271869-341 .
- Ashikari, M. (2003). "A nők fehér arcának emléke: japánság és a nők ideális képe". Japán fórum . 15 (1): 55–79. doi : 10.1080/0955580032000077739 . S2CID 144510689 .
- Assi, MA; Hezmee, MNM; Haron, AW; et al. (2016). "Az ólom káros hatásai az emberek és állatok egészségére" . Állatorvosi világ . 9 (6): 660–671. doi : 10.14202/vetworld.2016.660-671 . ISSN 0972-8988 . PMC 4937060 . PMID 27397992 .
- Auer, Charles M .; Kover, Frank D .; Aidala, V. Jakab .; Greenwood, Mark (2016. március 1.). Mérgező anyagok: fél évszázados haladás (PDF) (jelentés). EPA Öregdiák Szövetség . Letöltve: 2019. január 1 .
- Audsley, GA (1965). Az orgonaépítés művészete . 2 . Futár. ISBN 978-0-486-21315-6.
- Baird, C .; Cann, N. (2012). Környezeti kémia (5. kiadás). WH Freeman and Company. ISBN 978-1-4292-7704-4.
- Becker, M .; Förster, C .; Franzen, C .; et al. (2008). "Háromértékű ón és ólom tartós gyökei". Szervetlen kémia . 47 (21): 9965–78. doi : 10.1021/ic801198p . PMID 18823115 .
- Beeman, JW; Bellini, F .; Cardani, L .; et al. (2013). "Új kísérleti korlátok az ólomizotópok α -bomlására". Európai Fizikai Lapok A . 49 (50): 50. arXiv : 1212.2422 . Bibcode : 2013EPJA ... 49 ... 50B . doi : 10.1140/epja/i2013-13050-7 . S2CID 119280082 .
- Beiner, GG; Lavi, M .; Seri, H .; et al. (2015). "Oddy tesztek: az elemzési dimenzió hozzáadása" . Gyűjtemény fórum . 29. (1–2): 22–36. doi : 10.14351/0831-4985-29.1.22 . ISSN 0831-4985 .
- Bharara, MS; Atwood, DA (2006). "Vezető: Szervetlen kémia" Részben a Philip G. Harrison Lead: Inorganic Chemistry című cikkén alapul, amely az Encyclopedia of Inorganic Chemistry első kiadásában jelent meg. Vezető: Szervetlen kémia . doi : 10.1002/0470862106.ia118 . ISBN 978-0470860786.
- Bisel, SC ; Bisel, JF (2002). "Egészség és táplálkozás a Herculaneumban" . In Jashemski, WF; Meyer, FG (szerk.). Pompeji természettörténete . Cambridge University Press . 451–75. ISBN 978-0-521-80054-9.
- Bisson, MS; Vogel, JO (2000). Ősi afrikai kohászat: A szociokulturális kontextus . Rowman és Littlefield . ISBN 978-0-7425-0261-1.
- Blakemore, JS (1985). Szilárdtest -fizika . Cambridge University Press. ISBN 978-0-521-31391-9.
- Bouchard, MF; Bellinger, DC; Weuve, J .; et al. (2009). "Vérvezetési szint és súlyos depressziós zavar, pánikbetegség és általános szorongásos zavar az amerikai fiatal felnőtteknél" . Az Általános Pszichiátria Levéltára . 66. (12): 1313–9. doi : 10.1001/archgenpsychiatry.2009.164 . ISSN 0003-990X . PMC 2917196 . PMID 19996036 .
- Bremner, HA (2002). Biztonsági és minőségi kérdések a halfeldolgozásban . Elsevier . ISBN 978-1-85573-678-8.
- Brenner, GA (2003). Webster New World amerikai idiómák kézikönyve . John Wiley & Sons . ISBN 978-0-7645-2477-6.
- Brescia, F. (2012). A kémia alapjai: modern bevezetés . Elsevier. ISBN 978-0-323-14231-1.
- Bretherick, L. (2016). Bretherick kézikönyve a reaktív kémiai veszélyekről . Elsevier. ISBN 978-1-4831-6250-8.
- Bunker, Kr. E. Casey, WH (2016). Az oxidok vizes kémiája . Oxford University Press . ISBN 978-0-19-938425-9.
- Burbidge, EM ; Burbidge, Grúzia ; Fowler, WA ; et al. (1957). "Az elemek szintézise a csillagokban" (PDF) . Vélemények a modern fizikáról . 29 (4): 547–654. Bibcode : 1957RvMP ... 29..547B . doi : 10.1103/RevModPhys.29.547 .
- Burleson, M. (2001). A kerámia máz kézikönyv: anyagok, technikák, képletek . Sterling . ISBN 9781579904395.
- Kaliforniai Hal- és Vadvédelmi Minisztérium . "Vezeték nélküli lőszer Kaliforniában" . www.wildlife.ca.gov . Letöltve: 2017. május 17 .
- de Callataÿ, F. (2005). "A görög-római gazdaság szuper hosszú távon: ólom, réz és hajótörések". Római Régészeti Közlöny . 18 : 361–72. doi : 10.1017/S104775940000742X . S2CID 232346123 .
- Cama, T. (2017). "A belügyminiszter visszavonta az ólomgolyók tilalmát" . A domb . Letöltve: 2018. május 30 .
- Cangelosi, VM; Pecoraro, VL (2015). "Ólom" . In Roduner, E. (szerk.). Nanoszkópos anyagok: méretfüggő jelenségek és növekedési elvek . Királyi Kémiai Társaság. 843–875. ISBN 978-1-78262-494-3.
- Casciani, D. (2014). "Az ólom eltávolítása a benzinből csökkentette a bűnözést?" . BBC News . Letöltve: 2017. január 30 .
- Ceccarelli, P. (2013). Ógörög levélírás: kultúrtörténet (i . E. 600-150) . OUP Oxford. ISBN 978-0-19-967559-3.
- Centers for Disease Control and Prevention (1997). "Frissítés: vér ólomszintek-Egyesült Államok, 1991-1994". Morbiditás és mortalitás heti jelentés . 46 (7): 141–146. ISSN 0149-2195 . PMID 9072671 .
- Centers for Disease Control and Prevention (2015). "Sugárzás és egészséged" . Letöltve: 2017. február 28 .
- Christensen, NE (2002). "Relativisztikus szilárdtest -elmélet" . In Schwerdtfeger, P. (szerk.). Relativisztikus elektronikus szerkezetelmélet - Alapok . Elméleti és számítási kémia. 11 . Elsevier. 867–68. doi : 10.1016/s1380-7323 (02) 80041-3 . ISBN 978-0-08-054046-7.
- Cohen, AR; Trotzky, MS; Pincus, D. (1981). "Az ólommérgezés mikrocitás anémiájának újraértékelése" . Gyermekgyógyászat . 67. (6): 904–906. PMID 7232054 .
- A természetben előforduló radioaktív anyagok expozíciójára vonatkozó EPA -iránymutatások értékelési bizottsága; Élettudományi Bizottság; Osztály a Föld- és Élettudományokról; Nemzeti Kutatási Tanács (1999). A technológiailag javított, természetesen előforduló radioaktív anyagok expozíciójára vonatkozó iránymutatások értékelése . National Academies Press. 26., 30–32. ISBN 978-0-309-58070-0.
- Concordia Egyetem (2016). Ólom -sav akkumulátorok (PDF) (Jelentés) . Letöltve: 2019. február 17 .
- Considine, DM; Considine, GD (2013). Van Nostrand tudományos enciklopédiája . Springer Science & Business Media. ISBN 978-1-4757-6918-0.
- Rézfejlesztő Egyesület. "Vezetett rézek" . réz.org . Letöltve: 2016. július 10 .
- Cotnoir, B. (2006). A Weiser tömör útmutató az alkímiához . Weiser könyvek . ISBN 978-1-57863-379-1.
- Cox, PA (1997). Az elemek: eredetük, bőségük és elterjedésük . Oxford University Press. ISBN 978-0-19-855298-7.
- Crow, JM (2007). "Miért kell ólmot használni a festékben?" . Kémia Világ . Királyi Kémiai Társaság . Letöltve: 2017. február 22 .
- Dart, RC; Hurlbut, KM; Boyer-Hassen, LV (2004). "Vezet". Dart, RC (szerk.). Orvosi toxikológia (3. kiadás). Lippincott Williams és Wilkins . o. 1426. ISBN 978-0-7817-2845-4.
- Davidson, A .; Ryman, J .; Sutherland, CA; et al. (2014). "Vezet". Ullmann Encyclopedia of Industrial Chemistry . doi : 10.1002/14356007.a15_193.pub3 . ISBN 978-3-527-30673-2.
- de Marcillac, Pierre; Coron, Noël; Dambier, Gérard; et al. (2003). "A természetes bizmut radioaktív bomlásából származó α-részecskék kísérleti kimutatása". Természet . 422 (6934): 876–78. Bibcode : 2003Natur.422..876D . doi : 10.1038/nature01541 . PMID 12712201 . S2CID 4415582 .
- Delile, H .; Blichert-Toft, J .; Goiran, J.-P .; et al. (2014). "Ólom az ókori Róma városi vizeiben" . A Nemzeti Tudományos Akadémia közleményei . 111 (18): 6594–99. Bibcode : 2014PNAS..111.6594D . doi : 10.1073/pnas.1400097111 . ISSN 0027-8424 . PMC 4020092 . PMID 24753588 .
- Deltares; Holland Alkalmazott Tudományos Kutatási Szervezet (2016). Lood en zinkemissies door jacht [Ólom- és cinkkibocsátás a vadászatból] (PDF) (Jelentés) (hollandul) . Letöltve: 2017. február 18 .
- Dieter, RK; Watson, RT (2009). "Transzmetalációs reakciók, amelyek organikus rézvegyületeket termelnek" . In Rappoport, Z .; Marek, I. (szerk.). A szerves rézvegyületek kémiája . 1 . John Wiley & Sons. 443–526. ISBN 978-0-470-77296-6.
- Donnelly, J. (2014). Mélykék . Hachette Gyermekcsoport . ISBN 978-1-4449-2119-9.
- Downs, AJ; Adams, CJ (2017). A klór, a bróm, a jód és az statin kémiája: pergamonszövegek a szervetlen kémiában . Elsevier. ISBN 978-1-4831-5832-7.
- Duda, MB (1996). Hagyományos kínai kapcsoló: ellensúlyok és varázsa . Kiadások Didier Millet. ISBN 978-981-4260-61-9.
- Ede, A .; Cormack, LB (2016). A tudomány története a társadalomban, I. kötet: Az ókori görögöktől a tudományos forradalomig, harmadik kiadás . University of Toronto Press . ISBN 978-1-4426-3503-6.
- Emsley, J. (2011). A természet építőkövei: AZ útmutató az elemekhez . Oxford University Press. ISBN 978-0-19-960563-7.
- "Judaica Encyclopedia: Ossuaries és Sarcophagi" . www.jewishvirtuallibrary.org . Letöltve: 2018. július 14 .
- Eschnauer, HR; Stoeppler, M. (1992). "Bor - Enológiai mintabank". Stoeppler, M. (szerk.). Veszélyes anyagok a környezetben . Elsevier Science. 49–72. (58). doi : 10.1016/s0167-9244 (08) 70103-3 . ISBN 978-0-444-89078-8.
- Evans, JW (1908). "V.— A plumbago jelentése és szinonimái" . A Filológiai Társaság ügyletei . 26 (2): 133–79. doi : 10.1111/j.1467-968X.1908.tb00513.x .
- Finger, S. (2006). Doktor Franklin orvostudománya . University of Pennsylvania Press . ISBN 978-0-8122-3913-3.
- Fiorini, E. (2010). "2000 éves római ólom a fizikához" (PDF) . ASZPERA : 7–8. Archiválva az eredetiből (PDF) , 2018. április 26 . Letöltve: 2016. október 29 .
- Frankenburg, FR (2014). Agyrablók: Hogyan változtatta meg az alkohol, a kokain, a nikotin és az ópiátok az emberi történelmet . ABC-CLIO. ISBN 978-1-4408-2932-1.
- Frebel, A. (2015). A legrégebbi csillagok keresése: Ősi ereklyék a korai univerzumból . Princeton egyetem. ISBN 978-0-691-16506-6.
- Freeman, KS (2012). "A talaj ólomának megtisztítása halcsonttal" . Környezet -egészségügyi kilátások . 120 (1): a20 – a21. doi : 10.1289/ehp.120-a20a . PMC 3261960 . PMID 22214821 .
- Funke, K. (2013). "Solid State Ionics: Michael Faraday -tól a zöld energiáig - az európai dimenzió" . A fejlett anyagok tudománya és technológiája . 14 (4): 1–50. Bibcode : 2013STAdM..14d3502F . doi : 10.1088/1468-6996/14/4/043502 . PMC 5090311 . PMID 27877585 .
- Gale, WF; Totemeier, TC (2003). Smithells Metals Reference Book . Butterworth-Heinemann . ISBN 978-0-08-048096-1.
- Gilfillan, SC (1965). "Ólommérgezés és Róma bukása". Journal of Occupational Medicine . 7 (2): 53–60. ISSN 0096-1736 . PMID 14261844 .
- Gill, T .; Libraries Board of South Australia (1974). Glen Osmond története és topográfiája, térképpel és illusztrációkkal . Dél -Ausztrália Könyvtári Tanácsa. ISBN 9780724300358.
- Graedel, TE; et al. (2010). Fémkészletek a társadalomban - Tudományos szintézis (PDF) (Jelentés). Nemzetközi Erőforrás Panel. o. 17. ISBN 978-92-807-3082-1. Letöltve: 2017. április 18 .
- Grandjean, P. (1978). "Az ólomtoxicitás kilátásainak kiszélesítése". Környezeti kutatás . 17 (2): 303–21. Bibcode : 1978ER ..... 17..303G . doi : 10.1016/0013-9351 (78) 90033-6 . PMID 400972 .
- Greenwood, NN ; Earnshaw, A. (1998). Az elemek kémiája (2. kiadás). Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- Grout, J. (2017). "Ólommérgezés és Róma" . Romana enciklopédia . Letöltve: 2017. február 15 .
- Guberman, DE (2016). "Lead" (PDF) . 2014. évi ásványi évkönyv (jelentés). Egyesült Államok geológiai felmérése . Letöltve: 2017. május 8 .
- Gulbinska, MK (2014). Lítium-ion akkumulátorok és technológia: aktuális témák és problémák a gyártás szempontjából . Springer . o. 96. ISBN 978-1-4471-6548-4.
- Guruswamy, S. (2000). Az ólomötvözetek műszaki tulajdonságai és alkalmazása . Marcel Dekker. ISBN 978-0-8247-8247-4.
- Hadlington, TJ (2017). Az alacsony oxidációjú állapot 14. csoport komplexek katalitikus hatékonyságáról . Springer. ISBN 978-3-319-51807-7.
- Harbison, RD; Bourgeois, MM; Johnson, GT (2015). Hamilton és Hardy ipari toxikológiája . John Wiley & Sons. ISBN 978-0-470-92973-5.
- Hauser, PC (2017). "Analitikai módszerek az ólom meghatározására a környezetben". In Astrid, S .; Helmut, S .; Sigel, RKO (szerk.). Ólom: Hatásai a környezetre és az egészségre . Fémionok az élettudományokban. 17 . de Gruyter . 49–60. doi : 10.1515/9783110434330-003 . ISBN 9783110434330. PMID 28731296 .
- Hernberg, S. (2000). "Ólommérgezés történelmi szempontból" (PDF) . American Journal of Industrial Medicine . 38 (3): 244–54. doi : 10.1002/1097-0274 (200009) 38: 3 <244 :: AID-AJIM3> 3.0.CO; 2-F . PMID 10940962 . Archiválva az eredetiből (PDF) , 2017. szeptember 21 . Letöltve : 2017. március 1 .
- "A kozmetikumok története az ókorban" . Kozmetikai információk . Letöltve: 2016. július 18 .
- Hodge, TA (1981). "Vitruvius, ólomcsövek és ólommérgezés". American Journal of Archeology . 85 (4): 486–91. doi : 10.2307/504874 . JSTOR 504874 .
- Hong, S .; Candelone, J.-P .; Patterson, CC; et al. (1994). "A grönlandi jég bizonyítéka a félgömb ólomszennyezésére két évezreddel ezelőtt a görög és római civilizációk által" (PDF) . Tudomány . 265 (5180): 1841–43. Bibcode : 1994Sci ... 265.1841H . doi : 10.1126/science.265.5180.1841 . PMID 17797222 . S2CID 45080402 .
- Hunt, A. (2014). Kémia szótár . Útvonal . ISBN 978-1-135-94178-9.
- NAÜ - Nuclear Data Section (2017). "Élő diagram - Nuklidok táblázata - Nukleáris szerkezet és bomlási adatok" . www-nds.iaea.org . Nemzetközi Atomenergia Ügynökség . Letöltve : 2017. március 31 .
- Insight Explorer; IPEN (2016). Az új tanulmány megállapítja, hogy a festékek többségében az ólomszintek meghaladják a kínai előírásokat, és nem kerülhetnek a boltok polcaira (PDF) (jelentés) . Letöltve: 2018. május 3 .
- Ismawati, Yuyun; Primanti, Andita; Brosché, Sara; Clark, Clark; Weinberg, Jack; Denney, Valerie (2013). Timbal dalam Cat Enamel Rumah Tangga di Indonesia (PDF) (Jelentés) (indonéz nyelven). BaliFokus és IPEN . Letöltve: 2018. december 26 .
- Jensen, CF (2013). A földalatti sebességváltó hálózati kábeleinek hibáinak online elhelyezkedése . Springer. ISBN 978-3-319-05397-4.
- Jones, PA (2014). Jedburgh Justice and Kentish Fire: Az angol eredete tíz kifejezésben és kifejezésben . Rendőr . ISBN 978-1-47211-389-4.
- Kaupp, M. (2014). "A főcsoport elemeinek kémiai kötése" (PDF) . In Frenking, G .; Shaik, S. (szerk.). A kémiai kötés: kémiai kötés a periódusos rendszerben . John Wiley & Sons. 1–24. doi : 10.1002/9783527664658.ch1 . ISBN 9783527664658. S2CID 17979350 .
- Kellett, C. (2012). Mérgezés és mérgezés: Esetek, katasztrófák és bűncselekmények összefoglalója . Accent Press. ISBN 978-1-909335-05-9.
- King, RB (1995). A főcsoport elemeinek szervetlen kémiája . VCH Kiadó . ISBN 978-1-56081-679-9.
- Konu, J .; Chivers, T. (2011). "A nehéz p-blokk elemek stabil gyököi" . Hicks, RG (szerk.). Stabil gyökök: a páratlan elektronvegyületek alapjai és alkalmazott szempontjai . John Wiley & Sons. doi : 10.1002/9780470666975.ch10 . ISBN 978-0-470-77083-2.
- Kosnett, MJ (2006). "Vezet". Olson, KR (szerk.). Mérgezés és kábítószer -túladagolás (5. kiadás). McGraw-Hill Professional . o. 238. ISBN 978-0-07-144333-3.
- Krestovnikoff, M .; Halls, M. (2006). Búvárkodás . Dorling Kindersley . ISBN 978-0-7566-4063-7.
- Kroonen, G. (2013). Protogermán etimológiai szótár . Leiden indoeurópai etimológiai szótár sorozat. 11 . Brill . ISBN 978-90-04-18340-7.
- Langmuir, CH; Broecker, WS (2012). Hogyan építsünk lakható bolygót: A Föld története az ősrobbanástól az emberiségig . Princeton University Press . ISBN 978-0-691-14006-3.
- Lauwerys, RR; Hoet, P. (2001). Ipari vegyi expozíció: Irányelvek a biológiai megfigyeléshez, harmadik kiadás . CRC Press. ISBN 978-1-4822-9383-8.
- Layton, M. (2017). "A vezető új eurótilalommal fenyeget . " shootuk.co.uk . Letöltve: 2018. május 30 .
- "Ólomheveder golyó; mandula alakú; szárnyas mennydörgés az egyik oldalon, másrészt magas domborműben a DEXAI felirat" Fogd! " " . A British Museum . Lap 30-április 2012-es .
- "Ólomkerti dísztárgyak" . H. Crowther Ltd . 2016 . Letöltve: 2017. február 20 .
- "Ólom a hulladékkezelésben" . Egyesült Államok Környezetvédelmi Ügynöksége . 2016 . Letöltve: 2017. február 28 .
- "Ólombányászat" . Az északi visszhang . Letöltve: 2016. február 16 .
- Levin, HL (2009). A Föld az időn keresztül . John Wiley & Sons. ISBN 978-0-470-38774-0.
- Levin, R .; Barna, MJ; Kashtock, ME; et al. (2008). "Vezető expozíció amerikai gyermekeknél, 2008: Hatások a megelőzésre" . Környezet -egészségügyi kilátások . 116 (10): 1285–93. doi : 10.1289/ehp.11241 . PMC 2569084 . PMID 18941567 .
- Lewis, J. (1985). "Ólommérgezés: történelmi perspektíva" . EPA folyóirat . 11 (4): 15–18 . Letöltve: 2017. január 31 .
- Lide, DR, szerk. (2005). CRC kémia és fizika kézikönyve (85. kiadás). CRC Press . ISBN 978-0-8493-0484-2.
- Liu, J .; Liu, X .; Pak, V .; et al. (2015). "Korai vér ólomszintek és alvászavarok a serdülőkorban" . Alvás . 38 (12): 1869–74. doi : 10.5665/alvás.5230 . PMC 4667382 . PMID 26194570 .
- Lochner, JC; Rohrbach, G .; Cochrane, K. (2005). - Milyen a kozmikus kapcsolata az elemekkel? (PDF) . Goddard Űrrepülési Központ . Archiválva az eredetiből (PDF) , 2016. december 29 . Letöltve: 2017. július 2 .
- Lodders, K. (2003). "A Naprendszer bősége és az elemek kondenzációs hőmérsékletei" (PDF) . Az Astrophysical Journal . 591 (2): 1220–47. Bibcode : 2003ApJ ... 591.1220L . doi : 10.1086/375492 . ISSN 0004-637X .
- Luckey, TD; Venugopal, B. (1979). A fémtoxicitás fiziológiai és kémiai alapjai . Plénum prés. ISBN 978-1-4684-2952-7.
- Macintyre, JE (1992). Szervetlen vegyületek szótára . CRC Press. ISBN 978-0-412-30120-9.
- Marino, PE; Landrigan, PJ; Graef, J .; et al. (1990). "Esettanulmány ólomfesték -mérgezésről egy viktoriánus parasztház felújítása során" . American Journal of Public Health . 80 (10): 1183–85. doi : 10.2105/AJPH.80.10.1183 . PMC 1404824 . PMID 2119148 .
- Markowitz, G .; Rosner, D. (2000). " " Cater a gyerekeknek ": a vezető ipar szerepe a közegészségügyi tragédiában, 1900–55" . American Journal of Public Health . 90 (1): 36–46. doi : 10.2105/ajph.90.1.36 . PMC 1446124 . PMID 10630135 .
- Masters, SB; Trevor, AJ; Katzung, BG (2008). Katzung & Trevor's Pharmacology: Examination & Board Review (8. kiadás). McGraw-Hill Medical . ISBN 978-0-07-148869-3.
- McCoy, S. (2017). "Az ólom vége? A szövetségi kormány elrendeli a süllyesztőket, lőszer" . GearJunkie . Letöltve: 2018. május 30 .
- Meija, Juris; et al. (2016). "Az elemek atomtömegei 2013 (IUPAC Technical Report)" . Tiszta és alkalmazott kémia . 88. (3): 265–91. doi : 10.1515/pac-2015-0305 .
- Merriam-Webster . "A LEAD meghatározása" . www.merriam-webster.com . Letöltve: 2016. augusztus 12 .
- Moore, MR (1977). "Ólom az ivóvízben a lágyvizű területeken - egészségügyi veszélyek". A teljes környezet tudománya . 7 (2): 109–15. Bibcode : 1977ScTEn ... 7..109M . doi : 10.1016/0048-9697 (77) 90002-X . PMID 841299 .
- Több, AF; Spaulding, ÉK; Bohleber, P .; et al. (2017). "A következő generációs jégmag technológia feltárja a minimális természetes ólom (Pb) szintet a légkörben: Insights from the Black Death" (PDF) . GeoHealth . 1 (4): 211–219. doi : 10.1002/2017GH000064 . ISSN 2471-1403 . PMC 7007106 . PMID 32158988 .
- Mosseri, S .; Henglein, A .; Janata, E. (1990). "Háromértékű ólom, mint intermedier az ólom (II) oxidációjában és az ólom (IV) fajok redukciójában". Journal of Physical Chemistry . 94. (6): 2722–26. doi : 10.1021/j100369a089 .
- Mycyk, M .; Hryhorczuk, D .; Amitai, Y .; et al. (2005). "Vezet". Erickson, TB; Ahrens, WR; Aks, S. (szerk.). Gyermektoxikológia: a mérgezett gyermek diagnózisa és kezelése . McGraw-Hill Professional. ISBN 978-0-07-141736-5.
- Nakashima, T .; Hayashi, H .; Tashiro, H .; et al. (1998). "Nemek és hierarchikus különbségek az ólomszennyezett japán csontban az Edo időszakból" . Journal of Occupational Health . 40. (1): 55–60. doi : 10.1539/joh.40.55 .
- Nemzeti Sugárvédelmi és Mérési Tanács (2004). Szerkezeti árnyékoló kialakítás orvosi röntgenképalkotó létesítményekhez . ISBN 978-0-929600-83-3.
- Országos Munkavédelmi Intézet. "NIOSH Pocket Guide to Chemical Hazards - Lead" . www.cdc.gov . Letöltve: 2016. november 18 .
- Navas-Acien, A. (2007). "Ólom expozíció és szív- és érrendszeri betegségek - szisztematikus áttekintés" . Környezet -egészségügyi kilátások . 115 (3): 472–482. doi : 10.1289/ehp.9785 . PMC 1849948 . PMID 17431501 .
- Nikolajev, S., szerk. (2012). "*lAudh-". Indoeurópai etimológia . seregély.rinet.ru . Letöltve: 2016. augusztus 21 .
- Norman, NC (1996). Periodicitás és az s- és p-blokk elemek . Oxford University Press. ISBN 978-0-19-855961-0.
- Nriagu, JO (1983). "Szaturnusz köszvény a római arisztokraták között - Az ólommérgezés hozzájárult a Birodalom bukásához?". A New England Journal of Medicine . 308 (11): 660–63. doi : 10.1056/NEJM198303173081123 . PMID 6338384 .
- Nriagu, JO; Kim, MJ. (2000). "Ólom és cink kibocsátása gyertyákból fémmagos kanócokkal". A teljes környezet tudománya . 250 (1–3): 37–41. Bibcode : 2000ScTEn.250 ... 37N . doi : 10.1016/S0048-9697 (00) 00359-4 . PMID 10811249 .
- Munkavédelmi és Egészségügyi Igazgatás . "Anyag adatlap az ólom munkahelyi expozíciójához" . www.osha.gov . 2018. március 16 -án archiválva az eredetiből . Letöltve: 2017. július 1 .
- Olinsky-Paul, T. (2013). "East Penn és Ecoult akkumulátor telepítési esettanulmány webes szeminárium" (PDF) . Tiszta Energia Államok szövetsége . Letöltve: 2017. február 28 .
- Palmieri, R., szerk. (2006). Az orgona . Psychology Press . ISBN 978-0-415-94174-7.
- "halál". Oxford angol szótár (2. kiadás). Oxford University Press. 2009.
- Park, JH; Bolan, N .; Meghara, M .; et al. (2011). "Az ólom baktériumokkal támogatott immobilizálása a talajban: következmények a helyreállításhoz" (PDF) . Pedologist : 162-74. Archiválva az eredetiből (PDF) , 2015. november 26.
- Parker, RB (2005). Az új hidegen öntött csónaképítés: a tetőtől az indításig . Fahajó könyvek. ISBN 978-0-937822-89-0.
- Parthé, E. (1964). Tetraéderes szerkezetek kristálykémiája . CRC Press. ISBN 978-0-677-00700-7.
- Pauling, L. (1947). Általános kémia . WH Freeman and Company . ISBN 978-0-486-65622-9.
- Peneva, SK; Djuneva, KD; Tsukeva, EA (1981). "RHEED tanulmány az ólom és ón kristályosodásának és oxidációjának kezdeti szakaszáról". Journal of Crystal Growth . 53. (2): 382–396. Bibcode : 1981JCrGr..53..382P . doi : 10.1016/0022-0248 (81) 90088-9 . ISSN 0022-0248 .
- Petzel, S .; Juuti, M .; Sugimoto, Yu. (2004). "Környezetvédelmi gondozás regionális perspektívákkal és az ólommentes probléma mozgatórugóival" . Puttlitz, KJ; Stalter, KA (szerk.). Ólommentes forrasztási technológia kézikönyve mikroelektronikai szerelvényekhez . CRC Press. ISBN 978-0-8247-5249-1.
- Polyanskiy, NG (1986). Fillipova, N. A (szerk.). Аналитическая химия элементов: Свинец[ Analytical Chemistry of the Elements: Lead ] (oroszul). Nauka .
- Prasad, PJ (2010). Fogalmi farmakológia . Egyetemek Sajtó. ISBN 978-81-7371-679-9. Lap 21-június 2012-es .
- "Elsődleges ólomfinomítási technikai megjegyzések" . LDA International. Archiválva az eredetiből 2007. március 22 . Letöltve: 2007. április 7 .
- Progressive Dynamics, Inc. "Az ólomakkumulátorok működése: az elemek alapjai" . progressivedyn.com . 2018. november 19 -én archiválva az eredetiből . Letöltve: 2016. július 3 .
- Putnam, B. (2003). A szobrász útja: Útmutató a modellezéshez és a szobrászathoz . Dover Publications . ISBN 978-0-486-42313-5.
- Pyykkö, P. (1988). "Relativisztikus hatások a szerkezeti kémiában". Kémiai vélemények . 88 (3): 563–94. doi : 10.1021/cr00085a006 .
- Rabinowitz, MB (1995). "Ólomforrások imputálása a vér ólomizotóp arányaiból" . Szakáll, ME; Allen Iske, SD (szerk.). Ólom a festékben, a talajban és a porban: egészségügyi kockázatok, expozíciós vizsgálatok, ellenőrzési intézkedések, mérési módszerek és minőségbiztosítás . ASTM. 63–75. doi : 10.1520/stp12967s . ISBN 978-0-8031-1884-3.
- "Radioaktív bomlás sorozat" (PDF) . Nukleáris szisztematika. MIT OpenCourseWare . 2012 . Letöltve: 2018. április 28 .
- Ramage, CK, szerk. (1980). Lyman Cast Bullet Handbook (3. kiadás). Lyman Products Corporation.
- Randerson, J. (2002). "Gyertya szennyezés" . Új tudós (2348) . Letöltve: 2007. április 7 .
- Reddy, A .; Braun, CL (2010). "Ólom és a rómaiak". Journal of Chemical Education . 87 (10): 1052–55. Bibcode : 2010JChEd..87.1052R . doi : 10.1021/ed100631y .
- Retief, F .; Cilliers, LP (2006). "Ólommérgezés az ókori Rómában" . Acta Theologica . 26 (2): 147–64 (149–51). doi : 10.4314/actat.v26i2.52570 .
- Rich, V. (1994). A nemzetközi vezető kereskedelem . Woodhead Kiadó . ISBN 978-0-85709-994-5.
- Rieuwerts, J. (2015). A környezetszennyezés elemei . Útvonal. ISBN 978-0-415-85919-6.
- Riva, MA; Lafranconi, A .; d'Orso, MI; et al. (2012). "Ólommérgezés: A paradigmatikus" foglalkozási és környezeti betegség " történelmi vonatkozásai " . Munkahelyi biztonság és egészségvédelem . 3 (1): 11–16. doi : 10.5491/SHAW.2012.3.1.11 . PMC 3430923 . PMID 22953225 .
- Roederer, IU; Kratz, K.-L .; Frebel, A .; et al. (2009). "A nukleoszintézis vége: Ólom és tórium termelése a korai galaxisban". Az Astrophysical Journal . 698 (2): 1963–80. arXiv : 0904.3105 . Bibcode : 2009ApJ ... 698.1963R . doi : 10.1088/0004-637X/698/2/1963 . S2CID 14814446 .
- Rogalski, A. (2010). Infravörös detektorok (2. kiadás). CRC Press. ISBN 978-1-4200-7671-4. Letöltve: 2016. november 19 .
- Röhr, C. (2017). "Binare Zintl-Phasen" [Bináris Zintl-fázisok]. Intermetallische Phasen [ Intermettallic Fázisok ] (németül). Freiburgi Egyetem . Letöltve: 2017. február 18 .
- Rudolph, AM; Rudolph, CD; Hostetter, MK; et al. (2003). "Vezet". Rudolph Gyermekgyógyászat (21. kiadás). McGraw-Hill Professional. o. 369. ISBN 978-0-8385-8285-5.
- Sámson, GW (1885). A borok isteni törvénye . JB Lippincott & Co.
- Scarborough, J. (1984). "Az ólommérgezés mítosza a rómaiak körében: Esszé áttekintése". Journal of the History of Medicine and Allied Sciences . 39 (4): 469-475. doi : 10.1093/jhmas/39.4.469 . PMID 6389691 .
- Schoch, RM (1996). Esettanulmányok a környezettudományban . West Kiadó . ISBN 978-0-314-20397-7.
- Schoeters, G .; Den Hond, E .; Dhooge, W .; et al. (2008). "Endokrin rontók és a pubertás fejlődésének rendellenességei" (PDF) . Alap és klinikai farmakológia és toxikológia . 102 (2): 168–175. doi : 10.1111/j.1742-7843.2007.00180.x . hdl : 1854/LU-391408 . PMID 18226071 .
- Sharma, HR; Nozawa, K .; Smerdon, JA; et al. (2013). "A kvázikristályos ólom sablonos háromdimenziós növekedése" . Nature Communications . 4 : 2715. Bibcode : 2013NatCo ... 4.2715S . doi : 10.1038/ncomms3715 . PMID 24185350 .
- Sharma, HR; Smerdon, JA; Nugent, PJ; et al. (2014). "A Pb kristályos és kvázikristályos allotrópjai az ikozaéder Ag-In-Yb ötszörös felületén képződtek". The Journal of Chemical Physics . 140 (17): 174710. Bibcode : 2014JChPh.140q4710S . doi : 10.1063/1.4873596 . PMID 24811658 .
- Silverman, MS (1966). "Új kristályos ólom-dikhalkogenidek nagynyomású (70 k) szintézise". Szervetlen kémia . 5 (11): 2067–69. doi : 10.1021/ic50045a056 .
- Singh, P. (2017). "A festékek több mint 73% -ánál túlzott ólom található: tanulmány" . India idői . Letöltve: 2018. május 3 .
- Sinha, SP; Kagylós; Sharma, V .; et al. (1993). "Az ólom expozíció neurotoxikus hatásai a nyomdai dolgozók körében". Környezetszennyezési és Toxikológiai Közlöny . 51. (4): 490–93. doi : 10.1007/BF00192162 . PMID 8400649 . S2CID 26631583 .
- Slater, JC (1964). "Atomi sugarak kristályokban". The Journal of Chemical Physics . 41 (10): 3199–3204. Bibcode : 1964JChPh..41.3199S . doi : 10.1063/1.1725697 . ISSN 0021-9606 .
- Szmirnov, A. Yu .; Borisevich, VD; Sulaberidze, A. (2012). "Az ólom-208 izotóp gáznyomású centrifugákkal történő beszerzésének különböző költségeinek értékelése". A vegyipar elméleti alapjai . 46 (4): 373–78. doi : 10.1134/s0040579512040161 . S2CID 98821122 .
- Sokol, RC (2005). "Ólom expozíció és hatása a reproduktív rendszerre" . Golub, MS (szerk.). Fémek, termékenység és reproduktív toxicitás . CRC Press. 117–53. doi : 10.1201/9781420023282.ch6 . ISBN 978-0-415-70040-5.
- Stabenow, F .; Saak, W .; Weidenbruch, M. (2003). "Tris (trifenil -plumbil) plumbát: Anion három feszített ólom -ólom kötéssel". Kémiai kommunikáció (18): 2342–2343. doi : 10.1039/B305217F . PMID 14518905 .
- Stone, R. (1997). "A stabilitás eleme". Tudomány . 278 (5338): 571-572. Bibcode : 1997Sci ... 278..571S . doi : 10.1126/science.278.5338.571 . S2CID 117946028 .
- Utca, A .; Alexander, W. (1998). Fémek az ember szolgálatában (11. kiadás). Pingvin könyvek . ISBN 978-0-14-025776-2.
- Szczepanowska, HM (2013). A kulturális örökség megőrzése: legfontosabb elvek és megközelítések . Útvonal. ISBN 978-0-415-67474-4.
- Takahashi, K .; Boyd, RN; Mathews, GJ; et al. (1987). "Erősen ionizált atomok kötött állapotú béta-bomlása" (PDF) . Physical Review C . 36 (4): 1522–1528. Bibcode : 1987PhRvC..36.1522T . doi : 10.1103/physrevc.36.1522 . OCLC 1639677 . PMID 9954244 . Archiválva az eredetiből (PDF) , 2014. október 21 . Letöltve: 2013. augusztus 27 .
- Tarragó, A. (2012). "Esettanulmányok a környezeti orvostudományban (CSEM) ólomtoxicitás" (PDF) . Mérgező Anyagok és Betegségek Nyilvántartó Ügynöksége.
- Tétreault, J .; Sirois, J .; Stamatopoulou, E. (1998). "Ólomkorrózió vizsgálata ecetsav környezetben". Tanulmányok a természetvédelemről . 43. (1): 17–32. doi : 10.2307/1506633 . JSTOR 1506633 .
- "Think Lead kutatási összefoglaló" (PDF) . A Vezetőlap Egyesület . Letöltve: 2017. február 20 .
- Thomson, T. (1830). A kémia története . Henry Colburn és Richard Bentley (kiadók).
- Thornton, I .; Rautiu, R .; Brush, SM (2001). Vezető: A tények (PDF) . Nemzetközi Vezető Szövetség. ISBN 978-0-9542496-0-1. Letöltve: 2017. február 5 .
- Thürmer, K .; Williams, E .; Reutt-Robey, J. (2002). "Ólomkristallit felületek autokatalitikus oxidációja" . Tudomány . 297 (5589): 2033–35. Bibcode : 2002Sci ... 297.2033T . doi : 10.1126/science.297.5589.2033 . PMID 12242437 . S2CID 6166273 .
-
Tolliday, B. (2014). "Az ólomhasználat jelentős növekedése hangsúlyozza annak fontosságát a világgazdaság szempontjából" . Nemzetközi Vezető Szövetség . Letöltve: 2017. február 28 .
Az ólom iránti globális kereslet a kilencvenes évek eleje óta több mint kétszeresére nőtt, és a használat majdnem 90% -a ma már ólom-sav akkumulátorokban történik
- "A Torontói Múzeum a fogamzásgátlók történetét tárja fel" . ABC News . 2003 . Letöltve: 2016. február 13 .
- "Mérgező anyagok portálja - ólom" . Mérgező Anyagok és Betegségek Nyilvántartó Ügynöksége. Archiválva az eredetiből 2011. június 6.
- "Toxikológiai profil az ólomhoz" (PDF) . Mérgező anyagok és betegségek nyilvántartása/Toxikológiai és Környezeti Orvostudományi Osztály . 2007. Archiválva az eredetiből (PDF) , 2017. július 1.
- "Nyomelem -kibocsátás szénből" . IEA Tiszta Szénközpont. 2012 . Letöltve : 2017. március 1 .
- Tuček, K .; Carlsson, J .; Wider, H. (2006). "A nátrium- és ólomhűtéses gyorsreaktorok összehasonlítása a reaktorok fizikai vonatkozásai, súlyos biztonsági és gazdasági kérdések tekintetében" (PDF) . Nukleáris tervezés és tervezés . 236 (14–16): 1589–98. doi : 10.1016/j.nucengdes.2006.04.019 .
- Tungate, M. (2011). Márkás szépség: Hogyan változtatta meg a marketing a kinézetünket . Kogan Page Publishers. ISBN 978-0-7494-6182-9.
- UK Marine SACs Project (1999). "Ólom" . Vízminőség (jelentés) . Letöltve: 2018. június 10 .
- ENSZ Környezetvédelmi Program (2010). Az ólommal kapcsolatos tudományos információk záró felülvizsgálata (PDF) . Vegyipari ágazat, Technológiai, Ipari és Gazdasági Osztály . Letöltve: 2017. január 31 .
- Egyesült Államok Környezetvédelmi Ügynöksége (2010). "Kohászati ipar: másodlagos ólomfeldolgozás" . AP 42 Légszennyező kibocsátási tényezők összeállítása (5. kiadás) . Letöltve: 2018. május 20 .
- Egyesült Államok Környezetvédelmi Ügynöksége (2000). "A vállalkozók és a lakók által a háztartásokban végzett ólom-alapú festéktevékenységből származó hulladékok szabályozási státusza (2000. augusztus)" . Letöltve: 2017. február 28 .
- Egyesült Államok Környezetvédelmi Ügynöksége (2005). "A legjobb vezetési gyakorlatok az ólomhoz a szabadtéri lőtéren" (PDF) . Letöltve: 2018. június 12 .
- Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (2015). Q3D elemi szennyeződésekre vonatkozó útmutató az ipar számára (PDF) (jelentés). Egyesült Államok Egészségügyi és Humánszolgáltatási Minisztériuma . o. 41 . Letöltve: 2017. február 15 .
- Egyesült Államok Geológiai Szolgálata (1973). Földtani Szolgálat szakmai papírja . Egyesült Államok Kiadóhivatala . o. 314.
- Egyesült Államok geológiai felmérése (2005). Lead (PDF) (jelentés) . Letöltve: 2016. február 20 .
- Egyesült Államok geológiai felmérése (2017). "Lead" (PDF) . Ásványi áruk összefoglalói . Letöltve: 2017. május 8 .
- University of California Nuclear Forensic Search Project. "Bomlási láncok" . Nukleáris kriminalisztika: Tudományos keresési probléma . Letöltve: 2015. november 23 .
- Vasmer, M. (1986–1987) [1950–1958]. Trubachyov, ON ; Larin, BO (szerk.). Этимологический словарь русского языка [ Russisches etymologisches Worterbuch ] (oroszul) (2. kiadás). Haladás . Letöltve : 2017. március 4 .
- Vogel, NA; Achilles, R. (2013). A történelmi ólomüveg és ólomüveg megőrzése és javítása (PDF) (jelentés). Egyesült Államok Belügyminisztériuma . Letöltve: 2016. október 30 .
- Waldron, HA (1985). "Ólom és ólommérgezés az ókorban" . Orvostörténet . 29. (1): 107–08. doi : 10.1017/S0025727300043878 . PMC 1139494 .
- Wani, AL; Ara, A .; Usman, JA (2015). "Ólom toxicitás: áttekintés" . Interdiszciplináris toxikológia . 8 (2): 55–64. doi : 10.1515/intox-2015-0009 . PMC 4961898 . PMID 27486361 .
- Weast, RC; Astle, MJ; Beyer, WH (1983). CRC kémia és fizika kézikönyve: Kész kézikönyv kémiai és fizikai adatokról . CRC Press. ISBN 978-0-8493-0464-4.
- "Időjárás a mellvédekhez és a párkányokhoz" . A Vezetőlap Egyesület . Letöltve: 2017. február 20 .
- Webb, GA (2000). Nukleáris mágneses rezonancia . Királyi Kémiai Társaság. ISBN 978-0-85404-327-9.
- Webb, GW; Marsiglio, F .; Hirsch, JE (2015). "Szupravezető képesség az elemekben, ötvözetekben és egyszerű vegyületekben". Physica C: Szupravezetés és alkalmazásai . 514 : 17–27. arXiv : 1502.04724 . Bibcode : 2015PhyC..514 ... 17W . doi : 10.1016/j.physc.2015.02.037 . S2CID 119290828 .
- Whitten, KW; Gailey, KD; David, RE (1996). Általános kémia kvalitatív elemzéssel (3. szerk.). Saunders Főiskola. ISBN 978-0-03-012864-6.
- Wiberg, E .; Wiberg, N .; Holleman, AF (2001). Szervetlen kémia . Academic Press . ISBN 978-0-12-352651-9.
- Wilkes, CE; Summers, JW; Daniels, Kalifornia; et al. (2005). PVC kézikönyv . Hanser. ISBN 978-1-56990-379-7.
- Willey, DG (1999). "A fizika négy csodálatos demonstráció mögött - CSI" . Szkeptikus Érdeklődő . 23. (6) bekezdése . Letöltve: 2016. szeptember 6 .
- Winder, C. (1993a). "Az ólom története - 1. rész" . LEAD Akcióhírek . 2. (1) bekezdése. ISSN 1324-6011 . Archiválva az eredetiből 2007. augusztus 31 -én . Letöltve: 2016. február 5 .
- Winder, C. (1993b). "Az ólom története - 3. rész" . LEAD Akcióhírek . 2. (3) bekezdése. ISSN 1324-6011 . Archiválva az eredetiből 2007. augusztus 31 -én . Letöltve: 2016. február 12 .
- Windholz, M. (1976). Merck vegyi anyagok és gyógyszerek indexe (9. kiadás). Merck & Co. ISBN 978-0-911910-26-1. 8393. monográfia.
- Wood JR, Hsu, YT és Bell, C. 2021 Laurion küldése vissza a jövőbe: bronzkori ezüst és a zűrzavar forrása, internetes régészet 56. https://doi.org/10.11141/ia.56.9
- Egészségügyi Világszervezet (1995). Környezet -egészségügyi kritériumok 165: Szervetlen ólom (jelentés) . Letöltve: 2018. június 10 .
- Egészségügyi Világszervezet (2000). "Lead" (PDF) . Levegőminőségi irányelvek Európában . Európai Regionális Iroda. pp. 149-53 . ISBN 978-92-890-1358-1. OCLC 475274390 .
- Egészségügyi Világszervezet (2018). "Ólommérgezés és egészség" . Letöltve: 2019. február 17 .
- Nukleáris Világszövetség (2015). "Nukleáris sugárzás és egészségügyi hatások" . Letöltve: 2015. november 12 .
- Wrackmeyer, B .; Horchler, K. (1990). 207 Pb-NMR paraméterek . Éves jelentések az NMR spektroszkópiáról . 22 . Academic Press. 249–303. doi : 10.1016/S0066-4103 (08) 60257-4 . ISBN 978-0-08-058405-8.
- Yong, L .; Hoffmann, SD; Fässler, TF (2006). "[Pb 9 ] 4 · klaszterek alacsony dimenziós elrendezése [K (18-korona-6)] 2 K 2 Pb 9 · (en) 1.5 " -ben . Inorganica Chimica Acta . 359 (15): 4774-78. doi : 10.1016/j.ica.2006.04.017 .
- Young, S. (2012). "Ólomszennyezés elleni küzdelem, egy halcsont egyszerre" . Iránytű . Egyesült Államok parti őre . Letöltve: 2017. február 11 .
- Yu, L .; Yu, H. (2004). Kínai érmék: Pénz a történelemben és a társadalomban . Long River Press. ISBN 978-1-59265-017-0.
- Zhang, X .; Yang, L .; Li, Y .; et al. (2012). "Az ólom/cink bányászat és olvasztás hatása a környezetre és az emberi egészségre Kínában". Környezeti monitoring és értékelés . 184 (4): 2261–73. doi : 10.1007/s10661-011-2115-6 . PMID 21573711 . S2CID 20372810 .
- Zhao, F. (2008). Informatikai vállalkozói szellem és innováció . IGI Global. o. 440. ISBN 978-1-59904-902-1.
- Zuckerman, JJ; Hagen, AP (1989). Szervetlen reakciók és módszerek, kötések kialakulása halogénekhez . John Wiley & Sons. ISBN 978-0-471-18656-4.
- Zweifel, H. (2009). Műanyag adalékanyagok kézikönyve . Hanser. ISBN 978-3-446-40801-2.
- Zýka, J. (1966). "Az ólom -tetraacetát, mint oxidálószer alapvető tulajdonságainak elemző vizsgálata" . Tiszta és alkalmazott kémia . 13 (4): 569–81. doi : 10.1351/pac196613040569 . S2CID 96821219 . Letöltve : 2017. március 2 .
További irodalom
- Astrid, S .; Helmut, S .; Sigel, RKO, szerk. (2017). Ólom: Hatásai a környezetre és az egészségre . Fémionok az élettudományokban. 17 . De Gruyter. ISBN 978-3-11-044107-9. Tartalomjegyzék
- Casas, JS; Sordo, J., szerk. (2006). Vezető kémia, elemzési szempontok. Környezeti hatások és egészségügyi hatások . Elsevier. ISBN 978-0-444-52945-9.