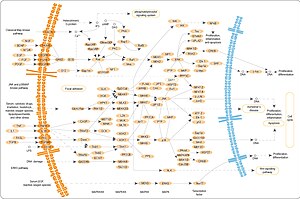
MAPK/ERK útvonal - MAPK/ERK pathway

A MAPK/ERK útvonal (más néven Ras-Raf-MEK-ERK útvonal ) a sejtekben található fehérjék lánca, amely a sejt felszínén lévő receptor jeleit továbbítja a sejtmag DNS -éhez.
A jel akkor kezdődik, amikor egy jelzőmolekula a sejt felszínén lévő receptorhoz kötődik, és akkor fejeződik be, amikor a sejtmagban lévő DNS fehérjét fejez ki, és valamilyen változást eredményez a sejtben, például a sejtosztódást . Az útvonal számos fehérjét tartalmaz, beleértve a MAPK-t ( mitogén-aktivált protein-kinázokat , eredetileg ERK-t, extracelluláris szignál-szabályozott kinázokat ), amelyek úgy kommunikálnak, hogy foszfátcsoportokat adnak hozzá a szomszédos fehérjéhez ( foszforilezik ), amely "be" vagy " ki "kapcsoló.
Ha az útvonal egyik fehérje mutálódik, akkor beragadhat az "on" vagy "off" helyzetbe, ami szükséges lépés számos rák kialakulásához. A MAPK/ERK útvonal összetevőit akkor fedezték fel, amikor rákos sejtekben találták őket. Azokat a gyógyszereket, amelyek megfordítják az "on" vagy "off" kapcsolót, rákkezelésként vizsgálják.
Háttér
Összességében az extracelluláris mitogén kötődik a membrán receptorhoz. Ez lehetővé teszi, hogy a Ras ( kis GTPáz ) kicserélje GDP -jét egy GTP -re . Mostantól aktiválhatja a MAP3K -t (pl. Raf ), amely aktiválja a MAP2K -t , amely aktiválja a MAPK -t . A MAPK most aktiválhat egy transzkripciós faktort, például a Myc -t . Részletesebben:
Ras aktiválás
A receptorokhoz kapcsolt tirozin-kinázokat, mint például az epidermális növekedési faktor receptor (EGFR), aktiválják az extracelluláris ligandumok , például az epidermális növekedési faktor (EGF). Az EGF EGFR -hez való kötődése aktiválja a receptor citoplazmatikus doménjének tirozin -kináz aktivitását. Az EGFR foszforilálódik a tirozin maradékokon. A dokkolófehérjék, például a GRB2 SH2 domént tartalmaznak , amely az aktivált receptor foszfotirozin -maradékaihoz kötődik. A GRB2 a GRB2 két SH3 doménje révén kötődik az SOS guanin nukleotidcsere faktorhoz. Amikor a GRB2-SOS komplex csatlakozik a foszforilezett EGFR-hez, az SOS aktiválódik. Az aktivált SOS ezután elősegíti a GDP eltávolítását a Ras alcsalád egyik tagjától (leginkább H-Ras vagy K-Ras ). A Ras ezután megkötheti a GTP -t és aktívvá válhat.
Az EGFR -en kívül más sejtfelszíni receptorok, amelyek képesek aktiválni ezt az utat a GRB2 -n keresztül, a Trk A/B , a Fibroblast növekedési faktor receptor (FGFR) és a PDGFR .
Kináz kaszkád
Az aktivált Ras aktiválja a RAF kináz protein kináz aktivitását . A RAF kináz foszforilálja és aktiválja a MEK -t (MEK1 és MEK2). A MEK foszforilálja és aktiválja a mitogén-aktivált protein-kinázt (MAPK).
A RAF és az ERK (más néven MAPK) egyaránt szerin/treonin-szelektív protein-kinázok . A MEK szerin/tirozin/treonin kináz.
Technikai értelemben az RAF, a MEK és a MAPK mind mitogén -aktivált kinázok, akárcsak az MNK (lásd alább). A MAPK-t eredetileg " extracelluláris szignál-szabályozott kinázoknak " ( ERK ) és "mikrotubulusokhoz kapcsolódó protein-kináznak" (MAPK) nevezték . Az egyik első ismert fehérje, amelyet ERK foszforilált, egy mikrotubulus-asszociált fehérje (MAP) volt. Amint azt az alábbiakban tárgyaljuk, később számos további célpontot találtak a MAPK általi foszforilezésre, és a fehérjét átnevezték "mitogén-aktivált protein-kináz" -ra (MAPK). A RAF -tól a MEK -ig a MAPK -ig terjedő kinázok egy példája a protein -kináz kaszkádnak. Az ilyen típusú kinázok lehetőséget biztosítanak a visszacsatolás szabályozására és a jelerősítésre.
A fordítás és az átírás szabályozása
A MAPK által foszforilált sok fehérje közül három látható az ábrán. Egyik hatása az MAPK aktiválását, hogy megváltoztassa a fordítást a mRNS fehérjékhez. A MAPK foszforilálja a 40S riboszómás fehérje S6 kinázt ( RSK ). Ez aktiválja az RSK -t, amely viszont foszforilálja a riboszómás S6 fehérjét. Elsőként a mitogén aktivált protein kinázokat izolálták, amelyek foszforilezik a riboszómás S6 fehérjét.
A MAPK számos transzkripciós faktor tevékenységét szabályozza . A MAPK képes foszforilezni a C-myc-t . A MAPK foszforilálja és aktiválja az MNK -t, amely viszont a CREB -t foszforilálja . A MAPK szabályozza a C-Fos gén transzkripcióját is . A transzkripciós faktorok szintjének és aktivitásának megváltoztatásával a MAPK a sejtciklus szempontjából fontos gének megváltozott transzkripciójához vezet .
A 22q11, 1q42 és 19p13 gének skizofréniához , skizoaffektív , bipoláris és migrénhez kapcsolódnak azáltal, hogy befolyásolják az ERK útvonalat.
A sejtciklus belépésének és proliferációjának szabályozása
A mitogén jelátvitel szerepe a sejtciklus progressziójában Az ERK út fontos szerepet játszik abban, hogy a mitogének, például epidermális növekedési faktor (EGF) jelenlétéből származó külső jeleket integrálja a jelzőeseményekbe, amelyek elősegítik a sejtnövekedést és -proliferációt sok emlős sejttípusban. Egy egyszerűsített modellben a mitogének és növekedési faktorok jelenléte kiváltja a kanonikus receptor tirozin kinázok, például az EGFR aktiválását, ami dimerizációjukhoz és a kis GTPáz Ras aktiválásához vezet. Ez egy sor foszforilációs eseményhez vezet a MAPK kaszkádban (Raf-MEK-ERK), ami végül az ERK foszforilációját és aktiválását eredményezi. Az ERK foszforilációja a kináz aktivitásának aktiválását eredményezi, és számos, a sejtproliferáció szabályozásában részt vevő downstream célpont foszforilációjához vezet. A legtöbb sejtben valamilyen tartós ERK -aktivitás szükséges ahhoz, hogy a sejtek aktiválják azokat a géneket, amelyek a sejtciklus belépését indukálják, és elnyomják a sejtciklus negatív szabályozóit. Két ilyen fontos célpont a Cdk4 és Cdk6 (Cdk4/6) Cyclin D komplexek, amelyeket mind az ERK foszforilez. A G1 fázisból az S fázisba való átmenetet a Cyclin D-Cdk4/6 aktivitása koordinálja, amely a késői G1 fázis során növekszik, miközben a sejtek a mitogének hatására felkészülnek az S fázisba való belépésre. A Cdk4/6 aktiválás hozzájárul a hiper-foszforilációhoz és a retinoblasztóma fehérje (Rb) ezt követő destabilizálásához. A hipofoszforilezett Rb általában a G1 korai szakaszában kötődik az E2F transzkripciós faktorhoz, és gátolja annak transzkripciós aktivitását, megakadályozva az S-fázisú belépő gének, köztük a Cyclin E, a Cyclin A2 és az Emi1 expresszióját. Az ERK1/2 aktiválása a mitogén által indukált Ras jelátvitelt követően szükséges és elegendő ahhoz, hogy eltávolítsa ezt a sejtciklus blokkot, és lehetővé tegye a sejtek S-fázisba történő előrehaladását a legtöbb emlőssejtben.
Lefelé irányuló visszacsatolásvezérlés és bistabil G1/S kapcsoló létrehozása
A restrikciós pont (R-pont) jelzi azt a kritikus eseményt, amikor egy emlőssejt elkötelezi magát a proliferáció mellett, és függetlenné válik a növekedés stimulációjától. Alapvető a normális differenciálódáshoz és a szövetek homeosztázisához, és úgy tűnik, hogy szinte minden rákos megbetegedésben szabályozatlan. Annak ellenére, hogy az R-pont az emlőssejt-ciklus G1-S átmenetének szabályozásával kapcsolatos különféle tevékenységekhez kapcsolódik, a mögöttes mechanizmus továbbra sem világos. Yao és mtsai egysejtű mérésekkel azt mutatják, hogy az Rb – E2F útvonal bistabil kapcsolóként működik, hogy az osztályozott szérum bemeneteket minden vagy sem E2F válaszrá alakítsa át.
A növekedési és mitogén jeleket az ERK útvonal után továbbítják, és több pozitív visszacsatolási hurokba építik be, hogy bistabil kapcsolót generáljanak az E2F aktiválás szintjén. Ez három fő kölcsönhatás miatt következik be a késői G1 fázisban. Az első a mitogén stimuláció eredménye az ERK -n keresztül, ami a Myc transzkripciós faktor expressziójához vezet, amely az E2F közvetlen aktivátora. A második út az ERK aktiválásának eredménye, amely a Cyclin D és Cdk4/6 aktív komplexeinek felhalmozódásához vezet, amelyek foszforiláció útján destabilizálják az Rb -t, és tovább szolgálnak az E2F aktiválásához és elősegítik célpontjainak kifejeződését. Végül ezeket a kölcsönhatásokat megerősíti az E2F saját pozitív visszacsatolási hurokja, mivel saját kifejezése a Cyclin E és a CDK2 aktív komplexének előállításához vezet, ami tovább gátolja a sejt S-fázisba való belépésének döntését. Ennek eredményeként, amikor a szérumkoncentrációt fokozatosan növelik, a legtöbb emlőssejt kapcsolószerűen reagál az S-fázisba való belépésre. Ez a mitogén által stimulált, bistabil E2F kapcsoló hiszterézist mutat, mivel a sejtek nem tudnak visszatérni a G1 -be még az E2F aktiválását követő mitogén -kivonás után sem.
Dinamikus jelfeldolgozás az ERK útvonalon
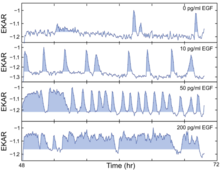
Az EGF által stimulált EGFR-ERK/MARK (epidermális növekedési faktor receptor extracellulárisan szabályozott kináz/mitogén-aktivált protein-kináz) útvonal kritikus a sejtproliferáció szempontjából, de a jel és a válasz közötti időbeli elkülönítés elfedi a jelet -válaszkapcsolat a korábbi kutatásokban. 2013 -ban Albeck et al. kulcsfontosságú kísérleti bizonyítékokkal szolgált a tudás ezen hiányának pótlására. Egyenletes állapotú EGF stimulációval mérték a jel erősségét és dinamikáját, amelyben a jelzés és a kimenet könnyen összekapcsolható. Továbbá feltérképezték a jel-válasz viszonyt az útvonal teljes dinamikatartományában. A foszforilált ERK (pERK) és az élősejtes FRET bioszenzorok nagy tartalmú immunfluoreszcencia (HCIF) kimutatásával a monitorozott ERK-útvonal kimenetét figyelte mind élő, mind fix sejtekben. Az ERK jelátvitel mennyiségi jellemzőinek a proliferációs arányokhoz való további kapcsolódása érdekében egy sor egyensúlyi állapotot állapítottak meg EGF koncentrációtartomány felhasználásával, különböző koncentrációjú EGF alkalmazásával.
Az egysejtes képalkotó kísérletek kimutatták, hogy az ERK sztochasztikus kitörésekben aktiválódik EGF jelenlétében. Ezenkívül az útvonalról kimutatták, hogy kódolja a jelzőbemenetek erősségét, bár tevékenységének frekvencia modulált impulzusai. Élősejtes FRET bioszenzorokat használva, különböző koncentrációjú EGF tiltott aktivitással indukált sejtek különböző gyakoriságú kitöréseket okoznak, ahol a magasabb EGF -szint az ERK aktivitás gyakoribb kitörését eredményezte. Annak megállapítására, hogy az S fázis belépését hogyan befolyásolhatják az ERK aktivitás szórványos impulzusai alacsony EGF koncentrációban, MCF-10A sejteket használtak, amelyek együtt expresszálják az EKAR-EV és az RFP-geminint, és azonosították az ERK aktivitás impulzusait a pontozással, majd igazították Ez az ERK aktivitásprofil a GFP-geminin indukció idejével. Azt találták, hogy az ERK aktivitás hosszabb időszakai stimulálják az S fázis belépését, amint azt a megnövekedett impulzushossz is sugallja. Az EGFR-ERK útvonal dinamikájának, különösen a frekvencia és az amplitúdó modulálásának megértéséhez az EGFR inhibitor gefitinibet vagy a nagyon szelektív MAPK/ERK kináz (MEK) inhibitor PD0325901 (PD) alkalmazását alkalmazták. Két inhibitor valójában egy kicsit más eredményt ad: a gefitinib közepes koncentrációban pulzáló viselkedést és bimodális eltolódást indukálna, ami nem figyelhető meg a PD esetében. Továbbá egyesítik az EGF -et és a PD -t, és arra a következtetésre jutnak, hogy az ERK aktivitások gyakoriságát mennyiségi variáció modulálja, míg az amplitúdót a MEK aktivitás változása. Végül az Fra-1-hez, az ERK-útvonal egyik downstream effektorjához fordultak, mivel technikailag nehéz az ERK-tevékenységek közvetlen becslése. Annak megértése érdekében, hogy az integrált ERK útvonal kimenete (amelynek függetlennek kell lennie a frekvenciától vagy az amplitúdótól) befolyásolja a proliferációs sebességet, az EGF és a PD széles koncentrációjának kombinációját használták, és azt találták, hogy valójában van egy fordított „L” alakú egyetlen görbe összefüggés, ami arra utal, hogy az ERK útvonal kimenetének alacsony szintjein a jelintenzitás kis változásai a proliferációs sebesség nagy változásainak felelnek meg, míg a dinamikus tartomány felső végéhez közeli nagy jelintenzitás -változások csekély hatással vannak a proliferációra. Az ERK jelátvitel ingadozása kiemeli a jelenlegi terápiás megközelítések lehetséges problémáit, új perspektívát adva a kábítószer -célzásról való gondolkodás szempontjából a rákos ERK -úton.
A mitogén- és stresszjelek integrálása a proliferációba
Az MCF10A és MCF7 sejtekben végzett friss élősejt-képalkotó kísérletek kimutatták, hogy a mitogén jelátvitel kombinációja az ERK és a stresszjelek révén a p53 aktiválása révén az anyasejtekben hozzájárul annak valószínűségéhez, hogy az újonnan létrehozott leánysejtek azonnal újra belépnek a sejtciklusba vagy belépnek a mitózist megelőző nyugalom (G0). Ahelyett, hogy a leánysejtek az osztódás után kulcsfontosságú jelzőfehérjék nélkül kezdődnének, a mitogén/ERK által indukált Cyclin D1 mRNS és a DNS károsodás által indukált p53 fehérje, mindkettő hosszú élettartamú tényezője a sejtekben, stabilan öröklődhet az anyasejtekből a sejtosztódás után. Ezeknek a szabályozóknak a szintje sejtenként változik a mitózis után, és a sztöchiometria közöttük erősen befolyásolja a sejtciklus elköteleződését a Cdk2 aktiválása ellenére. Az ERK jelátvitel gátlóit vagy a p53 jelátvitelt indukáló vegyi anyagokat alkalmazó kémiai zavarok az anyasejtekben arra utalnak, hogy a leánysejtek magas p53 fehérje- és alacsony Cyclin D1 transzkriptumokkal rendelkeznek, elsősorban a G0 -ba, míg a magas ciklin D1 és alacsony p53 -szinttel rendelkező sejtek valószínűleg hogy újra belépjen a sejtciklusba. Ezek az eredmények a kódolt molekuláris memória egy formáját szemléltetik, bár az ERK -n keresztül a mitogén jelátvitel története és a p53 stresszválasz.
Klinikai jelentőség
Az ellenőrizetlen növekedés szükséges lépés minden rák kialakulásához. Sok rák (pl. Melanoma ) esetén a MAP/ERK útvonal hibája ahhoz az ellenőrizetlen növekedéshez vezet. Sok vegyület gátolhatja a MAP/ERK út lépéseit, ezért potenciális gyógyszerek a rák kezelésére, pl. Hodgkin -betegség .
Az első gyógyszer, amely engedélyezett ezen az úton, a sorafenib - egy Raf -kináz inhibitor.
Egyéb Raf inhibitorok: SB590885, PLX4720, XL281, RAF265, encorafenib , dabrafenib , vemurafenib .
Néhány MEK-gátló : kobimetinib , CI-1040, PD0325901, binimetinib ( MEK162 ), selumetinib , trametinib (GSK1120212) Megállapították, hogy az akupunkt-moxibustion szerepet játszik az alkohol okozta gyomornyálkahártya-sérülések enyhítésében egérmodellben, amely szorosan összefügg az epidermális növekedési faktor/ERK jelátviteli út felerősítő tevékenységében kifejtett hatásaival.
A RAF-ERK útvonal részt vesz a polianformatív betegség, a Noonan-szindróma patofiziológiájában is , ahol a szimvasztatint javasolták a rendellenesség központi idegrendszeri kognitív tüneteinek javítására.
A fehérje -mikrotömb -elemzés felhasználható a fehérjeaktivitás finom változásainak kimutatására a jelátviteli utakon. Azokat a fejlődési szindrómákat, amelyeket a MAP/ERK jelátviteli út RAS komponenseit megváltoztató gének csíravonal mutációi okoznak, RASopathiáknak nevezzük .
Lásd még
Hivatkozások
Külső linkek
- MAP kináz erőforrás .
- Kyoto Encyclopedia of Genes and Genomes - MAPK útvonal
- MAP-kináz + + + jeladás rendszer az amerikai National Library of Medicine orvosi tárgyszórendszere (mm)