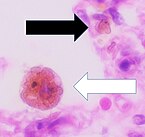
Makrofág - Macrophage
| Makrofág | |
|---|---|
 Makrofág, amely kinyújtja "karjait" ( filopodia ), hogy két részecskét, esetleg kórokozót nyeljen el egy egérben ( tripánkék kizárásos festés)
| |
| Részletek | |
| Kiejtés | /ˈmakrə(ʊ)feɪdʒ/ |
| Rendszer | Immunrendszer |
| Funkció | Fagocitózis |
| Azonosítók | |
| latin | Macrophagocytus |
| betűszó(k) | M φ , MΦ |
| Háló | D008264 |
| TH | H2.00.03.0.01007 |
| FMA | 63261 |
|
A mikroanatómia anatómiai fogalmai | |
A makrofágok (rövidítve M φ , MΦ vagy MP ) ( görög : nagy evők , a görög μακρός ( MAKROS ) = nagy, φαγεῖν ( phagein ) = enni) egy fajta fehérvérsejt a immunrendszert , hogy körülöleli és emésztett semmit amelynek felületén nem találhatók az egészséges testsejtekre jellemző fehérjék, beleértve a rákos sejteket , mikrobákat , sejttörmeléket, idegen anyagokat stb. A folyamatot fagocitózisnak nevezik., amely megvédi a gazdát a fertőzésektől és sérülésektől.
Ezek a nagy fagociták lényegében minden szövetben megtalálhatók, ahol amőboid mozgással járőröznek a potenciális kórokozók után . Különféle formákat öltenek (különböző elnevezésekkel) az egész testben (pl. hisztiociták , Kupffer-sejtek , alveoláris makrofágok , mikroglia és mások), de mindegyik a mononukleáris fagocita rendszer részét képezi . A fagocitózison kívül kritikus szerepet játszanak a nem specifikus védekezésben ( veleszületett immunitás ), és más immunsejtek, például limfociták toborzásával is segítenek specifikus védekezési mechanizmusok ( adaptív immunitás ) beindításában . Például fontosak a T-sejtek antigénprezentátoraiként . Emberben a diszfunkcionális makrofágok súlyos betegségeket, például krónikus granulomatózisos betegségeket okoznak, amelyek gyakori fertőzésekhez vezetnek.
A gyulladás fokozásán és az immunrendszer stimulálásán túl a makrofágok fontos gyulladáscsökkentő szerepet is játszanak, és citokinek felszabadulásával csökkenthetik az immunreakciókat . A gyulladást serkentő makrofágokat M1 makrofágoknak, míg azokat, amelyek csökkentik a gyulladást és elősegítik a szövetek helyreállítását, M2 makrofágoknak nevezik. Ez a különbség az anyagcseréjükben is megmutatkozik; Az M1 makrofágok egyedülállóan képesek az arginint a "gyilkos" nitrogén-oxid molekulává metabolizálni , míg az M2 makrofágok egyedülállóan képesek az arginint az ornitin "javító" molekulává metabolizálni . Ezt a kettősséget azonban a közelmúltban megkérdőjelezték, mivel további összetettséget fedeztek fel.
Az emberi makrofágok körülbelül 21 mikrométer (0,00083 hüvelyk) átmérőjűek, és a szövetekben a monociták differenciálódása révén keletkeznek. Azonosíthatók áramlási citometriával vagy immunhisztokémiai festéssel olyan fehérjék specifikus expressziója alapján, mint a CD14 , CD40 , CD11b , CD64 , F4/80 (egerek)/ EMR1 (humán), lizozim M, MAC-1 /MAC-3 és CD68. .
A makrofágokat először Élie Metchnikoff orosz zoológus fedezte fel és nevezte el 1884-ben.
Szerkezet
Típusok
A makrofágok többsége olyan stratégiai pontokon állomásozik, ahol valószínűsíthető a mikrobiális invázió vagy az idegen részecskék felhalmozódása. Ezeket a sejteket, mint egy csoportot, mononukleáris fagocita rendszerként ismerik, és korábban retikuloendoteliális rendszerként ismerték. A makrofágok mindegyik típusa, amelyet a helye határoz meg, meghatározott névvel rendelkezik:
| Cell Name | Anatómiai hely |
| A zsírszövet makrofágjai | Zsírszövet (zsír) |
| Monociták | Csontvelő / vér |
| Kupffer sejtek | Máj |
| Sinus hisztiociták | Nyirokcsomók |
| Alveoláris makrofágok ( porsejtek ) | Pulmonalis alveolusok |
| Tissue makrofágok (histiocyták) vezető óriássejtek | Kötőszöveti |
| Microglia | Központi idegrendszer |
| Hofbauer sejtek | Placenta |
| Intraglomeruláris mezangiális sejtek | Vese |
| Osteoklasztok | Csont |
| Langerhans sejtek | Bőr |
| Epithelioid sejtek | Granulomák |
| Vörös cellulóz makrofágok ( szinuszos béléssejtek) | Vörös léppép |
| Peritoneális makrofágok | Peritoneális üreg |
| LysoMac | Peyer tapasz |
A Kupffer-sejtekkel kapcsolatos vizsgálatokat hátráltatja, hogy emberben a Kupffer-sejtek csak biopsziákból vagy boncolásokból állnak rendelkezésre immunhisztokémiai analízisre. Patkányokból és egerekből nehéz elkülöníteni őket, és tisztítás után csak megközelítőleg 5 millió sejt nyerhető egy egérből.
A makrofágok olyan parakrin funkciókat fejezhetnek ki a szerveken belül, amelyek az adott szerv funkciójára jellemzőek. A herében például kimutatták, hogy a makrofágok képesek kölcsönhatásba lépni a Leydig-sejtekkel azáltal , hogy 25-hidroxikoleszterint választanak ki , egy olyan oxiszterint , amelyet a szomszédos Leydig-sejtek tesztoszteronná alakíthatnak . A herék makrofágjai emellett részt vehetnek az immunrendszer által kiváltságos környezet kialakításában a herében, és a meddőség közvetítésében a heregyulladás során.
A szívben rezidens makrofágok részt vesznek az elektromos vezetésben a szívizomsejtekkel való gap junction kommunikáción keresztül .
A makrofágok alapvető funkciójuk és aktivációjuk alapján osztályozhatók. E csoportosítás szerint vannak klasszikusan aktivált (M1) makrofágok , sebgyógyító makrofágok (más néven alternatív aktiválású (M2) makrofágok ) és szabályozó makrofágok (Mregs).
Fejlődés
A felnőtt egészséges szövetekben található makrofágok vagy keringő monocitákból származnak, vagy születés előtt létrejöttek, majd a felnőtt élet során a monocitáktól függetlenül fennmaradnak. Ezzel szemben a beteg helyeken felhalmozódó makrofágok többsége jellemzően keringő monocitákból származik. Amikor egy monocita egy véredény endotéliumán keresztül bejut a sérült szövetbe , ezt a folyamatot leukocita extravazációnak nevezik, egy sor változáson megy keresztül, és makrofággá válik. A monocitákat kémiai anyagok vonzzák a sérült helyre a kemotaxis révén , amelyet számos inger vált ki, beleértve a sérült sejteket, kórokozókat és a makrofágok által már a helyszínen felszabaduló citokineket . Egyes helyeken, például a herében, kimutatták, hogy a makrofágok szaporodás útján népesítik be a szervet. A rövid életű neutrofilektől eltérően a makrofágok tovább élnek a szervezetben, akár több hónapig is.
Funkció
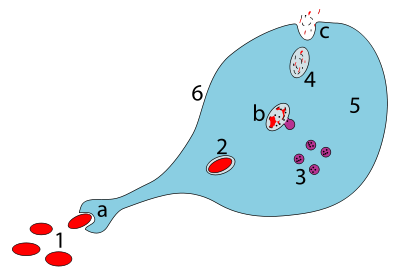
a. Fagocitózissal lenyelve fagoszóma képződik
b. A lizoszómák fúziója a fagoszómával fagolizoszómát hoz létre ; a kórokozót enzimek bontják le
c. Hulladék anyagot távozik, vagy asszimilálódott (az utóbbi nem a képen)
részei:
1. A kórokozók
2. fagoszóma
3. Lizoszómák
4. hulladékanyagokat
5. Citoplazma
6. A sejtmembrán
Fagocitózis
A makrofágok professzionális fagociták, és nagymértékben specializálódtak a haldokló vagy elhalt sejtek és sejttörmelékek eltávolítására. Ez a szerep fontos a krónikus gyulladásban, mivel a gyulladás korai szakaszában a neutrofilek dominálnak, amelyeket nagykorúságuk esetén a makrofágok lenyelnek ( a folyamat leírását lásd a CD31-ben ).
A neutrofilek először egy helyre vonzódnak, ahol ellátják funkciójukat és elpusztulnak, mielőtt a makrofágok fagocitizálják őket vagy extracelluláris neutrofil csapdáikat . A helyszínen a neutrofilek első hulláma az öregedési folyamat után és az első 48 óra után serkenti a makrofágok megjelenését, és ezek a makrofágok az idős neutrofileket lenyelik.
A haldokló sejtek eltávolítását nagyobb mértékben a fix makrofágok végzik , amelyek olyan stratégiai helyeken maradnak, mint a tüdő, a máj, az idegszövet, a csont, a lép és a kötőszövet, lenyelve idegen anyagokat, például kórokozókat, és további makrofágokat toboroznak. ha szükséges.
Amikor egy makrofág lenyel egy kórokozót, a kórokozó beszorul egy fagoszómába , amely azután egy lizoszómával egyesül . A fagolizoszómán belül enzimek és toxikus peroxidok emésztik meg a kórokozót. Egyes baktériumok, például a Mycobacterium tuberculosis azonban ellenállóvá váltak ezekkel az emésztési módszerekkel szemben. A tífuszos szalmonellák in vivo indukálják saját fagocitózisukat a gazdamakrofágok által, és lizoszómális hatás révén gátolják az emésztést, ezáltal a makrofágokat saját replikációjukhoz használják fel, és makrofág apoptózist okoznak. A makrofágok több mint 100 baktériumot képesek megemészteni, mielőtt azok végül elpusztulnak saját emésztővegyületeik miatt.
Szerep az adaptív immunitásban
A makrofágok sokoldalú sejtek, amelyek számos szerepet játszanak. Díszítőként megszabadítják a testet az elhasználódott sejtektől és egyéb törmelékektől. A dendrites sejtek mellett ezek az antigéneket prezentáló sejtek közé tartoznak , amelyek kulcsszerepet játszanak az immunválasz kiváltásában. Szekretoros sejtekként a monociták és a makrofágok létfontosságúak az immunválasz szabályozásában és a gyulladások kialakulásában; erős kémiai anyagok ( monokinek ) széles skáláját termelik, beleértve az enzimeket, komplement fehérjéket és szabályozó tényezőket, például az interleukin-1-et . Ugyanakkor limfokinek receptorait hordozzák, amelyek lehetővé teszik számukra, hogy „aktiválják” őket a mikrobák és daganatos sejtek együgyű üldözésébe.
A kórokozó emésztése után egy makrofág bemutatja a kórokozó antigénjét (egy molekula, leggyakrabban a kórokozó felszínén található, és az immunrendszer azonosításra használ fel) a megfelelő segítő T-sejtnek . A prezentáció a sejtmembránba való integrálásával és egy MHC II. osztályú molekulához (MHCII) csatolva valósul meg, jelezve más fehérvérsejtek számára, hogy a makrofág nem kórokozó, annak ellenére, hogy antigének vannak a felületén.
Végül az antigénprezentáció eredményeként olyan antitestek képződnek, amelyek a kórokozók antigénjeihez kötődnek, így a makrofágok könnyebben megtapadnak sejtmembránjukkal és fagocitózukkal. Egyes esetekben a kórokozók nagyon ellenállnak a makrofágok tapadásának.
A fertőzött makrofágok felszínén (az MHC II. osztályával összefüggésben) a nyirokcsomókban az antigénprezentáció serkenti a TH1 (1. típusú helper T-sejtek) proliferációját (főleg a makrofágokból történő IL-12 szekréció miatt ). Amikor egy B-sejt a nyirokcsomóban felismeri ugyanazt a feldolgozatlan felületi antigént a baktériumon a felülethez kötött antitestével, az antigén endocitizálódik és feldolgozódik. A feldolgozott antigén ezután MHCII-ben kerül bemutatásra a B-sejt felszínén. Az antigén-MHCII komplexet felismerő T-sejt-receptort expresszáló T-sejtek (társstimuláló faktorokkal - CD40 és CD40L ) a B-sejteket olyan antitestek termelésére késztetik, amelyek elősegítik az antigén opszonizációját , hogy a baktériumokat a fagociták jobban eltávolítsák. .
A makrofágok egy újabb védelmi vonalat biztosítanak a gombával vagy parazitákkal fertőzött daganatsejtek és szomatikus sejtek ellen . Amint egy T-sejt felismerte saját antigénjét egy rendellenes sejt felszínén, a T-sejt aktivált effektorsejtté válik, és limfokinként ismert kémiai mediátorokat termel, amelyek a makrofágokat agresszívebb formába stimulálják.
Makrofág altípusok
A makrofágoknak számos aktivált formája létezik. A makrofágok aktiválásának számos módja ellenére két fő csoport létezik, amelyeket M1-nek és M2-nek neveznek . M1 makrofágok: amint korábban említettük (korábban klasszikusan aktivált makrofágoknak nevezték), az M1 "gyilkos" makrofágokat LPS és IFN-gamma aktiválja , és magas szintű IL-12-t és alacsony IL-10 -et választanak ki . Az M1 makrofágok gyulladást elősegítő, baktericid és fagocitáló funkciókkal rendelkeznek. Ezzel szemben az M2 "repair" megjelölés (más néven alternatívan aktivált makrofágok) nagy vonalakban olyan makrofágokra utal, amelyek olyan építő folyamatokban működnek, mint a sebgyógyulás és a szövetek helyreállítása, valamint azokat, amelyek gyulladásgátló citokinek termelésével kapcsolják ki az immunrendszer károsító aktiválódását. IL-10 . Az M2 a rezidens szöveti makrofágok fenotípusa, és az IL-4 tovább növelheti . Az M2 makrofágok magas szintű IL-10-et, TGF-béta-t és alacsony IL-12-t termelnek . A tumorhoz kapcsolódó makrofágok főként M2 fenotípusúak, és úgy tűnik, hogy aktívan elősegítik a tumor növekedését.
A makrofágok számos fenotípusban léteznek, amelyeket a sebérésben játszott szerepük határoz meg. A fenotípusok túlnyomórészt két nagy kategóriába sorolhatók; M1 és M2. Az M1 makrofágok a domináns fenotípus, amelyet a gyulladás korai szakaszában figyeltek meg, és négy kulcsfontosságú mediátor aktiválja őket: γ-interferon (IFN-γ), tumor nekrózis faktor (TNF) és károsodással összefüggő molekuláris minták (DAMP). Ezek a közvetítő molekulák pro-inflammatorikus választ hoznak létre, amely cserébe olyan pro-inflammatorikus citokineket termel, mint az Interleukin-6 és a TNF. Az M1 makrofágokkal ellentétben az M2 makrofágok interleukin-4 vagy interleukin-13 hozzáadásával gyulladásgátló választ választanak ki. A sebgyógyulásban is szerepet játszanak, és revascularisatióhoz és reepitelializációhoz is szükségesek. Az M2 makrofágokat szerepük alapján négy fő típusra osztják: M2a, M2b, M2c és M2d. Az M2 fenotípusok meghatározásának módja még vita tárgya, de a tanulmányok kimutatták, hogy környezetük lehetővé teszi számukra, hogy alkalmazkodjanak a legmegfelelőbb fenotípushoz a seb hatékony gyógyulásához.
M2 makrofágokra van szükség az érrendszeri stabilitáshoz. Vaszkuláris endoteliális növekedési faktor-A-t és TGF-β1-et termelnek . Akut sebekben fenotípus-eltolódás tapasztalható M1-ről M2 makrofágokra, de ez az eltolódás károsodott krónikus sebeknél. Ez a diszreguláció elégtelen M2 makrofágokat és a megfelelő növekedési faktorokat eredményez, amelyek elősegítik a sebgyógyulást. Ezeknek a növekedési faktoroknak/gyulladásgátló citokineknek a hiányával és az M1 makrofágokból származó pro-inflammatorikus citokinek túlzott mennyiségével a krónikus sebek nem tudnak időben gyógyulni. Normális esetben, miután a neutrofilek törmeléket/kórokozókat fogyasztanak, apoptózist hajtanak végre, és eltávolítják őket. Ezen a ponton nincs szükség gyulladásra, és az M1 átvált M2-re (gyulladáscsökkentő). Azonban diszreguláció lép fel, mivel az M1 makrofágok nem képesek/nem fagocitizálják azokat a neutrofileket, amelyek apoptózison mentek keresztül, ami fokozott makrofág migrációhoz és gyulladáshoz vezet.
Mind az M1, mind az M2 makrofágok szerepet játszanak az érelmeszesedés elősegítésében . Az M1 makrofágok gyulladás által elősegítik az érelmeszesedést. Az M2 makrofágok képesek eltávolítani a koleszterint az erekből, de amikor a koleszterin oxidálódik, az M2 makrofágok apoptotikus habsejtekké válnak, hozzájárulva az atherosclerosis atheromatosus plakkjához.
Szerepe az izomregenerációban
Az első lépés a makrofágok izomjavításban, -növekedésben és -regenerációban betöltött fontosságának megértéséhez az, hogy két makrofág „hullám” van a károsodott izomfelhasználás kezdetén – olyan alpopulációk, amelyek közvetlenül befolyásolják az izomjavítást, és nem. A kezdeti hullám egy fagocita populáció, amely olyan fokozott izomhasználat időszakában jön létre, amely elegendő az izommembrán líziséhez és a membrángyulladáshoz, amely bejuthat a sérült izomrostok tartalmába, és lebonthatja azokat. Ezek a korai behatoló, fagocita makrofágok a legmagasabb koncentrációjukat körülbelül 24 órával az izomsejtek valamilyen formájának sérülése vagy újratöltése után érik el. Koncentrációjuk 48 óra elteltével gyorsan csökken. A második csoport a nem fagocitáló típusok, amelyek a regeneratív rostok közelében oszlanak el. Ezek két és négy nap között tetőznek, és több napig emelkednek, amíg az izomszövet újjáépül. Az első alpopulációnak nincs közvetlen előnye az izomjavításban, míg a második, nem fagocitáló csoportnak igen.
Úgy gondolják, hogy a makrofágok oldható anyagokat bocsátanak ki, amelyek befolyásolják az izom proliferációját, differenciálódását, növekedését, helyreállítását és regenerálódását, de jelenleg nem ismert, hogy milyen faktor képződik ezeknek a hatásoknak a közvetítésére. Ismeretes, hogy a makrofágok részvétele a szövetek helyreállításában nem izomspecifikus; a sérülést követő gyógyulási folyamat során számos szövetben felhalmozódnak.
Szerepe a sebgyógyulásban
A makrofágok nélkülözhetetlenek a sebgyógyuláshoz . A sérülést követő második napon helyettesítik a polimorfonukleáris neutrofileket, mint a sebben uralkodó sejteket. A vérlemezkék és más sejtek által kibocsátott növekedési faktorok által a seb helyére vonzva a véráramból származó monociták az érfalakon keresztül jutnak a területre. A monociták száma a sebben a sérülés után egy-másfél nappal tetőzik. Amint a seb helyén vannak, a monociták makrofágokká érnek. A lép a test monocitáinak felét tartalmazza tartalékban, készen arra, hogy a sérült szövetekbe kerüljenek.
A makrofágok fő feladata a baktériumok és a sérült szövetek fagocitálása, valamint proteázok felszabadulásával a sérült szövetek eltávolítása . A makrofágok számos faktort is kiválasztanak, például növekedési faktorokat és más citokineket, különösen a sebzés utáni harmadik és negyedik napon. Ezek a tényezők vonzzák a gyógyulás proliferációs szakaszában részt vevő sejteket a területre. A makrofágok is visszatarthatják a kontrakciós fázist. A makrofágokat a környezetük alacsony oxigéntartalma serkenti, hogy olyan faktorokat termeljenek, amelyek indukálják és felgyorsítják az angiogenezist, valamint stimulálják a sejteket, amelyek újraepiteliizálják a sebet, granulációs szövetet hoznak létre, és új extracelluláris mátrixot hoznak létre . Ezen tényezők kiválasztásával a makrofágok hozzájárulnak ahhoz, hogy a sebgyógyulási folyamatot a következő fázisba tolják.
Szerepe a végtag regenerációjában
A tudósok rájöttek, hogy a makrofágok az anyagi törmelék elfogyasztása mellett részt vesznek a szalamandra tipikus végtag-regenerációjában . Azt találták, hogy a makrofágok szalamandra eltávolítása a végtagok regenerációjának kudarcát és hegesedést eredményezett.
Szerep a vas homeosztázisban
Amint fentebb leírtuk, a makrofágok kulcsszerepet játszanak a haldokló vagy elhalt sejtek és sejttörmelékek eltávolításában. Az eritrociták átlagos élettartama 120 nap, ezért a lépben és a májban lévő makrofágok folyamatosan elpusztítják őket. A makrofágok a makromolekulákat is elnyelik , így kulcsszerepet játszanak a parenterális vasak farmakokinetikájában .
A hemoglobinból felszabaduló vas vagy belsőleg a ferritinben raktározódik, vagy a ferroportinon keresztül kerül a keringésbe . Azokban az esetekben, amikor a szisztémás vasszint megemelkedik, vagy ha gyulladás van jelen, a megemelkedett hepcidinszint a makrofágok ferroportincsatornáira hat, ami a vas maradásához vezet a makrofágokban.
Szerepe a pigmentmegtartásban
A melanofágok a szövetekben rezidens makrofágok egy részhalmaza, amely képes felszívni a szervezetben natív vagy exogén (például tetoválás ) pigmentet az extracelluláris térből. Ezzel szemben a dendritikus juncional melanociták , amelyek szintetizálása melanoszómákat és olyan különféle fejlődési szakaszaiban a melanophages csak halmozódik bekebelezett melanin lizoszómában-szerű fagoszómák. Ez ismétlődően előfordul, amikor az elhalt dermális makrofágokból származó pigmentet az utódaik fagocitizálják, így a tetoválás ugyanazon a helyen marad meg.
Szerep a szöveti homeosztázisban
Minden szövet saját, speciális rezidens makrofág-populációval rendelkezik, amelyek kölcsönös kapcsolatokat ápolnak a stromával és a funkcionális szövettel. Ezek a rezidens makrofágok ülők (nem vándorlóak), alapvető növekedési faktorokat biztosítanak a szövet fiziológiás működésének támogatásához (pl. makrofág-neuronális áthallás a bélben), és aktívan megvédhetik a szövetet a gyulladásos károsodásoktól.
Klinikai jelentősége
A fagocitózisban betöltött szerepük miatt a makrofágok az immunrendszer számos betegségében részt vesznek. Például részt vesznek a granulomák , gyulladásos elváltozások kialakulásában, amelyeket számos betegség okozhat. Leírtak például néhány, többnyire ritka, hatástalan fagocitózist és makrofágműködési rendellenességet.
Az intracelluláris kórokozók gazdájaként
Fagocita immunsejtként betöltött szerepükben a makrofágok felelősek azért, hogy elnyeljék a kórokozókat, hogy elpusztítsák azokat. Egyes kórokozók felforgatják ezt a folyamatot, és ehelyett a makrofágokban élnek. Ez olyan környezetet biztosít, amelyben a kórokozó el van rejtve az immunrendszer elől, és lehetővé teszi a szaporodást.
Az ilyen viselkedésű betegségek közé tartozik a tuberkulózis (a Mycobacterium tuberculosis által okozott ) és a leishmaniasis (a Leishmania fajok által okozott ).
Annak érdekében, hogy minimálisra csökkentsék annak lehetőségét, hogy egy intracelluláris baktérium gazdájává váljanak, a makrofágok olyan védekezési mechanizmusokat fejlesztettek ki, mint például a nitrogén-monoxid és a reaktív oxigén intermedierek indukciója, amelyek mérgezőek a mikrobák számára. A makrofágok azt a képességet is kifejlesztették, hogy korlátozzák a mikroba tápanyagellátását és autofágiát idézzenek elő .
Tuberkulózis
Miután bekebelezte egy makrofág, a tuberkulózis kórokozója, a Mycobacterium tuberculosis elkerüli a sejtes védekezést, és a sejtet használja a szaporodáshoz. A legújabb bizonyítékok arra utalnak, hogy a Mycobacterium tuberculosis tüdőfertőzésére válaszul a perifériás makrofágok M1 fenotípussá érnek. A makrofág M1 fenotípust a pro-inflammatorikus citokinek (IL-1β, TNF-α és IL-6) fokozott szekréciója és a fertőzés eltávolításához elengedhetetlen megnövekedett glikolitikus aktivitás jellemzi.
Leishmaniasis
Egy makrofág általi fagocitózis hatására a Leishmania parazita egy fagocita vakuólumban találja magát. Normál körülmények között ez a fagocita vakuólum lizoszómává fejlődik, és a tartalma megemésztődik. A Leishmania megváltoztatja ezt a folyamatot, és elkerüli, hogy elpusztuljon; ehelyett otthont teremtenek a vakuólumban.
Chikungunya
Az ízületekben lévő makrofágok fertőzése helyi gyulladással jár a Chikungunya akut fázisa alatt és után (CHIKV vagy Chikungunya vírus okozza).
Mások
Az adenovírus (a rózsaszín szem leggyakoribb oka) látens maradhat a gazdamakrofágban, és a vírus a kezdeti fertőzés után 6-18 hónappal folytatódik.
Brucella spp. maradhat látens egy makrofág gátlása útján fagoszóma - lizoszóma fúzió; brucellózist (hullámos láz) okoz .
A Legionella pneumophila , a légionárius- betegség kórokozójaszintén a makrofágokon belül telepszik meg.
Szívbetegség
A makrofágok a domináns sejtek, amelyek részt vesznek az atherosclerosis progresszív plakkos lézióinak létrehozásában .
A makrofágok fokális toborzása az akut miokardiális infarktus kezdete után következik be . Ezek a makrofágok a törmelékek, apoptotikus sejtek eltávolítására és a szövetek regenerációjára való felkészülésre szolgálnak .
HIV fertőzés
A makrofágok szerepet játszanak a humán immundeficiencia vírus (HIV) fertőzésében is. A T-sejtekhez hasonlóan a makrofágok is megfertőződhetnek HIV-vel, és akár a vírus folyamatos replikációjának tárolójává is válhatnak az egész szervezetben. A HIV bejuthat a makrofágokba a gp120 CD4-hez és a második membránreceptorhoz, a CCR5-höz (egy kemokinreceptor) való kötődés révén. Mind a keringő monociták, mind a makrofágok a vírus tárolójaként szolgálnak. A makrofágok jobban képesek ellenállni a HIV-1 fertőzésnek, mint a CD4+ T-sejtek, bár a HIV-fertőzésre való fogékonyság különbözik a makrofág-altípusok között.
Rák
A makrofágok hozzájárulhatnak a tumor növekedéséhez és progressziójához azáltal, hogy elősegítik a tumorsejtek proliferációját és invázióját, elősegítik a tumor angiogenezist és elnyomják a daganatellenes immunsejteket. Az oxigénhiányos ( hipoxiás ) és nekrotikus daganatsejtekhez vonzódva elősegítik a krónikus gyulladást . A makrofágok által kibocsátott gyulladásos vegyületek, mint például a tumor nekrózis faktor (TNF)-alfa aktiválják a génváltó nukleáris faktor-kappa B-t . Az NF-κB ezután belép a tumorsejt magjába, és elindítja az apoptózist leállító fehérjék termelését, valamint elősegíti a sejtproliferációt és a gyulladást. Ezen túlmenően a makrofágok számos pro-angiogén faktor forrásaként szolgálnak, beleértve a vaszkuláris endoteliális faktort (VEGF), a tumor nekrózis faktor-alfát (TNF-alfa), a makrofágkolónia-stimuláló faktort (M-CSF/CSF1) és az IL-1-et és az IL-t. -6 tovább járulva a daganat növekedéséhez. Kimutatták, hogy a makrofágok számos daganatba beszivárognak. Számuk bizonyos rákos megbetegedések rossz prognózisával korrelál, beleértve a mell-, méhnyak-, húgyhólyag-, agy- és prosztatarákot. Úgy gondolják, hogy a tumorhoz kapcsolódó makrofágok (TAM) M2 fenotípust szereznek, hozzájárulva a tumor növekedéséhez és progressziójához. Egyes daganatok olyan faktorokat is termelhetnek, mint például az M-CSF/CSF1, MCP-1/CCL2 és az angiotenzin II , amelyek kiváltják a makrofágok amplifikációját és mobilizálását a daganatokban. A különféle vizsgálati modellekben végzett kutatások azt sugallják, hogy a makrofágok néha daganatellenes funkciókra is szert tehetnek. Például a makrofágok citotoxikus hatással rendelkezhetnek a tumorsejtek közvetlen elpusztítására; a T-sejtek és a makrofágok együttműködése is fontos a daganatok visszaszorításában. Ez az együttműködés nemcsak a T-sejt és a makrofág közvetlen érintkezését jelenti az antigénprezentációval, hanem magában foglalja a citokinek megfelelő kombinációinak kiválasztását is, amelyek fokozzák a T-sejt daganatellenes aktivitását. A legújabb tanulmányi eredmények azt sugallják, hogy az IFN-α expressziójának kikényszerítésével a tumorba infiltráló makrofágokban lehetséges tompítani a veleszületett protumorális aktivitásukat, és átprogramozni a tumor mikrokörnyezetét a hatékonyabb dendritesejt-aktiváció és az immuneffektor sejt citotoxicitása felé. Ezenkívül a tumort elvezető nyirokcsomókban lévő szubkapszuláris sinus makrofágok elnyomhatják a rák progresszióját azáltal, hogy megakadályozzák a daganatból származó anyagok terjedését.
Rákterápia
A kísérleti vizsgálatok azt mutatják, hogy a makrofágok minden terápiás módot befolyásolhatnak, beleértve a műtétet , a kemoterápiát , a sugárterápiát , az immunterápiát és a célzott terápiát . A makrofágok pozitívan és negatívan is befolyásolhatják a kezelési eredményeket. A makrofágok többféleképpen védhetnek: eltávolíthatják az elhalt daganatsejteket (a fagocitózisnak nevezett folyamat során ) olyan kezeléseket követően, amelyek elpusztítják ezeket a sejteket; egyes rákellenes gyógyszerek gyógyszerraktáraiként szolgálhatnak; bizonyos terápiákkal is aktiválhatók a daganatellenes immunitás elősegítése érdekében. A makrofágok több szempontból is károsak lehetnek: például elnyomhatják a különféle kemoterápiákat, sugárterápiákat és immunterápiákat. Mivel a makrofágok szabályozhatják a tumor progresszióját, jelenleg terápiás stratégiákat tesztelnek e sejtek számának csökkentésére vagy fenotípusaik manipulálására rákos betegeken. Azonban a makrofágok is részt vesznek az antitest által közvetített citotoxicitásban (ADCC), és ez a mechanizmus fontosnak bizonyult bizonyos rák immunterápiás antitestek esetében.
Elhízottság
Megfigyelték, hogy az elhízott zsírszövetben a gyulladást elősegítő makrofágok megnövekedett száma hozzájárul az elhízás szövődményeihez, beleértve az inzulinrezisztenciát és a 2-es típusú cukorbetegséget.
Ezért a zsírszöveti makrofágok gyulladásos állapotának modulálása lehetséges terápiás célpontnak tekinthető az elhízással összefüggő betegségek kezelésében. Bár a zsírszöveti makrofágok szimpatikus beidegzéssel gyulladásgátló homeosztatikus szabályozásnak vannak kitéve, az ADRB2 génkiütött egerekkel végzett kísérletek azt mutatják, hogy ez a hatás közvetetten a zsírsejtek működésének modulációján keresztül fejtik ki, nem pedig a béta-2 adrenerg receptor közvetlen aktiválásán keresztül, ami arra utal, hogy az adrenerg a makrofágok stimulálása elégtelen lehet ahhoz, hogy befolyásolja a zsírszövet gyulladását vagy az elhízás működését.
Belül a zsír ( zsírszövet ) szövetébe CCR2 -hiányos egerek , van egy nagyobb számú eozinofilek , nagyobb alternatív makrofág aktiváció, és hajlamosak felé 2. típusú citokin expressziót. Ezenkívül ez a hatás eltúlzott volt, amikor az egerek elhíztak a magas zsírtartalmú étrendtől. Ezt részben a zsírsejtek ( zsírsejtek ) nekrózisa által kiváltott makrofágok fenotípusváltása okozza . Egy elhízott egyedben egyes zsírsejtek felrobbannak és nekrotikus halálon mennek keresztül, ami a lakóhelyi M2 makrofágokat M1 fenotípusra váltja át. Ez az egyik oka az elhízással összefüggő alacsony fokú szisztémás krónikus gyulladásos állapotnak.
Bél makrofágok
Bár szerkezetükben nagyon hasonlóak a szöveti makrofágokhoz, a bélrendszeri makrofágok sajátos jellemzőket és funkciókat alakítottak ki természetes környezetüknek köszönhetően, amely az emésztőrendszerben található. A makrofágok és a bélmakrofágok nagy plaszticitással rendelkeznek, ami miatt fenotípusukat a környezetük megváltoztatja. A makrofágokhoz hasonlóan a bélmakrofágok is differenciált monociták, bár a bélmakrofágoknak együtt kell élniük a belekben lévő mikrobiómmal . Ez kihívást jelent, tekintve, hogy a bélben található baktériumokat nem ismerik fel „önmagukként”, és potenciális célpontjai lehetnek a makrofágok fagocitózisának.
A bélbaktériumok pusztulásának megakadályozása érdekében a bél makrofágjai alapvető különbségeket mutattak ki a többi makrofághoz képest. Elsősorban a bél makrofágok nem indukálnak gyulladásos reakciókat. Míg a szöveti makrofágok különféle gyulladásos citokineket, például IL-1-et, IL-6-ot és TNF-α-t szabadítanak fel, a bélrendszeri makrofágok nem termelnek vagy választanak ki gyulladásos citokineket. Ezt a változást közvetlenül a bél makrofágok környezete okozza. A környező bélhámsejtek TGF-β-t szabadítanak fel , ami a proinflammatorikus makrofágról a nem gyulladásos makrofágra való átalakulást idézi elő.
Annak ellenére, hogy a gyulladásos válasz lelassul a bél makrofágjaiban, a fagocitózis még mindig végbemegy. A fagocitózis hatékonysága nem csökken, mivel a bél makrofágjai képesek hatékonyan fagocitálni a baktériumokat, a S. typhimuriumot és az E. colit , de a bél makrofágjai továbbra sem szabadítanak fel citokineket, még fagocitózis után sem. Ezenkívül a bél makrofágjai nem expresszálnak lipopoliszacharidot (LPS), IgA vagy IgG receptort. Az LPS-receptorok hiánya fontos a bél számára, mivel a bélmakrofágok nem észlelik a bélmikrobióma mikrobákkal kapcsolatos molekuláris mintázatait (MAMPS/PAMPS) . Nem expresszálnak IL-2 és IL-3 növekedési faktor receptorokat sem.
Szerep a betegségekben
Kimutatták, hogy a bél makrofágjai szerepet játszanak a gyulladásos bélbetegségben (IBD), például a Crohn-betegségben (CD) és a fekélyes vastagbélgyulladásban (UC). Egészséges bélben a bélben a makrofágok korlátozzák a gyulladásos választ a bélben, de kóros állapotban a bél makrofágok száma és diverzitása megváltozik. Ez a bélgyulladáshoz és az IBD betegség tüneteihez vezet. A bél makrofágjai kritikus szerepet játszanak a bél homeosztázisának fenntartásában . A gyulladás vagy kórokozó jelenléte megváltoztatja ezt a homeosztázist, és ezzel egyidejűleg megváltoztatja a bél makrofágjait. Még nem létezik egy meghatározott mechanizmus a bél makrofágjainak megváltoztatására új monociták felvételével vagy a már meglévő bélmakrofágok megváltoztatásával.
Média
Egy aktív J774 makrofág négy
konídiumot vesz fel kooperatív módon. A J774 sejteket 5 ng/ml interferon-y- vel kezeltük egy éjszaka a konídiumokkal való filmezés előtt. A megfigyeléseket 30 másodpercenként végezték 2,5 órán keresztül.Két igen aktív alveoláris makrofágok látható fogyasztásából konídiumok . Az időeltolódás 30 mp képkockánként 2,5 óra alatt.
Történelem
A makrofágokat először a 19. század végén fedezte fel Ilya Metchnikoff .
Lásd még
Hivatkozások
Külső linkek
- HIV és a makrofág Könyv a makrofágok szerepéről az AIDS patogenezisében
- A makrofágok szerepe a HIV patogenezisében
- Macrophages News Macrophages News az insciences szervezettől
- www.macrophages.com A Macrophage Community Website