Feokromocitóma - Pheochromocytoma
| Pheochromocytoma | |
|---|---|
| Más nevek | Phaeochromocytoma, mellékvese velős daganat, Chromaffin sejtdaganatok, Paraganglioma |
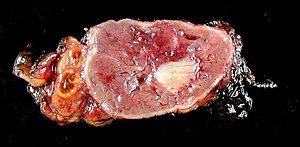 | |
| Normál maradék mellékvese (balra) feokromocitómával (jobbra) a mellékvese velővel | |
| Kiejtés | |
| Különlegesség | Endokrinológia , onkológia |
| Tünetek | Hypertonia , tachycardia , izzadás, fejfájás , sápadtság |
| Szövődmények | Hipertóniás válság |
| Diagnosztikai módszer | Megnövekedett plazma -mentes metanefrinek , plazma katekolaminok vagy vizelet -katekolaminok |
| Kezelés | Sebészet, kemoterápia, sugárzás és farmakológiai szerek |
| Frekvencia | 0,8 100 000 személyévenként |
A feokromocitóma ( PHEO vagy PCC ) a mellékvese ritka daganata, amely kromaffin sejtekből , más néven feokromocitákból áll. Ha a daganat, amely ugyanazon sejtekből áll, mint a feokromocitoma, a mellékvesén kívül fejlődik ki, azt paragangliomának nevezik . Ezek a neuroendokrin daganatok képesek hatalmas mennyiségű katekolamin , metanefrin vagy metoxi -tiramin termelésére és felszabadítására , amelyek a leggyakoribb tüneteket eredményezik, beleértve a magas vérnyomást (magas vérnyomás), a tachycardiát (gyors szívverés) és a diaphoresist (izzadás). Mindazonáltal ezek a daganatok nem mindegyike fog kiválasztani katekolaminokat. Azokat, amelyeket nem, biokémiailag csendesnek neveznek, és túlnyomórészt a fejben és a nyakban találhatók . Míg a biokémiailag csendes betegségben szenvedő betegek nem szenvednek a fent leírt tipikus betegség megnyilvánulásaitól, a daganatok növekednek és összenyomják a fej és a nyak környező struktúráit, és pulzáló fülzúgást (fülcsengést), halláskárosodást, hallás telítettséget okozhatnak. nehézlégzés (nehézlégzés) és rekedtség. Míg a fej és a nyak daganatai paraszimpatikusak, szimpatikus társaik túlnyomórészt a hasban és a medencében helyezkednek el, különösen Zuckerkandl szervében .
jelek és tünetek
A feokromocitóma jelei és tünetei a szimpatikus idegrendszer hiperaktivitásával kapcsolatosak . A klasszikus hármas közé tartozik a fejfájás (valószínűleg magas vérnyomással vagy magas vérnyomással összefüggésben ), tachycardia /emelkedett pulzusszám és diaphoresis (túlzott izzadás, különösen éjszaka, más néven hyperhidrosis ). A betegek azonban nem valószínű, hogy folyamatos tüneteket tapasztalnak. A katekolamin szintézisének és felszabadulásának paroxizmális jellege miatt a betegek "támadásokat" vagy "varázslatokat" tapasztalhatnak, ahol hirtelen elárasztják őket a daganat jelei és tünetei. A támadások spontán (figyelmeztetés nélkül) történhetnek, vagy különféle gyógyászati szerek, élelmiszerek, intraoperatív tumor manipuláció, intubálás vagy érzéstelenítés indukálása által kiválthatók .

| Életmód | Gyógyszerek | Diéta |
|---|---|---|
| Fizikai megterhelés | Hisztamin | Sajt |
| Szorongás/stressz | Metoklopramid | Erjesztett bor/sör |
| Trauma/Fájdalom | Glükagon | Paradicsom |
| Vizelés | ACTH | Kávébab |
Míg a fenti tünetek klasszikusak, más gyakori klinikai megnyilvánulásokról is beszámoltak, és ezek (nem különös sorrendben)
- Sápadtság
- Hő intolerancia
- Fogyás
- Mellkasi és/vagy hasi diszkomfort
- Hányinger / hányás
- Székrekedés
-
Ortosztatikus hipotenzió
- Orvosilag úgy definiálják, hogy a szisztolés vérnyomás (felső szám) 20 Hgmm -es csökkenése vagy a diasztolés vérnyomás (alsó szám) 10 Hgmm -es csökkenése a fekvő- vagy ülőhelyzetből álló helyzetbe történő váltás után
- Fájdalom vagy szédülés érzése a gyors pozícióváltás után
- Pszichiátriai megnyilvánulások
- Szorongás , pánikrohamok , idegesség, remegés
- Hyperglykaemia (magas vércukorszint)
Szövődmények
Míg a feokromocitóma tünetei meglehetősen gyakoriak, a betegséget "nagy mimikának" nevezik. A szakirodalom szerint a magas vérnyomásban szenvedő betegek mindössze 0,1% -ánál diagnosztizálják ezt a ritka endokrin rendellenességet, és a tünetekkel járó betegeket gyakran összetévesztik sokkal gyakoribb betegségekkel. Mivel a tünetek gyakran paroxizmálisak (epizodikusak/szórványosak), a betegek nem azonnal keresik a kezelést, mivel a probléma "magától eltűnik". Továbbá, ha a képen az ideális klinikai forgatókönyv (egy idősebb nőt közepén 50-es évek), a spontán rohamok kipirulás, izzadás és a szapora szívverés lehet összetéveszteni a menopauza előtti kapcsolódó hot-villog . A nem kezelt feokromocitóma veszélyes, és súlyos szövődményekhez vezethet, beleértve a halált is. A kardiovaszkuláris rendszer a leggyakrabban érintett.
Szív-és érrendszer
- Hipertóniás válság : A feokromocitómával összefüggő hipertóniás vészhelyzetek az egyik legfélelmetesebb klinikai megnyilvánulás. A támadások véletlenszerűek, és előfordulhatnak másodlagosan a kiváltó okok miatt (lásd a fenti jeleket és tüneteket), vagy spontán módon a katekolamin -túlfeszültség után. Az uralkodó tünet a megnövekedett szisztolés vérnyomás (> 200 Hgmm), amely nem reagál a hagyományos kezelési rendre, és fenyegeti a végszerv károsodását . A betegek azonnali, életmentő kezelést igényelnek, hogy megelőzzék más szervek további károsodását és/vagy halálát.
- Miokardiális ischaemia /infarktus: A szívrohamot gyakran a plakkok jelentős felhalmozódása ( érelmeszesedés )okozzaa koszorúerekben . A feokromocitómás betegek szívinfarktusban szenvednek, annak ellenére, hogy a plakkok felhalmozódása általában hiányzik, ami a miokardiális infarktus eltérő mechanizmusára utal. A jelenlegi kutatások azt feltételezik, hogy a daganat hatalmas mennyiségű katekolaminot választ ki, amelyek közvetlenül kölcsönhatásba lépnek a szívizom (szív) szöveteivel, és negatív hatásokat fejtenek ki, beleértve az oxigénhiányt, ami gyorsabb hegesedéshez és sejthalálhozvezet.
- Mérgező szívizomgyulladás : Még a szívizom károsodása nélküli betegeknél is a katekolaminok túlzott mennyisége kóros ST változásokat eredményezhet az EKG -n . A feltételezések szerint a norepinefrin (katekolamin) károsítja a szívszövetet, mivel gátolja a koszorúér -véráramlást és megfosztja a sejteket az oxigéntől, és így ischaemiás szövetet eredményez. Szerencsére a daganat kivágását és a katekolaminok későbbi elfojtását követően a károsodás visszafordíthatónak bizonyult.
- Kardiomiopátia : A feokromocitómákat a kardiomiopátia különböző típusaiban, köztük (myocarditis, lásd fent), a tágult kardiomiopátia és a stressz által kiváltott vagy Takotsubo kardiomiopátia okozza . A többi kardiovaszkuláris szövődményhez hasonlóan a katekolamin-felesleg felelős a megnövekedett szívizomterhelésért és a jelentős élettani stresszért. A jelenlegi szakirodalom azt mutatja, hogy a katekolamin által okozott károsodás nagy része reverzibilis, ezáltal megerősítve a korai és pontos diagnózis érvét a szív átalakulása és a további pusztulás megakadályozása érdekében.
- Ritmuszavarok : A szinuszos tachycardia a leggyakoribb rendellenes szívritmus, amely feokromocitómával társul, és a betegek "remegő szív" érzésként vagy szívdobogásként élik meg. Sok más tachyarrhythmiát (gyors szívverés) is jelentettek.
Idegrendszer
- Cerebrovaszkuláris baleset (stroke): Több jelentés részletes átmeneti ischaemiás rohamokat vagy stroke -ot mutatott feokromocitómás betegeknél. Egy 130, feokromocitómás beteg bevonásával végzett vizsgálatban 7 betegnél diagnosztizáltak átmeneti iszkémiás rohamot (a neurológiai hiány teljesen megszűnt), és 3 betegnél tapasztaltak stroke -ot tartós tünetekkel.
- Fejfájás : A fejfájás a feokromocitóma egyik alapvető klinikai megnyilvánulása, és gyengítő fájdalmat okozhat. A vizsgált betegek többsége arról számolt be, hogy fájdalma hirtelen, figyelmeztetés nélkül kezdődött és véget ért, és a fájdalmat súlyos, kétoldalú lüktetésnek minősítette (bár a súlyossági skálát nem tették közzé). Míg a vizsgált betegek 71% -a fejfájásról számolt be, az érintett betegek valamivel több mint 20% -a támogatta a kapcsolódó hányingert , hányást, fotofóbiát vagy fonofóbiát , amelyek jellemzően migrénhez kapcsolódnak.
Húgyúti rendszer
- Akut veseelégtelenség : Számos jelentéselsődleges tünete arészletes rabdomiolízis (vázizomzat gyors lebomlása), amely akut vesekárosodáshoz és átmeneti dialízis szükségességéhezvezet a nem diagnosztizált feokromocitómás betegeknél. A veseelégtelenséget katekolamin által kiváltott izomsérülés okozza. A norepinefrin az erek szűkületét okozza, ezáltal korlátozza a véráramlást és iszkémiát okoz.
Többszervi diszfunkció szindróma (MODS) : A fokozott gyulladásos válasz okozza, hogy a többszörös szervi diszfunkció súlyos, életveszélyes vészhelyzet, és az érintett rendszerek száma alapján növekszik a halálozás. A feochromocytoma-hoz kapcsolódó MODS több szervi elégtelenséghez, több mint 40 Celsius fokos hipertermiához , neurológiai megnyilvánulásokhoz és kardiovaszkuláris instabilitáshoz kapcsolódik, ami hipo vagy magas vérnyomást eredményez. A hipertóniás válsággal ellentétben a pheochromocytoma-hoz kapcsolódó MODS nem reagál a hagyományos alfa-receptor szerekre, és szükség lehet sebészeti kivágásra, ha nem érik el a klinikai stabilitást.
Genetika
A jelenlegi becslések szerint az összes feokromocitóma 40% -a öröklött csíravonal -érzékenységi mutációhoz kapcsolódik. A daganatok fennmaradó 60% -ában több mint 30% szomatikus mutációhoz kapcsolódik . Tekintettel a genetikai öröklődéssel való nagy összefüggésre, az Egyesült Államok Endokrin Társasága azt javasolja, hogy minden feokromocitómával diagnosztizált beteg vizsgálja meg a genetikai tanácsadót, hogy fontolja meg a genetikai vizsgálatot . A legfrissebb adatok azt mutatják, hogy 25 feokromocitóma -érzékenységi gén létezik; azonban csak 12-et ismerünk el egy jól ismert szindróma részeként. A feokromocitómás betegek genetikai állapotának meghatározása döntő fontosságú - minden gén más mintázatban öröklődik, és a betegség sajátosságaival jár együtt, és kedvezőbben reagálhat bizonyos kezelési lehetőségekre. Ezenkívül a korai azonosítás útmutathatja az orvosokat a feokromocitómás betegek első fokú rokonainak szűrési javaslataihoz. Jelenleg nincs egyetértés abban, hogy hogyan és mikor kell értékelni a tünetmentes hordozókat (olyan személyt, akinek genetikai változata van a feokromocitómával kapcsolatban, de nincsenek jelenlegi bizonyítékai a betegségről). A beteggel és a szolgáltatójával egyéni szinten kell beszélgetni, hogy személyre szabott szűrési tervet dolgozzanak ki, amely váltakozik a biokémiai (vérvizsgálat) értékelés és az egész test képalkotása között a betegség progressziójának nyomon követése érdekében.
Gyermekgyógyászati szempontok
További gyakorlatok segíthetnek fenntartani a kiskorú érzelmi és pszichológiai jólétét. A szűrés magában foglal egy multidiszciplináris csapatot ( endokrinológus , onkológus , pszichológus , genetikus , szülő és gyermek), ahol az elsődleges cél a gyermek támogatása.
- A család által megfigyelt ünnepi napokon végzett tesztek pozitív eredménye elfedheti a jövőben az ezekhez az eseményekhez kapcsolódó boldogságot.
- Egy -egy gyermek testvér tesztelése lehetővé teszi a család számára, hogy szűkítse figyelmét az eredmények visszaadásakor, és támogassa minden testvért egyénileg.
- A negatív eredmény felboríthatja a gyermeket, ha testvére pozitív volt; hasznos lehet a kérdések feltevése és az eredmények feldolgozása.
Örökletes szindrómák
Az alábbi táblázat (ok) részletesen ismertetik a jól ismert örökletes pheochromocytoma génváltozatok klinikai jellemzőit
| Gén | Öröklés | Áthatolás | Áttétes potenciál | 1 o A betegség jellemzői | |
|---|---|---|---|---|---|
| FÉRFI2 | RET | Autoszomális domináns | 40–50% | <5% | Medullaris pajzsmirigy karcinóma , hyperparathyreosis , marfanoid habitus, feokromocitóma |
| VHL | VHL | 10-30% | 5% | Vesesejtes karcinóma , hasnyálmirigy NET , retina és központi idegrendszeri hemangioblastoma , feokromocitóma | |
| NF1 | NF1 | 1–5% | 12% | Neurofibromák , cafe-au-lait makula , lisch csomók , kognitív károsodás, feokromocitóma |
MEN2 (többszörös endokrin neoplazia-2); VHL (von-Hippel Lindau); NF1 (Neurofibromatosis-1); NET (neuroendokrin tumor); CNS (központi idegrendszer)
| Gén | Öröklés | Áthatolás | Áttétes potenciál | 1 o A betegség jellemzői | |
|---|---|---|---|---|---|
| PGL1 | SDHD | Autoszomális domináns | 90% | <5% | Fej és nyak paraganglioma, feokromocitóma, gyomor -bél sztróma daganat |
| PGL2 | SDHAF2 | 100% | Alacsony | Fej és nyak paraganglioma | |
| PGL3 | SDHC | Autoszomális domináns | Következetlen | Következetlen | Feokromocitóma, fej és nyak paraganglioma, gyomor -bél sztróma daganat |
| PGL4 | SDHB | 30–50% | 30–70% | Fej és nyak paraganglioma, feokromocitóma, gyomor -bél sztróma daganat | |
| PGL5 | SDHA | 10–15% | Alacsony | Feokromocitóma, fej és nyak paraganglioma, gyomor -bél sztróma daganat |
SDHx (szukcinát -dehidrogenáz x alegység)
| Öröklés | Áthatolás | Áttétes potenciál | 1 o A betegség jellemzői | |
|---|---|---|---|---|
| MAX | Autoszomális domináns | Következetlen | <5% | Kétoldalú feokromocitóma |
| TMEM127 | Következetlen | Alacsony | Feokromocitóma, fej és nyak paraganglioma |
MAX (MYC kapcsolódó X faktor); TMEM127 (transzmembrán fehérje 127)
Más génváltozatok
Számos publikált esetjelentés érkezett más, ritka feokromocitómával kapcsolatos érzékenységi génekről:
-
Pacak-Zhuang szindróma
- Hypoxia által indukálható 2-es alfa-faktor ( HIF2A )
- Policitémia
- Duodenális szomatostatinoma
- Retina és choroidal vascularis elváltozások
- Paraganglioma/feokromocitóma
- Feokromocitóma és a csont
óriássejtes daganata
- H3 hiszton, 3A család ( H3F3A ), poszt-zigóta G34W
- Pheochromocytoma/Paraganglioma
-
Carney Triad
- Emésztőrendszeri stromális daganat
- Tüdő chondroma
- Paraganglioma
- Carney-Stratakis szindróma
- Emésztőrendszeri stromális daganat
- Paraganglioma
Számos további génváltozatot írtak le, de a közölt információk következetlenek, és nem született konszenzus a közösségben, ha ezek a mutációk valóban feokromocitóma -érzékenységi gének.
Diagnózis
Differenciális
Ha a páciens rendelkezik a feokromocitóma jellegzetes jeleivel és tüneteivel, és úgy dönt, hogy további biokémiai (vérvizsgálat) vizsgálatot folytat, a differenciáldiagnózis fontos, mivel valószínűbb, hogy a feokromocitóma más, mint a relatív gyakorisága 0,8 100 000 személyévenként.
| Endokrin | Szív- és érrendszer | Idegi | Pszichiátriai | Egyéb |
|---|---|---|---|---|
| Hyperthyreosis | Szív elégtelenség | Migrén | Szorongás | Porphyria |
| Karcinoid szindróma | Ritmuszavarok | Agyvérzés | Pánikbetegség | Gyógyszerek |
| Hipoglikémia | Ischaemiás szívbetegség | Epilepszia | Anyaghasználat | |
| Menopauza szindróma | Baroreflex kudarc | Meningioma | Tény rendellenesség | |
| Medullaris pajzsmirigy karcinóma | - | EDÉNYEK | - |
Megjegyzések
Biokémiai értékelés
Aranystandard
A fehromromocitóma arany standard diagnózisának a megemelkedett plazmamentes metanefrineket tekintik. Több mint 10 tanulmány megerősítette, hogy a teszt érzékenysége és specificitása 97%, illetve 93%; azonban továbbra is aggodalomra ad okot a téves pozitív eredmények a helyes klinikai forgatókönyvben. A feokromocitóma biokémiai elemzésének értelmezésekor a szolgáltatónak nagy figyelmet kell fordítania a (1) gyűjtési feltételekre, (2) a beteg által szedett összes gyógyszerre és (3) az étrendjére.
- Gyűjtési feltételek: Sok rutinszerű laboratóriumi vizsgálattal ellentétben, amelyeket egy pillanat alatt le lehet rajzolni, számos ajánlást kell követni az ideális körülmények és a pontos minta biztosítása érdekében. A jelenlegi kutatások azt mutatják, hogy a vérvizsgálatot csak azután szabad elvégezni, ha a beteg 30 percig feküdt ( feküdt a hátán) a gyűjtés előtt. Ebben a forgatókönyvben speciális fekvő referenciaértékeket kell használni. Ezeknek a feltételeknek a biztosítása nehéz, és a legtöbb intézményben költséges lehet. Ezekben az esetekben a pihent, fekvő helyzetben végzett húzás megismételhető pozitív eredményt követően ülő helyzetben a hamis pozitív eredmények kiküszöbölése érdekében.
- Gyógyszerészeti interferencia: Sok recept, over-the-counter , és a tiltott anyagok zavarhatják a megfelelő beszedése plazma metanephrinnek és vezet hamis pozitív eredményt. A szolgáltatóknak részletesen át kell tekinteniük a beteg gyógyszereinek listáját, és meg kell vitatniuk, ha lehetséges a zavaró gyógyszerek ideiglenes felfüggesztése. A leggyakrabban jelentett gyógyszerek, amelyek hamisan megemelt metanefrineket eredményeznek, a következők: β-adrenoreceptor-blokkolók , fenoxi-benzamin , triciklikus antidepresszánsok , monoamin-oxidáz inhibitorok , szerotonin-norepinefrin-újrafelvétel-gátlók ( SNRI ) és metildopa . Mivel ezeknek a gyógyszereknek a többségét általában pszichiátriai állapotokra írják fel, szükség lehet egy beszélgetésre a felíróval, hogy megkönnyítse az alternatív terápiás lehetőségeket, miközben a páciens feokromocitóma értékelése alatt áll. Miután minden lehetséges vényköteles gyógyszert felfüggesztettek, fontos felülvizsgálni a vény nélkül kapható gyógyszereket/kiegészítőket, valamint az általánosan használt acetaminofent és pszeudoefedrint, amelyek hamis emelkedést okoznak a metanefrinben. Végezetül fontos, hogy nyílt, megítélés nélküli vitákat folytassunk a beteg rekreációs szerek használatáról. Az amfetaminok , a nikotin és a kokain jelentős plazma norepinefrinszintet eredményezhetnek.
- Életmód és étrend: A legtöbb laboratóriumi munkához hasonlóan a betegnek tartózkodnia kell az evéstől (böjtöléstől) a gyűjtést megelőző éjszaka éjfél után. Vannak azonban további, a metanefrinek gyűjtésére vonatkozó ajánlások is, beleértve a nikotintól, alkoholtól és a testmozgástól való tartózkodást legalább 12 órán keresztül a laboratóriumi sorsolás előtt. A betegeknek legalább 24 órával a gyűjtés előtt kerülniük kell a katekolamin-tartalmú ételeket (gyümölcsöket, gyümölcsitalokat, csokoládét, koffeint, paradicsomot, babot, diót és burgonyát).
Bár a fenti (3) feltételek valószínűleg hamis pozitív eredményekhez járulnak hozzá, ha nem ellenőrzik őket, a normál felső referenciahatár 3-4-szeresénél nagyobb értékeket pheochromocytoma diagnosztikának kell tekinteni.
Alternatív tesztek
A huszonnégy órás metanephrines vizelettel elfogadható alternatíva, ha a plazmateszt nem áll rendelkezésre. Egyéb kiegészítő biomarkerek hasznos lehet, hogy segítse a diagnózis phaeochromocytoma is, leginkább figyelemre méltó az kromogranin . A feokromocitómás betegekben a megemelkedett katecholaminok specifitásával összehasonlítva a kromogranin A nem specifikus polipeptid, amely magas a különböző neuroendokrin tumorokban. Egy 2006 -os olaszországi jelentés azonban azt találta, hogy a vizsgált feokromocitómás betegek több mint 90% -a emelkedett kromogranin A -szintet mutatott. Ha a metanefrin értékei kétértelműek, a kromogranin A használható kiegészítő markerként a tumor jelenlétének előrejelzésére.
A határmenti emelkedett metanefrinek diagnosztikai kihívást jelentenek az orvos számára - az első lépés a laboratóriumok megismétlése, extra óvintézkedések megtétele a fent leírt arany standard diagnózis követése érdekében, beleértve a gyűjtés körülményeit, a gyógyszerészeti beavatkozásokat, valamint az esetleges lehetséges étrendi és életmódbeli szokásokat. módosítsa az eredményeket. Ha a szabálysértő gyógyszereket nem lehet abbahagyni, vagy az ismételt laboratóriumok változatlanok maradnak, fontolja meg a klonidin -szuppresszió teszt alkalmazását. Az 1970 -es években a klonidin -hidroklorid gyógyszer a magas vérnyomás új szereként söpörte be a piacot ; azonban a jelentett mellékhatások ( hányinger , hányás , álmosság , szem- és szájszárazság, székrekedés és általános gyengeség) korlátozzák a megfelelést, és jelentősen csökkentik az előírásokat. Míg a klonidin mellékhatásai kényelmetlenek, a klonidin legveszélyesebb aspektusa a visszavonásos rebound hipertónia - vagyis a gyógyszer hirtelen abbahagyása esetén a vérnyomás gyorsan visszatérhet vagy meghaladhatja az eredeti értéket. Egy egyszeri, súlyalapú adag azonban korlátozott körülmények között alkalmazható a betegség állapotának meghatározásához. Éjszakai böjt után a páciens bemutatja a vizsgálati helyét a metanephrines vérvétel és a klonidin beadásához. (3) órán át fekve maradnak, és ismételt vérvételt vesznek. Pozitív eredmény (feokromocitóma jelzése) következik be, ha a plazma metanefrin szintje magas marad a klonidin beadása után. Ha az eredmények megegyeznek vagy csökkennek, a teszt negatív, és a betegnek nincs feokromocitómája. Fontos megjegyezni, hogy ha a páciens nem rendelkezik feokromocitómával, a klonidint követően rendkívül alacsony vérnyomás alakulhat ki . A vizsgálatot követően a betegeknek nem szabad magukra hagyatkozniuk a szállítás során.
A plazma -metoxitiramin a katekolamin, a dopamin bomlásterméke . A fej és a nyak paragangliómái általában dopamint választanak ki, de "biokémiailag csendesnek" nevezik őket, mivel nem okozzák a feokromocitómához kapcsolódó jellegzetes tüneteket. A metoxi -tiramin azonban felhasználható a fej és a nyak daganatainak kimutatására. További kutatások azt mutatják, hogy a biomarker a metasztatikus betegség hasznos mutatója is - ez az egyetlen jelenlegi biokémiai bizonyíték a metasztázisokra.
Biokémiai fenotípusok
Míg a diagnosztikai, laboratóriumi értékek fontos információkat is nyújthatnak az orvosoknak a tumor típusáról, helyéről, méretéről és a kapcsolódó genotípusról . Vannak (3) fontos, jól elismert biokémiai fenotípusok, amelyeket az egészségügyi szolgáltatók felhasználhatnak a betegellátás irányítására.
-
Adrenergikus ( epinefrin és metanefrin )
- Nagyobb valószínűséggel mellékvese daganatot jelez
- Ha a metanephrin plazmaszintjét a normetanefrin és a metanephrin együttes szintjének több mint 15% -ára emelték, akkor előre jelezhető a mellékvese daganata vagy a már kivágott mellékvese daganat kiújulása.
- A betegek nagyobb valószínűséggel jelentkeznek a fent leírt klasszikus, paroxizmális (epizodikus) tünetekkel
-
Noradrengeric ( norepinefrin és normetanefrin )
- Valószínűbb, hogy mellékvese-daganatot jelez
- A betegek nagyobb valószínűséggel mutatnak folyamatos, tartós feokromocitómával kapcsolatos tüneteket ( magas vérnyomás és tachycardia ), mint azok, amelyek klasszikusan adrenerg fenotípusúak.
- Gyakori a von-Hippel Lindau és a szukcinát-dehidrogenáz X alegység genetikai változataiban szenvedő betegeknél
-
Dopaminerg ( dopamin és 3-metoxitiramin)
- Valószínűbb, hogy a fej és a nyak mellékvese daganatát jelzi
- A betegek nagyobb valószínűséggel tünetmentesek; azonban nem specifikus jelei lehetnek az émelygésnek , a hányásnak , a hasi fájdalomnak, a hasmenésnek és a súlycsökkenésnek, ami a dopaminreceptorok stimulációjának következménye az egész gyomor-bél traktusban.
- Különösen gyakori a szukcinát -dehidrogenáz B alegység genetikai változataiban szenvedő betegeknél
Mind az adrenerg, mind a noradrenerg fenotípus esetében minél nagyobb a metanephrin és a normetanefrin plazma- vagy vizeletkoncentrációinak összege, annál nagyobb a várható tumorátmérő.
A tumor lokalizációja
Anatómiai képalkotás
Az anatómiai képalkotás számítógépes tomográfiára (CT) [CAT scan] vagy mágneses rezonancia képalkotásra (MR) utal . Ezek a képalkotási módszerek arra szolgálnak, hogy kezdetben lokalizálják a daganatot, és részletes információkat nyújtsanak a méretről, a morfológiáról és a szomszédos belső struktúrákhoz való szerkezeti viszonyról. Hagyományosan a páciens a feokromocitóma tüneteit mutatja be orvosának, ami biokémiai értékelést igényel. Ha az eredmény pozitív, a beteget CT vagy MR vizsgálat segítségével anatómiai képalkotásra irányítják. Mivel azonban az anatómiai képalkotás egyre könnyebben elérhetővé válik, a betegeket endokrinológushoz küldik, miután egy véletlenszerű (váratlan lelet) mellékvese csomót találtak egy más okból elrendelt vizsgálaton. Például az "M beteg" bemutatja a helyi sürgősségi osztályát hasi fájdalom miatt, és CT-t rendelnek a vakbélgyulladás kizárására; a radiológus azonban megjegyzi, hogy van egy 3,5 centiméteres jobb mellékvese.
Noha nem született konszenzus arról, hogy a CT vagy az MR a legelőnyösebb képalkotási módszer a feokromocitómában, mindegyik módszernek megvannak az erősségei és gyengeségei. Mivel a CT ionizáló sugárzásnak teszi ki a beteget, gyermekeknél és terhes nőknél előnyben részesítik az MR -t. Ezenkívül a CT-ben alkalmazott intravénás kontraszt vesekárosodást okozhat, ezért kerülni kell a már meglévő károsodásban szenvedő betegeknél. Mindazonáltal azok a betegek, akik hosszú ideig zárt térben tartózkodnak ( klausztrofóbia ), gyakran nem tolerálják az MR-t, mivel a gép zárva van a CT nyílt végű kialakításához képest. Amikor a betegek szorongni kezdenek és mozogni kezdenek a gépben, ez mozgásműterméket okoz, ami kevésbé fordul elő a CT-alapú képeken.
A CT -hez és az MR -hez képest az ultrahang nem előnyben részesített képalkotó módszer, és el kell kerülni a feokromocitómás betegeknél. Azonban bizonyos betegpopulációkban, ahol az ionizáló sugárzás elkerülése a legfőbb prioritás (gyermekek, terhes nők), az ultrahang kiegészítő módszerként használható, ha az MR esetleg nem érhető el, vagy a beteg nem tudja befejezni a vizsgálatot. Továbbá, ha heveny mellékvese vérzést gyanítanak egy feokromocitómás betegnél, az ultrahang gyors, fájdalommentes, sugárzásmentes és olcsó módszer az "első lépéshez", mielőtt a fenti képalkotási módszereket vagy műtétet alkalmazzák a diagnózis megerősítésére.
Funkcionális képalkotás
Az alább tárgyalt képalkotási módszerek a tumor jellemzésére, a metasztatikus betegség megerősítésére és a kezelés tervezésére vonatkoznak - nem a tumor lokalizációjának meghatározására vagy a sebészi csapat kivágásra való felkészítésére szolgálnak. A legtöbb feokromocitómás beteg esetében a funkcionális képalkotás CT -t vagy MR -t követ. Ha az anatómiai képalkotás csak mellékvese daganatot mutat be, anélkül, hogy bárhol a szervezetben betegségre utalna, és a metanefrin szintje nyilvánvalóan megemelkedik, a funkcionális képalkotás lemondhat az azonnali sebészeti kimetszés javára. Az elmúlt évtizedben öt funkcionális technikát alkalmaztak a feokromocitómás páciens értékelésére (1) 18F- fluorodezoxiglükóz- pozitron emissziós tomográfia ( 18 F-FDG PET ), amelyet általában PET-vizsgálatnak neveznek, (2) jód-123 meta- iodobenzylguanadine ( 123 I-MIBG), (3) 18F-flurodihydroxyphenylalanine ( 18 F- FDOPA ), (4) 68Ga-DOTA kapcsolt szomatosztatin analógok ( 68 Ga- DOTA ), (5) 11C-Hidroxi efedrin (HED-PET). Innentől kezdve ezekre a képalkotási módszerekre a zárójelben található rövidített nevükön hivatkozunk.

A feokromocitómás betegeknél az első funkcionális képalkotó technika 123 I- MIBG szcintigráfia volt (kép jobbra). Tekintettel a katekolamin- norepinefrinhez hasonló szerkezetű vegyületekre (feokromocitómák szekretálják), a MIBG jól alkalmas volt a legtöbb neuroendokrin tumor felvételére . Továbbá, ha a páciens pozitívnak bizonyult az MIBG -vizsgálaton, jogosult volt a MIBG -kezelésre, további lehetőségeket kínálva a széles körben áttétes betegségben szenvedők számára. A további vizsgálatok azonban azt mutatták, hogy míg a MIBG kitűnő volt a mellékvese-elváltozásokkal, sokkal kevésbé volt kiváló a mellékvese-paragangliómában szenvedő betegeknél, különösen olyan specifikus genetikai változatokkal, mint a szukcinát-dehidrogenáz X alegység ( SDHx). A pozitron emissziós tomográfiás vizsgálatok kifejlesztésekor az MIBG lassan elveszíti előnyét a feokromocitóma beteg számára.

A fent említett négy módszer közül a 18 F- FDG PET a leggyakoribb és legkönnyebben elérhető funkcionális képalkotó technika a legtöbb kórházi rendszerben, de a legkevésbé specifikus a neuroendokrin tumorokra (kép balra). 2012 -ben több mint 200 beteg vett részt egy olyan vizsgálatban, amely az akkori jelenlegi aranyszabványt (MIBG/CT/MRI) az új FDG PET -hez hasonlította. Funkcionális megfelelőjéhez képest az FDG felülmúlta a MIBG-t a lágyrész- és csontáttétek kimutatásában, nagyobb specificitással a biokémiailag aktív tumorokban szenvedő betegeknél.
Az FDG-PET kifejlesztését követően kezdtek megjelenni a neuroendokrin-specifikus PET-vizsgálatok. Az egyik első kedvező képalkotási módszer a 18 F- FDOPA volt , amely nagy érzékenységet mutatott a fej-nyak paragangliomák, valamint a nem áttétes betegségek észlelésében a fej és a nyak területén. Sajnos áttétes betegségek esetén, különösen a szukcinát-dehidrogenáz B alegység ( SDHB ) mutációival kapcsolatban, az 18 F- FDOPA rosszabb volt, mint a hagyományos FDG-PET. Azonban a betegek a genetikai variánsok egyéb phaeochromocytoma fogékonysági gének ( NF1 , VHL , RET ) 18 F- FDOPA vált a preferált radiogyógyászati szer.
A legújabb PET-módszer magában foglalja a második típusú szomatosztatin- receptor-képalkotást 68 Ga- DOTA analóggal. Az elmúlt évtizedben a további kutatások továbbra is azt mutatják, hogy ez a funkcionális képalkotási mód felülmúlja a klinikai forgatókönyvek széles skáláját, sőt felülmúlja az anatómiai képalkotást ( CT / MR ) szukcinát-dehidrogenáz ( SDHx) mutációjú gyermekeknél . Míg FDOPA következetlenül észlelt áttétes betegségben, 68 Ga- DOTA analógok bizonyították kiváló lokalizációját metasztatikus pheochromocytoma. Amikor közvetlenül összehasonlítva egy fej-fej vizsgálat 2019-ben, 68 Ga- DOTA analógok felülmúlta FDOPA, különösen a kimutatására áttételes csontelváltozások. A DOTA analógok további előnye a peptidreceptor radionuklid terápiával történő kezelés lehetősége, amelyet az alábbi kezelési részben tárgyalunk.
Ezenkívül a HED-PET pontos eszköznek bizonyult a feokromocitóma diagnosztizálására és kizárására bonyolult klinikai forgatókönyvekben, valamint az egyértelmű mellékvese-daganatok jellemzésére.
Menedzsment
Sebészet
A sebészeti reszekció az egyetlen gyógyító lehetőség a feokromocitóma kezelésére 2019-től. A sikeres kimetszés multidiszciplináris erőfeszítés, amely magában foglalja az endokrinológust és a beteget a műtét előtt (az alábbiakban tárgyaljuk), valamint a műtéti csapatot és az aneszteziológust intraoperatívan. A fent említett csapatok közötti gyakori és megfelelő kommunikáció nélkül a kedvező eredmény sokkal nehezebb. Az Egyesült Államok Endokrin Társasága 2014 klinikai gyakorlati útmutatója a feokromocitóma kezelésére laparoszkópiás adrenalektómiát (minimálisan invazív technika) javasol a legtöbb mellékvese daganat számára, kivéve, ha azok invazívak vagy 6,0 cm -nél nagyobbak. Fontos megjegyezni, hogy a nagyobb daganatokat minimálisan invazív megközelítéssel is meg lehet próbálni, de a csapatnak készen kell állnia arra, hogy szükség esetén nyílt eljárásra térjen át. A nyitott eljárást (hagyományos sebészeti technika) jelenleg előnyben részesítik a mellékvese-betegségben, kivéve, ha a daganat kicsi, nem invazív és könnyen kezelhető helyen van. Míg a korábbi adatok azt jelzik, hogy szükség van egy minimálisan invazív megközelítésre rosszindulatú és/vagy áttétes betegség esetén, a jelenlegi kutatások szerint a sikeres műtét megvalósítható, és rövidebb kórházi tartózkodást eredményez. Az elmúlt évtized irodalma is bebizonyította, hogy a robottechnika sikeresen alkalmazható a mellékvese daganatok kezelésére .
Jellemzően teljes vagy teljes adrenalectomiát végeznek; azonban a "cortical sparing" -nek nevezett technika elhagyhatja a mellékvese maradványát (darabját) abban a reményben, hogy elkerülheti az egész életen át tartó szteroidpótlást, ha a bal és a jobb mellékveséket el kell távolítani. A kérdés különösen fontos betegeknél MEN és VHL - kapcsolódó betegség, amely nagyobb esélyt kétoldalú phaeochromocytomák. A mellékvese -szövet elhagyásának kockázata visszatérő betegség (a daganat visszatér). Egy 2019-es kohorsz-tanulmány arról számolt be, hogy annak ellenére, hogy 13% -ban ismétlődtek azok a betegek, akik agykérget kímélő adrenalectomiát végeztek a feokromocitóma miatt, nem csökkent a túlélés a teljes adrenalectomia társaikhoz képest.
A műtét előtti menedzsment
Vitathatatlanul a pheochromocytoma sebészeti terv legfontosabb része a megfelelő műtét előtti blokád. A katekolamin -felesleget szunnyadó vulkánként írták le, amely bármikor kész kitörni, és katasztrofális pusztítást okoz a szervezetben. Bár a kitörés bármikor bekövetkezhet, a leggyakoribb kiváltó tényezők közül kettő az érzéstelenítés és a közvetlen tumor -manipuláció, így a műtét az egyik legveszélyesebb időpont a feokromocitómás betegek számára, ha nincs megfelelően felkészülve. A katekolamin-válság megkerülése érdekében az Egyesült Államok Endokrin Társasága azt javasolja, hogy minden funkcionális (hormonálisan aktív) daganattal rendelkező beteget legalább hét nappal a műtét előtt kezdjenek műtét előtti alfa-adrenoceptor blokádba. A klinikai forgatókönyvetől függően számos gyógyszerezési lehetőség létezik, mindegyiknek megvan a maga erőssége és gyengesége.
Alfa blokád
Ha a beteg vérnyomása mérsékelten megemelkedik, akkor előnyös szelektív, rövid hatású alfa-1-adrenoreceptor-antagonista ( doxazozin , prazozin , terazozin ). A beteget azonban figyelmeztetni kell az " első adag jelenség " néven ismert lehetséges mellékhatásokra . Amikor a betegek kezdetben a fenti szerek valamelyikének vannak kitéve, fejfájásuk , szédülésük és hányingereik lehetnek , különösen akkor, ha ülő helyzetből álló helyzetbe kerülnek a vérnyomás gyors csökkenése miatt . Ezek a hatások idővel csökkenni fognak, de a szolgáltatók megpróbálhatják elkerülni őket, ha alacsony dózissal kezdik, és lassan növelik, amíg el nem érik a kívánt mennyiséget. Nem kontrollált magas vérnyomásban szenvedő betegeknél a nem szelektív alfa-1 és 2 adrenoceptor antagonistát ( fenoxi-benzamin ) kell alkalmazni. Sajnos a fent felsorolt szelektív szerekhez képest a fenoxi -benzamin sokkal drágább, és előfordulhat, hogy néhány beteg számára nem áll rendelkezésre. A gyakori mellékhatások közé tartozik a szájszárazság , az orrdugulás és a férfi ejakuláció károsodása , amelyek mindegyike nem szűnik meg idővel, és korlátozhatja a betegek megfelelőségét . Bár ritka, a betegek hormonálisan aktív feokromocitómában és normális vérnyomásban szenvedhetnek. Egy 2014-es összehasonlításból kiderült, hogy néhány embernél kis adag kalciumcsatorna-blokkoló (például amlodipin ) alkalmazható műtét előtt. Ez nem csökkenti drasztikusan a betegek vérnyomását és hipotenziót okoz , de segíti a sebészeket és az altatókat, ha a műtét során hemodinamikai instabilitás lép fel.
Béta -blokád
Fokozott pulzusszám ( tachycardia ) és szapora szívérzés ( szívdobogás ) következhet az alfa-adrenoceptor-antagonista kezelés megkezdése után . Ebben az esetben béta-adrenoceptor antagonistát írnak fel a pulzus szabályozására. Az alfa-antagonistákhoz hasonlóan vannak szelektív (béta-1) és nem-szelektív (béta-1 és béta-2) adrenoreceptor-antagonisták. A szelektív szerek ( atenolol , metoprolol ) előnyösebbek a nem szelektív szereknél ( propranolol ). Számos ( labetalol , karvedilol ) kombinált alfa-béta-adrenoceptor antagonista létezik . Ezeket a szereket lehetőleg kerülni kell, mivel hétszer nagyobb béta-adrenoreceptor antagonizmus van, mint alfa, ami súlyosbíthatja a magas vérnyomást és katekolamin-krízishez vezethet.
Szövődmények
A béta -adrenoceptor antagonistákat nem szabad önmagukban fehromromocitómás betegeknek adni - ez súlyos következményekhez vezethet. 1995-ben egy londoni orvoscsoport leírta annak a személynek a halálát, akinél nemrégiben diagnosztizáltak feokromocitómát a propranolol , a nem szelektív béta-blokkoló kezelés megkezdése után . Gyorsan hipertóniás krízis alakult ki, ami sokkhoz , szívinfarktushoz , szívelégtelenséghez és sűrű jobb félvérzéshez vezetett . Az újraélesztési kísérletek ellenére a személy néhány nappal később meghalt. Ez a szövődmény összefügg az alfa- és béta-adrenoreceptor-antagonisták erekre gyakorolt hatásával, valamint a katecholaminok hatásával . A normál véredény nyitva van, lehetővé téve a megfelelő véráramlást. Amikor a katekolaminok aktiválják az alfa -receptort, az ér összehúzódik (kisebb lesz), ami magas vérnyomást eredményez . Amikor azonban a katekolaminok aktiválják a béta -receptort, az erek kitágulnak (megnagyobbodnak), és lehetővé teszik a fokozott véráramlást, csökkentve a vérnyomást. Ha egy feokromocitómás beteget csak béta-adrenoceptor antagonistával kezdenek kezelni, ez visszafordítja a védő értágulatot, és súlyosbítja a betegek magas vérnyomását.
Vita
Míg a fentebb tárgyalt, a műtét előtti alfa- és béta-blokádot túlnyomórészt az ellátás színvonalának ismerik el, különösen az Egyesült Államokban, nemzetközi szintű vita folyt, ha blokádra van szükség. 2017 -ben egy német kutatócsoport közzétett egy megfigyelési esetsorozatot, amely megkérdőjelezte a blokád jelenlegi ajánlásait. A tanulmány megvizsgálta az intraoperatív maximális szisztolés artériás nyomást alfa-adrenoceptor blokáddal rendelkező és anélkül szenvedő emberekben, és nem talált különbséget a két csoport közötti szövődményekben. A következő évben egy francia csoport hasonló cikket tett közzé, figyelmeztetve arra, hogy ne várjon egy egész hetet az alfa-blokád megkezdésével. A francia kutatók azonnali sebészeti beavatkozást és az esetleges intraoperatív katekolamin -válság enyhítésének lépéseit kérték. Ezek a cikkek az amerikai kutatócsoportok cáfolatait eredményezték, de nemzetközi konszenzus még nem született.
Perioperatív folyadék állapot
A katekolamin -felesleg a teljes vérmennyiség csökkenését okozza , ami miatt a beteg kiszolgáltatott a hipotenziónak a műtét során. Ezért a műtét előtt ösztönözni kell a magas nátriumtartalmú étrendet, megfelelő folyadékbevitellel. Az Egyesült Államok egyes intézményei még a műtét előtti éjszakán is fogadnak betegeket intravénás folyadékpótlás miatt éjfélkor, egészen a műtét idejéig. Egy 2009 -es kis vizsgálat azonban nem számolt be a halálozási különbségről a műtét előtti intravénás folyadékkal kezelt betegekben azokhoz képest, akik nem.
A 2010-es 40 endokrinológus felmérésében, amelyet a kaliforniai Los Angeles-i Cedars-Sinai Medical Center kutatói végeztek , szinte mindenki jelezte a műtét előtti térfogat-újraélesztés fontosságát (a betegnek sok folyadékot kell bevennie a műtét előtt). A betegadatok áttekintése után azonban ugyanazon orvosok több mint 60% -a nem beszélt a sóterhelésről és a megfelelő hidratálásról. Amikor a betegeket életkor szerint rétegezték, a fiatalabbak megkapták a hidratálási tanácsot , de az idősebb betegek nem. Azt feltételeztük, hogy a szolgáltatók úgy döntött, hogy lemond térfogat jóllakottság az idősebb betegpopulációban félelem a potenciális társbetegségek ( szívelégtelenség ), ahol a felesleges folyadékot veszélyes. Bár még mindig nincs elismert konszenzus vagy aranyszabvány, a szolgáltatóknak egyedivé kell tenniük a döntést a beteg táplálkozási helyzete, mennyisége , társbetegségei és önhidratálási képessége alapján.
A posztoperatív menedzsment
A leggyakoribb műtét utáni szövődmények, valószínű okok és kezelési lehetőségek a következők:
- Hipertónia : A feokromocitómás betegeknél a posztoperatív magas vérnyomás jelezheti a hiányos daganatreszekciót vagy más ismeretlen helyű daganatot. Ugyanakkor figyelembe kell venni a posztoperatív magas vérnyomás hagyományos, nem specifikus okait is, beleértve a fájdalmat, a folyadék-túlterhelést és az esszenciális hipertóniát . A perioperatív hipertenzív krízis oldatát először egy 5,0 milligrammos (mg) intravénás bolus a fentolamin , további 5,0 mg dózis minden tíz percig, amíg a vérnyomás csökken az elfogadható tartományon belül. Ha a vérnyomás csak minimálisan emelkedik, a beteg folytathatja az alfa- és béta-adrenoreceptor-antagonistáját a műtét előtt.
- Hipotenzió : Számos oka lehet annak, hogy a páciensnek alacsony a vérnyomása a műtét utáni időszakban. Elsősorban a daganatot (és rengeteg magas vérnyomást okozó katekolaminot) távolították el. Továbbá a beteg továbbra is tapasztalhatja alfa-adrenoceptor antagonistájának hatásait , ami alacsonyabb vérnyomást okoz. A posztoperatív hipotenzió első vonalbeli kezelése agresszív folyadék-újraélesztés , ezért nagyon fontos, hogy a beteg jól hidratált legyen (lásd fent) a műtét előtt. Vazopresszorokra lehet szükség, ha a vérnyomás nem reagál a folyadékokra.
- Hiperglikémia : A katekolaminok megakadályozzák az inzulin - a szervezet vércukorszintjének csökkentéséért felelős hormon - kiválasztását . A vércukorszintet gyakran ellenőrizni kell a perioperatív időszakban, és szükség esetén inzulint kell adni, ha a szint emelkedik. A reszekciót követően a tumorral összefüggő hiperglikémia valószínűleg megszűnik.
- Hipoglikémia : A daganat eltávolítása után az inzulin már nem gátolt, ami veszélyesen csökkentheti a vércukorszintet. A tünetek közé tartozik a remegés , szorongás , szívdobogásérzés , izzadás , megváltozott mentális állapot (zavartság), szédülés és homályos látás . A béta -blokkoló retrospektív elemzése azt mutatta, hogy bizonyos béta -blokkoló -készítmények hajlamosabbá tehetik az embereket a hipoglikémiára, és nem tapasztalhatják ezeket a tüneteket, ami késleltetheti a diagnózist.
-
Mellékvese elégtelenség: Kétoldalú adrenalectomia (bal és jobb) után a beteg már nem képes a szervezet működéséhez szükséges hormonok kiválasztására . Élethosszig tartó szteroid ( hidrokortizon és fludrokortizon ) orális kiegészítésre lehet szükség annak biztosítása érdekében, hogy ne alakuljon ki mellékvese-elégtelenség. Amikor a szervezet stresszes (műtét közben), a mellékvesék természetesen több szteroidot termelnek; ha azonban a mirigyeket eltávolították, akkor nem képesek erre. Ezért "stresszadagoló" szteroidokra van szükség, amelyeket intraoperatívan kell elkezdeni, hogy utánozzák a mellékvesék természetes fiziológiáját. Az a tipikus kezelés, amikor valószínűnek tartják a posztoperatív mellékvese elégtelenséget:
- 50 milligramm (mg) intravénás hidrokortizon a műtőben az érzéstelenítés előtt
- Ismételje meg 25-50 mg intravénás hidrokortizon beadását nyolc óránként, legfeljebb 72 órán keresztül (3 nap) a műtét után. Térjen át orális helyettesítő terápiára, amint a beteg szájon át szedheti a gyógyszert
- A betegeket át kell állítani a normál fenntartó (rendszeres, napi) szteroidadagra a kiürítés előtt, és endokrinológiára kell utalni a megfelelő titrálás és kezelés érdekében. A páciens teljes testfelületétől függően a hidrokortizon tipikus napi adagja 15 és 25 mg között van (reggeli és délutáni tablettákra osztva).
- Azok, akik elvesztették mindkét mellékveséjüket, szükségük lesz egy másik szteroidra is ( ásványi -kortikoid -pótlás ). A tipikus napi adag 50-200 mikrogramm fludrokortizon
Számos egyéb szövődményt jelentettek ( veseelégtelenség , szívelégtelenség , bél pszeudo-elzáródás ) a tumor eltávolítását követően. A fentiekkel azonban nagyobb valószínűséggel találkozhatunk, ezért kezelésüket kifejezetten körvonalazták itt ebben a cikkben.
Áttétes betegség
Diagnózis és hely
A metasztatikus feokromocitóma a tumorsejtek ( chromaffin szövet ) jelenléte, ahol általában nem találhatók meg. A paragangliomában szenvedő betegeknél nagyobb valószínűséggel alakulnak ki áttétek, mint a feokromocitómában szenvedőknél. A metasztázisok leggyakoribb extra-adrenalis helyei a nyirokcsomók , a tüdő , a máj és a csont . Számos kockázati tényezőt vizsgáltak a metasztatikus betegségek kialakulásával kapcsolatban - míg a betegek genetikai háttere fontos szerepet játszik, a kezdeti megjelenési kor és a tumor mérete negatív kimenetelhez vezet. Az összes genetikai változat közül a szukcinát -dehidrogenáz B alegység (SDHB) mutációi mutatják a legnagyobb arányban az áttétes betegséget. Egy másik tanulmány a férfi nemhez és a szinkron áttétekhez kapcsolódó megnövekedett mortalitásról számolt be . A metasztázisok szinkronra és metakronra oszlanak; azok, amelyek szinkronok, az elsődleges daganatot követő néhány hónapon belül alakultak ki, míg a metakron áttétek jelentős ideig nem jelennek meg.
Az eredeti betegség laparoszkópos megközelítését, különösen nagy daganatok esetében, fontos kockázati tényezőnek nevezték a tumoros magvak számára.
Az összes lehetséges kezelési lehetőség ellenére a legújabb szakirodalom kiemeli, hogy (a legtöbb beteg esetében) a metasztatikus feokromocitóma lassan növekszik. Azoknál a betegeknél, akiknek minimális a betegségterhe, a " figyelj és várj " megközelítés gyakori képalkotással a betegség figyelemmel kísérésére előnyös, a kezelést felfüggeszti, amíg a progresszió bizonyítéka láthatóvá válik.
Kezelés
Az áttétes feokromocitóma kezelése a legjobban multidiszciplináris onkológusokból , sebészekből , radiológusokból , nukleáris medicina orvosokból és endokrinológusokból álló csapattal lehetséges . A betegség mennyiségétől és helyétől függően számos kezelési lehetőség áll a betegek rendelkezésére:
Sebészet - Általában a műtét célja a teljes citoreduktív műtét ; ne hagyjon betegség maradványokat. Azonban széles körben áttétes betegség esetén ez nem mindig kivitelezhető. Ezért sebészeti mentesítési eljárást hajtanak végre (a rákos szövetek lehető legnagyobb részét eltávolítják) annak érdekében, hogy csökkentsék a beteg tüneteit a katekolamin -források eltávolításával, javítsák a kemo- vagy radionuklid -terápiára adott választ , vagy egyszerűen csökkentsék a daganat méretét. Sajnos az eljárás tervezett enyhítése gyakran rövid életű, különösen akkor, ha a betegnek a hasán kívül van betegsége. A National Institutes of Health 2013 -as tanulmánya arról számolt be, hogy a betegek többsége a műtétet követő egy éven belül ismétlődő biokémiai betegségben szenvedett, és kevesebb mint 30% -uk öt év után is biokémiailag mentes a betegségtől.
A nem áttétes betegséggel végzett műtéttel szemben a nyílt eljárás előnyben részesíthető a minimálisan invazív technikával szemben a potenciális tumor terjedésének megkerülése érdekében. Ez is segíti a sebészeti vizualizációt, és a legjobb lehetőséget kínálja az áttétes nyirokcsomók azonosítására és eltávolítására. A jelentések azt is jelzik, hogy a műtét előtt radionuklidot, például jód-123 meta-jód-benzil-guanadint ( 123 I-MIBG) kell beadni, majd a beteget intraoperatív módon szondával be kell szkennelni a szabad szemmel hiányzó betegség kimutatására.
Sugárterápia - A feokromocitóma tekintetében a sugárzási technikákat elsősorban fájdalomcsillapításra használják, különösen a csontáttétekre , a betegség helyi ellenőrzésére és a gerincvelő kompressziójának korlátozására . A Mayo Klinika multidiszciplináris csapata visszamenőleg felülvizsgálta az összes olyan beteget, akik 1973-2015 között külső sugárkezelésen estek át, és arról számoltak be, hogy a betegek 94% -a elismerte a tünetek javulását, és a betegek több mint 80% -a nem mutatott bizonyítékot a visszatérő betegségre 5 évvel a kezelés után. terápia. Ugyanebből az intézményből származó másik jelentés csaknem két évtizede vizsgálta azokat a betegeket, akik rádiófrekvenciás abláción , krioabláción vagy perkután etanol injekción estek át áttétes feokromocitóma miatt, és arról számoltak be, hogy a célzott elváltozások több mint 85% -ában sikerült helyi kontrollt elérni, és hogy az eljárások 92% -a csökkent a fájdalom és/vagy a katekolamin -felesleg tünetei .
Kemoterápia - Az áttétes feokromocitóma leggyakoribb kemoterápiás kezelési rendje a ciklofoszfamid , vinkristin és dakarbazin , amelyek együttesen CVD néven ismertek. A terápiára adott választ a teljes tumor térfogatának csökkenésével, valamint a beteg által jelentett tüneti enyhüléssel mérik. A CVD-kezelésen átesett, nem osztályozott pheochromocytoma betegek szisztematikus áttekintése és metaanalízise azt mutatta, hogy a betegek 37% -ánál szignifikánsan csökkent a tumor térfogata, míg a betegek 40% -ánál alacsonyabb volt a katecholaminterhelés. Bár nem volt különbség a teljes túlélésben azok között a betegek között, akiknél a daganatok összezsugorodtak a válasz nélküli betegek között (nem csökkent a daganatterhelés a képalkotáson keresztül), még a nem reagáló betegeknél is a betegek jobban érezték magukat, alacsonyabb volt a vérnyomásuk, és egyes betegek műtéten esnek át, miután a betegség stabilizálódott CVD -vel. Amikor a betegeket különböző kategóriák szerint vizsgálják, a kutatások azt sugallják, hogy a nők kevésbé valószínű, hogy a CVD kemoterápiával meghosszabbítják a túlélést, mint férfi társaik. A genetikai állapot nagymértékben befolyásolja a CVD -re adott választ. A National Institutes of Health kutatócsoportja arról számolt be, hogy a szukcinát -dehidrogenáz B alegység (SDHB) mutációjú betegek nemcsak kezdetben nagyobb valószínűséggel reagálnak a CVD -re , hanem 30 hónapos progressziómentes túlélést is tapasztaltak (a tumor visszatéréséig) ) folyamatos adminisztrációval.
Azonban a CVD nem az egyetlen bizonyított kemoterápiás kezelés a feokromocitómás betegeknél. Egy 2018 -as jelentés kimutatta két SDHB -beteg figyelemre méltó válaszát, akik nem jártak sikerrel a CVD kemoterápiában (a betegség a gyógyszeres kezelés ellenére is előrehaladt), de ezt követően temozolomiddal (TMZ) kezelték őket, és a progressziómentes túlélésük 13 és 27 hónap volt, ami azt jelzi, hogy a TMZ alternatív kezelési rend azoknál, akik előrehaladtak a CVD -ben. Azóta számos tanulmány számolt be sikeres válaszokról a TMZ-vel, különösen az SDHB alpopulációban.
Radionuklid terápia
- Jód-131 meta-jód-benzil-guanadin (MIBG)
- Amint azt a fenti funkcionális képalkotó részben említettük, az MIBG nemcsak a metasztatikus betegség jelenlétének lokalizálásában, hanem egy rendelkezésre álló kezelési módként is hasznos. 2019-ben egy többközpontú, 2. fázisú vizsgálatban a MIBG terápia biztonságosságát és hatékonyságát vizsgálták áttétes vagy nem eltávolítható (nem műtétet elősegítő) feokromocitómás betegekben, és az eredmények ígéretesek voltak. A teljes túlélés medián értéke 36,7 hónap volt, és a betegek 92% -ának volt legalább részleges pozitív választ (tumor zsugorodása) vagy stabil betegsége a progresszió nélkül a vizsgálat első évében. Ezenkívül a betegek több mint egynegyede képes volt csökkenteni vérnyomáscsökkentő gyógyszereit, és tüneti javulásról számolt be. Számos olyan beteg van, akik nem jogosultak a MIBG-kezelésre, beleértve a terhes nőket (a sugárzásnak való kitettség káros a magzatra ), aktívan szoptató nőket , veseelégtelenségben szenvedő betegeket és azokat, akik várhatóan nem élnek tovább 3- hónapok. Mivel a MIBG terápia elpusztíthatja a pajzsmirigyet , a kezelés előtt védő gyógyszereket ( kálium -jodid ) kell elkezdeni, és a kezelés befejezése után legalább 3 hétig folytatni kell őket. A kapcsolódó mellékhatások ( izomgyengeség , hányinger , hányás és hematológiai (vér) toxicitás) gyakoriak, de gyakran minimálisak, és lassú, egyenletes adagolással enyhíthetők.
-
Peptidreceptor radionuklid terápia (PRRT)
- A kezelési lehetőségek közül a legújabb, a PRRT a funkcionális képalkotási részben említett 68-Ga DOTA analógokat használja . A 177 Lu-DOTATATE kezelés először sikeres volt a differenciálatlan neuroendokrin tumorokban szenvedő betegeknél, majd metasztatikus feokromocitómás betegekkel kezdődtek a vizsgálatok. 2019 -ben Vyakaranam és munkatársai kedvező eredményeket tettek közzé 22 PRRT -n átesett betegük esetében, 2 beteg részleges válaszával és stabil betegséggel (progresszió nélkül) a fennmaradó 20 betegnél. Az általános toxicitás alacsony volt, nem jelentettek magas fokú hematológiai (vér) vagy vesekárosodást. Ugyanezen év végén egy szisztémás felülvizsgálat során megvizsgálták az összes publikált cikket (12), ahol a metasztatikus feokromocitómás betegek PRRT-n estek át, és megállapították, hogy a kezeléssel összefüggő mellékhatások minimálisak, 102 betegből csak 5 döntött úgy, hogy önként kezdeményezi a kezelés abbahagyását. Az újabb jelentések részletesen ismertették a 90 Y- DOTATATE és a hagyományosan vizsgált 177 Lu analóg kombinálásának hasznosságát, valamint a különféle lehetőségeket és új kezelési lehetőségeket, amelyeket ezek a kombinációk a területen hoznak. Bár az összes bejelentett mellékhatás ígéretes volt, fontos, míg az összes bejelentett mellékhatás ígéretes volt, fontos megjegyezni, hogy a Nemzeti Egészségügyi Intézetek és a Radboud Egyetemi Orvosi Központ közötti együttműködés két sajnálatos esetet jelentett a betegség gyors előrehaladása a PRRT -re adott figyelemre méltó, szinte teljes választ követően. Bár a kiújulásuk etiológiája ismeretlen, a csapat feltételezte, hogy a megnövekedett tumor marker ( Ki-67 ) a PRRT-re adott rossz válasz jele lehet, és felszólított a PRRT előtti értékelésekre, hogy tartalmazzák a Ki-67 értékeket, hogy segítsenek a betegek kezelésének személyre szabásában terveket.
Prognózis
Az Országos Rákkutató Intézet szerint a prognózist úgy határozzák meg, mint egy betegség VAGY kimenetelét, a gyógyulás esélyét vagy a kiújulást. Ez rendkívül nehéz kérdés a feokromcitóma tekintetében, és a válasz a betegek genetikai állapotától, áttétes betegség jelenlététől és elsődleges daganatának helyétől függ. A prognózisról szóló, 2000-ben megjelent cikk 91% -os 5 éves túlélési arányról számolt be betegpopulációjukban; fontos azonban megjegyezni, hogy betegeik több mint 86% -ának szórványos daganata volt (nincs ismert genetikai mutációja), amelyek általában alacsony malignitásúak. 2019 -ben csaknem húsz európai orvosi központból álló konzorcium vizsgálta a rosszindulatú feokromocitóma prognózisát, és az adatok élesen eltérnek a szórványos, egyes daganatok jelentésétől, átlagos túlélése 6,7 év. A teljes túlélés javult, ha a betegnek (1) fej- és nyakbetegsége volt a hashoz képest, (2) 40 évesnél fiatalabb, (3) és ha biokémiája kevesebb volt, mint a normál érték felső határának ötszöröse.
A legújabb szakirodalom számos olyan tényezőt részletezett, amelyek előre jelzik a betegség gyorsabb előrehaladását és a magasabb halálozási arányokat, beleértve azokat a betegeket, akik az elsődleges daganat műtéti reszekcióját, a nagyobb daganatokat a kezdeti megjelenéskor, az idősebb korban a kezdeti diagnózisnál és az elsődleges daganatról a áttétek jelenléte. A metasztázisok tényleges elhelyezkedése is előrejelzést jelezhet, a csontos elváltozások (csont) jobban teljesítenek, mint lágyszöveti ( tüdő , máj ) társaik.
Járványtan
Az Észak -Amerikai Neuroendokrin Tumor Society szerint a feokromocitóma előfordulási gyakorisága 1: 2500 és 1: 6500 között van, ami azt jelenti, hogy minden 2500 - 6500 ember esetében (átlagosan) egy feokromocitóma van. Az Egyesült Államokban ez évente 500–1600 esetet jelent (évente új esetek). A közelítő adatok azonban a 2000 -es évek elején arról számoltak be, hogy a feokromocitóma diagnózisok több mint 50% -a boncolásban van ; ezért a fenti becslések a vártnál alacsonyabbak lehetnek. Egy 50 éves boncolási esettanulmányban a Mayo Klinika 54 pheochromocytoma esetet vizsgált meg 1928–1977 között, és felfedezte, hogy a betegek mindössze 24% -át diagnosztizálták helyesen a haláluk előtt. Az Egyesült Államokon kívül több ország dokumentálta saját járványtani tanulmányait, és összehasonlította azokat Észak -Amerikában ismertekkel . Az első Ázsiában végzett, országos, epidemiológiai népesség-alapú vizsgálatban, amely a Koreai Nemzeti Egészségbiztosítási Szolgálat adatait használta fel, a feokromocitóma prevalenciáját 2,13-ról számolták be 100 000 főre, előfordulási gyakorisága 0,18 / 100 000 személyév. Ez alacsonyabb, mint a Rochester, Minnesota államban jelentett esemény (0,8 / 100 000 személyév) egy 1950-1979 között végzett tanulmányban. Hollandia azonban egy országos nyilvántartást használó tanulmányt is végzett, és 2011–2015 között 100 000 személyévre számított 0,57-es előfordulási eredményt jelentett, ami jelentős növekedést jelent az 1995–1999 közötti időszakban jelentett 100 ezer személyévi 0,37 esethez képest. A jelenlegi hipotézisek arra vonatkozóan, hogy miért nő a feokromocitóma előfordulási gyakorisága a holland lakosságban, a modern képalkotó értékelés megjelenésére és ezeknek a daganatoknak a halál előtti kimutatására. Bár a fenti tanulmányok mindegyike eltérő előfordulási és prevalenciaértékeket számolt be, mindegyik azt jelezte, hogy a kezdeti diagnózis átlagos életkora az élet harmadik és ötödik évtizede között van. Amikor a fiatalabb betegeknél feokromocitómát diagnosztizálnak, nagy a gyanú az örökletes betegségre, mivel a genetikai várakozás (a betegség kezdete minden generációnál) bizonyos mutációkkal jár.
Klasszikusan a feokromocitóma "10 -es szabályait" tanították, különösen az orvostanhallgatóknak:
- A betegek 10% -a rosszindulatú betegségben szenved
- A betegek 10% -a kétoldali (bal és jobb mellékvesék) betegségben szenved
- A betegek 10% -ánál van mellékvese (paraganglioma) betegség
- A betegek 10% -a öröklődött (családi betegség)
Annak ellenére, hogy sok elismert tankönyvben előtérbe kerül, ezeket az irányelveket azóta pontatlannak találták, és nem használják fel a jelenlegi járványügyi megbeszéléseken.
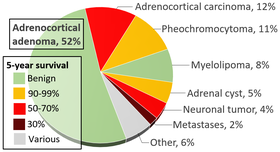
Amint azt fentebb javasolták, a véletlen képalkotás fontos szerepet játszott a feokromocitómás betegek diagnózisában, a jelenlegi becslések szerint a képalkotás után diagnosztizált esetek 10–49% -a más okból történt. Ha számítógépes tomográfián vagy mágneses rezonancia képalkotáson mellékvese csomót (potenciális daganatot) fedeznek fel , akkor 5–10% az esély arra, hogy a lézió feokromocitóma. A mellékvese daganatok előfordulási gyakorisága megtalálható a fenti infografikán, a feokromocitóma sárgával van jelölve a jobb felső sarokban.
Történelem
1800-ban egy ír orvos (Charles Sugrue) esettanulmányt írt a London Medical and Physical Journal-nak, amelyben egy 8 éves férfi páciens sajátos esetét ismertette, aki látszólag véletlenszerű, a hasban összpontosuló fájdalomrohamokat szenvedett. hektikus öblítés, egyértelműen megjelölve minden arcán "" állandó bőséges és univerzális izzadsággal ". Halála után az orvosok egy csoportja boncolást végzett a halál okának megállapítása érdekében, és felfedezett egy 6 hüvelyk hosszúkás daganatot, amely ismeretlen "sárga színű anyagból" állt, amely a capsula renalis-ból származik (amit ma mellékvesének neveznek) . Ez lesz a feokromocitóma első ismert klinikai leírása, de mivel magának a daganatnak a jellemzőit nem írták le, teljes elismerés illeti a német Felix Fraenkel -t , aki klinikai és morfológiai képet nyújtott erről a daganatról. Míg a különböző orvosok felismerték a tüneteket és kezelték a betegeket, Alfred Kohn cseh biológus beszámolt a paraganglia rendszer felfedezéséről , amely később döntő fontosságú lesz e daganatok diagnosztizálásában. Továbbá bevezette a " chromaffin " kifejezést is , amely lehetővé teszi a patológusok számára, hogy felismerjék a mellékveséből származó daganatokat .
1908-ban két patológus , Henri Alezais és Felix Peyron, bevezette a tudományos közösséget a " paraganglioma " -ba, miután felfedezték a mellékvese-szövetet, amely reagált a króm-sókra, ami utánozza a mellékvese velőreakcióját. Alig négy évvel később a német patológus, Ludwig Pick megalkotta a "feokromocitóma" kifejezést, miután megfigyelte a mellékvese velővel összefüggő daganatok állandó színváltozását . Sok sebész megpróbálta eltávolítani ezeket a daganatokat a következő évtizedben, de betegeik intraoperatívan meghaltak a sokktól. 1926 -ban Charles Mayo (a Mayo Klinika alapítója ) lett az első orvos, aki sikeresen kivágta a feokromocitómát. Mayo azonban valószínűleg nem tudott a diagnózisról a műtét előtt. Csak 1929 -ben ismerték fel a feokromocitómát a műtét előtt. Az 1900-as évek elején a feokromocitóma operatív halálozási aránya 30-45%között mozgott. A retrospektív sorozatok azt feltételezték, hogy ezek a riasztóan magas halálozási arányok az alfa- és béta-adrenoreceptor-antagonistával végzett műtét előtti blokád hiányának és a modern érzéstelenítési gyakorlatok szükségességének tudhatók be. Innentől kezdve az orvos-tudósok felismerik a feokromocitómás betegek mintáit, és azonosítják a genetikai asszociációkat és a különböző szindrómákat.
Társadalom és kultúra
Bár ritka betegség, a populáris kultúrában és a médiában, különösen az orvosi televíziós drámákban , több alkalommal is utaltak a feokromocitómára . Ezenkívül létezik egy erős online betegellátó közösség , amely összekapcsolja a ritka betegségekben szenvedő betegeket, és lehetővé teszi számukra, hogy találkozzanak más személyekkel, akik hasonló diagnózist és kezelési stratégiát tapasztalnak.
Zebra kultúra
Az orvostársadalomban a diákokat gyakran tanítják "amikor patacsapásokat hall Texasban, gondoljon lovakra, ne pedig zebrákra". Más szavakkal, a gyakori diagnózisok gyakoriak, ezért az egészségügyi szakembereknek először ki kell zárniuk, hogy mit várnak el leginkább (a lovakat), mielőtt belevetik magukat a ritka etiológiákba, amelyek jóval kevésbé valószínűek, hogy helyesek (a zebrák). A zebra szimbóluma azonban egyre erősebbé vált a ritka betegségek közösségében, és több szervezetet, társaságot és különleges eseményt ( ritka betegségek napja ) eredményezett, amelyek felhívták a figyelmet a legkevésbé gyakori lehetőségre, amely néha a helyes diagnózis.
A Ritka Rendellenességek Nemzeti Szervezete az Egyesült Államokban székelő érdekképviseleti szülői szervezet, amelynek célja, hogy elősegítse a tudatosságot és a kutatási lehetőségeket a ritka betegségek gyógyítására. Az ilyen csoportok arra ösztönzik a betegeket, hogy önálló szószólókká váljanak és megváltoztassák az egészségügyi döntéshozatali folyamatokat.
Média
2012 júliusában egy tényleges feokromocitómás beteg, Tannis Brown, a PheoPara Troopers korábbi alelnöke szerepelt a Discovery Fit & Health Network Diagnosis: Dead or Alive programjában . A műsor kiemelte személyes küzdelmét a rosszul diagnosztizált betegséggel, mivel sok orvos úgy érezte, hogy epizodikus fejfájása és magas vérnyomása (magas vérnyomása) összefügg a stresszel.
A hetedik és nyolcadik szezont Greys Anatomy , sorozatban Henry egy Von Hippel-Lindau (VHL) mutációt eredményezett pheochromocytomája. A történet ívét a ritka betegségek közösségének vegyes véleményei fogadták. Ekkor a VHL Szövetség ügyvezető igazgatója elégedett volt egy VHL -páciensnek a mainstream médiában való ábrázolásával, de rámutatott, hogy a VHL -páciens által ismert négy forgatókönyv közül három feochromocytoma volt, ami valójában kevesebb mint egyötödében fordul elő minden VHL -beteg.
Hivatkozások
Külső linkek
- " Általános információk a feokromocitómáról és a paragangliomáról ", az Országos Rákkutató Intézet
- Pheochromocytoma és Paraganglioma az Amerikai Klinikai Onkológiai Társaságból
- Feokromocitóma ; Ritka Betegségek Adatbázisa a Ritka Betegségek Országos Szervezetétől
- Mit kell tudni a feokromocitómáról az orvosi hírekből?
- MedlinePlus Áttekintés pheochromocytoma
- GeneReviews bejegyzés az " Örökletes paraganglioma-feokromocitóma szindrómák " témakörben
| Osztályozás | |
|---|---|
| Külső erőforrások |