Rádium - Radium
 | |||||||||||||||||||||||||||||||
| Rádium | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Kiejtés |
/ R eɪ d i ə m / ( RAY -dee-əm ) |
||||||||||||||||||||||||||||||
| Megjelenés | ezüstös fehér metál | ||||||||||||||||||||||||||||||
| Tömegszám | [226] | ||||||||||||||||||||||||||||||
| Rádium a periódusos rendszerben | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Atomi szám ( Z ) | 88 | ||||||||||||||||||||||||||||||
| Csoport | 2. csoport (alkáliföldfémek) | ||||||||||||||||||||||||||||||
| Időszak | időszak 7 | ||||||||||||||||||||||||||||||
| Blokk | s-blokk | ||||||||||||||||||||||||||||||
| Elektron konfiguráció | [ Rn ] 7s 2 | ||||||||||||||||||||||||||||||
| Elektronok héjonként | 2, 8, 18, 32, 18, 8, 2 | ||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||
| Fázis az STP -n | szilárd | ||||||||||||||||||||||||||||||
| Olvadáspont | 973 K (700 ° C, 1292 ° F) (vitatott) | ||||||||||||||||||||||||||||||
| Forráspont | 2010 K (1737 ° C, 3159 ° F) | ||||||||||||||||||||||||||||||
| Sűrűség ( rt közelében ) | 5,5 g/cm 3 | ||||||||||||||||||||||||||||||
| Fúziós hő | 8,5 kJ/mol | ||||||||||||||||||||||||||||||
| A párolgás hője | 113 kJ/mol | ||||||||||||||||||||||||||||||
Gőznyomás
| |||||||||||||||||||||||||||||||
| Atomi tulajdonságok | |||||||||||||||||||||||||||||||
| Az oxidációs állapotok | +2 (várhatóan erősen bázikus oxidot tartalmaz) | ||||||||||||||||||||||||||||||
| Elektronegativitás | Pauling skála: 0,9 | ||||||||||||||||||||||||||||||
| Ionizációs energiák | |||||||||||||||||||||||||||||||
| Kovalens sugár | 221 ± 2 óra | ||||||||||||||||||||||||||||||
| Van der Waals sugara | 283 óra | ||||||||||||||||||||||||||||||
| Színképvonalai rádium | |||||||||||||||||||||||||||||||
| Egyéb tulajdonságok | |||||||||||||||||||||||||||||||
| Természetes előfordulás | a bomlástól | ||||||||||||||||||||||||||||||
| Kristályszerkezet | tércentrált köbös (BCC) | ||||||||||||||||||||||||||||||
| Hővezető | 18,6 W/(m⋅K) | ||||||||||||||||||||||||||||||
| Elektromos ellenállás | 1 µΩ⋅m (20 ° C -on) | ||||||||||||||||||||||||||||||
| Mágneses rendezés | nem mágneses | ||||||||||||||||||||||||||||||
| CAS -szám | 7440-14-4 | ||||||||||||||||||||||||||||||
| Történelem | |||||||||||||||||||||||||||||||
| Felfedezés | Pierre és Marie Curie (1898) | ||||||||||||||||||||||||||||||
| Első elszigeteltség | Marie Curie (1910) | ||||||||||||||||||||||||||||||
| A rádium fő izotópjai | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Rádium egy kémiai elem a szimbólum Ra és atomi száma 88. Ez a hatodik eleme a 2. csoport a periódusos , más néven a alkáliföldfémek . A tiszta rádium ezüstfehér, de levegővel való érintkezéskor könnyen reagál nitrogénnel (nem oxigénnel), és fekete felületű rádium-nitrid réteget képez (Ra 3 N 2 ). Minden izotópok rádium erősen radioaktív , a legstabilabb izotópja hogy rádium-226 , amely egy felezési 1600 év, és bomlások be radon gázt (konkrétan az izotóp radon-222 ). Amikor a rádium bomlik, az ionizáló sugárzás melléktermék, amely gerjesztheti a fluoreszkáló vegyi anyagokat és radiolumineszcenciát okozhat .
A rádium, formájában rádium-klorid , ben fedezték fel a Marie és Pierre Curie 1898-ban bányászott ércből a Jáchymov . Kivonták a rádiumvegyületet az uraninitből, és öt nappal később közzétették a felfedezést a Francia Tudományos Akadémián . Radium izoláljuk annak fémes állapotban Marie Curie és André-Louis Debierne keresztül elektrolízis rádium-klorid 1911.
A természetben a rádium az urán- és (kisebb mértékben) a tóriumércben található nyomokban, akár egy heted gramm / tonna uraninit nyomon. A rádium nem szükséges az élő szervezetek számára , és káros egészségkárosító hatások valószínűek, ha radioaktivitása és kémiai reakcióképessége miatt beépítik a biokémiai folyamatokba. Jelenleg a nukleáris gyógyászatban való felhasználásán kívül a rádiumnak nincs kereskedelmi alkalmazása; korábban radiolumineszcens eszközök radioaktív forrásaként használták, és feltételezett gyógyító ereje miatt radioaktív quackery -ben is . Ma ezek a korábbi alkalmazások már nem divatosak, mert a rádium toxicitása ismertté vált, és kevésbé veszélyes izotópokat használnak helyette a radiolumineszcens eszközökben.
Tömeges tulajdonságok
A rádium a legnehezebb ismert alkáliföldfém, és csoportja egyetlen radioaktív tagja. Fizikai és kémiai tulajdonságai leginkább a könnyebb rokon báriumhoz hasonlítanak .
A tiszta rádium illékony ezüstfehér fém, bár könnyebb rokonai kalcium , stroncium és bárium enyhe sárga árnyalatúak. Ez az árnyalat gyorsan eltűnik a levegő hatására, és fekete réteg radium -nitridet (Ra 3 N 2 ) kap. A olvadáspontja jelentése vagy 700 ° C (1,292 ° F) vagy 960 ° C (1760 ° F) és annak forráspontja jelentése 1,737 ° C (3.159 ° F). Mindkét érték valamivel alacsonyabb, mint a báriumé, ami megerősíti az időszakos tendenciákat a 2. csoport elemeiben. A báriumhoz és az alkálifémekhez hasonlóan a rádium szabványos hőmérsékleten és nyomáson kristályosodik a testközpontú köbös szerkezetben : a rádium-rádium kötés távolsága 514,8 pikométer . A rádium sűrűsége 5,5 g/cm 3 , magasabb, mint a báriumé, ami ismét megerősíti az időszakos tendenciákat; a rádium-bárium sűrűség arány a rádium-bárium atomtömeg-arányhoz hasonlítható, a két elem hasonló kristályszerkezete miatt.
Izotópok
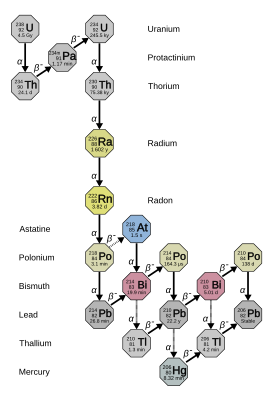
A rádiumnak 33 ismert izotópja van, tömegszáma 202 és 234 között van: mindegyik radioaktív . Ezek közül négy - 223 Ra ( felezési 11,4 nap), 224 Ra (3,64 nap), 226 Ra (1600 év), és a 228 Ra (5,75 év) - természetesen előfordulnak a bomlási láncok primordiális tórium -232, urá 235 és urán-238 ( 223 Ra az urán-235-ből, 226 Ra az urán-238-ból, és a másik kettő a tórium-232-ből). Ennek ellenére ezeknek az izotópoknak a felezési ideje túl rövid ahhoz, hogy ősradionuklidok legyenek, és csak ezekben a bomlási láncokban léteznek a természetben. A többnyire mesterséges 225 Ra -val (15 d) együtt, amely a természetben csak 237 Np -os apró nyomok bomlástermékeként fordul elő , ez a rádium öt legstabilabb izotópja. Az összes többi ismert rádium-izotóp felezési ideje két óra alatt van, a többségé pedig egy perc alatt. Legalább 12 nukleáris izomert jelentettek; közülük a legstabilabb a rádium-205m, felezési ideje 130 és 230 milliszekundum; ez még mindig rövidebb, mint huszonnégy alapállapotú rádium-izotóp.
A radioaktivitás vizsgálatának korai történetében a rádium különböző természetes izotópjai különböző neveket kaptak. Ebben a sémában 223 Ra -t actinium X (AcX), 224 Ra tórium X (ThX), 226 Ra rádium (Ra) és 228 Ra mezotórium 1 (MsTh 1 ) nevet kaptak . Amikor rájöttek, hogy ezek mind ugyanazon elem izotópjai, sok ilyen név kiesett a használatból, és a "rádium" az összes izotópra vonatkozik, nem csak a 226 Ra -ra . A rádium-226 bomlástermékeinek egy része történelmi neveket kapott, beleértve a "rádiumot", az A rádiumtól a G rádiumig, a betű pedig azt jelzi, hogy milyen messze vannak a láncban a szülő 226 Ra-tól. Rádiumemanáció = 222 Rn, Raa = 218 Po, RAB = 214 Pb, RAC = 214 Bi, az RaC 1 = 214 Po, az RaC 2 = 210 Tl, RAD = 210 Pb, Rae = 210 Bi, Raf = 210 Po és a RAG = 206 Pb.
A 226 Ra a rádium legstabilabb izotópja, és az urán-238 (4 n + 2) bomlási láncának utolsó izotópja , amelynek felezési ideje több mint egy évezred: ez teszi ki a természetes rádium szinte teljes mennyiségét. Közvetlen bomlásterméke a sűrű radioaktív nemesgáz -radon (különösen a 222 Rn izotóp ), amely felelős a rádium környezeti veszélyeinek nagy részéért. 2,7 milliószor radioaktívabb, mint az azonos moláris mennyiségű természetes urán (többnyire urán-238), arányosan rövidebb felezési ideje miatt.
A rádiumfém mintája a sugárzás - alfa -részecskék , béta -részecskék és gamma -sugárzás - miatt magasabb hőmérsékleten tartja magát, mint környezete . Pontosabban, a természetes rádium (amely többnyire 226 Ra) többnyire alfa -részecskéket bocsát ki, de bomlási láncának más lépései (az urán- vagy rádium -sorozat ) alfa- vagy béta -részecskéket bocsátanak ki, és szinte minden részecske -kibocsátást gamma -sugárzás kísér.
2013-ban felfedezték, hogy a rádium-224 magja körte alakú. Ez volt az első aszimmetrikus mag felfedezése.
Kémia
A rádium, akárcsak a bárium, erősen reakcióképes fém, és csoportos oxidációs állapota mindig +2. Ez képezi az színtelen Ra 2+ kation a vizes oldatban , amely nagymértékben bázikus és nem képez komplexeket könnyen. A legtöbb rádiumvegyület tehát egyszerű ionos vegyület, bár a 6s és 6p elektronok részvétele (a 7 -es vegyértékű elektronokon kívül) a relativisztikus hatások miatt várható, és fokozza a rádiumvegyületek, például Ra F 2 és Ra At 2 kovalens jellegét . Emiatt, a standardpotenciál a fél-reakció Ra 2+ (aq) + 2e - → Ra (ek) -2,916 V , sőt valamivel alacsonyabb, mint az értéke -2,92 V bárium, mivel az értékek korábban simán csökkent a csoportban (Ca: -2,84 V; Sr: -2,89 V; Ba: -2,92 V). A bárium és a rádium értékei majdnem pontosan megegyeznek a nehezebb alkálifémek kálium , rubídium és cézium értékeivel .
Vegyületek
A szilárd rádiumvegyületek fehérek, mivel a rádium-ionok nem adnak különleges színezést, de fokozatosan sárgulnak, majd sötétednek az idő múlásával a rádium alfa-bomlása következtében bekövetkező ön- radiolízis miatt . Az oldhatatlan rádiumvegyületek minden bárium-, legtöbb stroncium- és ólomvegyülettel együtt kicsapódnak.
A rádium -oxidot (RaO) nem jellemezték jóval a létezése előtt, annak ellenére, hogy az oxidok a többi alkáliföldfém közös vegyületei. A rádium -hidroxid (Ra (OH) 2 ) a legkönnyebben oldható az alkáliföldfém -hidroxidok közül, és erősebb bázis, mint bárium -rokonvegyülete, a bárium -hidroxid . Ez is jobban oldódik, mint az aktinium -hidroxid és a tórium -hidroxid : ezt a három szomszédos hidroxidot el lehet választani ammóniával történő kicsapással .
A rádium -klorid (RaCl 2 ) színtelen, fényes vegyület. Sárgává válik egy idő után a rádium által kibocsátott alfa-sugárzás okozta önsérülés miatt, amikor lebomlik. Kis mennyiségű bárium -szennyeződés rózsaszínűvé teszi a vegyületet. Vízben oldódik, bár kevésbé, mint a bárium -klorid , és oldhatósága csökken a sósav koncentrációjának növekedésével . Kristályosítás vizes oldatot ad a dihidrát RaCl 2 · 2H 2 O, izomorfak a bárium-analóg.
A rádium -bromid (RaBr 2 ) szintén színtelen, fényes vegyület. Vízben jobban oldódik, mint a rádium -klorid. Mint rádium-kloridot, kristályosítás vizes oldat adja a dihidrát RaBr 2 · 2H 2 O, izomorfak a bárium-analóg. A rádium -bromid által kibocsátott ionizáló sugárzás izgatja a nitrogénmolekulákat a levegőben. A rádium által kibocsátott alfa -részecskék gyorsan két elektronot nyernek, hogy semleges héliummá váljanak , amely felhalmozódik és gyengíti a rádium -bromid kristályokat. Ez a hatás néha a kristályok törését vagy akár felrobbanását okozza.
Radium nitrátot (Ra (NO 3 ) 2 ) egy fehér vegyület, amely lehet elő, feloldva a rádium-karbonát a salétromsav . A salétromsav koncentrációjának növekedésével a rádium -nitrát oldhatósága csökken, ami a rádium kémiai tisztításának fontos tulajdonsága.
A rádium nagyjából ugyanazokat az oldhatatlan sókat képezi, mint a könnyebb rokon bárium: oldhatatlan szulfátot (RaSO 4 , a legelső oldhatatlanabb ismert szulfát), kromátot (RaCrO 4 ), karbonátot (RaCO 3 ), jodátot (Ra (IO 3 ) 2 ) , tetrafluor -berilát (RaBeF 4 ) és nitrát (Ra (NO 3 ) 2 ). A karbonát kivételével mindezek kevésbé oldódnak vízben, mint a megfelelő bárium -sók, de mindegyikük izostrukturális bárium -társaikhoz képest. Ezenkívül a rádium -foszfát , oxalát és szulfit valószínűleg szintén oldhatatlanok, mivel a megfelelő oldhatatlan bárium -sókkal együtt kicsapódnak. A rádium -szulfát nagy oldhatatlansága (20 ° C -on csak 2,1 mg oldódik 1 kg vízben) azt jelenti, hogy a biológiailag kevésbé veszélyes rádiumvegyületek közé tartozik. A Ra 2+ nagy ionsugara (148 pm) gyenge komplexképződést és rossz rádium -kivonást eredményez a vizes oldatokból, ha nem magas pH -n.
Esemény
A rádium minden izotópjának felezési ideje jóval rövidebb, mint a Földé , így bármely ősrádium már régen elbomlott volna. A rádium ennek ellenére még mindig előfordul a környezetben , mivel a 223 Ra, 224 Ra, 226 Ra és 228 Ra izotópok a természetes tórium- és uránizotópok bomlási láncának részei; mivel a tóriumnak és az uránnak nagyon hosszú felezési ideje van, ezek a lányok folyamatosan regenerálódnak bomlásuk miatt. E négy izotóp közül a leghosszabb élettartamú 226 Ra (felezési ideje 1600 év), a természetes urán bomlásterméke. Viszonylag hosszú élettartama miatt a 226 Ra az elem leggyakoribb izotópja, amely a Föld kéregének ezermilliárdjánként körülbelül egy részét teszi ki ; lényegében minden természetes rádium 226 Ra. Így rádium megtalálható kis mennyiségben az uránérc uránszurokérc és egyéb urán ásványi anyagok és még apróbb mennyiségben tórium ásványi anyagokat. Egy tonna a uránszurokérc jellemzően hozamok mintegy hetede egy gramm rádium. Egy kilogramm a földkéreg körülbelül 900 pg rádium és egy liter a tengervíz körülbelül 89 femtogramm rádium.
Történelem
Rádium-ben fedezték fel a Marie Sklodowska-Curie és férje , Pierre Curie december 21-én 1898-ben egy uránszurokérc (uránszurokérc) mintát Jáchymov . Az ásvány korábbi tanulmányozása során a Curies eltávolította az uránt, és megállapította, hogy a maradék anyag még mindig radioaktív. A július 1898, míg tanul uránszurokérc ezek elszigetelt eleme hasonló bizmut ami kiderült, hogy a polónium . Ezután izoláltak egy radioaktív keveréket, amely többnyire két komponensből állt: báriumvegyületekből , amelyek ragyogó zöld lángszínt adtak, és ismeretlen radioaktív vegyületekből, amelyek kármin spektrális vonalakat adtak, amelyeket korábban soha nem dokumentáltak. A Curies úgy találta, hogy a radioaktív vegyületek nagyon hasonlóak a báriumvegyületekhez, kivéve, hogy kevésbé oldódnak. Ez lehetővé tette, hogy a Curies izolálja a radioaktív vegyületeket, és új elemet fedez fel bennük. A Curies 1898. december 26 -án jelentette be felfedezését a Francia Tudományos Akadémiának. A rádium elnevezése körülbelül 1899 -re nyúlik vissza, a francia radium szóból , amelyet a modern latinban a sugárból ( ray ) alakítottak ki : ez a rádium kibocsátó erejének elismerése volt. energiát sugárzás formájában.
Szeptemberében 1910 Marie Curie és André-Louis Debierne bejelentették, hogy elszigetelt rádiumot, mint egy tiszta fém keresztül elektrolízis tiszta rádium -kloridot (RaCl 2 ) oldatot a higany katód , termelő rádium-higany amalgám . Ezt az amalgámot ezután hidrogéngáz atmoszférában melegítették, hogy eltávolítsák a higanyt, és tiszta rádiumfém maradjon. Ugyanebben az évben E. Eoler izolálta a rádiumot az azid , Ra (N 3 ) 2 termikus bontásával . A rádiumfémet iparilag a 20. század elején állította elő iparilag a Biraco , a Union Minière du Haut Katanga (UMHK) leányvállalata a belgiumi Olen gyárban.
A radioaktivitás közös történelmi egysége, a curie a 226 Ra radioaktivitásán alapul .
Történelmi alkalmazások
Lumineszcens festék
A rádiumot korábban önvilágító festékekben használták órákhoz, nukleáris panelekhez, repülőgép-kapcsolókhoz, órákhoz és műszer-tárcsákhoz. Egy tipikus önvilágító óra, amely rádiumfestéket használ, körülbelül 1 mikrogramm rádiumot tartalmaz. Az 1920-as évek közepén pert indított az Egyesült Államok Radium Corporation ellen öt haldokló " Radium Girls "-számlapfestő, akik rádium-alapú fényes festéket festettek az órák számlapjaira. A számlapfestőket arra utasították, hogy nyalják meg az ecsetüket, hogy finom pontot kapjanak, ezáltal lenyelve a rádiumot. A rádiumnak való kitettségük súlyos egészségügyi hatásokat okozott, beleértve a sebeket, az anaemiát és a csontrákot . Ennek oka az, hogy a szervezet a rádiumot kalciumként kezeli, és a csontokban rakja le , ahol a radioaktivitás rontja a csontvelőt és mutálhatja a csontsejteket .
A peres eljárás során megállapították, hogy a vállalat tudósai és vezetése jelentős óvintézkedéseket tettek, hogy megvédjék magukat a sugárzás hatásaitól, mégsem látták megfelelőnek az alkalmazottaik védelmét. Ezenkívül a vállalatok több éven keresztül megpróbálták leplezni a hatásokat és elkerülni a felelősséget azzal, hogy ragaszkodtak ahhoz, hogy a Radium Girls szifiliszben szenvedjen . A munkavállalói jólétnek ez a teljes figyelmen kívül hagyása jelentős hatással volt a foglalkozási megbetegedések munkajogának megfogalmazására .
A per eredményeként a radioaktivitás káros hatásai széles körben ismertté váltak, és a rádium-tárcsás festőket megfelelő biztonsági óvintézkedésekre utasították, és védőfelszereléssel látták el. Különösen a tárcsázó festők már nem nyalták meg az ecseteket, hogy alakítsák azokat (ami némi rádium -só lenyelését okozta). A rádiumot még az 1960 -as években is használták a tárcsázásban, de a tárcsázó festők nem szenvedtek további sérüléseket. Ez rávilágított arra, hogy a Radium Girls ártalma könnyen elkerülhető lett volna.
Az 1960 -as évektől megszűnt a rádiumfesték használata. Sok esetben fényes tárcsákat valósítottak meg nem radioaktív fluoreszkáló anyagokkal, amelyeket fény gerjesztett; az ilyen eszközök a sötétben világítanak a fény hatására, de az izzás elhalványul. Ahol hosszú távú önvilágításra volt szükség sötétben, biztonságosabb radioaktív promethium -147 (felezési idő 2,6 év) vagy trícium (felezési idő 12 év) festéket használtak; mindkettőt ma is használják. Ezek további előnye volt, hogy a rádiumtól eltérően nem rontották a foszfort az idő múlásával. A trícium nagyon alacsony energiájú béta-sugárzást bocsát ki (még alacsonyabb energiájú, mint a prométium által kibocsátott béta-sugárzás), amely nem tud behatolni a bőrbe, nem pedig a rádium áthatoló gamma-sugárzását, és biztonságosabbnak tekinthető.
A 20. század első feléből származó órákat, műszereket, gyakran katonai célokra, radioaktív fényfestékkel festhették. Általában már nem világítanak; ez azonban nem a rádium radioaktív bomlásának köszönhető (amelynek felezési ideje 1600 év), hanem a cink-szulfid-fluoreszkáló közeg fluoreszcenciája, amelyet a rádium sugárzása elhasznál. A gyakran vastag zöld vagy sárgásbarna festékréteg megjelenése a készülékekben ebből az időszakból radioaktív veszélyre utal. Az ép készülék sugárzási dózisa viszonylag alacsony, és általában nem akut kockázat; de a festék veszélyes, ha kiszabadul, belélegzi vagy lenyeli.
Kereskedelmi használat
A rádium feltételezett gyógyító ereje miatt egykor adalékanyag volt olyan termékekben, mint a fogkrém, hajkrémek és még az élelmiszerek is. Az ilyen termékek hamar kiestek a divatból, és számos ország hatóságai betiltották, miután kiderült, hogy súlyos káros egészségügyi következményekkel járhatnak. (Lásd például a Radithor vagy Revigator típusú "rádium vizet" vagy "Standard Radium Solution for Drinking" -t.) A rádiumban gazdag vizet tartalmazó fürdőket időnként még mindig előnyösnek tartják, például Misasában, Tottori-ban , Japánban. Az Egyesült Államokban orr-rádium besugárzást is adtak a gyermekeknek, hogy megelőzzék a középfül problémáit vagy a megnagyobbodott mandulákat az 1940-es évek végétől az 1970-es évek elejéig.
Orvosi felhasználás
Rádiumot (általában rádium -klorid vagy rádium -bromid formájában ) használtak az orvostudományban radongáz előállítására, amelyet viszont rákkezelésként használtak ; például ezek közül a radonforrások közül többet használtak Kanadában az 1920 -as és 1930 -as években. Az 1900 -as évek elején alkalmazott kezeléseket azonban már nem használják a rádium -bromid -expozíció káros hatásai miatt. Néhány példa ezekre a hatásokra a vérszegénység , a rák és a genetikai mutációk . Biztonságosabb gamma -kibocsátókat, például a 60 Co -t, amely olcsóbb és nagyobb mennyiségben kapható, ma általában a rádium korábbi felhasználásának helyettesítésére használják ebben az alkalmazásban.
Az 1900 -as évek elején a biológusok rádiumot használtak a mutációk kiváltására és a genetika tanulmányozására . Daniel MacDougal már 1904 -ben rádiumot használt annak megállapítására, hogy képes -e hirtelen nagy mutációkat kiváltani, és jelentős evolúciós változásokat okozni. Thomas Hunt Morgan rádiumot használt a változások kiváltására, amelyek fehér szemű gyümölcslegyeket eredményeztek. Hermann Muller Nobel-díjas biológus röviden tanulmányozta a rádium hatását a gyümölcslégy mutációira, mielőtt a kedvezőbb árú röntgenkísérletekhez fordult.
Howard Atwood Kelly , a Johns Hopkins Kórház egyik alapító orvosa úttörő szerepet játszott a rádium rákos megbetegedésekben történő orvosi felhasználásában. Első páciense 1904 -ben a saját nagynénje volt, aki nem sokkal a műtét után meghalt. Kellyről ismert, hogy túlzott mennyiségű rádiumot használt különböző rákok és daganatok kezelésére. Ennek eredményeképpen páciensei egy része meghalt a rádiumnak való kitettség miatt. Rádiumfelhordási módszere az volt, hogy rádiumkapszulát helyezett az érintett terület közelébe, majd a rádium "pontjait" közvetlenül a tumorhoz varrta . Ez ugyanaz volt, kezelésére alkalmazott módszer Henrietta Lacks , a fogadó az eredeti HeLa-sejtek , a méhnyakrák . Jelenleg biztonságosabb és elérhetőbb radioizotópokat használnak helyette.
Termelés

A 19. század végén az uránnak nem volt nagy kiterjedésű alkalmazása, ezért nem léteztek nagy uránbányák. Az elején az egyetlen nagy forrása uránérc volt az ezüst bányák Jáchymov , Ausztria-Magyarország (ma Csehország ). Az uránérc csak a bányászati tevékenység mellékterméke volt.
A rádium első extrakciójában Curie felhasználta az urán szurokból előállított maradványait. Az uránt kénsavban oldva extrahálták, és a rádium -szulfátot hagyták, amely hasonló a bárium -szulfáthoz, de még kevésbé oldódik a maradékokban. A maradékok meglehetősen jelentős mennyiségű bárium -szulfátot is tartalmaztak, amely így a rádium -szulfát hordozójaként működött. A rádiumkivonási eljárás első lépései közé tartozott a nátrium -hidroxiddal való forralás, majd a sósavkezelés, hogy minimálisra csökkentsék a többi vegyület szennyeződését. A maradékot nátrium -karbonáttal kezeltük, hogy a bárium -szulfátot bárium -karbonáttá alakítsuk át (a rádiumot hordozva), így sósavban oldhatóvá válik. Feloldódás után a báriumot és a rádiumot szulfát formájában újra kicsapjuk; ezt megismételtük a kevert szulfát további tisztítása érdekében. Néhány oldhatatlan szulfidot képező szennyeződést a klorid -oldat hidrogén -szulfiddal való kezelésével, majd szűréssel eltávolítottunk. Amikor a kevert szulfátok elég tiszták voltak, ismét kevert kloridokká alakultak át; a báriumot és a rádiumot ezután frakcionált kristályosítással elválasztottuk, miközben spektroszkóppal (a rádium jellegzetes vörös vonalakat ad a zöld báriumvonalakkal ellentétben) és az elektroszkóp segítségével figyelemmel kísértük a folyamatot .
Miután Marie és Pierre Curie elkülönítették a rádiumot a Joachimsthal -i uránércből, több tudós elkezdte kis mennyiségben elkülöníteni a rádiumot. Később a kis cégek bányadarabokat vásároltak a joachimsthali bányákból, és megkezdték a rádium izolálását. 1904 -ben az osztrák kormány államosította a bányákat, és leállította a nyers érc exportját. Egy ideig a rádium rendelkezésre állása alacsony volt.
Az osztrák monopólium kialakulása és más országok erős késztetése a rádiumhoz való hozzáféréshez világszerte uránérceket kerestek. Az Egyesült Államok az 1910 -es évek elején vette át a vezető gyártót. A koloratói homok Coloradóban biztosítja az elemek egy részét, de gazdagabb ércek találhatók Kongóban, valamint a Kanada északnyugati részén található Nagy Medve -tó és Nagy Szolga -tó területén. A lerakódások egyikét sem rádiumra bányásszák, de az urántartalom nyereségessé teszi a bányászatot.
A Curies -eljárást 1940 -ben még használták ipari rádium -extrakcióra, de ezután kevert bromidokat használtak a frakcionáláshoz. Ha az uránérc báriumtartalma nem elég magas, könnyű hozzáadni a rádium hordozásához. Ezeket az eljárásokat kiváló minőségű uránércekre alkalmazták, de lehet, hogy nem működnek jól alacsony minőségű ércekkel.
Az 1990 -es években még kis mennyiségű rádiumot vontak ki az uránércből ezzel a vegyes kicsapási és ioncserélési módszerrel, de ma már csak kiégett nukleáris fűtőanyagból nyerik ki. 1954 -ben a tisztított rádium összkínálata világszerte körülbelül 2,3 kg volt, és ma is ebben a tartományban van, míg a tiszta rádiumvegyületek éves termelése ma mindössze 100 g. A fő rádiumtermelő országok Belgium, Kanada, Csehország, Szlovákia , az Egyesült Királyság és Oroszország . Az előállított rádium mennyisége viszonylag kicsi volt és mindig is; például 1918 -ban 13,6 g rádiumot állítottak elő az Egyesült Államokban. A fémet a rádium -oxid redukálásával alumíniumfémmel vákuumban, 1200 ° C -on izolálják.
Modern alkalmazások
Atomi, molekuláris és optikai fizika kutatások
A rádium egyre nagyobb mértékben alkalmazható az atomi, molekuláris és optikai fizika területén . A szimmetria megtörő erők skálája arányos azzal , hogy a rádium, a legnehezebb alkáliföld elem, jól alkalmazható az új fizika korlátozására a standard modellen túl. Egyes rádium-izotópok, mint például a 225-ös rádium, oktupól-deformált paritás-duplákkal rendelkeznek, amelyek Hg- hez képest két-három nagyságrenddel növelik az új fizikát sértő töltésparitás érzékenységet .
A rádium ígéretes egy csapdába esett optikai óra tekintetében is . A rádiumionnak két subhertz-vonal szélességű átmenete van az alapállapotból, amelyek óraátmenetként szolgálhatnak egy optikai órában. Ezenkívül a rádium különösen jól alkalmazható egy hordozható optikai órához, mivel az óra működéséhez szükséges összes átmenetet közvetlen diódás lézerekkel lehet kezelni.
Bár a rádiumnak nincs stabil izotópja, tizenegy olyan rádium-izotóp van, amelyek felezési ideje egy percnél hosszabb, és nagy pontossággal összehasonlítható egy King-ábrán. Az izotópeltolódásokat nagy pontossággal lehetett mérni a rádiumion-szubhertz-vonal szélességű átmenetek bármelyikén az alapállapotból, vagy a semleges rádiumban az interkombinációs vonalon. Bármilyen lehetséges nemlinearitás mértéke egy ilyen King -parcellában határt szabhat az új fizikának a standard modellen túl.
A rádium néhány gyakorlati felhasználásának egy része radioaktív tulajdonságaiból származik. A közelmúltban felfedezett radioizotópok , mint például a kobalt-60 és a cézium-137 , még ezekben a korlátozott felhasználásokban is helyettesítik a rádiumot, mivel ezek közül az izotópok közül több erőteljesebb kibocsátó, biztonságosabb kezelni és koncentráltabb formában is elérhető.
A 223 Ra izotópot ( Xofigo márkanév alatt ) az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala 2013 -ban hagyta jóvá az orvostudományban , csontáttétek rák kezelésére . A Xofigo-kezelés fő indikációja a kasztráció-rezisztens prosztatarákból származó csontos áttétek kezelése ezen alfa-sugárzó radiofarmakon kedvező tulajdonságai miatt. A 225 Ra-t a terápiás besugárzással kapcsolatos kísérletekben is alkalmazták, mivel ez az egyetlen ésszerűen hosszú élettartamú rádium-izotóp, amelynek egyik leánya nem tartalmaz radont.
A rádiumot még ma is használják sugárforrásként egyes ipari röntgenkészülékeken, hogy ellenőrizzék a hibás fémrészeket, hasonlóan a röntgenképhez . Berilliummal keverve a rádium neutronforrásként működik . Rádium-berillium neutronforrásokat még ma is használnak néha, de más anyagok, mint például a polónium, ma már gyakoribbak: évente körülbelül 1500 polónium-berillium neutronforrást használtak Oroszországban , 1850 Ci (68 TBq) egyéni aktivitással . Ezek RaBeF 4 -alapú (α, n) neutronforrás már elavult nagy száma ellenére a neutronok bocsátanak ki (1,84 × 10 6 neutronok másodpercenként) mellett 241 Am -be forrásokból. Manapság a 226 Ra izotópot elsősorban atomreaktorban történő neutron besugárzással 227 Ac képzésére használják .
Veszélyek
A rádium erősen radioaktív, és közvetlen leánya, a radon gáz is radioaktív. Lenyeléskor a bevitt rádium 80% -a a széklettel távozik a szervezetből , míg a többi 20% a véráramba kerül , többnyire a csontokban halmozódik fel. A belső vagy külső rádiumnak való kitettség rákot és más rendellenességeket okozhat, mivel a rádium és a radon bomlásuk során alfa- és gamma -sugarakat bocsátanak ki , amelyek elpusztítják és mutálják a sejteket. A manhattani projekt idején, 1944 -ben a dolgozók "tolerancia dózisa" 0,1 mikrogramm lenyelt rádium volt.
A rádium egyes biológiai hatásai közé tartozik az első "rádium-dermatitis" eset, amelyet 1900-ban jelentettek be, két évvel az elem felfedezése után. A francia fizikus, Antoine Becquerel hat órán keresztül hordott egy kis ampullát rádiumot a mellényzsebében, és arról számolt be, hogy a bőre fekélyesedett . Pierre -t és Marie Curie -t annyira felkeltette érdeklődésük a sugárzás iránt, hogy feláldozták saját egészségüket, hogy többet megtudjanak róla. Pierre Curie tíz órára rádiummal töltött csövet erősített a karjához, ami bőrkárosodás megjelenését eredményezte, ami azt sugallja, hogy rádiumot használnak a rákos szövetek megtámadására, ahogy az egészséges szöveteket támadta meg. Marie Curie aplasztikus anémia miatt bekövetkezett haláláért a rádium kezelését okolták . A rádium jelentős veszélye a leány radonból származik: mivel gáz, sokkal könnyebben juthat be a szervezetbe, mint az eredeti rádium.
Ma a 226 Ra -t tartják a legmérgezőbb mennyiségű rádióelemnek, és szűk kesztyűtartóban kell kezelni, jelentős légáramlással, amelyet ezután kezelnek, hogy elkerüljék 222 Rn lánya környezetbe való menekülését . A rádium oldatokat tartalmazó régi ampullákat óvatosan kell kinyitni, mert a víz radiolitikus bomlása hidrogén és oxigéngáz túlnyomását okozhatja. A világ legnagyobb 226 Ra koncentrációját az ideiglenes hulladékgyűjtő szerkezetben tárolják , körülbelül 15,4 km -re északra a New York -i Niagara -vízeséstől .
Lásd még
Megjegyzések
Hivatkozások
Bibliográfia
- Kirby, HW; Salutsky, Murrell L. (1964). A rádium radiokémiája (PDF) . National Academies Press.
- Greenwood, Norman N .; Earnshaw, Alan (1997). Az elemek kémiája (2. kiadás). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
További irodalom
- Albert Stwertka (1998). Útmutató az elemekhez - átdolgozott kiadás . Oxford University Press. ISBN 978-0-19-508083-4.
- Denise Grady (1998. október 6.). "Ragyogás a sötétben, és lecke a tudományos veszedelemben" . A New York Times . Lap 25-December 2007-es .
- Fröman dadus (1996. december 1.). "Marie és Pierre Curie és a polónium és a rádium felfedezése" . Nobel Alapítvány . Lap 25-December 2007-es .
- Macklis, RM (1993). "A nagy rádiumbotrány". Scientific American . 269 (2): 94–99. Bibcode : 1993SciAm.269b..94M . doi : 10.1038/scientificamerican0893-94 . PMID 8351514 .
- Clark, Claudia (1987). Rádium lányok: nők és ipari egészségügyi reform, 1910–1935 . University of North Carolina Press. ISBN 978-0-8078-4640-7.
- Marie Curie (1921), A rádium felfedezése (1. kiadás), Poughkeepsie: Vassar College , Wikidata Q22920166
Külső linkek
- "Oldaltudomány: A rádium felfedezése" . 2012. július 8. Archiválva az eredetiből 2016. március 9 -én . Letöltve: 2017. május 13 .
- Fotók a Radium vízfürdőről Oklahomában
- NLM Veszélyes Anyagok Adatbank - Rádium, Radioaktív
- Annotált bibliográfia a rádium a Alsos Digital Library for Nuclear Issues archivált június 25, 2019 at a Wayback Machine
- Rádium a videók időszakos táblázatában (Nottinghami Egyetem)












