Sarlósejtes anaemia -Sickle cell disease
| Sarlósejtes anaemia | |
|---|---|
| Más nevek | Sarlósejtes rendellenesség |
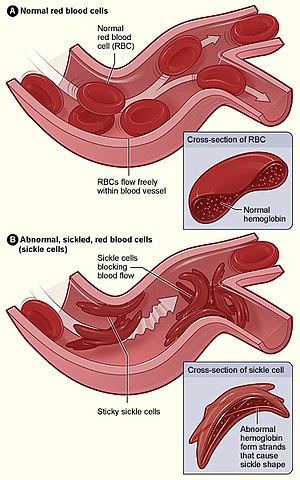 | |
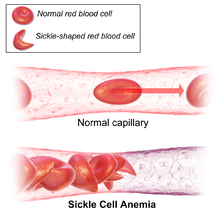
| Az (A) ábra a normál vörösvérsejteket mutatja, amelyek szabadon áramlanak át egy véredényen. A betét egy normál vörösvértest metszetét mutatja normál hemoglobinnal . A (B) ábra abnormális, sarlós vörösvértesteket ábrázol, amelyek egy véredény elágazási pontján tapadnak meg. A beépített képen egy sarlósejt keresztmetszete látható, hosszú polimerizált sarló hemoglobin (HbS) szálakkal, amelyek megnyúlnak és eltorzítják a sejt alakját, hogy úgy nézzen ki, mint egy félhold. | |
| Különlegesség | Hematológia , orvosi genetika |
| Tünetek | Fájdalomrohamok, vérszegénység , kéz- és lábduzzanat , bakteriális fertőzések , szélütés |
| Komplikációk | Krónikus fájdalom , szélütés , aszeptikus csontnekrózis , epekő , lábszárfekély , priapizmus , pulmonális hipertónia , látási problémák , veseproblémák |
| Szokásos kezdet | 5-6 hónapos korban |
| Okoz | Genetikai |
| Diagnosztikai módszer | Vérvizsgálat |
| Kezelés | Védőoltás , antibiotikumok , magas folyadékbevitel, folsavpótlás , fájdalomcsillapítás , vérátömlesztés |
| Prognózis | Várható élettartam 40-60 év (fejlett világ) |
| Frekvencia | 4,4 millió (2015) |
| Halálozások | 114 800 (2015) |
A sarlósejtes betegség ( SCD ) a vérbetegségek egy csoportja, amelyet jellemzően egy személy szüleitől örökölnek . A leggyakoribb típus sarlósejtes vérszegénység néven ismert . Ez a vörösvértestekben található oxigénszállító fehérje, a hemoglobin rendellenességét eredményezi . Ez bizonyos körülmények között merev, sarlószerű alakhoz vezet . A sarlósejtes analízis problémái általában 5-6 hónapos kor körül kezdődnek. Számos egészségügyi probléma alakulhat ki, például fájdalomrohamok ( sarlósejtes krízisként ismert ), vérszegénység , kéz- és lábduzzanat , bakteriális fertőzések és szélütés . Hosszú távú fájdalom alakulhat ki, ahogy az emberek öregszenek. A fejlett világban az átlagos várható élettartam 40-60 év.
A sarlósejtes betegség akkor fordul elő, ha egy személy a hemoglobint termelő β-globin gén ( HBB ) két rendellenes másolatát örökli, mindkét szülőtől egyet. Ez a gén a 11-es kromoszómában fordul elő . Számos altípus létezik, az egyes hemoglobin gének pontos mutációitól függően . A támadást a hőmérséklet-változás, a stressz, a kiszáradás és a nagy magasság indíthatja el. Az egyetlen rendellenes másolattal rendelkező személynek általában nincsenek tünetei, és sarlósejtes tulajdonságokkal rendelkezik . Az ilyen embereket hordozóknak is nevezik . A diagnózis vérvizsgálattal történik , és néhány országban minden születéskor megvizsgálják a betegséget. A diagnózis terhesség alatt is lehetséges.
A sarlósejtes betegségben szenvedők ellátása magában foglalhatja a fertőzések megelőzését védőoltással és antibiotikumokkal , magas folyadékbevitelt, folsav- kiegészítést és fájdalomcsillapítást . Egyéb intézkedések közé tartozhat a vérátömlesztés és a hidroxi- karbamid (hidroxi-karbamid) gyógyszer . Az emberek kis százaléka meggyógyulhat csontvelő-sejtek transzplantációjával .
2015-ben körülbelül 4,4 millió embernek van sarlósejtes betegsége, míg további 43 millió embernek sarlósejtes tulajdonsága van. A sarlósejtes megbetegedések körülbelül 80%-a a szubszaharai Afrikában fordul elő . Viszonylag gyakran előfordul India egyes részein , az Arab-félszigeten és a világ más részein élő afrikai származású emberek körében is. 2015-ben körülbelül 114 800 halálesetet okozott. Az állapotot először James B. Herrick amerikai orvos írta le 1910-ben az orvosi szakirodalomban. 1949-ben az EA Beet és JV Neel határozta meg genetikai átvitelét. 1954- ben írták le a sarlósejtes tulajdonságú malária elleni védő hatást .
jelek és tünetek
A sarlósejtes betegség jelei általában kora gyermekkorban jelentkeznek. A tünetek súlyossága személyenként változhat. A sarlósejtes betegség különféle akut és krónikus szövődményekhez vezethet, amelyek közül többnek magas a halálozási aránya.
Sarlósejtes krízis
A "sarlósejtes krízis" vagy "sarlósejtes krízis" kifejezések számos független akut állapot leírására használhatók, amelyek SCD-ben szenvedő betegeknél fordulnak elő, amelyek vérszegénységhez és sokféle krízishez vezetnek, beleértve az érelzáródásos krízist , aplasztikus krízist , lépszekvestrációs krízis , hemolitikus krízis és mások. A sarlósejtes válságok legtöbb epizódja öt és hét napig tart. "Bár a fertőzés, a kiszáradás és az acidózis (melyek mindegyike kedvez a sarlósodásnak) kiváltó okok lehetnek, a legtöbb esetben nem azonosítanak hajlamosító okot."
Vaso-okkluzív válság
Az érelzáródásos krízist a sarló alakú vörösvérsejtek okozzák, amelyek elzárják a kapillárisokat és korlátozzák a vér áramlását egy szervbe, ami ischaemiát , fájdalmat , nekrózist és gyakran szervkárosodást eredményez. Ezeknek a válságoknak a gyakorisága, súlyossága és időtartama jelentősen eltérő. A fájdalmas kríziseket hidratálással, fájdalomcsillapítókkal és vérátömlesztéssel kezelik ; a fájdalomcsillapításhoz rendszeres időközönként opioid szerek beadása szükséges a válság rendeződéséig. Enyhébb krízisek esetén a betegek egy alcsoportja nem szteroid gyulladáscsökkentő szereket , például diklofenakot vagy naproxent kap . Súlyosabb krízisek esetén a legtöbb beteg intravénás opioidok kórházi kezelését igényli; Ebben a beállításban általában a páciens által irányított fájdalomcsillapító eszközöket használják. A szerveket, például a péniszt vagy a tüdőt érintő vazookkluzív krízis vészhelyzetnek minősül, és vörösvérsejt-transzfúzióval kezelik. Az ösztönző spirometria , egy olyan technika, amely ösztönzi a mély légzést az atelektázia kialakulásának minimalizálása érdekében .
Lépsequestrációs krízis
A lépet gyakran érintik sarlósejtes betegségben, mivel a sarló alakú vörösvértestek az erek beszűkülését és csökkentik a hibás sejtek tisztításának funkcióját. A sarlósejtes vérszegénységben szenvedő egyéneknél általában gyermekkor vége előtt infarktust kap. Ez a lépkárosodás növeli a kapszulázott organizmusok fertőzésének kockázatát ; a megfelelő lépműködés hiányában megelőző antibiotikumok és védőoltások javasoltak .
A lépszekvesztrálási krízisek a lép akut, fájdalmas megnagyobbodása, amelyet a vörösvértestek lépen belüli befogása okoz, és ami a hemoglobinszint rohamos csökkenését eredményezi, ami hipovolémiás sokkot okozhat. A szekvesztrálási válságok vészhelyzetnek minősülnek. Ha nem kezelik, a betegek 1-2 órán belül meghalhatnak keringési elégtelenség miatt. A kezelés támogató, néha vérátömlesztéssel. Ezek a válságok átmenetiek; 3-4 óráig tartanak, és akár egy napig is eltarthatnak.
Akut mellkasi szindróma
Az akut mellkasi szindrómát az alábbi jelek vagy tünetek közül legalább kettő határozza meg: mellkasi fájdalom, láz, tüdőinfiltrátum vagy fokális rendellenesség, légúti tünetek vagy hipoxémia. Ez a második leggyakoribb szövődmény, és az SCD-ben szenvedő betegek halálozásának körülbelül 25%-áért felelős. A legtöbb esetben vazookkluzív krízisek jelentkeznek, majd akut mellkasi szindróma alakul ki. Ennek ellenére az emberek körülbelül 80%-a érelzáródásos krízisben szenved az akut mellkasi szindróma során.
Aplasztikus válság
Az aplasztikus krízisek a beteg kiindulási anémiájának akut súlyosbodását jelentik, ami sápadt megjelenést , gyors szívverést és fáradtságot okoz. Ezt a válságot általában a parvovírus B19 váltja ki , amely közvetlenül befolyásolja a vörösvértestek termelését azáltal, hogy behatol a vörösvértest-prekurzorokba, és elszaporodik és elpusztítja azokat. A parvovírus fertőzés két-három napig szinte teljesen megakadályozza a vörösvértestek termelését. Normális egyéneknél ennek kevés a következménye, de az SCD-s betegek vörösvértest-élettartamának lerövidülése hirtelen, életveszélyes helyzetet eredményez. A betegség során a retikulocitaszám drámaian csökken ( retikulocitopéniát okoz ), a vörösvértestek gyors cseréje pedig a hemoglobinszint csökkenéséhez vezet. Ez a válság 4-7 nap alatt megszűnik. A legtöbb beteg szupportív módon kezelhető; egyeseknek vérátömlesztésre van szükségük.
Haemolitikus válság
A hemolitikus krízisek a hemoglobinszint akut, felgyorsult csökkenése. A vörösvértestek gyorsabban bomlanak le. Ez különösen gyakori azoknál az embereknél, akiknél egyidejűleg G6PD-hiány áll fenn . A kezelés támogató, néha vérátömlesztéssel.
Egyéb
Az egyik legkorábbi klinikai megnyilvánulás a dactilitis , amely már hat hónapos korban jelentkezik, és előfordulhat sarlósejtes tulajdonságú gyermekeknél. A válság akár egy hónapig is eltarthat. Tekintettel arra, hogy a tüdőgyulladás és a tüdő sarlósodása egyaránt okozhat akut mellkasi szindróma tüneteit, a beteget mindkét állapot miatt kezelik. Kiválthatja fájdalmas krízis, légúti fertőzés, csontvelő-embólia, esetleg atelektázia, opiát adás vagy műtét. Hematopoietikus fekélyek is előfordulhatnak.
Komplikációk
A sarlósejtes vérszegénység különféle szövődményekhez vezethet, beleértve:
- A súlyos bakteriális fertőzések fokozott kockázata a működő lépszövet elvesztésének köszönhető (és összemérhető a lép műtéti eltávolítása utáni fertőzések kockázatával ). Ezeket a fertőzéseket jellemzően olyan kapszulázott szervezetek okozzák, mint a Streptococcus pneumoniae és a Haemophilus influenzae . A napi penicillin profilaxis a leggyakrabban alkalmazott kezelés gyermekkorban, és egyes hematológusok határozatlan ideig folytatják a kezelést. Ma a betegek számára előnyös a S. pneumoniae elleni rutin vakcinázás .
- A szélütés , amely az erek fokozatos beszűküléséből adódhat, megakadályozza, hogy az oxigén elérje az agyat . Gyermekeknél agyi infarktus, felnőtteknél agyvérzés fordul elő.
- A csendes stroke nem okoz azonnali tüneteket, de az agykárosodáshoz kapcsolódik. A csendes stroke valószínűleg ötször gyakoribb, mint a tüneti stroke. Az SCD-ben szenvedő gyermekek körülbelül 10-15%-a szenved szélütésben, a fiatalabb betegeknél a csendes stroke dominál.
- Cholelithiasis (epekő) és epehólyag -gyulladás a túlzott bilirubintermelésből és az elhúzódó hemolízis miatti kicsapódásból eredhet .
- A csípő és más nagyobb ízületek érelhalása ( aszeptikus csontnekrózis ) ischaemia következtében fordulhat elő.
- Csökkent immunreakciók hyposplenismus (a lép hibás működése) miatt
- Priapizmus és péniszinfarktus _ _
- Osteomyelitis (bakteriális csontfertőzés), az osteomyelitis leggyakoribb oka SCD-ben a Salmonella (különösen az atípusos Salmonella typhimurium, Salmonella enteritidis, Salmonella choleraesuis és Salmonella paratyphi B szerotípusok), ezt követi a Staphylococcus aureus és a Gram-negatív enterális intravascularis kórkép miatt. a bél sarlósodása foltos ischaemiás infarktushoz vezet.
- Akut papilláris nekrózis a vesékben
- Lábszárfekélyek
- Szemben háttérretinopátia, proliferatív retinopátia, üvegtesti vérzések és retinaleválások vakságot eredményezhetnek. Rendszeres éves szemellenőrzés javasolt.
- Terhesség alatt méhen belüli növekedési korlátozás , spontán abortusz és pre-eclampsia
- Krónikus fájdalom: Sok betegnél még az akut vazookkluzív fájdalom hiányában is jelentkezik krónikus fájdalom.
- A pulmonális hipertónia (a pulmonális artériára nehezedő fokozott nyomás ) a jobb kamra megterheléséhez és a szívelégtelenség kockázatához vezethet ; tipikus tünetek a légszomj, a csökkent terhelési tolerancia és a syncope epizódok . A vizsgálatok során a gyermekek 21%-ánál és a felnőttek 30%-ánál mutatkozott pulmonális hipertónia; ez a gyalogos távolság csökkenésével és a halálozás növekedésével jár.
- Cardiomyopathia és bal kamrai diasztolés diszfunkció , amelyet a szívszövetek fibrózisa vagy hegesedése okoz. Ez szintén hozzájárul a pulmonális hipertóniához, a csökkent fizikai aktivitáshoz és az aritmiákhoz .
- A sarlósejtes nefropátia miatt kialakuló krónikus veseelégtelenség magas vérnyomással , fehérjeveszteséggel a vizeletben , vörösvértestek elvesztésével a vizeletben és súlyosbodó vérszegénységgel nyilvánul meg . Ha végstádiumú veseelégtelenségig fejlődik, rossz prognózist hordoz.
Genetika

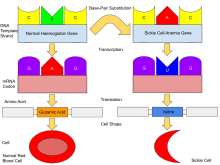
Normális esetben az emberek testében a hemoglobin A , amely két alfa és két béta láncból áll, a hemoglobin A2 , amely két alfa és két delta láncból áll, és a hemoglobin F (HbF), amely két alfa és két gamma láncból áll. E három típus közül a hemoglobin F dominál körülbelül 6 hetes korig. Ezt követően a hemoglobin A dominál az élet során. A sarlósejtes betegséggel diagnosztizált betegeknél a hemoglobin A β-globin alegységei közül legalább egyet helyettesítenek az úgynevezett hemoglobin S-sel. Sarlósejtes vérszegénységben, a sarlósejtes betegség gyakori formája, a hemoglobin S mindkét β-globint helyettesíti. alegységei a hemoglobinban.
A sarlósejtes betegség autoszomális recesszív módon öröklődik a szülőktől. Az, hogy egy személy milyen típusú hemoglobint termel a vörösvértestekben, attól függ, hogy milyen hemoglobingéneket örököltek tőle vagy szüleitől. Ha az egyik szülőnek sarlósejtes vérszegénysége van, a másiknak pedig sarlósejtes tulajdonsága van, akkor a gyermeknél 50% esély van a sarlósejtes vérszegénységre, és 50% a sarlósejtes vérszegénységre. Ha mindkét szülő sarlósejtes tulajdonsággal rendelkezik, a gyermeknek 25% az esélye a sarlósejtes betegségre; 25%-uk nem hordoz sarlósejtes allélt, és 50%-uk heterozigóta állapotú.
A sarlósejtes génmutáció valószínűleg spontán módon keletkezett különböző földrajzi területeken, amint azt a restrikciós endonukleáz analízis is sugallja. Ezek a változatok Kamerun, Szenegál, Benin, Bantu és Szaúd-Ázsiai néven ismertek. Klinikai jelentőségük az, hogy egyesek magasabb HbF-szinttel társulnak, pl. a szenegáli és a szaúd-ázsiai változatok, és általában enyhébb betegségük van.
A génhiba a β-globin gén egyetlen nukleotidos mutációja (lásd egynukleotidos polimorfizmus – SNP) (GAG kodon GTG-re változik), ami azt eredményezi, hogy a glutamátot (E/Glu) valin (V/Val) helyettesíti. 6. pozíció (E6V helyettesítés). Az ezzel a mutációval rendelkező hemoglobin S-t HbS-nek nevezik, szemben a normál felnőtt HbA-val. Ez általában jóindulatú mutáció, amely normális oxigénkoncentráció mellett nem okoz nyilvánvaló hatást a hemoglobin másodlagos , harmadlagos vagy kvaterner szerkezetére . Alacsony oxigénkoncentráció mellett azonban a HbS polimerizálódik és rostos csapadékot képez, mivel a hemoglobin dezoxiformája hidrofób foltot tesz fel a fehérjén az E és F hélixek között (Phe 85, Leu 88).
A HbS -re heterozigóta emberekben (sarlós hemoglobin hordozói ) a polimerizációs problémák csekélyek, mivel a normál allél a hemoglobin felét képes előállítani. A HbS-re homozigóta emberekben a hosszú láncú HbS polimerek jelenléte a vörösvértestek alakját sima, fánkszerű alakról rongyosra és tüskékkel teli alakra torzítja , ami törékennyé és hajlamossá teszi a kapillárisokon belüli betörésre . A hordozóknak csak akkor vannak tünetei, ha oxigénhiányban szenvednek (például hegymászás közben), vagy ha súlyosan kiszáradnak .

A sarlósejtes vérszegénységért felelős allél a 11. kromoszóma rövid karján található , pontosabban a 11p15.5. Az a személy, aki apától és anyától is megkapja a hibás gént, kifejti a betegséget; az a személy, aki egy hibás és egy egészséges allélt kap, egészséges marad, de továbbadhatja a betegséget, és hordozóként vagy heterozigótaként ismert. A heterozigóták továbbra is képesek elkapni a maláriát, de tüneteik általában kevésbé súlyosak.
A heterozigóta adaptív előnye miatt a betegség továbbra is elterjedt, különösen a malária által sújtott területeken, például Afrikában , a Földközi -tengeren , Indiában és a Közel-Keleten élő emberek körében . A malária történelmileg honos volt Dél-Európában, de a 20. század közepén – a ritka szórványos esetek kivételével – kiirtottnak nyilvánították.
A maláriás parazita összetett életciklusú, és egy részét a vörösvértestekben tölti. Egy hordozóban a maláriaparazita jelenléte a hibás hemoglobinnal rendelkező vörösvértestek idő előtti megrepedését okozza, ami miatt a Plasmodium parazita nem képes szaporodni. Ezenkívül a Hb polimerizációja elsősorban a parazita Hb-emésztési képességét befolyásolja. Ezért azokon a területeken, ahol a malária problémát jelent, az emberek túlélési esélyei valóban nőnek, ha sarlósejtes tulajdonságokat hordoznak (a heterozigóta szelekciója).
Az Egyesült Államokban, ahol nincs endémiás malária, a sarlósejtes vérszegénység előfordulása az afrikai származásúak körében alacsonyabb (körülbelül 0,25%), mint Nyugat-Afrikában (körülbelül 4,0%), és csökken. Endémiás malária nélkül a sarlósejtes mutáció tisztán hátrányos, és hajlamos csökkenni az érintett populációban a természetes szelekció révén, most pedig mesterségesen a prenatális genetikai szűrés révén . Az afroamerikai közösség azonban számos afrikai és nem afrikai etnikai csoport jelentős keveredéséből származik, és a rabszolgaság és a rabszolga-kereskedelem túlélőinek leszármazottait is képviseli. Így a nem afrikai emberekkel való keresztezésből eredő bizonyos fokú genetikai felhígulás és a rabszolgaságból eredő magas egészségügyi szelektív nyomás (különösen a rabszolga-kereskedelem és a gyakran halálos Middle Passage ) lehet a legvalószínűbb magyarázat a sarlósejtes vérszegénység alacsonyabb előfordulására (és , esetleg más genetikai betegségek) az afroamerikaiak körében a nyugat-afrikaiakhoz képest. Egy másik tényező, amely korlátozza a sarlósejtes gének terjedését Észak-Amerikában, a poligámia relatív hiánya . A poligám társadalmakban az érintett férfiak sok gyermeket nemzhetnek több partnerrel.
Kórélettan

A vörösvértestek rugalmasságának elvesztése központi szerepet játszik a sarlósejtes betegség patofiziológiájában. A normál vörösvérsejtek meglehetősen rugalmasak és bikonkáv korong alakúak, ami lehetővé teszi a sejtek deformálódását, hogy áthaladjanak a kapillárisokon. Sarlósejtes betegségben az alacsony oxigénfeszültség elősegíti a vörösvértestek sarlósodását, az ismétlődő sarlós epizódok pedig károsítják a sejtmembránt és csökkentik a sejt rugalmasságát. Ezek a sejtek nem térnek vissza normális alakjukba, amikor a normál oxigénfeszültség helyreáll. Következésképpen ezek a merev vérsejtek nem tudnak deformálódni, amikor szűk hajszálereken haladnak keresztül, ami érelzáródáshoz és ischaemiához vezet .
A betegség tényleges vérszegénységét a hemolízis , a vörösvértestek alakjuk miatti pusztulása okozza. Bár a csontvelő új vörösvértestek létrehozásával próbálja kompenzálni, ez nem felel meg a pusztulás mértékének. Az egészséges vörösvérsejtek általában 90-120 napig működnek, de a sarlós sejtek csak 10-20 napig.
Diagnózis
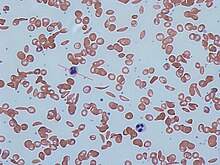
A HbS-ben a teljes vérkép 6-8 g/dl hemoglobinszintet mutat ki magas retikulocitaszám mellett (mivel a csontvelő több vörösvérsejt termelésével kompenzálja a sarlós sejtek pusztulását). A sarlósejtes betegség más formáiban a Hb-szint általában magasabb. A vérfilmen megjelenhetnek a hyposplenizmus jellemzői ( célsejtek és Howell-Jolly testek ).
A vörösvérsejtek sarlósodását a vérfilmen nátrium-metabiszulfit hozzáadásával lehet előidézni . A sarlós hemoglobin jelenléte a "sarlóoldékonysági teszttel" (más néven "sarlós oldhatósági teszttel") is kimutatható. A hemoglobin S (HbS) elegye redukáló oldatban (például nátrium-ditionitban ) zavaros megjelenést kölcsönöz, míg a normál Hb tiszta oldatot ad.
A kóros hemoglobinformák kimutathatók hemoglobin-elektroforézissel , amely a gélelektroforézis egy olyan formája, amelyen a különböző típusú hemoglobin változó sebességgel mozog. A sarlósejtes hemoglobin (HgbS) és a sarlós hemoglobin C (HgbSC) – a két leggyakoribb forma – innen azonosítható. A diagnózist nagy teljesítményű folyadékkromatográfiával lehet megerősíteni . Genetikai vizsgálatot ritkán végeznek, mivel más vizsgálatok nagyon specifikusak a HbS-re és a HbC-re.
Az akut sarlósejtes krízist gyakran fertőzés váltja ki. Ezért rutinszerűen el kell végezni a vizeletvizsgálatot az okkult húgyúti fertőzés kimutatására, valamint a mellkas röntgenfelvételét az okkult tüdőgyulladás felderítésére.
Azok az emberek, akik ismerten hordozói a betegségnek, vagy akiknél fennáll a sarlósejtes vérszegénységben szenvedő gyermekvállalás kockázata, genetikai tanácsadáson vehetnek részt . A genetikai tanácsadók a családokkal együttműködve megvitatják a genetikai vizsgálati lehetőségek előnyeit, korlátait és logisztikáját, valamint a tesztelés és a teszteredmények egyénre gyakorolt lehetséges hatását. Terhesség alatt a genetikai vizsgálat elvégezhető a magzat vérmintáján vagy a magzatvíz mintáján . Mivel a magzati vérminta vétele nagyobb kockázattal jár, általában az utóbbi tesztet alkalmazzák. Az újszülöttek szűrése, amelyet néha újszülöttek szűrésének is neveznek, nemcsak a sarlósejtes betegségben szenvedő egyének korai felismerésének módszerét kínálja, hanem lehetővé teszi a sarlósejtes tulajdonságot hordozó embercsoportok azonosítását is. A genetikai tanácsadók segíthetnek a színes bőrű egyéneknek és családjaiknak az egészségügyben tapasztalható faji és etnikai különbségek leküzdésében.
2010-ben az Egyesült Államokban jelentős megfontolások és viták folytak a sportolók SCD-re vonatkozó átfogó szűréséről. Az American Society of Hematology 2012-es nyilatkozatában arra a következtetésre jutott, hogy nem támogatják a sarlósejtes tulajdonságok vizsgálatát vagy felfedését a sporttevékenységekben való részvétel előfeltételeként a tudományos bizonyítékok hiánya, a helyes orvosi gyakorlattal való összeegyeztethetetlenség és a közegészségügy ellentmondása miatt. etika. Univerzális beavatkozásokat javasoltak az erőkifejtéssel összefüggő sérülések és halálozások csökkentése érdekében, amely minden sportoló számára hatékony, sarlósejtes állapotától függetlenül.
Menedzsment
A kezelés számos intézkedést foglal magában. Míg a történelem során azt javasolták, hogy a sarlósejtes betegségben szenvedők kerüljék a testmozgást, a rendszeres testmozgás előnyös lehet az emberek számára. A kiszáradást kerülni kell. A kalciumban gazdag étrend javasolt, de a D-vitamin- pótlás hatékonysága továbbra is bizonytalan. Az L-glutamin használatát öt éves kortól támogatta az FDA, mivel csökkenti a szövődményeket.
Folsav és penicillin
Születéstől öt éves korig napi penicillin adása javasolt, mivel az immunrendszer éretlen, ami hajlamosabbá teszi őket a korai gyermekkori betegségekre. A WHO már korábban javasolta a folsav étrend-kiegészítését . Egy 2016 -os Cochrane -felülvizsgálat megállapította, hogy "a kiegészítés hatása anémiára és a vérszegénység bármely tünetére továbbra is tisztázatlan" az orvosi bizonyítékok hiánya miatt.
Malária megelőzés
A sarlósejtes tulajdonság védő hatása nem vonatkozik a sarlósejtes betegségben szenvedőkre; valójában sebezhetőbbek a maláriával szemben, mivel a maláriás országokban a fájdalmas válságok leggyakoribb oka a malária fertőzés. A maláriás országokban élő sarlósejtes betegségben szenvedőknek élethosszig tartó gyógyszeres kezelést kell kapniuk a megelőzés érdekében .
Vaso-okkluzív válság
A legtöbb sarlósejtes betegségben szenvedő embernek erősen fájdalmas epizódjai vannak, amelyeket érelzáródásos kríziseknek neveznek. Azonban ezeknek a válságoknak a gyakorisága, súlyossága és időtartama rendkívül eltérő. A fájdalmas kríziseket fájdalomcsillapítókkal tünetileg kezelik ; a fájdalomcsillapításhoz rendszeres időközönként opioid szerek beadása szükséges a válság rendeződéséig. Enyhébb krízisek esetén a betegek egy alcsoportja kezel NSAID -okat (például diklofenakot vagy naproxent ). Súlyosabb krízisek esetén a legtöbb beteg intravénás opioidok kórházi kezelését igényli.
Az orálisan vagy intravénásan beadott extra folyadék a vazookkluzív krízisek kezelésének rutinszerű részét képezi, de a folyadékpótlás leghatékonyabb módjára, mennyiségére és típusára vonatkozó bizonyítékok továbbra is bizonytalanok.
A crizanlizumabot , a p-szelektin elleni monoklonális antitestet 2019-ben hagyták jóvá az Egyesült Államokban, hogy csökkentsék az érelzáródásos krízisek gyakoriságát a 16 éves és idősebb korosztályban.
Stroke megelőzés
A transzkraniális Doppler ultrahang (TCD) képes kimutatni a sarlósejtes gyermekeket, akiknél magas a stroke kockázata. Az ultrahangvizsgálat a sarlósejtek által részben elzárt ereket az agyba jutó vér sebességének mérésével észleli, mivel a véráramlás sebessége fordítottan arányos az artéria átmérőjével, következésképpen a nagy véráramlási sebesség az artériák szűkületével függ össze. 2002-ben az Országos Egészségügyi Intézet (NIH) közleményt adott ki, amelyben azt javasolta, hogy a sarlósejtes gyermekek évente végezzenek transzkraniális Doppler ultrahang szűrést, 2014-ben pedig az NIH által összehívott szakértői testület iránymutatást adott ki, amelyben megismételte ugyanezt az ajánlást. Dr. Julie Kanter hematológus, a Birminghami Alabamai Egyetem orvosi feljegyzéseinek egyik áttekintése kimutatta, hogy átlagosan a sarlósejtes gyermekek 48,4 százaléka kapja meg az ajánlott ultrahangvizsgálatot.
Egy 1994-es NIH-tanulmány kimutatta, hogy a stroke kockázatának kitett gyermekeknél, akik vérátömlesztést kaptak, az éves stroke aránya kevesebb mint 1 százalék volt, míg azoknál a gyerekeknél, akik nem kaptak vérátömlesztést, évi 10 százalékos stroke-arányt tapasztaltak. (Lásd még a New England Journal of Medicine 1998-as tanulmányát .) Az ultrahangok és vérátömlesztések mellett az olcsó generikus gyógyszer, a hidroxi-karbamid csökkentheti a visszafordíthatatlan szerv- és agykárosodás kockázatát. Az NIH 2014-ben közzétett irányelvei kimondják, hogy minden gyermeknek és serdülőnek hidroxi-karbamidot kell szednie, csakúgy, mint azoknak a felnőtteknek, akik súlyos szövődményekkel vagy három vagy több fájdalomkrízisben szenvednek egy éven belül.
Akut mellkasi szindróma
A kezelés hasonló a vazookkluzív krízishez, antibiotikumok hozzáadásával (általában kinolon vagy makrolid, mivel sejtfalhiányos ["atipikus"] baktériumokról feltételezik, hogy hozzájárulnak a szindrómához), oxigénpótlással hipoxia esetén és szoros megfigyeléssel. A sarlósejtes analízisben szenvedő betegek akut mellkasi szindrómájában az antibiotikumok hatékonyságára vonatkozó magas színvonalú bizonyítékok hiányában 2019-től nincs szabványos antibiotikus kezelés. Javasoljuk, hogy az akut mellkasi szindróma gyanújával rendelkező személyeket kórházba helyezzék. az Aa gradiens romlása az intenzív osztályra történő felvétel indikációja.
Ha a tüdőinfiltráció súlyosbodik vagy az oxigénigény megnő, egyszerű vértranszfúzió vagy cseretranszfúzió javasolt . Ez utóbbi magában foglalja az egyén vörösvértest-tömegének jelentős részének normál vörösvértestekre cseréjét, ami csökkenti a hemoglobin S szintjét a beteg vérében. Jelenleg azonban bizonytalan bizonyítékok állnak rendelkezésre a vérátömlesztés lehetséges előnyeiről vagy ártalmairól az akut mellkasi szindrómában szenvedő betegeknél.
Hidroxi-karbamid
A hidroxi-karbamid , más néven hidroxi -karbamid , valószínűleg csökkenti a fájdalmas epizódok gyakoriságát és az életveszélyes betegség vagy halál kockázatát, de jelenleg nincs elegendő bizonyíték a káros hatások kockázatára vonatkozóan. A hidroxi-karbamid és a flebotómia együttes alkalmazása hatékonyabb lehet, mint a transzfúzió és a kelát együttes alkalmazása a fájdalom, az életveszélyes betegség és a halálozás kockázata szempontjából.
Ez volt az első jóváhagyott gyógyszer a sarlósejtes vérszegénység kezelésére, és 1995-ben kimutatták, hogy csökkentette a rohamok számát és súlyosságát, és egy 2003-as vizsgálatban kimutatták, hogy növeli a túlélési időt. Ezt részben a magzati reaktiválással érik el. hemoglobintermelés a hemoglobin S helyett, amely sarlósejtes vérszegénységet okoz. A hidroxi-karbamidot korábban kemoterápiás szerként használták, és bizonyos aggodalomra ad okot, hogy a hosszú távú használat káros lehet, de ez a kockázat vagy hiányzik, vagy nagyon kicsi, és az előnyök valószínűleg meghaladják a kockázatokat.
A Voxelotort 2019 -ben hagyták jóvá az Egyesült Államokban, hogy növelje a hemoglobinszintet SS-betegségben szenvedőknél.
Vérátömlesztés
A vérátömlesztést gyakran alkalmazzák a sarlósejtes betegség kezelésére akut esetekben, és a szövődmények megelőzésére azáltal, hogy csökkentik a sarlóképes vörösvértestek számát normál vörösvérsejtek hozzáadásával. Gyermekeknél kimutatták, hogy a megelőző vörösvértest- transzfúziós terápia csökkenti az első stroke vagy a csendes stroke kockázatát, ha a koponyán keresztüli Doppler ultrahangvizsgálat rendellenes agyi véráramlást mutat. Azoknál, akiknek korábban volt stroke-ja, csökkenti az ismétlődő stroke és a további csendes stroke kockázatát.
Csontvelő átültetés
A csontvelő-transzplantáció hatékonynak bizonyult gyermekeknél; ezek az egyetlen ismert gyógymód az SCD-re. A csontvelő-transzplantációt azonban nehéz megszerezni, mivel a szükséges specifikus HLA-tipizálás. Ideális esetben egy közeli hozzátartozó (allogén) adományozná a transzplantációhoz szükséges csontvelőt. Egyes génterápiák fejlesztés alatt állnak, amelyek ex vivo megváltoztatnák a páciens saját csontvelői őssejtjeit , amelyeket aztán vissza lehet ültetni a betegbe, miután a kemoterápia megszünteti az eredeti, nem módosított sejteket.
Vascularis nekrózis
Sarlósejtes analízisben szenvedő betegeknél a csont vaszkuláris nekrózisának kezelésekor a kezelés célja a fájdalom csökkentése vagy megszüntetése, valamint az ízületek mozgékonyságának fenntartása. A jelenlegi kezelési lehetőségek közé tartozik az ízület pihentetése, a fizikoterápia , a fájdalomcsillapító gyógyszer , az ízületpótló műtét vagy a csontátültetés . Kiváló minőségű, randomizált, ellenőrzött vizsgálatokra van szükség a leghatékonyabb kezelési lehetőség felméréséhez, és annak megállapításához, hogy a fizikoterápia és a műtét kombinációja hatékonyabb-e, mint a fizikoterápia önmagában.
Pszichológiai terápiák
Az olyan pszichológiai terápiák, mint a betegoktatás , a kognitív terápia , a viselkedésterápia és a pszichodinamikus pszichoterápia , amelyek célja a jelenlegi orvosi kezelések kiegészítése, további kutatásokat igényelnek hatékonyságuk meghatározásához.
Prognózis
Az emberek körülbelül 90%-a túléli 20 éves korát, és közel 50%-a túléli 50 éves korát. 2001-ben egy Jamaicán végzett tanulmány szerint a homozigóta SCD-ben szenvedő emberek becsült átlagos túlélése 53 év, a nők esetében pedig 58 év volt. . A fejlődő világ nagy részén a várható élettartam nem ismert. 1975-ben az SCD-ben szenvedők körülbelül 7,3%-a halt meg 23. születésnapja előtt; míg 1989-ben az SCD-ben szenvedők 2,6%-a halt meg 20 éves korára.
Járványtan
A sarlósejtes betegség leggyakoribb gyakorisága a trópusi régiókban, különösen a szubszaharai Afrikában, India törzsi régióiban és a Közel-Keleten található. Jelentős populációk vándorlása ezekről a magas prevalenciájú területekről az alacsony prevalenciájú európai országokba az elmúlt évtizedekben drámaian megnövekedett, és néhány európai országban a sarlósejtes betegség mára már az ismertebb genetikai állapotokat, például a hemofíliát és a cisztás fibrózist megelőzte . 2015-ben körülbelül 114 800 halálesetet okozott.
A sarlósejtes betegség gyakrabban fordul elő olyan embereknél, akiknek ősei trópusi és szubtrópusi szubszaharai régiókban éltek, ahol gyakori vagy volt malária. Ahol gyakori a malária, az egyetlen sarlósejtes allél (tulajdonság) hordozása heterozigóta előnyt jelent ; a sarlósejtes analízis két allélja közül az egyikben szenvedő emberek kevésbé súlyos tüneteket mutatnak, ha maláriával fertőződnek meg.
Ez az állapot autoszomális recesszív mintázatban öröklődik, ami azt jelenti, hogy az egyes sejtekben a gén mindkét másolata mutációkkal rendelkezik. A szülők mindegyike hordozza a mutált gén egy példányát, de jellemzően nem mutatják az állapot jeleit és tüneteit.
Afrika
A sarlósejtes esetek háromnegyede Afrikában fordul elő. Egy közelmúltbeli WHO -jelentés becslése szerint Nigériában az újszülöttek körülbelül 2%-át érinti sarlósejtes vérszegénység, így csak Nigériában évente 150 000 érintett gyermek születik. A vivőfrekvencia 10 és 40% között mozog az egyenlítői Afrikában, az észak-afrikai partvidéken 1-2%-ra, Dél-Afrikában pedig 1%-ra csökken. Afrikában végzett vizsgálatok azt mutatják, hogy a 2–16 hónapos korú csecsemők mortalitása jelentősen csökkent a sarlósejtes tulajdonság miatt. Ez azokon a területeken történt, ahol túlnyomórészt maláriás esetek fordultak elő.
Ugandában az ötödik legmagasabb a sarlósejtes betegség Afrikában. Egy tanulmány azt mutatja, hogy évente 20 000 csecsemő születik sarlósejtes betegséggel, amelynek 13,3%-a sarlósejtes, és 0,7%-a betegség.
| Ország | Népesség (2020) | Alrégió | A prevalencia %-a | Prevalencia | Előfordulása |
| Angola | 32,866,272 | Közép-Afrika | 0,09375 | 3,081,213 | 14,869 |
| Kamerun | 26,545,863 | Közép-Afrika | 0,117 | 3,105,866 | 11,826 |
| Kongói DR | 89,561,403 | Közép-Afrika | 0,1163333333 | 10,418,977 | 65 536 |
| Ghána | 31,072,940 | Nyugat-Afrika | 0,09375 | 2,913,088 | 9,588 |
| Guinea | 13,132,795 | Nyugat-Afrika | 0,139375 | 1,830,383 | 8,907 |
| Niger | 24,206,644 | Nyugat-Afrika | 0,07025 | 1 700 517 | 8,756 |
| Nigéria | 206 139 589 | Nyugat-Afrika | 0,1286666667 | 26,523,294 | 150 000 |
| Tanzánia | 59,734,218 | Kelet-Afrika | 0,0545 | 3,255,515 | 19,585 |
| Uganda | 45,741,007 | Kelet-Afrika | 0,07025 | 3,213,306 | 17 936 |
| Zambia | 18,383,955 | Kelet-Afrika | 0,082 | 1,507,484 | 9,958 |
| Algéria | 43,851,044 | Észak-Afrika | 0,029 | 1,271,680 | 6,624 |
| Benin | 12,123,200 | Nyugat-Afrika | 0,1286666667 | 1,559,852 | 8,125 |
| Botswana | 2,351,627 | Dél-Afrika | 0,029 | 68,197 | 355 |
| Burkina Faso | 20,903,273 | Nyugat-Afrika | 0,07025 | 1,468,455 | 7,649 |
| Burundi | 11,890,784 | Kelet-Afrika | 0,023 | 273 488 | 1,425 |
| Cabo Verde | 555 987 | Nyugat-Afrika | 0,023 | 12,788 | 67 |
| Közép-Afrikai Köztársaság | 4,829,767 | Közép-Afrika | 0,082 | 396 041 | 2,063 |
| Csád | 16,425,864 | Közép-Afrika | 0,0585 | 960 913 | 5005 |
| Comore-szigetek | 869 601 | Kelet-Afrika | 0,023 | 20 001 | 104 |
| Kongó | 5,518,087 | Közép-Afrika | 0,1615 | 891,171 | 4,642 |
| Elefántcsontpart | 26,378,274 | Nyugat-Afrika | 0,07025 | 1,853,074 | 9,652 |
| Dzsibuti | 988 000 | Kelet-Afrika | 0,023 | 22,724 | 118 |
| Egyiptom | 102,334,404 | Észak-Afrika | 0,029 | 2,967,698 | 15,458 |
| Egyenlítői-Guinea | 1,402,985 | Közép-Afrika | 0,181 | 253 940 | 1,323 |
| Eritrea | 3,546,421 | Kelet-Afrika | 0,023 | 81,568 | 425 |
| Eswatini | 1,160,164 | Dél-Afrika | 0,023 | 26,684 | 139 |
| Etiópia | 114 963 588 | Kelet-Afrika | 0,029 | 3,333,944 | 17,366 |
| Gabon | 2,225,734 | Közép-Afrika | 0,181 | 402,858 | 2,098 |
| Gambia | 2,416,668 | Nyugat-Afrika | 0,082 | 198,167 | 1,032 |
| Bissau-Guinea | 1 968 001 | Nyugat-Afrika | 0,035 | 68 880 | 359 |
| Kenya | 53,771,296 | Kelet-Afrika | 0,04675 | 2,513,808 | 13,094 |
| Lesotho | 2,142,249 | Dél-Afrika | 0,023 | 49,272 | 257 |
| Libéria | 5,057,681 | Nyugat-Afrika | 0,07025 | 355 302 | 1,851 |
| Líbia | 6,871,292 | Észak-Afrika | 0,029 | 199,267 | 1,038 |
| Madagaszkár | 27,691,018 | Kelet-Afrika | 0,04675 | 1,294,555 | 6,743 |
| Malawi | 19,129,952 | Kelet-Afrika | 0,035 | 669 548 | 3,488 |
| Mali | 20,250,833 | Nyugat-Afrika | 0,082 | 1,660,568 | 8,650 |
| Mauritánia | 4,649,658 | Nyugat-Afrika | 0,04675 | 217 372 | 1,132 |
| Mauritius | 1,271,768 | Kelet-Afrika | 0,023 | 29,251 | 152 |
| Marokkó | 36.910.560 | Észak-Afrika | 0,029 | 1 070 406 | 5,576 |
| Mozambik | 31,255,435 | Kelet-Afrika | 0,035 | 1,093,940 | 5,698 |
| Namíbia | 2,540,905 | Dél-Afrika | 0,03883333333 | 98,672 | 514 |
| Ruanda | 12,952,218 | Kelet-Afrika | 0,035 | 453 328 | 2,361 |
| Sao Tome és Principe | 219,159 | Közép-Afrika | 0,181 | 39,668 | 207 |
| Szenegál | 16,743,927 | Nyugat-Afrika | 0,07025 | 1,176,261 | 6,127 |
| Seychelle-szigetek | 98.347 | Kelet-Afrika | 0,023 | 2,262 | 12 |
| Sierra Leone | 7,976,983 | Nyugat-Afrika | 0,1615 | 1,288,283 | 6,711 |
| Szomália | 15,893,222 | Kelet-Afrika | 0,029 | 460 903 | 2,401 |
| Dél-Afrika | 59,308,690 | Dél-Afrika | 0,029 | 1,719,952 | 8,959 |
| Dél Szudán | 11,193,725 | Kelet-Afrika | 0,04675 | 523 307 | 2,726 |
| Szudán | 43,849,260 | Észak-Afrika | 0,03883333333 | 1,702,813 | 8,870 |
| Menni | 8,278,724 | Nyugat-Afrika | 0,09375 | 776 130 | 4,043 |
| Tunézia | 11,818,619 | Észak-Afrika | 0,023 | 271,828 | 1,416 |
| Zimbabwe | 14,862,924 | Kelet-Afrika | 0,035 | 520 202 | 2,710 |
| Teljes | 1,338,826,604 | Afrika | 91,868,664 | 495 726 |
Egyesült Államok
A betegségben szenvedők száma az Egyesült Államokban körülbelül 100 000 (3300-ból egy), ami leginkább a szubszaharai afrikai származású amerikaiakat érinti. Az Egyesült Államokban 365 afro-amerikai gyermekből körülbelül egy és 16 300 spanyol-amerikai gyermekből egy szenved sarlósejtes vérszegénységben. Az SCD-ben szenvedő férfiak várható élettartama körülbelül 42 év, míg a nők körülbelül hat évvel tovább élnek. További 2 millióan a sarlósejtes tulajdonság hordozói. Az Egyesült Államokban született SCD-s csecsemők többségét rutin újszülöttkori szűréssel azonosítják. 2016-tól kezdve mind az 50 államban szerepel a sarlósejtes betegség szűrése az újszülöttek szűrésének részeként. Az újszülött véréből sarokszúrással mintát vesznek, és laboratóriumba küldik vizsgálatra. A csecsemőnek legalább 24 órája evett kell lennie, mielőtt elvégezhető a sarokszúrási teszt. Egyes államok megkövetelik a második vérvizsgálat elvégzését is, amikor a baba két hetes lesz az eredmények biztosítása érdekében. A sarlósejtes vérszegénység a leggyakoribb genetikai rendellenesség az afroamerikaiak körében. Körülbelül 8%-uk hordozó , és 375-ből 1 születik ezzel a betegséggel. A sarlósejtes betegséget támogató betegek panaszkodtak, hogy ez kevesebb állami és magán kutatási támogatást kap, mint a hasonló ritka betegségek, például a cisztás fibrózis , Elliott Vichinsky kutató szerint ez a faji megkülönböztetést vagy a vagyon szerepét mutatja az egészségügyi ellátásban.
Franciaország
A tengerentúli Franciaország afrikai-karibi régióiban tapasztalható népességnövekedés, valamint az Észak- és a szubszaharai Afrikából Franciaország szárazföldi részébe irányuló bevándorlás eredményeként a sarlósejtes betegség komoly egészségügyi problémává vált Franciaországban. Az SCD a leggyakoribb genetikai betegség lett az országban, a születési gyakoriság 2415-ből egy a francia nagyvárosban , megelőzve a fenilketonuriát (10 862-ből egy), a veleszületett hypothyreosisot (3132-ből egy), a veleszületett mellékvese hiperpláziát (19 008-ból egy). és cisztás fibrózis (5014-ből egy) ugyanabban a referencia-időszakban.
2000 óta az újszülöttkori SCD-szűrést nemzeti szinten végzik minden olyan újszülött esetében, akiket etnikai hovatartozás alapján „veszélyeztetettnek” minősítettek (ezek a meghatározása szerint a szubszaharai Afrikából, Észak-Afrikából és a Földközi-tenger térségéből származó szülők születtek. területen (Dél-Olaszország, Görögország és Törökország ), az Arab-félszigeten, a francia tengerentúli szigeteken és az indiai szubkontinensen.
Egyesült Királyság
Az Egyesült Királyságban 12 000 és 15 000 közötti emberről feltételezik, hogy sarlósejtes betegségben szenved, és csak Angliában 250 000 hordozója van. Mivel a hordozók számát csak becsülik, az Egyesült Királyságban minden újszülöttet rutin vérvizsgálaton vesznek át az állapot szűrésére. Mivel a magas kockázatú csoportokba tartozó felnőttek közül sokan nem tudják, hogy hordozók-e, a várandós nők és egy pár mindkét partnere szűrést ajánl fel, hogy tanácsot kapjanak, ha sarlósejtes tulajdonsággal rendelkeznek. Ezenkívül a magas kockázati csoportba tartozó véradókat is szűrik, hogy megbizonyosodjanak arról, hogy hordozók-e, és megfelelően szűrik-e a vérüket. Ezt követően tájékoztatják azokat a donorokat, akikről kiderül, hogy hordozók, és vérüket, bár gyakran használják ugyanahhoz az etnikai csoporthoz, nem használják fel a sarlósejtes betegségben szenvedőknek, akiknek vérátömlesztésre van szükségük.
Közel-Kelet
Szaúd-Arábiában a lakosság mintegy 4,2%-a hordozza a sarlósejtes tulajdonságot, és 0,26%-a szenved sarlósejtes betegségben. A legmagasabb prevalencia a keleti tartományban van, ahol a lakosság körülbelül 17%-a hordozza a gént, és 1,2%-a sarlósejtes betegségben szenved. 2005-ben Szaúd-Arábia kötelező házasság előtti tesztet vezetett be, beleértve a HB elektroforézist is, amelynek célja az SCD és a talaszémia előfordulásának csökkentése volt .
Bahreinben egy 1998 -ban publikált tanulmány, amely körülbelül 56 000 embert vont be a bahreini kórházakban, azt találta, hogy az újszülöttek 2%-a sarlósejtes betegségben szenved, a megkérdezettek 18%-a rendelkezik sarlósejtes tulajdonsággal, és 24%-uk hordozó volt a génmutációt okozó génmutációban. a betegség. Az országban 1992-ben kezdték meg az összes terhes nő szűrését, és az újszülötteket is megvizsgálták, hogy az anya hordozó-e. 2004-ben törvényt fogadtak el, amely előírja, hogy a házasságot tervező párok ingyenes házasság előtti tanácsadáson vegyenek részt . Ezeket a programokat közművelődési kampányok kísérték.
India és Nepál
A sarlósejtes betegség gyakori Közép-India egyes etnikai csoportjaiban, ahol a prevalencia Madhya Pradesh , Rajasthan és Chhattisgarh endémiás területein 9,4 és 22,2% között mozgott . A nepáli és indiai tharu nép körében is endemikus ; azonban hétszer alacsonyabb a malária aránya, annak ellenére, hogy maláriával fertőzött zónában élnek.
Karib-szigetek
Jamaicán a lakosság 10%-a hordozza a sarlósejtes gént, így ez a legelterjedtebb genetikai rendellenesség az országban.
Történelem
Az első modern jelentés a sarlósejtes betegségről 1846-ban lehetett, ahol egy kivégzett szökött rabszolga boncolását tárgyalták; a legfontosabb megállapítás a lép hiánya volt. Állítólag az Egyesült Államokban élő afrikai rabszolgák ellenálltak a maláriának, de hajlamosak voltak lábfekélyekre. A vörösvértestek abnormális jellemzőit, amelyek később a nevüket az állapotnak tulajdonították, először Ernest E. Irons (1877–1959), James B. Herrick (1861–1954) chicagói kardiológus gyakornok és orvosprofesszor írta le. 1910-ben. Irons "sajátos hosszúkás és sarló alakú" sejteket látott egy Walter Clement Noel nevű férfi vérében, egy 20 éves grenadai elsőéves fogorvostanhallgató. Noelt 1904 decemberében a Chicagói Presbiteriánus Kórházba vették vérszegénységben. Noelt a következő három évben többször is visszafogadták „izomreuma” és „epes rohamok” miatt, de befejezte tanulmányait, és visszatért Grenada fővárosába (Szent-Györgyibe), hogy fogászatot gyakoroljon . 1916-ban tüdőgyulladásban halt meg, és a Grenada északi részén található Sauteurs katolikus temetőjében nyugszik . Röviddel Herrick jelentése után egy másik eset jelent meg a Virginia Medical Semi-Monthly- ben, ugyanazzal a címmel: "Különleges megnyúlt és sarló alakú vörös vértestek súlyos vérszegénység esetén". Ez a cikk egy páciensen alapul, akit 1910. november 15-én vettek fel a Virginia Egyetemi Kórházba. Verne Mason 1922-es későbbi leírásában használták először a "sarlósejtes vérszegénység" nevet. A sarlósejtes betegséggel kapcsolatos gyermekkori problémákat csak az 1930-as években jelentettek, annak ellenére, hogy ez nem lehetett ritka az afroamerikai populációban.
Lemuel Diggs memphisi orvos , a sarlósejtes betegség termékeny kutatója először 1933-ban tett különbséget a sarlósejtes betegség és a tulajdonság között, bár 1949-ig a genetikai jellemzőket James V. Neel és EA Beet nem tudta megvilágítani. 1949 volt az az év, amikor Linus Pauling leírta a hemoglobin S szokatlan kémiai viselkedését, és ezt magának a molekulának a rendellenességnek tulajdonította. A HbS molekuláris változását Vernon Ingram írta le 1956-ban . Az 1940-es évek végén és az 1950-es évek elején még jobban megértették a malária és a sarlósejtes betegség közötti kapcsolatot. 1954-ben a hemoglobin elektroforézis bevezetése lehetővé tette bizonyos altípusok, például a HbSC-betegség felfedezését.
Az 1970-es és 1980-as években nagyszabású természetrajzi tanulmányokat és további beavatkozási tanulmányokat vezettek be, ami a pneumococcus fertőzések megelőzésének széles körben elterjedt alkalmazásához vezetett az egyéb beavatkozások mellett. Bill Cosby 1972-es Emmy-díjas tévéfilmje, a To All My Friends on Shore egy sarlósejtes betegségben szenvedő gyermek szüleinek történetét ábrázolta. Az 1990-es években fejlesztették ki a hidroxi-karbamidot, és 2007-ben jelentek meg a csontvelő-transzplantációval történő gyógyulásról.
Néhány régi szöveg drepanocitózisnak nevezi.
Társadalom és kultúra
Amerikai társadalombiztosítás
2017. szeptember 15-i hatállyal az Egyesült Államok Társadalombiztosítási Hivatala irányelvértelmezési határozatot adott ki, amely háttérinformációkat ad a sarlósejtes betegségről, és leírja, hogy a társadalombiztosítás hogyan értékeli a betegséget a fogyatékossági igények elbírálási folyamata során.
Stigma az Egyesült Államokban
Az Egyesült Államokban az SCD körül stigmák vannak, amelyek elriasztják az SCD-ben szenvedőket a szükséges ellátástól. A National Heart, Lung and Blood Institute szerint ezek a stigmák főként az afro-amerikai és latin felmenőkkel rendelkező embereket érintik. Az SCD-ben szenvedők megtapasztalják a betegség stigmáinak hatását az élet számos területére, beleértve a szociális és pszichológiai jólétet. Tanulmányok kimutatták, hogy az SCD-ben szenvedők gyakran úgy érzik, hogy titokban kell tartaniuk diagnózisukat, hogy elkerüljék a diszkriminációt a munkahelyen és a párkapcsolati társaik között. Az 1960-as években az Egyesült Államok kormánya támogatta a genetikai betegségek munkahelyi szűrésére irányuló kezdeményezéseket annak érdekében, hogy megvédjék az SCD-ben szenvedőket. Ezzel az átvilágítással az volt a cél, hogy az alkalmazottak ne kerüljenek olyan környezetbe, amely potenciálisan káros lehet és SCD-t válthat ki.
Stigma Ugandában
Ugandában az 5. legmagasabb a sarlósejtes betegség (SCD) a világon. Ugandában a sarlósejtes betegségben szenvedők társadalmi megbélyegzése a betegség általános ismereteinek hiánya miatt létezik . A sarlósejtes betegséggel kapcsolatos ismeretek általános hiányossága a serdülők és a fiatal felnőttek körében a betegség kulturálisan engedélyezett titkolása miatt. Míg a legtöbb ember általában hallott a betegségről, a lakosság nagy része viszonylag rosszul tájékozott az SCD diagnosztizálásáról vagy öröklődéséről. Azok, akik értesültek a betegségről, családjuktól vagy barátoktól értesültek róla, nem egészségügyi szakemberektől . Ha elmulasztják a nyilvánosság tájékoztatását a sarlósejtes betegségről, akkor a lakosság rosszul ismeri a betegség okait, tüneteit és megelőzési technikáit. A sarlósejtes betegségben szenvedőkben fellépő fizikai és társadalmi különbségek, mint például a sárgaság, a fizikai növekedés visszamaradása és a késleltetett szexuális érettség, arra is vezethetnek, hogy zaklatás, elutasítás és megbélyegzés célpontjaivá váljanak.
A sarlósejtes betegség aránya Ugandában
Az ugandai sarlósejtes betegséggel kapcsolatos adatokat az 1970-es évek eleje óta nem frissítették. Az adatok hiánya a kormányzati kutatási források hiányának tudható be, jóllehet az ugandaiak naponta halnak meg SCD-ben. Az adatok azt mutatják, hogy Uganda lakosságának 20%-a a sarlósejtes betegség jellemző gyakorisága. Ez azt jelenti, hogy 66 millió embert fenyeget annak a veszélye, hogy sarlósejtes betegségben szenvedő gyermeke születik. Becslések szerint évente körülbelül 25 000 ugandai születik SCD-vel, és ezeknek az embereknek 80%-a nem éli meg az ötéves kort. Az SCD 25%-kal járul hozzá a gyermekhalandósághoz Ugandában. Az ország délnyugati részén található ugandai bamba nép a gén 45%-át hordozza, ami a legmagasabb jellemző gyakoriság a világon. A mulagói Sarlósejtes Klinika csak egy sarlósejtes betegséggel foglalkozó klinika az országban, és naponta átlagosan 200 beteget látnak el.
Tévhitek a sarlósejtes betegségről
A betegség körüli megbélyegzés különösen rossz az ország azon régióiban, amelyek nem annyira érintettek. Például a kelet-ugandaiak általában jobban ismerik a betegséget, mint a nyugat-ugandaiak, akik nagyobb valószínűséggel hiszik, hogy a sarlósejtes betegség Isten büntetés vagy boszorkányság következménye . Az SCD-vel kapcsolatos egyéb tévhitek közé tartozik az a hiedelem, hogy környezeti tényezők okozzák, de valójában az SCD genetikai betegség. Uganda-szerte erőfeszítéseket tettek a betegséggel kapcsolatos társadalmi tévhitek kezelésére. 2013-ban hozták létre az Uganda Sarlósejtes Mentőalapítványt, hogy felhívja a figyelmet a sarlósejtes betegségre és leküzdje a betegséghez kapcsolódó társadalmi megbélyegzést. A szervezet erőfeszítései mellett szükség van a sarlósejtes betegségekkel kapcsolatos oktatás beépítésére a már meglévő közösségi egészségnevelési programokba annak érdekében, hogy csökkentsék a sarlósejtes betegség megbélyegzését Ugandában.
Sarlósejtes betegségben szenvedők társadalmi elszigeteltsége
Az SCD mélyen gyökerező megbélyegzése a társadalomban arra készteti a családokat, hogy gyakran titkolják családtagjaik beteg állapotát, attól tartva, hogy megcímkézik, átkozzák vagy kihagyják őket a társadalmi eseményekből. Néha Ugandában, amikor bebizonyosodik, hogy egy családtag sarlósejtes betegségben szenved, elkerülik az intim kapcsolatokat a család minden tagjával. A sarlósejtes betegségben szenvedők megbélyegzése és társadalmi elszigeteltsége gyakran annak a népszerű tévhitnek a következménye, hogy az SCD-ben szenvedőknek nem szabad a betegségtől mentesekkel szocializálódniuk. Ez a mentalitás megfosztja az SCD-ben szenvedőket attól a jogtól, hogy mindenki máshoz hasonlóan szabadon részt vegyenek a közösségi tevékenységekben. Az SCD-vel kapcsolatos megbélyegzés és a társadalmi elszigeteltség különösen az iskolákban rendkívül megnehezítheti a sarlósejtes betegségben szenvedő fiatalok életét. Az SCD-vel küzdő iskoláskorú gyermekek esetében a megbélyegzés a kortársak elutasításához vezethet. A kortársak elutasítása magában foglalja a társadalmi csoportokból vagy összejövetelekből való kizárást. Ez gyakran arra készteti a kirekesztett egyént, hogy érzelmi szorongást tapasztaljon, és a tanulmányi alulteljesítéshez, az iskolakerüléshez és a foglalkozási kudarcokhoz vezethet későbbi életében. Ez a társadalmi elszigeteltség valószínűleg negatívan befolyásolja az SCD-vel élő emberek önbecsülését és általános életminőségét.
Nők Ugandában és az SCD megbélyegzése
Sarlósejtes betegségben szenvedő gyermekek anyja
A sarlósejtes betegségben szenvedő gyermekek anyja általában aránytalanul sok megbélyegzést kap kortársaiktól és családtagjaiktól. Ezeket a nőket gyakran hibáztatják azért, hogy gyermeküknél SCD- t diagnosztizáltak , különösen akkor, ha az SCD a korábbi generációkban nem fordult elő, annak gyanúja miatt, hogy a gyermek rossz egészségi állapotát az okozhatta, hogy az anya elmulasztotta végrehajtani a megelőző egészségügyi intézkedéseket vagy elősegíteni az egészséges környezet megteremtését. hogy gyermeke boldoguljon. Az, hogy a környezeti tényezőkkel kapcsolatos elméletekre hagyatkoznak az anyára hárítva, sok ugandai szegényes tudását tükrözi a betegség kialakulásának módjáról, mivel azt a genetika határozza meg, nem a környezet. A sarlósejtes analízisben szenvedő gyermekek anyja gyakran nagyon korlátozott erőforrásokkal rendelkezik ahhoz, hogy megvédjék jövőjüket az SCD megbélyegzésével szemben. Az erőforrásokhoz való hozzáférés hiánya a családi struktúrákon belüli alárendelt szerepükből, valamint az osztálykülönbségekből adódik, amelyek sok anyát akadályoznak abban, hogy kielégítsék a további gyermekgondozási költségeket és kötelezettségeket.
Sarlósejtes betegségben szenvedő terhes nők
Az SCD-vel élő, teherbe eső nők gyakran szélsőséges diszkriminációval és csüggedéssel szembesülnek Ugandában. Ezeket a nőket társaik gyakran felelőtlennek bélyegzik azért, mert sarlósejtes betegségben szenvednek, vagy akár szexuális életet folytatnak, miközben SCD-vel élnek. A kritika és az ítélet, amelyet ezek a nők kapnak, nemcsak az egészségügyi szakemberektől, hanem a családjuktól is, gyakran egyedül érzik magukat, depressziósak, szoronganak, szégyellik őket, és nagyon kevés társadalmi támogatást kapnak . A legtöbb SCD-s terhes nő továbbra is egyedülálló anya lesz, mivel gyakran előfordul, hogy férfi partnerük elhagyja őket, akik azt állítják, hogy nem tudtak partnerük SCD-státuszáról. Nemcsak az ezeknél a nőknél tapasztalt elhagyatottság okoz számukra érzelmi feszültséget, de a szülői támogatás alacsony szintje a depressziós tünetekhez és a születés utáni gyermek általános alacsonyabb életminőségéhez is köthető.
Kutatás
Köldökzsinórvér átültetés
Míg a köldökzsinórvér-átültetés potenciálisan gyógyíthatja az állapotot, megfelelő donor csak az emberek 10%-ánál áll rendelkezésre. Az emberek körülbelül 7%-a meghal az eljárás következtében, és előfordulhat graft versus host betegség .
Génterápia
Az olyan betegségek, mint például a sarlósejtes betegség, amelyeknél az egyén normális fenotípusa vagy sejtfunkciója helyreállítható a betegségben szenvedő sejtekben a mutált gén normál másolatával, jó jelöltek lehetnek génterápiás kezelésre. A sarlósejtes betegség génterápiájával kapcsolatos kockázatok és előnyök nem ismertek.
2001-ben a jelentések szerint a sarlósejtes betegséget egereken sikeresen kezelték génterápiával . A kutatók egy vírusvektort használtak arra, hogy az egerekben – amelyeknek lényegében ugyanaz a hibája van, mint ami az emberi sarlósejtes betegséget okozzák – a magzati hemoglobin (HbF) termelődését kényszerítsék ki, amelyet az egyed általában röviddel a születés után abbahagy. Emberben a hidroxi-karbamid használata a HbF termelésének serkentésére köztudottan átmenetileg enyhíti a sarlósejtes betegség tüneteit. A kutatók bebizonyították, hogy ez a génterápiás módszer tartósabb módja a terápiás HbF-termelés növelésének.
2014-ben megkezdődtek a sarlósejtes betegség humán génterápiájának 1. fázisú klinikai vizsgálatai . A klinikai vizsgálatok során felmérik a lentivírus vektorral módosított csontvelő biztonságosságát súlyos sarlósejtes betegségben szenvedő felnőtteknél. 2020-ig azonban nem számoltak be randomizált, kontrollált vizsgálatokról. Az első kezelt személy esetéről 2017 márciusában tették közzé az esetjelentést, azóta még néhány embert kezeltek.
A CRISPR/Cas9-hez hasonló génszerkesztő platformokat alkalmaztak a betegséget okozó mutáció kijavítására a betegségben szenvedő személytől vett vérképző őssejtekben. 2019 júliusában a CRISPR génszerkesztő eszközt használták az SCD-ben szenvedő személy csontvelői sejtjeinek szerkesztésére a magzati hemoglobin gén "bekapcsolásáig" . Számos kutató úgy vélte, hogy az SCD etikai vonatkozásai a CRISPR technológia egyik első lehetséges alkalmazása, tekintettel az afroamerikai közösséget az orvostudományban tapasztalt történelmi visszaélésekre és elhanyagolásra.
2017-ben tizenkét klinikai vizsgálat összpontosított a sarlósejtes vérszegénység kezelésére szolgáló génterápiára. A 12 kísérletből négyben a mutált HBB gént egészségesre cserélték. Három kísérletben a Mozobilt, a ráktípusok kezelésére használt gyógyszert alkalmazták annak meghatározására, hogy az őssejtek számának növekedése felhasználható-e génterápiában. Az egyik vizsgálat a sarlósejtes vérszegénységben szenvedő betegek csontvelő-mintáinak elemzésére összpontosított. Egy másik kísérletben sarlósejtes vérszegénységben szenvedő és nem szenvedő csecsemők köldökzsinórvérének felhasználásával kísérleteztek génterápia kidolgozására.
Hematopoietikus őssejt-transzplantáció
Nincs erős orvosi bizonyíték a sarlósejtes betegségben szenvedő betegek vérképző őssejt-transzplantációval történő kezelésével kapcsolatos kockázatok és lehetséges előnyök meghatározására.
Megjegyzések
Hivatkozások
További irodalom
|
Könyvtári források a sarlósejtes betegségről |
- Brown RT, szerk. (2006). A gyermekkori rák és a sarlósejtes betegség átfogó kézikönyve: biopszichoszociális megközelítés . Oxford University Press. ISBN 978-0-19-516985-0.
- Hill SA (2003). Sarlósejtes betegség kezelése alacsony jövedelmű családokban . Temple University Press. ISBN 978-1-59213-195-2.
- Serjeant GR, Serjeant BE (2001). Sarlósejtes betegség . Oxford University Press. ISBN 978-0-19-263036-0.
- Tapper M (1999). A vérben: sarlósejtes vérszegénység és a fajpolitika . University of Pennsylvania Press. ISBN 978-0-8122-3471-8.
Külső linkek
- Sarlósejtes Curlie -nál