A gerinc izomsorvadása - Spinal muscular atrophy
| A gerinc izomsorvadása | |
|---|---|
| Más nevek | Autoszomális recesszív proximális gerinc izomsorvadás, 5q spinális izomsorvadás |
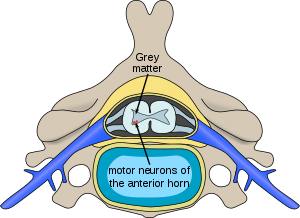 | |
| A gerinc izomsorvadásával érintett idegsejtek elhelyezkedése a gerincvelőben | |
| Különlegesség | Ideggyógyászat |
| Tünetek | Progresszív izomgyengeség |
| Bonyodalmak | Scoliosis , ízületi kontraktúrák , tüdőgyulladás |
| Típusok | Írjon be 0 -tól 4 -ig |
| Okoz | Mutáció az SMN1 -ben |
| Diagnosztikai módszer | Genetikai vizsgálat |
| Megkülönböztető diagnózis | Veleszületett izomsorvadás , Duchenne izomdisztrófia , Prader-Willi szindróma |
| Kezelés | Támogató ellátás , gyógyszerek |
| Gyógyszer | Nusinersen , onasemnogene abeparvovec , Risdiplam |
| Prognózis | Típusonként változik |
| Frekvencia | 10 000 emberből 1 |
A spinális izomsorvadás ( SMA ) egy ritka neuromuscularis rendellenesség, amely a motoros neuronok elvesztését és progresszív izomsorvadást eredményez . Általában csecsemőkorban vagy kisgyermekkorban diagnosztizálják, és ha nem kezelik, a csecsemők halálának leggyakoribb genetikai oka. Az élet későbbi szakaszában is megjelenhet, majd enyhébb lefolyású lesz a betegség. A közös jellemző az önkéntes izmok fokozatos gyengesége, először a kar-, láb- és légzőizmokat érinti. A kapcsolódó problémák közé tartozik a rossz fejkontroll , nyelési nehézségek, scoliosis és ízületi kontraktúrák .
A kezdeti életkor és a tünetek súlyossága képezik a gerinc izomsorvadásának hagyományos típusokba sorolásának alapját.
Spinális izomatrófia annak köszönhető, hogy egy rendellenesség ( mutáció ) a SMN1 kódoló gén SMN , egy fehérje szükséges túlélését motoros neuronok . Ezen idegsejtek elvesztése a gerincvelőben megakadályozza az agy és a vázizmok közötti jelátvitelt . Egy másik gént, az SMN2 -t betegségmódosító génnek tekintik, mivel általában minél több az SMN2 másolat, annál enyhébb a betegség lefolyása. Az SMA diagnózisa tüneteken alapul, és genetikai vizsgálatokkal megerősítik .
Általában a mutáció a SMN1 gént örökölt mindkét szülőtől egy autoszomális recesszív módon, bár mintegy 2% -ában fordul elő során a korai fejlesztés ( de novo ). A spinális izomsorvadás gyakorisága világszerte körülbelül 1 000 -ből 1 -ig 16 000 -ből 1 -ig terjed, Európában és az Egyesült Államokban általában 7 000 -ből és 10 000 -ből 1 -et szoktak idézni.
A betegség természetes lefolyásának eredményei a leghevesebb esetekben a születést követő néhány héten belüli haláltól a normális várható élettartamig változnak az elhúzódó SMA formákban. Az okozati kezelések 2016 -os bevezetése jelentősen javította az eredményeket. A betegség genetikai okát célzó gyógyszerek közé tartozik a nusinersen , a risdiplam és az onasemnogene abeparvovec génterápiás gyógyszer . A támogató ellátás magában foglalja a fizikoterápiát , a munkaterápiát, a légzéstámogatást, a táplálkozást, az ortopédiai beavatkozásokat és a mobilitást .
Osztályozás
Az 5q SMA egyetlen betegség, amely a súlyosság széles tartományában nyilvánul meg, és a csecsemőket felnőtteken keresztül érinti. Mielőtt a genetikáját megértették volna, különböző megnyilvánulásait különböző betegségeknek gondolták-Werdnig – Hoffmann-betegség, amikor kisgyermekek érintettek, és Kugelberg-Welander-betegség a későn kezdődő esetekben.
1990 -ben rájöttek, hogy ezek a különálló betegségek ugyanazon rendellenesség spektrumát alkotják. A gerinc izomsorvadását ezután 3-5 klinikai típusba sorolták a tünetek megjelenésének kora vagy az elért maximális motoros funkció alapján. Jelenleg egyetértés van abban, hogy a gerinc izomsorvadásának fenotípusa a tünetek folytonosságát öleli fel anélkül, hogy az altípusokat egyértelműen körülhatárolná. Az alábbi táblázatban felvázolt hagyományos osztályozást azonban ma is alkalmazzák mind a klinikai kutatások során, mind néha - ellentmondásos módon - a terápiákhoz való hozzáférés kritériumaiként.
| típus | Névadó | Szokásos kezdeti életkor | Természettörténet (gyógyszeres kezelés nélkül) | OMIM |
|---|---|---|---|---|
| SMA 0 | Születés előtti | A tünetek születéskor figyelhetők meg, és gyakran a prenatális időszakban nyilvánulnak meg, mint a magzat mozgásának csökkenése. Az érintett gyermekek jellemzően csak egyetlen példányban rendelkeznek az SMN2 génjével, és általában csak néhány hetet élnek meg, akár 24/7 légzési támogatás mellett is. Ez a forma nagyon ritka - kb. Az esetek 2% -a. | ||
|
SMA 1 (infantilis) |
Werdnig -Hoffmann -betegség | 0-6 hónap | Ezt a formát a betegek körülbelül 50% -ánál diagnosztizálják, akiknél a betegség az élet első heteiben vagy hónapjaiban nyilvánul meg. Az SMA ekkor gyorsan és váratlanul kezdődik, a különböző izomcsoportok fokozatosan megbuknak. A csecsemők soha nem tanulnak meg támasztás nélkül ülni, és a legtöbben fokozatosan elveszítik izomfunkciójuk nagy részét. A halál oka általában a tény, hogy a légzőizmok okozta tüdőgyulladás (gyakran aspirációs tüdőgyulladás ). Hacsak nem kínálnak korai légzési támogatást és/vagy gyógyszeres kezelést, az 1. típusú SMA -val diagnosztizált csecsemők általában nem élik túl az elmúlt két évet. Megfelelő légzőszervi támogatás mellett az enyhébb SMA 1-es típusú fenotípussal rendelkezők, akik az SMA 1 esetek körülbelül 10% -át teszik ki, köztudott, hogy farmakológiai kezelés nélkül is túlélik a serdülőkort és a felnőttkort, bár mindig éjjel-nappali ellátást igényelnek. | 253300 |
|
SMA 2 (középhaladó) |
Dubowitz -betegség | 6-18 hónap | A köztes forma, amelyet a betegek körülbelül 20% -ánál diagnosztizálnak, azokat az embereket jelöli, akik életükben legalább egy ideig képesek voltak ülő helyzetben maradni, de soha nem tanultak meg támogatottan járni. A gyengeség kialakulását általában az élet 6 és 18 hónapja között észlelik. A fejlődésről ismert, hogy nagymértékben változik, egyesek idővel fokozatosan gyengülnek, míg mások gondos karbantartás révén viszonylag stabilak maradnak. A testizmok legyengülnek, és a légzőrendszer komoly aggodalomra ad okot, akárcsak az izom -összehúzódások és a gerinc görbülete. A várható élettartam csökken, még akkor is, ha az SMA 2 -es betegek többsége kezelés nélkül is jól éli meg a felnőttkort. | 253550 |
|
SMA 3 (fiatalkorú) |
Kugelberg -Welander betegség | > 12 hónap | A fiatalkori forma, amelyet a betegek körülbelül 30% -ánál diagnosztizálnak, 12 hónapos kor után nyilvánul meg, vagy miután a gyerekek már megtanultak legalább néhány független lépést megtenni. A betegség lassan halad előre, és a legtöbb SMA 3 -as ember elveszíti járóképességét valamikor az életében, ami mobilitási támogatást igényel. A légzés érintettsége ritka, és a várható élettartam normális vagy közel normális. | 253400 |
|
SMA 4 (felnőttkori megjelenés) |
Felnőttkor | Ez a felnőttkori formát jelöli, néha szintén késői SMA 3. típusba sorolják. Előfordul kb. A betegek 5% -a, és általában az élet harmadik vagy negyedik évtizedében nyilvánul meg. A tünetek a lábizmok fokozatos gyengüléséből állnak, ami gyakran szükségessé teszi, hogy a beteg járókelléket használjon. Más szövődmények ritkák, és a várható élettartam nem változik. | 271150 |
A kényelem érdekében az ellátásra összpontosító kiadványok a betegeket tényleges funkcionális állapotuk alapján "nem ülő", "ülő" és "sétáló" kategóriába sorolják.
A motoros fejlődést és a betegség előrehaladását az SMA-ban szenvedő betegeknél általában validált funkcionális skálák segítségével értékelik-CHOP-INTEND (The Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders) vagy HINE (Hammersmith Infant Neurological Examination) csecsemőknél; és vagy az MFM (Motor Function Measure), vagy a HFMS (Hammersmith Functional Motor Scale) több változata közül egy az idősebb betegeknél.
A névadó címke, a Werdnig – Hoffmann -kór (néha egyetlen n betűvel írva ) Johann Hoffmann és Guido Werdnig legkorábbi, gyermekkori SMA -klinikai leírására utal . A névadó Kugelberg – Welander-betegség kifejezés Erik Klas Hendrik Kugelberg (1913–1983) és Lisa Welander (1909–2001) után született, akik először dokumentálták a későn megjelenő formát, és megkülönböztették azt az izomdisztrófiától. Nagyon ritkán használt Dubowitz -betegséget (nem tévesztendő össze a Dubowitz -szindrómával ) Victor Dubowitz angol neurológusról nevezték el , aki számos tanulmányt írt a köztes SMA -fenotípusról .
jelek és tünetek
A tünetek az SMA típusától, a betegség stádiumától és az egyéni tényezőktől függően változnak. Az alábbi jelek és tünetek a leggyakoribbak a 0/I típusú súlyos SMA -ban:
- Areflexia , különösen a végtagokban
- Általános izomgyengeség , gyenge izomtónus , sántulás vagy hajlam a flopra
- Fejlődési mérföldkövek elérésének nehézsége, ülés/állás/járás
- Kisgyermekeknél: békacomb helyzetének elfogadása ülve (csípőt elrabolva és térdet hajlítva)
- A légzőizmok erejének elvesztése : gyenge köhögés , gyenge sírás (csecsemők), váladék felhalmozódása a tüdőben vagy a torokban, légzési nehézség
- Harang alakú törzs (amelyet csak a hasizmok légzése okoz) súlyos SMA típusban
- A nyelv elbizonytalanodása (rángatózás)
- Szopási vagy nyelési nehézség, rossz táplálkozás
Okoz
A gerinc izomsorvadását az SMN1 gén genetikai mutációja okozza .
A humán 5. kromoszóma két közel azonos gént tartalmaz az 5q13 helyen : az SMN1 telomer kópiát és az SMN2 centromer kópiát . Egészséges egyénekben az SMN1 gén a motoros neuronfehérje (SMN) túlélését kódolja, amely, mint a neve is mondja, döntő szerepet játszik a motoros neuronok túlélésében . Az SMN2 gén ezzel szemben - egyetlen nukleotid variációjának köszönhetően (840.C → T) - alternatív illesztésen megy keresztül a 6. intron és a 8. exon találkozásánál, az SMN2 transzkriptumok mindössze 10–20% -a kódol teljesen a motoros neuron fehérje (SMN-fl) és a transzkriptumok 80–90% -ának funkcionális túlélése, ami egy csonka fehérjevegyületet (SMNΔ7) eredményez, amely gyorsan lebomlik a sejtben.
Az SMA által érintett egyénekben az SMN1 gén oly módon mutálódik , hogy nem képes helyesen kódolni az SMN fehérjét - akár a 7. exonon történt deléció , akár más pontmutációk miatt (gyakran az SMN1 funkcionális átalakulását eredményezi) sorozat SMN2 -be ). Szinte minden ember rendelkezik azonban az SMN2 gén legalább egy funkcionális másolatával (a legtöbbjük 2–4 -et tartalmaz), amely még mindig az SMN fehérje szokásos szintjének 10–20% -át kódolja, lehetővé téve néhány idegsejt túlélését. Hosszú távon azonban az SMN fehérje csökkent rendelkezésre állása a motoros idegsejtek fokozatos elhalását eredményezi a gerincvelő és az agy elülső szarvában . A vázizmok , amelyek mindegyike ezeknek a motoros neuronoknak az idegi bemenetétől függ, most csökkent beidegzéssel (más néven denervációval ) rendelkeznek, és ezért csökkent a központi idegrendszer (CNS) bemenete. A motoros idegsejteken keresztül csökkent impulzusátvitel a denervált izom összehúzódó aktivitásának csökkenéséhez vezet. Következésképpen a denervált izmok progresszív sorvadáson mennek keresztül (hulladék).
Általában az alsó végtagok izmait érintik először, majd a felső végtagok, a gerinc és a nyak izmait, és súlyosabb esetekben a tüdő- és rágóizmokat. A proximális izmokat mindig korábban és nagyobb mértékben érintik, mint a disztális izmokat.
Az SMA tüneteinek súlyossága nagyjából összefügg azzal, hogy a fennmaradó SMN2 gének mennyire tudják pótolni az SMN1 funkcióvesztését . Ez részben a kromoszómán jelen lévő SMN2 gén példányainak számától függ . Míg az egészséges egyének általában két SMN2 génpéldányt hordoznak , addig az SMA -ban szenvedő betegek 1 és 5 (vagy több) között bármit megkaphatnak; minél nagyobb az SMN2 másolatok száma , annál enyhébb a betegség súlyossága. Így a legtöbb I. típusú SMA baba egy vagy két SMN2 másolattal rendelkezik; az SMA II és III -as betegek általában legalább három SMN2 példányt tartalmaznak; és az SMA IV -ben szenvedő emberek általában legalább négyet tartalmaznak. A tünetek súlyossága és az SMN2 kópiaszám közötti korreláció azonban nem abszolút, és úgy tűnik, hogy más tényezők is befolyásolják a betegség fenotípusát.
A gerinc izomsorvadása autoszomális recesszív mintában öröklődik , ami azt jelenti, hogy a hibás gén egy autoszómán helyezkedik el . A hibás gén két példánya - minden szülőtől egy - szükséges a rendellenesség örökléséhez: a szülők hordozók lehetnek, és személyesen nem érintettek. Úgy tűnik, hogy az SMA de novo (azaz örökletes okok nélkül) jelenik meg az esetek körülbelül 2–4% -ában.
A gerinc izomsorvadása minden etnikai csoport egyedeit érinti, ellentétben más jól ismert autoszomális recesszív rendellenességekkel, mint például a sarlósejtes betegség és a cisztás fibrózis , amelyek előfordulási aránya jelentősen eltér az etnikai csoportok között. Az SMA általános prevalenciája , minden típusban és minden etnikai csoportban, 1 /10 000 egyed között van; a gének gyakorisága 1: 100 körül van, ezért körülbelül minden 50 -ből egy ember hordozó. A hordozónak nincs ismert egészségügyi következménye. Egy személy csak akkor tanulhatja meg a hordozó státuszt, ha gyermekét érinti az SMA vagy az SMN1 gén szekvenálása.
Az érintett testvérek általában nagyon hasonló SMA formájúak. A testvérek között azonban előfordulnak különböző SMA típusok - bár ritkák, ezek az esetek az SMN gén további de novo deléciói , amelyek nem érintik az NAIP gént, vagy az SMN2 másolatok számának különbségei .
Diagnózis
Az SMA -t olyan genetikai tesztek segítségével diagnosztizálják, amelyek az esetek több mint 95% -ában kimutatják az SMN1 gén homozigóta delécióját , és a többi betegben egy összetett SMN1 mutációt. A genetikai vizsgálatot általában vérmintával végzik, és az MLPA az egyik leggyakrabban használt genetikai vizsgálati technika, mivel lehetővé teszi az SMN2 génpéldányok számának megállapítását is , amelynek klinikai jelentősége van.
Tünetileg az SMA csak bizonyos akut formájú gyermekeknél diagnosztizálható bizonyos fokú bizonyossággal, akik progresszív betegséget mutatnak ki paradox légzéssel , kétoldalú alacsony izomtónussal és hiányzó ínreflexekkel.
Korai diagnózis
Az SMA korai diagnózisa, a betegség tünetmentes szakaszában lehetővé teszi
Preimplantációs vizsgálat
Preimplantációs genetikai diagnosztika lehet használni a képernyő SMA-érintett embriók során in vitro megtermékenyítés .
Prenatális vizsgálat
Az SMA prenatális tesztelése chorionic villus mintavétellel , sejtmentes magzati DNS- elemzéssel és más módszerekkel lehetséges.
Újszülött szűrés
Az SMA rutinszerű szűrése egyre gyakoribbá válik a fejlett országokban, tekintettel arra, hogy a betegség tünetmentes szakaszában a leghatékonyabb okozó kezelések állnak rendelkezésre. 2018 -ban az újszülött SMA szűrést felvették az Egyesült Államok ajánlott újszülött szűrővizsgálatainak listájára, és 2020 áprilisától 39 amerikai államban fogadták el. 2021 májusától az SMA újszülött szűrést Tajvanon hajtották végre, és Ausztráliában, Belgiumban, Kanadában, Franciaországban, Németországban, Hollandiában, Lengyelországban, Szerbiában és Szlovéniában is folyamatban van. Ezenkívül kísérleti projekteket hajtanak végre Ausztráliában, Kínában, Olaszországban és Japánban.
Hordozó tesztelés
Azok, akiknél fennáll a veszélye annak, hogy az SMN1 deléció hordozói , és így az SMA által érintett utódok születésének kockázata, vér- vagy nyálminta segítségével hordozóelemzést végezhetnek. Az Amerikai Szülészeti és Nőgyógyászati Kollégium azt javasolja, hogy minden teherbe esésen gondolkodó embert vizsgáljanak meg, hogy ők hordozók -e. Az SMA hordozófrekvenciája összehasonlítható más rendellenességekkel, például a thalassémiával, és észak -indiai kohorszban 1: 38. A genetikai vizsgálatok azonban nem tudják azonosítani az összes veszélyeztetett személyt, mivel az esetek körülbelül 2% -át okozza de novo mutációk és a normál populációk 5% -ának két SMN1 -példánya van ugyanazon a kromoszómán, ami lehetővé teszi, hogy hordozó legyünk azáltal, hogy egy kromoszómánk két példányban van, és egy második kromoszóma nulla másolattal. Ez a helyzet hamis negatív eredményhez vezet, mivel a hordozó állapotát a hagyományos genetikai teszt nem fogja megfelelően kimutatni.
Menedzsment
Az SMA kezelése a súlyosságtól és a típustól függően változik. A legsúlyosabb formákban (0/1 típus) az egyéneknél van a legnagyobb izomgyengeség, amely azonnali beavatkozást igényel. Míg a legkevésbé súlyos forma (4 -es típus/felnőttkori megjelenés), az egyének az élet későbbi szakaszában (évtizedekben) nem törekedhetnek az ellátás bizonyos aspektusaira. Míg az SMA típusai és az egyes típusok személyei eltérőek lehetnek, ezért az egyén gondozásának bizonyos vonatkozásai eltérhetnek.
Gyógyszer
A Nusinersen -t ( Spinraza néven forgalmazzák) a gerinc izomsorvadásának kezelésére használják. Ez egy antiszensz nukleotid, amely módosítja az SMN2 gén alternatív splicingjét . Ez adott közvetlenül a központi idegrendszer alkalmazásával intratekális injekciót . A Nusinersen meghosszabbítja a túlélést és javítja az SMA -ban szenvedő csecsemők motoros működését. Az USA -ban 2016 -ban, az EU -ban pedig 2017 -ben engedélyezték a használatát.
Az Onasemnogene abeparvovec ( Zolgensma néven forgalmazott) egy génterápiás kezelés, amely önmagát komplementer, 9-es típusú adeno-asszociált vírust (scAAV-9) használja vektorként az SMN1 transzgén szállítására. A terápiát először az Egyesült Államokban, 2019 májusában engedélyezték intravénás készítményként 24 hónaposnál fiatalabb gyermekek számára. Az Európai Unióban, Japánban és más országokban a jóváhagyás következett, bár gyakran eltérő engedélyezési hatókörökkel.
A Risdiplam ( Evrysdi néven forgalmazott) folyékony formában szájon át szedett gyógyszer . Ez egy piridazin -származék, amely úgy működik, mennyiségének növelésével funkcionális túlélő motoros neuron által termelt fehérjét a SMN2 gén révén módosítsa annak splicing mintázat . A Risdiplamot először 2020 augusztusában engedélyezték orvosi használatra az Egyesült Államokban, és azóta több mint 30 országban engedélyezték.
Lélegző
A légzőrendszer a leggyakrabban érintett rendszer, és a szövődmények a fő halálok a 0/1 és 2 -es típusú SMA típusokban. A 3. típusú SMA -nak hasonló légzési problémái lehetnek, de ez ritkább. A szövődmények, amelyek a bordaközi izmok legyengülése miatt merülnek fel az ideg stimuláció hiánya miatt. A rekeszizom kevésbé érintett, mint a bordaközi izmok. A gyengülés után az izmok soha nem térítik vissza teljesen ugyanazt a funkcionális kapacitást, amely segíti a légzést és a köhögést, valamint egyéb funkciókat. Ezért a légzés nehezebb, és azzal a kockázattal jár, hogy nem kap elegendő oxigént/sekély légzést, és nem elegendő a légúti váladék felszabadulása. Ezek a problémák gyakrabban jelentkeznek alvás közben, amikor az izmok nyugodtabbak. A garat nyelő izmait érintheti, ami az aspirációhoz és a rossz köhögési mechanizmushoz vezet, növeli a fertőzés/ tüdőgyulladás valószínűségét . A váladékok mobilizálása és tisztítása magában foglalja a kézi vagy mechanikus mellkasi fizioterápiát poszturális vízelvezetéssel, valamint kézi vagy mechanikus köhögéssegítő eszközt. A légzés segítésére gyakran használnak nem invazív lélegeztetést ( BiPAP ), és néha súlyosabb esetekben tracheostomiát is végezhetnek; mindkét lélegeztetési módszer összehasonlítható mértékben meghosszabbítja a túlélést, bár a tracheostomia megakadályozza a beszédfejlődést.
Táplálás
Minél súlyosabb az SMA típusa, annál valószínűbb, hogy táplálkozással kapcsolatos egészségügyi problémái vannak. Az egészségügyi problémák közé tartozhat az etetés, az állkapocs nyitása, a rágás és a nyelés nehézségei. Az ilyen nehézségekkel küzdő személyeket fokozottan veszélyeztetheti a túl- vagy alultápláltság, a fejlődés elmulasztása és a törekvés. Egyéb táplálkozási problémák, különösen a nem ambuláns személyeknél (az SMA súlyosabb típusai), ide tartoznak azok az ételek, amelyek nem jutnak el elég gyorsan a gyomron, a gyomor refluxja, székrekedés, hányás és puffadás. Ebben az esetben szükség lehet az I. típusú SMA és a súlyosabb II. Típusú betegeknél etetőcsőre vagy gasztrosztómára . Ezenkívül az SMA - ból származó anyagcsere-rendellenességek károsítják az izomzat zsírsav -oxidációját , és szerves acidémiához és ennek következtében izomkárosodáshoz vezethetnek, különösen koplaláskor. Javasolt, hogy az SMA -ban szenvedők, különösen a betegség súlyosabb formáiban szenvedők, csökkentsék a zsírbevitelt és kerüljék a hosszan tartó böjtölést (azaz gyakrabban étkezzenek, mint az egészségesek), valamint lágyabb ételeket válasszanak az aspiráció elkerülése érdekében. Egy akut betegség során, különösen gyermekeknél, a táplálkozási problémák először jelentkezhetnek vagy súlyosbíthatnak egy meglévő problémát (például: aspiráció), valamint más egészségügyi problémákat is okozhatnak, például elektrolit- és vércukorszint -zavarokat.
Ortopédia
Az SMA gyenge izomzatával kapcsolatos csontváz -problémák közé tartoznak a korlátozott mozgásterülettel rendelkező szoros ízületek, csípő -diszlokációk, gerincdeformitás, osteopenia, a csonttörések és a fájdalom kockázatának növekedése. A gyenge izmok, amelyek általában stabilizálják az ízületeket, például a gerincoszlopot, kifózishoz és/vagy gerincferdüléshez és ízületi kontraktúrához vezetnek . A gerincfúziót néha az SMA I/II -ben szenvedő emberekben is elvégzik, miután elérték a 8–10 éves kort, hogy enyhítsék a deformált gerinc nyomását a tüdőre. Továbbá a mozdulatlan személyek, a testtartás és a helyzet a mobilitási eszközökön, valamint a mozgásgyakorlatok és a csontok erősítése fontosak lehetnek a szövődmények megelőzésében. Az SMA -ban szenvedők is sokat profitálhatnak a fizioterápia , a foglalkozási terápia és a fizikai terápia különböző formáiból .
Az ortotikus eszközök használhatók a test támogatására és a járás segítésére. Például az ortéziseket, például az AFO -kat (boka láb ortézisek) használják a láb stabilizálására és a járás segítésére, TLSO -kat (thoracic lumbalis sacralis ortéziseket) a törzs stabilizálására. A segítő technológiák segíthetnek a mozgás és a napi tevékenység kezelésében, és jelentősen javíthatják az életminőséget.
Egyéb
Bár a szív nem rutinszerű kérdés, az SMA és bizonyos szívbetegségek közötti kapcsolat felvetődött.
Az SMA -s gyermekek viselkedésükben nem különböznek az általános populációtól; a kognitív fejlődés lehet kicsit gyorsabb, és bizonyos szempontból az intelligencia meghaladja az átlagot. A fogyatékosság ellenére az SMA-s betegek nagyfokú elégedettségről számolnak be az élettel.
Az SMA palliatív ellátását egységesítették a Consensus Statement for Standard of Care in Spinal Muscular Atrophy konszenzusnyilatkozatában, amelyet világszerte szabványos elfogadásra ajánlottak.
Prognózis
Farmakológiai kezelés hiányában az SMA -s betegek idővel romlanak. A közelmúltban a túlélés megnőtt a súlyos SMA betegeknél, akik agresszív és proaktív támogató légzőszervi és táplálkozási támogatást kaptak.
Ha nem kezelik, a 0 és 1 -es típusú SMA -val diagnosztizált gyermekek többsége nem éri el a 4 éves kort, a visszatérő légzési problémák az elsődleges halálokok. Megfelelő gondossággal az enyhébb I. típusú SMA -esetek (amelyek az összes SMA1 -es eset kb. 10% -át teszik ki) felnőtt korukig élnek. Az I. típusú SMA hosszú távú túlélése nem bizonyított kellőképpen; 2007 -től azonban úgy tűnik, hogy a légzéssegítés terén elért eredmények csökkentették a halálozást.
A kezeletlen II -es típusú SMA -ban a betegség lefolyása lassabb, és a várható élettartam kevesebb, mint az egészséges populáció. A 20 éves kor előtti halál gyakori, bár sok SMA -s ember szülővé és nagyszülővé válik. A III. Típusú SMA várható élettartama normális vagy közel normális, ha betartják az ellátási előírásokat. A IV. Típusú felnőttkori SMA általában csak mozgáskorlátozottságot jelent, és nem befolyásolja a várható élettartamot.
Kutatási irányok
Amióta az SMA mögöttes genetikai okát 1995 -ben azonosították, számos terápiás megközelítést javasoltak és vizsgáltak, amelyek elsősorban az SMN fehérje motoros idegsejtekben való rendelkezésre állásának növelésére összpontosítanak. A fő kutatási irányok a következők voltak:
SMN1 génhelyettesítési
Az SMA génterápiája az SMN1 génfunkció helyreállítását célozza meg azáltal, hogy egy speciálisan kialakított nukleotidszekvenciát ( SMN1 transzgént ) a sejtmagba egy vírusvektor segítségével behelyez . Ezt a megközelítést alkalmazta az SMA első jóváhagyott génterápiája, a scAAV -9 alapú kezelés onasemnogene abeparvovec.
SMN2 alternatív splicing moduláció
Ennek a megközelítésnek az a célja, hogy módosítsa az SMN2 gén alternatív splicingjét , hogy kényszerítse azt a teljes hosszúságú SMN fehérje magasabb százalékának kódolására. Néha génkonverziónak is nevezik, mert megpróbálja az SMN2 gént funkcionálisan SMN1 génné alakítani . Ez a jóváhagyott gyógyszerek, a nusinersen és a risdiplam terápiás mechanizmusa.
A Branaplam egy másik SMN2 splicing modulátor, amely elérte a fejlődés klinikai szakaszát.
Történelmileg ez a kutatási irány más molekulákat is vizsgált. Az RG3039, más néven Quinazoline495, a Repligen által kifejlesztett, 2014 márciusában a Pfizer számára engedélyezett, szabadalmaztatott kinazolinszármazék, amelyet röviddel azután állítottak le, miután csak az I. fázisú vizsgálatokat fejezték be. A PTK-SMA1 a Paratek Pharmaceuticals által kifejlesztett tetraciklinek csoportjának kis molekulájú splicing modulátora volt, és 2010-ben készül a klinikai fejlesztésbe, amely azonban soha nem történt meg. A Hoffmann-La Roche által kifejlesztett RG7800 a rizdiplamhoz hasonló molekula volt, amelyet az I. fázis tesztelésén estek át, de állati toxicitás miatt leállították. A korai vezetők közé tartoztak a nátrium -ortovanadát és az aklarubicin is .
A morfolino típusú antiszensz oligonukleotidok, ugyanazzal a sejtcéllal, mint a nusinersen, továbbra is kutatások tárgyát képezik az SMA és más egygénes betegségek kezelésében, többek között a University College Londonban és az Oxfordi Egyetemen .
SMN2 gén aktiválása
Ez a megközelítés az SMN2 gén expressziójának (aktivitásának) növelését célozza , ezáltal növelve a rendelkezésre álló teljes hosszúságú SMN fehérje mennyiségét.
- Az orális szalbutamol (albuterol), egy népszerű asztmás gyógyszer, terápiás potenciált mutatott az SMA-ban mind in vitro, mind pedig három kis léptékű klinikai vizsgálatban, amelyekben a 2. és 3. típusú SMA-s betegeket is bevonták, a légzési előnyök mellett.
Néhány vegyület kezdetben ígéretesnek mutatkozott, de nem bizonyította hatékonyságát a klinikai vizsgálatok során. Butirátok ( nátrium-butirát és nátrium-fenil ) tartott néhány ígéretesnek in vitro vizsgálatokban, de a klinikai vizsgálatok tünetekkel emberek nem erősítette meg azok hatékonyságát. 2015-ben befejeződött egy másik klinikai vizsgálat a tüneteket megelőző 1-2 típusú csecsemőkkel, de eredményeket nem tettek közzé.
- A valproinsavat (VPA) kísérleti jelleggel használták az SMA -ban az 1990 -es és 2000 -es években, mivel az in vitro kutatások mérsékelt hatékonyságát sugallták. Azonban nem mutatott hatékonyságot az elérhető koncentrációkban, ha nagy klinikai vizsgálatnak vetették alá. Azt is javasolták, hogy hatásos lehet az SMA -s betegek egy csoportjában, de másokban zsírsav transzlokáz elnyomhatja hatását . Mások azzal érvelnek, hogy valójában súlyosbíthatja az SMA tüneteit. Jelenleg nem használják a hosszú távú használathoz kapcsolódó súlyos mellékhatások kockázata miatt. Egy 2019-es metaanalízis szerint a VPA előnyöket kínálhat, még a funkcionális pontszám javítása nélkül is.
- A hidroxi -karbamid (hidroxi -karbamid) hatékonynak bizonyult egérmodellekben, és ezt követően kereskedelmi forgalomban a dán Novo Nordisk kutatta , de a későbbi klinikai vizsgálatokban nem mutattak ki hatást az SMA -ban szenvedő emberekre.
Vegyületeket, amelyek megnövekedett SMN2 aktivitást in vitro , de nem teszi, hogy a klinikai fázisban tartalmazzák a növekedési hormon , a különböző hiszton dezacetiláz inhibitorok , benzamid M344, hidroxámsavak (CBHA, SBHA, entinostat , panobinostatot , trichosztatin A , vorinostat ), prolaktin , valamint a természeti polifenolvegyületek, mint a resveratrol és a kurkumin . A celekoxibot , a p38 útvonal aktivátort, néha egyetlen állatkísérlet alapján használják az SMA-ban szenvedők, de ezt a használatot nem támasztják alá klinikai stádiumú kutatások.
SMN stabilizálás
Az SMN stabilizáció célja az SMNΔ7 fehérje, az SMN2 gén által kódolt rövid életű hibás fehérje stabilizálása , hogy képes legyen fenntartani az idegsejteket.
A vegyületeket nem vitték tovább a klinikai stádiumba. Az aminoglikozidok két vizsgálatban kimutatták, hogy képesek növelni az SMN fehérje elérhetőségét. Az indoprofen ígéretet tett in vitro .
Idegvédelem
A neuroprotektív gyógyszerek célja, hogy lehetővé tegyék a motoros idegsejtek túlélését még alacsony SMN fehérje szint mellett is.
- Az Olesoxime a francia Trophos cég által kifejlesztett, a Hoffmann-La Roche által később megvásárolt, szabadalmaztatott neuroprotektív vegyület volt , amely stabilizáló hatást mutatott egy II. Fázisú klinikai vizsgálatban, amelyen 2-es és 3-as SMA-s személyeket is bevontak. Fejlesztését 2018-ban leállították, tekintettel verseny a nusinersennel, és a vártnál rosszabb adatok, amelyek egy nyílt kiterjesztésű vizsgálatból származnak.
A klinikailag vizsgált, hatásosságot nem mutató vegyületek közül a tirotropint felszabadító hormon (TRH) némi ígéretet tartott egy nyílt, kontrollálatlan klinikai vizsgálatban, de nem bizonyult hatékonynak egy későbbi kettős-vak, placebo-kontrollos vizsgálatban. A riluzolt , egy olyan gyógyszert, amely enyhe klinikai előnyökkel jár az amiotrófiás laterális szklerózis kezelésében , javasolták hasonló módon SMA vizsgálatra; azonban a 2008–2010 -es próba a 2. és 3. típusú SMA -val korán leállt a kielégítő eredmények hiánya miatt. Más vegyületek, amelyek némi neuroprotektív hatást fejtettek ki az in vitro kutatásban, de soha nem mozdultak in vivo vizsgálatokhoz, a béta-laktám antibiotikumok (pl. Ceftriaxon ) és a follistatin .
Izom helyreállítás
Ennek a megközelítésnek az a célja, hogy ellensúlyozza az SMA hatását azáltal, hogy a neuronok helyett az izomszövetet célozza meg.
- A Reldesemtiv (CK-2127107, CK-107) egy csontváz troponin aktivátor, amelyet a Cytokinetics fejlesztett ki az Astellas- szal együttműködve . A gyógyszer célja az izomreaktivitás növelése a csökkent idegi jelzés ellenére. A molekula némi sikert mutatott a II. Fázisú klinikai vizsgálatban serdülőknél és felnőtteknél SMA 2, 3 és 4 típusban.
- Az apitegromab (SRK-015) monoklonális antitest , amely gátolja a vázizomfehérje miosztatin aktiválását , ezáltal elősegítve az izomszövet növekedését. 2021-től a molekula sikeres volt kísérleti kiegészítő kezelésként a nusinersennel kezelt gyermek- és felnőtt betegeknél.
Őssejtek
Míg az őssejtek soha nem képezik részét az SMA elismert terápiájának, számos magánvállalat, amelyek általában laza szabályozási felügyelet alatt álló országokban találhatók, kihasználják a média hype -ját és a piaci őssejt -injekciókat, mint "gyógymódot" a betegségek széles skálájára , beleértve az SMA -t is. Az orvosi konszenzus az, hogy az ilyen eljárások nem jelentenek klinikai előnyöket, miközben jelentős kockázatot hordoznak, ezért az SMA -ban szenvedőket nem javasolják. 2013–2014-ben Olaszországban kis számú SMA1-es gyermek kapott bíróság által előírt őssejt-injekciót a Stamina -átverést követően , de a kezelésről nem számoltak be
Nyilvántartások
Az Európai Unióban SMA-val rendelkező személyek részt vehetnek a klinikai kutatásban, ha adataikat beírják a TREAT-NMD által kezelt nyilvántartásokba .
Lásd még
Hivatkozások
További irodalom
- Parano E, Pavone L, Falsaperla R, Trifiletti R, Wang C (1996. augusztus). "A fenotípusos heterogenitás molekuláris alapja a gerinc izomsorvadású testvéreiben". A neurológia évkönyvei . 40. (2): 247–51. doi : 10.1002/ana.410400219 . PMID 8773609 . S2CID 42514712 .
- Wang CH, Finkel RS, Bertini ES, Schroth M, Simonds A, Wong B, Aloysius A, Morrison L, Main M, Crawford TO, Trela A (2007. augusztus). "Konszenzusos nyilatkozat a gerinc izomsorvadás ellátásának színvonaláról". Gyermekneurológiai folyóirat . 22 (8): 1027–49. doi : 10.1177/0883073807305788 . PMID 17761659 . S2CID 6478040 .
Külső linkek
| Osztályozás | |
|---|---|
| Külső erőforrások |


