Sztereoizomerizmus - Stereoisomerism
A sztereokémia , sztereoizoméria , vagy a térbeli izomériát , egyfajta izoméria , amelyben molekulában azonos molekuláris képietű , és szekvenciája összekapcsolódó atomok (alkotmány), de különböznek a háromdimenziós irányok atomjaik térben. Ez ellentétben áll a strukturális izomerekkel , amelyek molekuláris képlete megegyezik, de a kötési kapcsolatok vagy sorrendjük eltérő. A definíció szerint azok a molekulák, amelyek egymás sztereoizomerjei, ugyanazt a szerkezeti izomert képviselik.
Enantiomerek
Az enantiomerek , más néven optikai izomerek , két sztereoizomer, amelyek egymással tükröződéssel kapcsolódnak egymáshoz: egymás tükörképei , amelyek nem egymásra rakhatók. Az emberi kéz ennek makroszkopikus analógja. Az egyikben minden sztereogén központ ellentétes konfigurációjú. Két vegyület, amelyek egymás enantiomerjei, ugyanazokkal a fizikai tulajdonságokkal rendelkeznek, kivéve azt az irányt, amelyben a polarizált fényt forgatják, és azt, hogy hogyan lépnek kölcsönhatásba más vegyületek különböző optikai izomerjeivel . Ennek eredményeként egy vegyület különböző enantiomerjei lényegesen eltérő biológiai hatásokkal járhatnak. A tiszta enantiomerek az optikai aktivitás jelenségét is mutatják, és csak királis szer alkalmazásával választhatók szét . A természetben a legtöbb királis biológiai vegyületnek csak egy enantiomerje van jelen , például aminosavak (kivéve a glicint , amely akirális). Egy optikailag aktív vegyületnek két formája van: D -(+) forma és L -( -) forma.
Diasztereomerek
A diasztereomerek olyan sztereoizomerek, amelyek nem kapcsolódnak egy reflexiós művelethez. Nem egymás tükörképei. Ezek közé tartozik a mezo vegyületek , cisz - transz -izomerek , EZ izomerek , és a nem-enantiomer optikai izomerek . A diasztereomerek ritkán rendelkeznek azonos fizikai tulajdonságokkal. Az alábbi példában a borkősav mezo formája diasztereomer párt képez mind a levó, mind a dextro borsavakkal, amelyek enantiomerpárt képeznek.

|

|
|
|
(természetes) borkősav |
D -(-)-borkősav |
mezo-borkősav |
|
(1: 1) |
||
A fenti izomerek D - és L - jelölése nem ugyanaz, mint a d - és l - jelölés, amelyeket gyakrabban látnak, és megmagyarázza, miért tűnhetnek megfordítva azok, akik csak az utóbbi elnevezési konvenciót ismerik.
Cisz -transz és EZ izomerizmus
A kettős kötésekkel kapcsolatos sztereoizomerizmus azért keletkezik, mert a kettős kötés körüli forgás korlátozott, és a szubsztituensek egymáshoz képest rögzítve maradnak. Ha a két szubsztituens legalább egyik végén egy kettős kötés azonos, akkor nincs sztereoizomerje, és a kettős kötés nem egy sztereocentrum, pl propén, CH 3 CH = CH 2 , ahol a két szubsztituens egyik végén egyaránt hidrogénatom .
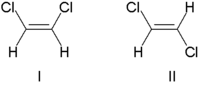
Hagyományosan a kettős kötés sztereokémiáját cisz (latin, ezen az oldalon) vagy transz (latin, kereszt) kifejezéssel írták le, a kettős kötés mindkét oldalán lévő szubsztituensek relatív helyzetére való hivatkozással. A legegyszerűbb példa cisz - transz izoméria a 1,2-diszubsztituált etilének, mint a diklór-etén (C 2 H 2 Cl 2 ) izomerek alább látható.
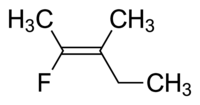
Az I. molekula cisz -1,2 -diklór -etén, a II -es molekula pedig transz -1,2 -diklór -etén. Időnként a félreérthetőség miatt az IUPAC szigorúbb rendszert fogadott el, amelyben a kettős kötés mindkét végén lévő szubsztituenseket az atomszámuk alapján prioritásként kezelik . Ha a magas prioritású szubsztituensek a kötés ugyanazon oldalán vannak, akkor Z (Ger. Zusammen , együtt) van hozzárendelve . Ha ellentétes oldalon vannak, akkor E (Ger. Entgegen , szemben). Mivel a klór atomszáma nagyobb, mint a hidrogéné, ez a legmagasabb prioritású csoport. Ezt a jelölést használva a fenti képen látható molekulák megnevezésére az I. molekula (Z) -1,2-diklór-etén, a II. Molekula pedig (E) -1,2-diklór-etén. Nem az a helyzet, hogy Z és cisz vagy E és transz mindig felcserélhetők. Vegye figyelembe a következő fluor -metil -pentént:
Ennek a molekulának a megfelelő neve vagy transz -2-fluor-3-metil-pent-2-én, mert a gerincláncot alkotó alkilcsoportok (pl. Metil és etil) a kettős kötésen keresztül helyezkednek el egymástól, vagy (Z) -2-fluor-3-metilpent-2-én, mert a kettős kötés mindkét oldalán a legmagasabb prioritású csoportok a kettős kötés ugyanazon oldalán találhatók. A fluor a legmagasabb prioritású csoport a kettős kötés bal oldalán, és az etil a legmagasabb prioritású csoport a molekula jobb oldalán.
A cisz és transz kifejezéseket két szubsztituens egymáshoz viszonyított helyzetének leírására is használjuk; cisz, ha ugyanazon az oldalon, különben transz .
Konformerek
A konformációs izomerizmus az izomerizmus egyik formája, amely leírja az azonos szerkezeti képletű, de különböző alakú molekulák jelenségét egy vagy több kötés körül. A különböző konformációk különböző energiákkal rendelkezhetnek, általában egymással átalakulhatnak, és nagyon ritkán izolálhatók. Például a ciklohexán különféle konformációkban létezhet, beleértve a székkonformációt és a hajókonformációt, de maga a ciklohexán esetében ezeket soha nem lehet elválasztani. A hajókonformáció az energiamaximumot jelenti a konformációs útvonalon a két egyenértékű székforma között; azonban ez nem jelenti az átmeneti állapotot ehhez a folyamathoz, mert vannak alacsonyabb energiájú utak.
Vannak olyan molekulák, amelyek több konformációban izolálhatók, a különböző konformációk közötti nagy energiagátak miatt. A 2,2 ', 6,6'-tetraszubsztituált bifenilcsoportok ebbe a kategóriába tartozhatnak.
Anomerek
Az anomerizmus azon egyszemélyes kötésű gyűrűs szerkezetek azonossága, ahol "cisz" vagy "Z" és "transz" vagy "E" (geometriai izomerizmus) meg kell nevezni a szubsztitúciókat egy szénatomon, amely egyben a kiralitás azonosságát is mutatja; így az anomerek olyan szénatomokkal rendelkeznek, amelyek geometriai izomerizmussal és optikai izomerizmussal ( enantiomerizmussal ) rendelkeznek a gyűrű egy vagy több szénatomján. Az anomereket "alfa" vagy "axiális" és "béta" vagy "ekvatoriális" névvel illetik, amikor olyan gyűrűs gyűrűs szerkezetet helyettesítenek, amely egyetlen kötéssel rendelkezik a gyűrű szénatomjai között, például egy hidroxilcsoport, metil -hidroxil -csoport, metoxicsoport vagy más piranóz vagy furanóz csoport, amelyek tipikus egyszeres kötéses szubsztitúciók, de nem korlátozódnak ezekre. Az axiális geometriai izomerizmus merőleges (90 fok) lesz a referenciasíkra, az egyenlítői pedig 120 fokos távolságra lesznek az axiális kötéstől, vagy 30 fokkal térnek el a referenciasíktól.
Atropizomerek
Az atropizomerek olyan sztereoizomerek, amelyek az egyes kötések körüli akadályozott forgásból származnak, és ahol a sztérikus törésgát a forgáshoz elég magas ahhoz, hogy lehetővé tegyék a konformerek elkülönítését.
További definíciók
- A konfigurációs sztereoizomer olyan referenciamolekula sztereoizomerje, amelynek sztereocentruma ellentétes konfigurációjú (pl. R- vs S- vagy E- vs Z- ). Ez azt jelenti, hogy a konfigurációs izomereket csak úgy lehet átalakítani, ha kovalens kötéseket szakítunk a sztereocentrumhoz, például egy vegyületben lévő sztereocentrumok egy részének vagy egészének megfordításával .
- Az epimer olyan diasztereoizomer, amelynek konfigurációja csak az egyik sztereocentrumban van.
Le Bel-van't Hoff uralkodik
A Le Bel-van't Hoff-szabály kimondja, hogy egy n aszimmetrikus szénatomot tartalmazó szerkezet esetében legfeljebb 2 n különböző sztereoizomer lehetséges. Példaként a D -glükóz egy aldohexóz, és képlete C 6 H 12 O 6 . Hat szénatomjából négy sztereogén, ami azt jelenti, hogy a D -glükóz a 2 4 = 16 lehetséges sztereoizomer egyike .