X -inaktiválás - X-inactivation

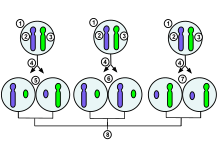
1.Early szakaszában embrionális sejt egy női emberi
2.Maternal X kromoszómán
3.Paternal X kromoszóma
4.Mitosis és véletlenszerű X-kromoszóma inaktiváció esemény
5.Paternal kromoszóma véletlenszerűen inaktiválódik egy leánysejt, anyai kromoszóma inaktiválódik a másik
6 Az apai kromoszóma véletlenszerűen inaktiválódik mindkét leánysejtben
7. Az anyai kromoszóma véletlenszerűen inaktiválódik mindkét leánysejtben 8.
Három lehetséges véletlenszerű kombinációs eredmény
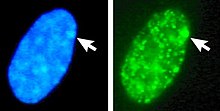
Balra: DNS (DAPI) festett mag. A nyíl jelzi Barr testének helyét (Xi). Jobbra: DNS -hez kapcsolódó hisztonfehérjét észleltünk
X-inaktiváció (más néven Lyonization , angol után genetikus Mary Lyon ) egy olyan folyamat, amelynek egyik példányát a X-kromoszóma , inaktiválva van azon therian nőstény emlősökben . Az inaktív X -kromoszóma elnémul, ha egy transzkripciósan inaktív szerkezetbe csomagolják, amelyet heterokromatinnak neveznek . Mivel szinte minden nőstény emlősnek két X kromoszómája van, az X-inaktiváció megakadályozza, hogy kétszer annyi X-kromoszóma géntermékük legyen, mint a hímeknek , akiknek csak egyetlen példányuk van az X-kromoszómából (lásd az adagolás kompenzációját ).
A méhlepényes emlősök, például az emberek véletlenszerű választása, hogy melyik X kromoszómát inaktiválják , de ha az X kromoszóma inaktiválódik, akkor a sejt és a szervezetben (annak sejtvonalában) lévő utódai élettartama alatt inaktív marad. Gyakran előfordul az X-inaktiváció, amely egyenetlenül oszlik el egy szervezetben a sejtvonalak között ( ferde X-inaktiváció ).
Ellentétben a véletlenszerű X-inaktivációval a placenta emlősökben, az erszényes állatokban történő inaktiválás kizárólag az apai eredetű X kromoszómára vonatkozik.
Gépezet
X-kromoszóma aktivációs ciklus rágcsálókban
Az alábbi bekezdések csak rágcsálókkal kapcsolatosak, és az emlősök többségében nem tükrözik a XI. Az X-inaktiváció az X-kromoszóma aktivációs ciklusának része a nő életében. A tojás és a megtermékenyített zigóta kezdetben anyai átiratokat használ, és az egész embrionális genomot elhallgattatják a zigóta genom aktiválásáig. Ezt követően minden egérsejt korai, lenyomott inaktiváción megy keresztül az apai eredetű X kromoszóma 4-8 sejtes stádiumú embrióiban . Az extraembrionális szövetek (amelyek a méhlepényt és az embriót támogató egyéb szöveteket hozzák létre) megtartják ezt a korai lenyomatos inaktivációt, és így csak az anyai X kromoszóma aktív ezekben a szövetekben.
A korai blasztocisztában ez a kezdeti, lenyomatos X-inaktiváció megfordul a belső sejtmassza sejtjeiben (amelyekből az embrió keletkezik), és ezekben a sejtekben mindkét X kromoszóma újra aktívvá válik. E sejtek mindegyike önállóan és véletlenszerűen inaktiválja az X kromoszóma egy példányát. Ez az inaktivációs esemény visszafordíthatatlan az egyén élete során, kivéve a csíravonalat. A nőstény csíravonalban a meiotikus belépés előtt az X-inaktiváció megfordul, így a meiózis után minden haploid petesejt egyetlen aktív X-kromoszómát tartalmaz.
Áttekintés
Az Xi az inaktív, a Xa az aktív X kromoszómát jelöli . X P az apai, X M pedig az anyai X kromoszómát jelöli. Amikor a tojást (amely X M -et hordoz ) egy spermium megtermékenyíti (Y vagy X P ), diploid zigóta képződik. A zigótától a felnőtt stádiumon át a tojások következő generációjáig az X kromoszóma a következő változásokon megy keresztül:
- Xi P Xi M zigóta → zigóta genom aktiváláson megy keresztül , ami a következőkhöz vezet:
- Xa P Xa M → nyomott (apai) X-inaktiváláson megy keresztül , ami a következőkhöz vezet:
- Xi P Xa M → X-aktiváláson megy keresztül a korai blasztocisztás szakaszban, ami a következőkhöz vezet:
- Xa P Xa M → véletlenszerű X-inaktiváción megy keresztül az embrionális törzsben (belső sejttömeg) a blasztociszta stádiumban, ami a következőkhöz vezet:
- Xi P Xa M VAGY Xa P Xi M → X-reaktiváción megy keresztül az őscsírasejtekben a meiózis előtt , ami a következőkhöz vezet:
- Xa M Xa P diploid csírasejtek meiotikus leállásban. Mivel a meiózis csak az ovulációval fejeződik be , az emberi csírasejtek ebben a szakaszban léteznek a fejlődés első heteitől a pubertásig. A meiózis befejezése a következőket eredményezi:
- Xa M ÉS Xa P haploid csírasejtek (tojások).
Az X aktivációs ciklust legjobban egereken tanulmányozták, de embereken több vizsgálat is létezik. Mivel a legtöbb bizonyíték egerekből származik, a fenti séma az egerekben történt eseményeket mutatja be. Az egyszerűség kedvéért itt leegyszerűsítik a meiózis befejezését. Az 1–4. Lépés tanulmányozható in vitro megtermékenyített embriókban és differenciáló őssejtekben; Az X-reaktiváció a fejlődő embrióban és az azt követő (6–7) lépésekben történik a női testben, ezért sokkal nehezebb tanulmányozni.
Időzítés
Az egyes folyamatok időzítése a fajtól függ, és sok esetben aktívan vitatják a pontos időt. [Az X-inaktiválás emberi időzítésének egész része ebben a táblázatban erősen megkérdőjelezhető, és el kell távolítani, amíg empirikus adatok nem igazolják megfelelően]
| Folyamat | Egér | Emberi | |
| 1 | Zigóta genom aktiválás | 2–4 sejtes stádium | 2-8 sejtes stádium |
| 2 | Nyomtatott (apai) X-inaktiválás | 4-8 sejtes stádium | Nem világos, hogy emberekben történik -e |
| 3 | X-aktiválás | Korai blasztocisztás stádium | Korai blasztocisztás stádium |
| 4 | Véletlenszerű X-inaktiváció az embrionális törzsben (belső sejttömeg) | Késő blasztocisztás stádium | Késői blasztocisztás stádium, beültetés után |
| 5 | X-reaktiváció őssejtekben a meiózis előtt | A fejlődés előtti 4. héttől a 14. hétig |
Az inaktiválási állapot öröklődése a sejtgenerációk között
Minden egyes sejt leszármazottai, amelyek inaktiválták egy adott X kromoszómát, szintén inaktiválják ugyanazt a kromoszómát. Ezt a jelenséget, amely a teknősbéka-macskák színezésében figyelhető meg, amikor a nőstények heterozigóták az X-kapcsolt génre , nem szabad összetéveszteni a mozaikossággal , amely kifejezés kifejezetten az azonos sejtpopulációk genotípusának különbségeire utal. Egyedi; Az X-inaktiválás, amely egy epigenetikus változás, amely más fenotípust eredményez, nem változás a genotípus szintjén. Ezért az egyes sejtek vagy törzsek esetében az inaktiváció torz vagy „ nem véletlenszerű ”, és ez enyhe tüneteket okozhat az X-kapcsolt genetikai rendellenességek női „hordozóiban” .
Egy aktív X kromoszóma kiválasztása
A normális nőstények két X kromoszómával rendelkeznek, és bármelyik sejtben egy kromoszóma lesz aktív (Xa jelöléssel), egy pedig inaktív (Xi). Az X kromoszóma extra másolataival rendelkező egyének vizsgálatai azonban azt mutatják, hogy a kettőnél több X kromoszómával rendelkező sejtekben még mindig csak egy Xa van, és az összes többi X kromoszóma inaktivált. Ez azt jelzi, hogy a nők X -kromoszómájának alapértelmezett állapota inaktiváció, de mindig egy X -kromoszóma van kiválasztva, hogy aktív maradjon.
Magától értetődik, hogy az X-kromoszóma inaktiválása véletlenszerű folyamat, amely körülbelül a gasztruláció idején következik be az epiblasztban (az embriót okozó sejtek). Az anyai és apai X kromoszómák azonos valószínűséggel inaktiválódnak. Ez azt sugallja, hogy a nők várhatóan körülbelül 50% -ban olyan gyakran szenvednek X-hez kapcsolódó rendellenességektől, mint a férfiak (mivel a nőknek két X kromoszómája van, míg a férfiaknak csak egy); valójában azonban ezeknek a rendellenességeknek a nőknél való előfordulása ennél jóval alacsonyabb. Ennek az eltérésnek az egyik magyarázata az, hogy az inaktivált X kromoszóma génjeinek 12–20% -a expresszált marad, ezáltal a nők védelmet kapnak az X-kromoszóma által kódolt hibás génekkel szemben. Néhányan azt sugallják, hogy ennek az eltérésnek bizonyítéknak kell lennie a preferenciális (nem véletlenszerű) inaktivációra. Az apai X-kromoszóma preferenciális inaktiválása mind az erszényes állatokban, mind az embriót körülvevő membránokat alkotó sejtvonalakban fordul elő, míg a placenta emlősökben akár az anyai, akár az apai eredetű X-kromoszóma különböző sejtvonalakban inaktiválódhat.
Az X-kromoszóma inaktiválásának időtartama megmagyarázza ezt az eltérést. Az inaktiváció az epiblasztban történik a gasztruláció során, ami az embriót eredményezi. Az inaktiválás sejtszinten történik, ami mozaik expressziót eredményez, amelyben a sejtek foltjai inaktív anyai X-kromoszómával rendelkeznek, míg más tapaszok inaktív apai X-kromoszómával rendelkeznek. Például egy hemofíliában (X-hez kapcsolódó betegség) heterozigóta nő esetében a májsejtek körülbelül fele megfelelően működne, ami jellemzően elegendő a normális véralvadáshoz. Az esély jelentősen több diszfunkcionális sejtet eredményezhet; azonban ilyen statisztikai szélsőségek nem valószínűek. A kromoszóma genetikai különbségei miatt egy X-kromoszóma is nagyobb valószínűséggel inaktiválódhat. Továbbá, ha egy X-kromoszóma mutációját gátolja, vagy életképtelenné teszi, akkor az X-et véletlenszerűen inaktiváló sejtek szelektív előnyben részesülnek a normál allélt véletlenszerűen inaktiváló sejtekkel szemben. Így, bár az inaktiválás kezdetben véletlenszerű, a normál allélt inaktiváló sejtek (a mutált allélt aktív állapotban hagyva) végül túlnőttek, és funkcionálisan normális sejtekkel helyettesítik, amelyekben szinte mindegyik aktivált X-kromoszóma.
Feltételezések szerint létezik egy autoszomálisan kódolt „blokkoló faktor”, amely kötődik az X kromoszómához és megakadályozza annak inaktiválódását. A modell azt feltételezi, hogy létezik korlátozó blokkoló faktor, így ha a rendelkezésre álló blokkoló faktor molekula egy X kromoszómához kötődik, a fennmaradó X kromoszóma (k) nincsenek védve az inaktiválással szemben. Ezt a modellt alátámasztja egyetlen Xa létezése a sok X kromoszómával rendelkező sejtekben, valamint két aktív X kromoszóma létezése a normál autoszómák kétszeresével rendelkező sejtvonalakban.
Az X -inaktivációs központban ( XIC ) található szekvenciák, amelyek az X -kromoszómán vannak, szabályozzák az X -kromoszóma elnémítását. A feltételezett blokkoló faktor várhatóan kötődni fog az XIC -n belüli szekvenciákhoz.
X-kapcsolt rendellenességek kifejeződése heterozigóta nőstényekben
A nőstény X heterozigótás hatása néhány lokalizált tulajdonságban nyilvánvaló, például egy kalikó macska egyedi szőrzetmintájában. Nehezebb lehet azonban teljesen megérteni ezekben a nőstényekben a nem lokalizált tulajdonságok kifejeződését, például a betegség kifejeződését.
Mivel a hímeknek csak egy példánya van az X-kromoszómából, az összes expresszált X-kromoszóma gén (vagy allél , ha a populációban egy adott gén többféle formája létezik) a kromoszóma azon másolatán található. A nőstények azonban elsősorban azokat a géneket vagy allélokat fejezik ki, amelyek az X-kromoszóma másolatán találhatók, és továbbra is aktívak. Figyelembe véve egy vagy több gén helyzetét, amelyek egyedi különbségeket okoznak egy adott fenotípusban (azaz a populációban megfigyelhető eltéréseket okoznak ebben a fenotípusban), homozigóta nőstényeknél nem mindegy, hogy a kromoszóma melyik példánya inaktivált, mivel az allélok mindkét példányon ugyanaz. Azoknál a nőstényeknél azonban, akik heterozigóta az ok -okozati géneknél, a kromoszóma egyik példányának inaktiválása a másik felett közvetlen hatással lehet a fenotípusos értékükre. Ennek a jelenségnek köszönhetően megfigyelték a fenotípusos eltérések növekedését azokban a nőstényekben, amelyek heterozigótaak az érintett génnél vagy géneknél, mint azoknál a nőknél, amelyek homozigótaak az adott génnél vagy azoknál a géneknél. A fenotípusos variációnak sokféle módja lehet. Sok esetben a heterozigóta nőstények tünetmentesek lehetnek, vagy csak kisebb tüneteket mutathatnak egy adott rendellenességre, például X-kapcsolt adrenoleukodystrophia esetén.
A heterozigóta nőstények fenotípusának differenciálódását elősegíti az X-inaktivációs torzulás jelenléte. Jellemzően minden X-kromoszóma elnémul a sejtek felében, de ez a folyamat torz, amikor a kromoszóma előnyben részesül. Úgy gondolják, hogy a torzulás vagy véletlenül, vagy a kromoszóma fizikai jellemzői miatt következik be, amelyek miatt többé -kevésbé gyakran elnémulhat, például kedvezőtlen mutáció.
Átlagosan minden X kromoszóma inaktiválódik a sejtek felében, azonban a "látszólag normális" nők 5-20% -a mutat X-inaktivációs torzulást. Azokban az esetekben, amikor torzítás van jelen, a tünetek kifejeződése széles skálán fordulhat elő, ami azt eredményezheti, hogy a kifejezés a ferde aránytól függően kisebb vagy súlyos. Ennek szélsőséges esete volt az, amikor a monozigóta nőstény ikrek rendkívüli eltéréseket mutattak a Menkes-betegség (X-hez kapcsolódó rendellenesség) kifejezésében, ami az egyik iker halálát okozta, míg a másik tünetmentes maradt.
Úgy gondolják, hogy az X-inaktivációs torzulást az inaktivációt okozó mechanizmus problémái vagy maga a kromoszóma okozhatja. A fenotípus és a ferdeség közötti kapcsolatot azonban még mindig megkérdőjelezik, és ezt eseti alapon kell megvizsgálni. A Duchenne és Becker izomdisztrófiák (DMD) tekintetében heterozigóta nőstényeket vizsgáló, tüneteket és tüneteket nem mutató nőket egyaránt vizsgáló tanulmány nem talált nyilvánvaló kapcsolatot a transzkriptum expressziója és a ferde X-inaktiváció között. A tanulmány azt sugallja, hogy mindkét mechanizmust egymástól függetlenül szabályozzák, és vannak más ismeretlen tényezők is.
Kromoszóma komponens
Az X-inaktivációs központ (vagy egyszerűen XIC) az X-kromoszómán szükséges és elegendő ahhoz , hogy X-inaktivációt okozzon. A kromoszóma transzlokációk, amelyek az XIC -t egy autoszómára helyezik, az autoszóma inaktiválásához vezetnek, és az XIC hiányzó X kromoszómák nem inaktiválódnak.
Az XIC négy nem lefordított RNS gént tartalmaz, Xist , Tsix , Jpx és Ftx , amelyek részt vesznek az X-inaktivációban. Az XIC kötőhelyeket is tartalmaz ismert és ismeretlen szabályozófehérjékhez .
Xist és Tsix RNS -ek
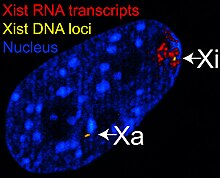
Az X-inaktív specifikus transzkript ( Xist ) gén egy nagy, nem kódoló RNS-t kódol , amely felelős az X-kromoszóma specifikus elnémításának közvetítéséért, amelyből átírták. Az inaktív X kromoszómát Xist RNS borítja, míg az Xa nem (lásd a jobb oldali ábrát). Az X kromoszómákat, amelyekből hiányzik a Xist gén, nem lehet inaktiválni. A Xist gén mesterséges elhelyezése és kifejezése egy másik kromoszómán a kromoszóma elhallgatásához vezet.
Az inaktiválás előtt mindkét X kromoszóma gyengén expresszálja a Xist génből származó Xist RNS -t. Az inaktiválási folyamat során a jövőbeli Xa megszűnik Xist kifejezni, míg a jövőbeli Xi drámaian megnöveli az Xist RNS termelést. A jövőbeni Xi -n az Xist RNS fokozatosan beborítja a kromoszómát, az XIC -ből terjedve; a Xist RNS nem lokalizálódik az Xa -hoz. A gének elnémítása az Xi mentén hamarosan a Xist RNS bevonat után következik be.
A Xisthez hasonlóan a Tsix gén egy nagy RNS -t kódol, amelyről feltételezések szerint nem fehérjét kódol. A Tsix RNS átíródik antiszensz hogy Xist, ami azt jelenti, hogy a Tsix gén átfedi a Xist gént, és átíródik az ellentétes szálon a DNS a Xist gént. A Tsix a Xist negatív szabályozója; Azok az X kromoszómák, amelyekből hiányzik a Tsix expresszió (és így magas a Xist transzkripció szintje), sokkal gyakrabban inaktiválódnak, mint a normál kromoszómák.
A Xisthez hasonlóan az inaktiválás előtt mindkét X kromoszóma gyengén expresszálja a Tsix RNS -t a Tsix génből. Az X-inaktiváció megkezdésekor a jövőbeli Xi leállítja a Tsix RNS expresszióját (és növeli a Xist expressziót), míg az Xa néhány napig továbbra is expresszálja a Tsix-et.
Az Rep A egy hosszú, nem kódoló RNS, amely egy másik hosszú, nem kódoló RNS -sel, a Xist -nel működik együtt az X inaktiválásához. Az Rep A gátolja a Tsix, a Xist antiszensz funkcióját, és kizárja a Xite expresszióját. Elősegíti a Tsix régió metilálását azáltal, hogy vonzza a PRC2 -t, és ezáltal inaktiválja az egyik X -kromoszómát.
Némítás
Az inaktív X kromoszóma nem fejezi ki génjeinek többségét, ellentétben az aktív X kromoszómával. Ennek oka az Xi elnyomása az elnyomó heterokromatin által , amely tömöríti az Xi DNS -t és megakadályozza a legtöbb gén expresszióját.
Az Xa-hoz képest az Xi-ben magas a DNS-metiláció , alacsony a hiszton-acetiláció szintje, alacsony a hiszton-H3- lizin-4- metiláció szintje, és magas a H3-lizin-9-metiláció és a H3-lizin-27-metilációs jel, amely a Xist által toborzott PRC2 komplex által , amelyek mindegyike géncsendesítéshez kapcsolódik. A PRC2 számos folyamatban szabályozza a kromatin tömörítését és a kromatin átalakítását , beleértve a DNS károsodási válaszát. Ezenkívül a makroH2A ( H2AFY ) nevű hisztonvariáns kizárólag a Xi mentén található nukleoszómákon található.
Barr testek
A heterokromatinba csomagolt DNS, például az Xi, jobban kondenzálódik, mint az euchromatinba csomagolt DNS , például a Xa. Az inaktív X egy különálló testet képez a magban, amelyet Barr testnek neveznek . A Barr -test általában a mag perifériáján helyezkedik el , későn replikálódik a sejtcikluson belül , és mivel tartalmazza a Xi -t, heterokromatin -módosításokat és Xist -RNS -t tartalmaz.
Kifejezett gének az inaktív X kromoszómán
Az X kromoszóma mentén lévő gének töredéke elkerülheti az inaktiválást a Xi -n. A Xist gén magas szinten expresszálódik az Xi -n, és nem expresszálódik az Xa -n. Sok más gén elkerülheti az inaktivációt; egyesek egyenlő mértékben expresszálódnak az Xa -ból és Xi -ből, míg mások, míg mindkét kromoszómából kifejeződnek, még mindig túlnyomórészt az Xa -ból expresszálódnak. Az emberi Xi génjeinek egynegyede képes menekülni. Az egereken végzett vizsgálatok azt sugallják, hogy bármely adott sejttípusban a gének 3–15% -a menekül az inaktiváció elől, és hogy a menekülő génazonosság szövetenként változik.
Az inaktiváció elől menekülő gének közül sok az X kromoszóma olyan régiói mentén van jelen, amelyek az X kromoszóma többségével ellentétben az Y kromoszómán is jelen lévő géneket tartalmaznak . Ezeket a régiókat pszeudoautoszomális régióknak nevezik , mivel bármelyik nem egyedei két példányban kapnak minden gént ezekben a régiókban (például egy autoszóma), ellentétben a nemi kromoszómák mentén található gének többségével. Mivel bármely nemű személyek két példányban kapnak minden gént egy pszeudoautoszomális régióban , a nők esetében nincs szükség dóziskompenzációra, ezért feltételezhető, hogy ezek a DNS-régiók kifejlesztették az X-inaktiváció elkerülésére szolgáló mechanizmusokat. A Xi pszeudoautoszomális régióinak génjei nem rendelkeznek a Xi tipikus módosulataival, és kevés Xist RNS kötődik hozzájuk.
A nem elhallgatott gének létezése az inaktív X mentén megmagyarázza az emberek hibáit az X kromoszóma kóros számával, mint például a Turner -szindróma (X0) vagy a Klinefelter -szindróma (XXY). Elméletileg az X-inaktiválásnak ki kell küszöbölnie a különbségeket a génadagolásban az érintett egyének és a normális kromoszóma komplementtel rendelkező egyének között. Az érintett egyénekben azonban az X-inaktiváció nem teljes, és ezeknek a nem csendesített géneknek az adagja eltérő lesz, mivel elkerülik az X-inaktivációt, hasonlóan az autoszomális aneuploidiahoz .
Az X-inaktivációból való menekülést szabályozó pontos mechanizmusok nem ismertek, de az elnémított és menekülési területekről kimutatták, hogy különböző kromatinjelekkel rendelkeznek. Azt javasolták, hogy az X-inaktiváció elől való menekülést a nem kódoló RNS (lncRNS) expressziója közvetítheti a menekülő kromoszóma doménekben.
Alkalmazás a kísérleti biológiában
Stanley Michael Gartler X-kromoszóma inaktiválást alkalmazott a rák klonális eredetének igazolására. A nemi kötődésű G6PD gén izoenzimjeire heterozigóta nőstények normális szöveteinek és daganatainak vizsgálata kimutatta, hogy az ilyen egyedekből származó tumorsejtek csak a G6PD egyik formáját expresszálják, míg a normál szövetek a két különböző fenotípust kifejező sejtek közel azonos keverékéből állnak. Ez a minta azt sugallja, hogy egyetlen sejt, és nem populáció, rákrá nő. Ez a minta azonban sok ráktípus esetében hibásnak bizonyult, ami arra utal, hogy egyes rákok poliklonális eredetűek lehetnek.
Ezenkívül az X-kromoszómán található polimorf humán androgén receptor (HUMARA) metilációs (inaktivációs) állapotának mérését tekintik a legpontosabb módszernek a klónosság értékelésére a női rákbiopsziákban. Nagyon sokféle daganatot teszteltek ezzel a módszerrel, egyesek, például a vesesejtes karcinóma monoklonálisnak bizonyultak, míg mások (pl. Mesothelioma) poliklonálisnak bizonyultak.
A kutatók azt is megvizsgálták, hogy X-kromoszóma inaktiválást alkalmaznak az autoszomális kromoszómák aktivitásának elnémítására. Például Jiang és mtsai. behelyezte a Xist gén egy példányát a 21. kromoszóma egy példányába a 21 -es triszómiából ( Down -szindróma ) szenvedő egyénből származó őssejtekben . A beillesztett Xist gén Barr-testképződést indukál, stabil heterokromatin-módosításokat indít el, és elhallgatja a 21. gén kromoszóma extra példányának génjeit. Ezekben a módosított őssejtekben a Xist-közvetített géncsendesítés megfordítja a Down-szal kapcsolatos hibákat. szindróma.
Történelem
Susumu Ohno 1959 -ben kimutatta, hogy az emlősök két X -kromoszómája eltérő: az egyik az autoszómákhoz hasonlított ; a másik sűrített és heterokromatikus volt. Ez a megállapítás két kutatócsoporttól függetlenül azt sugallta, hogy az X kromoszóma egyike inaktiválódott.
1961 -ben Mary Lyon egy nőstény X -kromoszóma véletlenszerű inaktiválását javasolta, hogy megmagyarázza a szőrzet génjeire heterozigóta nőstény egerek foltos fenotípusát . A Lyon -hipotézis azt is megállapította, hogy a női sejtek X -kromoszómájának egy példánya erősen sűrített, és hogy az egerek, amelyeknek csak egy példánya volt az X -kromoszóma, terméketlen nőstényekké fejlődtek. Ez azt sugallta Ernest Beutlernek , aki a glükóz-6-foszfát-dehidrogenáz (G6PD) hiányát vizsgáló heterozigóta nőstényeket vizsgálta , hogy két vörösvérsejt-populáció volt az ilyen heterozigótákban: hiányos sejtek és normál sejtek, attól függően, hogy az inaktivált X-kromoszóma a vörösvértest prekurzor sejtmagja) tartalmazza a normál vagy hibás G6PD allélt.
Lásd még
- Szexmeghatározó rendszer
- Adagkompenzáció
- Barr test
- Heterochromatin
- Epigenetika
- Ferde X-inaktiváció
- Fejlődési rendellenességek, amelyekről feltételezik, hogy az X-inaktivációhoz kapcsolódnak:
Hivatkozások
További irodalom
- Huynh KD, Lee JT (2005. május). "X-kromoszóma inaktiváció: hipotézis, amely összeköti az ontogeneziát és a filogengiát". Nature Vélemények. Genetika . 6 (5): 410–8. doi : 10.1038/nrg1604 . PMID 15818384 . S2CID 19245310 .
- Goto T, Monk M (1998. június). "Az X-kromoszóma inaktivációjának szabályozása a fejlődésben egerekben és emberekben" (áttekintő cikk) . Mikrobiológiai és molekuláris biológiai vélemények . 62. (2): 362–78. doi : 10.1128/MMBR.62.2.362-378.1998 . PMC 98919 . PMID 9618446 .
- Lyon MF (2003. december). "A Lyon és a LINE hipotézis". Szemináriumok a sejt- és fejlődésbiológiában (áttekintő cikk). 14 (6): 313–8. doi : 10.1016/j.semcdb.2003.09.015 . PMID 15015738 .
- Ng K, Pullirsch D, Leeb M, Wutz A (2007. január). "Xist és a némítás rendje" (áttekintő cikk) . EMBO jelentések . 8. (1): 34–9. doi : 10.1038/sj.embor.7400871 . PMC 1796754 . PMID 17203100 .
- Cerase A, Pintacuda G, Tattermusch A, Avner P (2015. augusztus). "Xist lokalizáció és funkció: új betekintés több szintről" . Genombiológia . 16 : 166. doi : 10.1186/s13059-015-0733-y . PMC 4539689 . PMID 26282267 .
Külső linkek
-
 Az X kromoszóma inaktiválásával kapcsolatos médiák a Wikimedia Commonsban
Az X kromoszóma inaktiválásával kapcsolatos médiák a Wikimedia Commonsban - Kruszelnicki K (2004-02-11). "Hibrid autoimmun nők 3" . ABC Tudomány .

