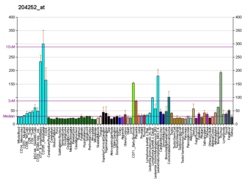
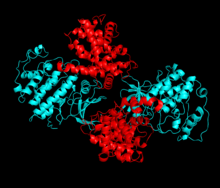
Ciklinfüggő kináz 2 - Cyclin-dependent kinase 2
A ciklinfüggő kináz 2 , más néven sejtosztódási protein-kináz 2 vagy Cdk2, olyan enzim , amelyet emberekben a CDK2 gén kódol . Az e gén által kódolt fehérje a Ser/Thr protein kinázok ciklinfüggő kinázcsaládjának tagja . Ez a protein -kináz nagyon hasonlít az S. cerevisiae cdc28 és a S. pombe cdc2, más néven Cdk1 géntermékeihez az emberekben. Ez egy katalitikus alegységét ciklin-dependens kináz komplex, amelynek aktivitása korlátozódik a G1-S fázis a sejtciklus , ahol a sejtek teszik szükséges fehérjéket mitózist és megismételni a DNS-t. Ez a fehérje társítja, és szabályozza a szabályozó alegységek a komplex, beleértve a ciklin E vagy A . A ciklin E megköti a G1 Cdk2 fázist, amely a G1 fázisból az S fázisba való átmenethez szükséges, míg a ciklin A kötődése az S fázis előrehaladásához szükséges. Tevékenységét a foszforiláció is szabályozza . Ennek a génnek több alternatív módon összeillesztett változatát és több transzkripciós iniciációs helyét jelentették. Ennek a fehérjének a G1-S átmenetben betöltött szerepe nemrég megkérdőjeleződött, mivel a jelentések szerint a Cdk2-hiányos sejteknek nincs problémájuk ezen átmenet során.
Kiadhatatlanság a normálisan működő szövetekben
Az eredeti sejttenyésztésen alapuló kísérletek sejtciklus leállását mutatták a G1-S átmenet során a Cdk2 törléséből. Későbbi kísérletek azt mutatták, hogy a Cdk2 deléciók meghosszabbították a sejtciklus G 1 fázisát egér embrió fibroblasztokban. Azonban ezen időszak után is beléptek az S fázisba, és képesek voltak befejezni a sejtciklus fennmaradó fázisait. Amikor a Cdk2 -t törölték egerekben, az állatok életképesek maradtak a testméret csökkenése ellenére. Mind a hím, mind a nőstény egerek meiotikus működése azonban gátolt volt. Ez arra utal, hogy a Cdk2 nem nélkülözhetetlen az egészséges sejtek sejtciklusához, de elengedhetetlen a meiózishoz és a szaporodáshoz. A Cdk2 knockout egerek sejtjei valószínűleg kevesebb osztódáson mennek keresztül, ami hozzájárul a testméret csökkenéséhez. A csírasejtek a meiózis propázisában is megállnak osztódni, ami reproduktív sterilitáshoz vezet. Most úgy gondolják, hogy a Cdk1 kompenzálja a Cdk2 törlés számos aspektusát, kivéve a meiotikus funkciót.
Az aktiválás mechanizmusa
A ciklinfüggő kináz 2 két lebenyben van felépítve. Az N-terminálison (N-lebeny) kezdődő lebeny sok bétalapot tartalmaz, míg a C-terminális lebeny (C-lebeny) gazdag alfa-hélixben. A Cdk2 számos különböző ciklinhez képes kötődni, beleértve az A, B, E és esetleg C ciklint is. A legújabb tanulmányok azt mutatják, hogy a Cdk2 előnyösen kötődik az A és E ciklinekhez , míg a Cdk1 az A és B ciklint.
A Cdk2 akkor válik aktívvá, amikor egy ciklin fehérje (vagy A vagy E) kötődik a kináz N és C lebenyei közötti aktív helyen. Az aktív hely elhelyezkedése miatt a partnerciklinek kölcsönhatásba lépnek a Cdk2 mindkét lebenyével. A Cdk2 egy fontos alfa-hélixet tartalmaz, amely a kináz C lebenyében helyezkedik el, az úgynevezett C-hélix vagy a PSTAIRE-hélix. A hidrofób kölcsönhatások hatására a C-hélix egy másik spirálhoz kapcsolódik az aktiváló ciklinben. Az aktiválás konformációs változást idéz elő, ahol a spirál elfordul és közelebb kerül az N-lebenyhez. Ez lehetővé teszi, hogy a C-hélixen található glutaminsav ionpárt képezzen egy közeli lizin oldallánccal. Ennek a mozgásnak az a jelentősége, hogy a katalitikus helyre hozza a Glu 51 oldalláncát, amely az összes eukarióta kinázban konzervált katalitikus helymaradványok hármasához tartozik. Ez a hármas (Lys 33, Glu 51 és Asp 145) részt vesz az ATP foszfát orientációban és a magnézium koordinációban, és úgy gondolják, hogy kritikus a katalízis szempontjából. Ez a konformációs változás áthelyezi az aktivációs hurkot a C-lebenybe, feltárva az új kölcsönhatások számára most elérhető ATP-kötési helyet. Végül a treonin-160-as maradékot kitesszük és foszforilezzük, amikor a C-lebeny aktiváló szegmense kiszorul a katalitikus helyről, és a treonin-maradék már nincs sztérikusan akadályozva. A foszforilezett treonin maradék stabilitást teremt a végső enzimkonformációban. Fontos megjegyezni, hogy az aktiválási folyamat során a Cdk2 -hez kötődő ciklinok semmilyen konformációs változáson nem mennek keresztül.
Szerep a DNS replikációjában
A sejtosztódási folyamat sikere a folyamatok pontos szabályozásától függ, mind a sejtek, mind a szövetek szintjén. A fehérjék és a DNS közötti komplex kölcsönhatások lehetővé teszik a genomiális DNS átadását a leánysejtekhez. A sejtek és az extracelluláris mátrixfehérjék közötti kölcsönhatások lehetővé teszik új sejtek beépítését a meglévő szövetekbe. Sejtszinten a folyamatot különböző ciklinfüggő kinázok (Cdks) és társciklinjeik szabályozzák. A sejtek különféle ellenőrző pontokat használnak a sejtciklus előrehaladásának késleltetésére, amíg meg nem tudják javítani a hibákat.
A Cdk2 aktív a sejtciklus G 1 és S fázisában, ezért G 1 -S fázis ellenőrzőpont -vezérlőként működik . A G 1 fázis előtt a Cdk4 és a Cdk6 szintje a ciklinnel D együtt nő. Ez lehetővé teszi az Rb részleges foszforilációját, és az E2F részleges aktiválását a G 1 fázis elején , ami elősegíti a ciklin E szintézist és fokozza a Cdk2 aktivitást. A G 1 fázis végén a Cdk2/Cyclin E komplex eléri a maximális aktivitást, és jelentős szerepet játszik az S fázis elindításában. Más, nem Cdk fehérjék is aktívvá válnak a G 1 -S fázisátmenet során. Például a retinoblasztóma (Rb) és a p27 fehérjéket a Cdk2 -ciklin A/E komplexek foszforilezik, teljesen deaktiválva őket. Ez lehetővé teszi, hogy az E2F transzkripciós faktorok olyan géneket fejezzenek ki, amelyek elősegítik az S fázisba való belépést, ahol a DNS replikálódik az osztódás előtt. Ezenkívül az NPAT, a Cdk2-Cyclin E komplex ismert szubsztrátja, a foszforilezés során aktiválja a hiszton gén transzkripcióját. Ez növeli a hisztonfehérjék (a kromatin fő fehérjekomponense) szintézisét, és ezt követően támogatja a sejtciklus DNS -replikációs szakaszát. Végül az S fázis végén az ubikvitin proteaszóma lebontja a ciklin E -t.
A rákos sejtek proliferációja
Noha a Cdk2 többnyire nélkülözhető a normálisan működő sejtek sejtciklusában, kritikus fontosságú a rákos sejtek kóros növekedési folyamatai szempontjából. A CCNE1 gén ciklint E termel, amely a Cdk2 két fő fehérjekötő partnere közül az egyik. A CCNE1 túlexpressziója sok tumorsejtben fordul elő, ami miatt a sejtek függővé válnak a Cdk2 -től és a ciklin E -től. Rendellenes ciklin E -aktivitás figyelhető meg emlő-, tüdő-, vastagbél-, gyomor- és csontrákokban, valamint leukémiában és limfómában is. Hasonlóképpen, a ciklin A2 kóros expressziója a kromoszóma instabilitásával és a tumor proliferációjával jár, míg a gátlás a tumor növekedésének csökkenéséhez vezet. Ezért a CDK2 és ciklinkötő partnerei lehetséges terápiás célpontokat jelentenek az új rákgyógyszerek számára. A preklinikai modellek előzetes sikereket mutattak a tumorok növekedésének korlátozásában, és azt is megfigyelték, hogy csökkentik a jelenlegi kemoterápiás gyógyszerek mellékhatásait.
A szelektív Cdk2 inhibitorok azonosítása nehéz a Cdk2 és más Cdk, különösen a Cdk1 aktív helyei közötti rendkívüli hasonlóság miatt. A Cdk1 az egyetlen lényeges ciklinfüggő kináz a sejtciklusban, és a gátlás nem kívánt mellékhatásokhoz vezethet. A legtöbb CDK2 inhibitor jelölt az ATP kötési helyet célozza meg, és két fő alosztályra osztható: I. típusú és II. Az I. típusú inhibitorok versenyképesen célozzák az ATP kötőhelyet aktív állapotában. A II -es típusú inhibitorok a CDK2 -t kötetlen állapotukban célozzák, vagy az ATP -kötési helyet, vagy a kinázon belüli hidrofób zsebet foglalják el. A II -es típusú inhibitorok vélhetően szelektívebbek. A közelmúltban az új CDK kristályszerkezetek elérhetősége egy lehetséges alloszterikus kötőhely azonosításához vezetett a C-hélix közelében. Ennek az alloszterikus helynek a gátlói a III. Típusú inhibitorok közé tartoznak. Egy másik lehetséges célpont a CDK2 T-hurka. Amikor a ciklin A kötődik a CDK2-hez, az N-terminális lebeny elfordul, hogy aktiválja az ATP kötési helyet, és megváltoztassa az aktiváló hurok helyzetét, az úgynevezett T-hurkot.
Gátlók
A dinamikus szimulációk értelmezése és a kötelező energiamentes vizsgálatok azt mutatták, hogy a Ligand2 (17 házon belül szintetizált pirrolonnal kondenzált benzoszuberén (PBS) vegyület) stabil és egyenértékű szabad energiával rendelkezik a flavopiridol, SU9516 és CVT-313 inhibitorokhoz képest. A ligand2-t a CDK2 szelektív inhibitoraként vizsgálták a célon kívüli kötődés (CDK1 és CDK9) nélkül, a ligand hatékonysága és kötési affinitása alapján.
Ismert CDK inhibitorok a p21Cip1 ( CDKN1A ) és a p27Kip1 ( CDKN1B ).
Azok a gyógyszerek, amelyek gátolják a Cdk2-t és leállítják a sejtciklust, mint például a GW8510 és a kísérleti rákgyógyszer, a seliciclib , csökkenthetik a hám érzékenységét számos sejtciklus-aktív daganatellenes szerre, és ezért stratégiát jelentenek a kemoterápia által kiváltott alopecia megelőzésére .
A rozmarinsav-metil-észter növényi eredetű Cdk2-gátló, amelyről kimutatták, hogy elnyomja az erek simaizomsejtjeinek proliferációját és csökkenti a neointima kialakulását egér restenosis modellben.
Lásd még az alábbi EKT -galériát, amely bemutatja a kölcsönhatásokat számos inhibitorral (beleértve a Purvalanol B -t)
Génszabályozás
A melanocitás sejttípusokban, expressziója a CDK2-gén szabályozza a microphthalmia-asszociált transzkripciós faktor .
Interakciók
A ciklinfüggő kináz 2 kölcsönhatásba lépett:
- BRCA1 ,
- CDK2AP1 ,
- CDKN1B
- CDKN3 ,
- CEBPA ,
- Cyclin A1 ,
- Cyclin E1 ,
- Flap szerkezet specifikus endonukleáz 1 ,
- ORC1L ,
- P21 ,
- PPM1B ,
- PPP2CA ,
- Retinoblasztóma-szerű fehérje 1 ,
- Retinoblasztóma-szerű fehérje 2 , és
- SKP2 .

Hivatkozások
További irodalom
- Kaldis P, Aleem E (2005. november). "Sejtciklus testvérverseny: Cdc2 vs. Cdk2" . Sejtciklus . 4 (11): 1491–4. doi : 10.4161/cc.4.11.2124 . PMID 16258277 .
- Moore NL, Narayanan R, Weigel NL (2007. február). "Ciklinfüggő kináz 2 és a humán progeszteron receptor aktivitás szabályozása" . Szteroidok . 72. (2): 202–9. doi : 10.1016/j.steroids.2006.11.025 . PMC 1950255 . PMID 17207508 .
Külső linkek
- Ciklintól függő+kináz+2 az Egyesült Államok Országos Orvostudományi Könyvtárának orvosi tantárgyaiban (MeSH)
- CDK2 humán gén elhelyezkedése az UCSC genomböngészőben .
- CDK2 humán gén részletei az UCSC genomböngészőben .