Decapentaplegic - Decapentaplegic
| Decapentaplegic | |||||||
|---|---|---|---|---|---|---|---|
| Azonosítók | |||||||
| Szervezet | |||||||
| Szimbólum | Dpp | ||||||
| UniProt | P07713 | ||||||
| |||||||
A Decapentaplegic (Dpp) kulcsfontosságú morfogén, amely a Drosophila melanogaster gyümölcslégy fejlődésében vesz részt, és ez az első validált szekretált morfogén. Ismeretes, hogy szükséges a korai Drosophila embrió és a tizenöt képzeletbeli lemez helyes mintázatához és fejlődéséhez , amelyek szövetek, amelyek végtagokká és más szervekké és szerkezetekké válnak a felnőtt légyben. Azt is felvetették, hogy a Dpp szerepet játszik a szövetek növekedésének és méretének szabályozásában. A decapentaplegikus mutációval rendelkező legyek nem tudják megfelelően kialakítani ezeket a struktúrákat, ezért a név ( decapenta -, tizenöt, - plegic , bénulás). A Dpp a gerinces csont morfogenetikus fehérjeinek (BMP) Drosophila homológja , amelyek a TGF-β szupercsalád tagjai, a fehérjék egy csoportja, amelyek gyakran társulnak saját specifikus jelátviteli útjukkal. A Drosophilában végzett Dpp-tanulmányok jobban megértették homológjaik funkcióját és fontosságát olyan gerincesekben, mint az emberek.
Funkció Drosophilában
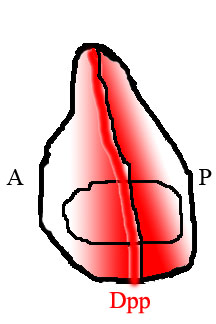
A Dpp egy klasszikus morfogén, ami azt jelenti, hogy térbeli koncentráció-gradiensben van jelen azokban a szövetekben, ahol megtalálható, és gradiensként való jelenléte funkcionális jelentést ad neki a fejlődésre gyakorolt hatásában. A legtöbb tanulmányozott szövet, amelyben Dpp található, a korai embrió és a képzeletbeli szárnylemezek, amelyek később a légy szárnyait képezik. Az embrionális fejlődés során a Dpp egységesen expresszálódik az embrió hátsó oldalán, éles koncentrációs gradienst hozva létre. A képzeletbeli korongokban a Dpp erősen kifejeződik egy keskeny sejtcsíkban a korong közepén, ahol a szövet jelöli az elülső és a hátsó oldal közötti határt. A Dpp ebből a csíkból diffundál a szövet szélei felé, gradienst képezve a morfogéntől elvárható módon. Bár az embrióban a Dpp domén sejtjei nem szaporodnak, a képzeletbeli szárnylemez sejtjei erősen szaporodnak, ami szöveti növekedést okoz. Jóllehet a korai embrióban a gradiens képződése jól érthető, továbbra is ellentmondásos a Dpp morfogén gradiens kialakulása a képzelet szárnyán.
Szerep és kialakulás az embrionális fejlődésben
A korai csírahártya szakaszban DPP jelátvitel egyenletes és alacsony mentén dorzális oldalába. A sejtesítés során az embrió hátsó középvonalán éles jelzőprofil jelenik meg, magas Dpp-szint meghatározza az extraembrionális amnioserosát, alacsony szint pedig a háti ektodermát . A Dpp jelzés magában foglal egy pozitív visszacsatolási mechanizmust is, amely elősegíti a jövőbeni Dpp kötést. Az embriókban a morfogén gradienst egy ismert aktív transzportmechanizmus segítségével állapítják meg. A gradiens kialakulása a BMP-inhibitoroktól függ: rövid gasztruláció (Sog) és csavart gasztruláció (Tsg), valamint egyéb extracelluláris fehérjék, például Tolloid (Tld) és Screw (Scw). A Sog az embrió ventrális-laterális régiójában keletkezik (merőleges a Dpp-gradiensre), és egy BMP-gátló gradienst képez, amely megakadályozza, hogy a Dpp a receptorához kötődjön. A Sog és a Tsg komplexet alkotnak a Dpp-vel, és a Sog koncentráció gradiensét követve aktívan szállítják a hátsó középvonal felé (az embrió közepe). A Tld, egy metalloproteáz , felszabadítja a Dpp-t a komplexből a Sog-folyamat közvetítésével, aktiválva a Dpp-jelzést a középvonalon. Miután gasztruláció az embrió, a DPP gradiens indukál szív- és visceralis mesoderma képződése.
Jelzési útvonal
A Dpp, gerinces homológjaihoz hasonlóan, jelátviteli molekula. Drosophilában a Dpp receptorát két fehérje, a Thickveins (Tkv) és a Punt alkotja. Mint maga a Dpp, a Tkv és a Punt is nagyon hasonlít más fajok homológjaihoz. Amikor egy sejt Dpp jelet kap, a receptorok foszforilezéssel aktiválhatják az anyáknak nevezett intracelluláris fehérjét a Dpp (őrült) ellen . A madrosz Drosophilában való kezdeti felfedezése utat nyitott a későbbi kísérletek számára, amelyek azonosították a gerincesek TGF-β jelzésére reagálót , az úgynevezett SMAD-okat . Az Activated Mad képes kötődni a DNS-hez és transzkripciós faktorként hat, hogy befolyásolja a különböző gének expresszióját a Dpp szignalizációra válaszul. A Dpp jelátvitel által aktivált gének közé tartozik az optomotoros vak (omb) és a spalt, és ezeknek a géneknek az aktivitását gyakran használják a Dpp jelátvitel indikátoraként a kísérletek során. Egy másik, a Dpp-vel bonyolultabb szabályozási interakcióval rendelkező gén a brinker. A Brinker egy transzkripciós tényező, amely elnyomja a Dpp aktivációs célpontjait, ezért ezeknek a géneknek a bekapcsolásához a Dpp-nek el kell nyomnia a brinkert, valamint aktiválnia kell a többi célpontot is.
Szerep a képzeletbeli szárnylemezben
A légszárnyban a szövet hátsó és elülső felét különféle sejtek töltik be, amelyek különböző géneket expresszálnak. A hátsó sejtek, de az elülső rész nem, az Engrailed (En) transzkripciós faktort fejezik ki . Az En által aktivált gének egyike a sündisznó (hh), jelátviteli tényező. Hedgehog jelzés utasítja a szomszédos sejteket a Dpp expresszálására, de a Dpp expressziót az En is elnyomja. Az eredmény az, hogy a Dpp csak egy keskeny sejtcsíkban termelődik, amely közvetlenül a szövet hátsó felével szomszédos, de nem azon belül. Az ezen az elülső / hátsó határon keletkezett Dpp a szövet széléig diffundál, területi koncentrációs gradienst alkotva.
A Dpp gradiens mentén elfoglalt helyzetük leolvasásával a szárny sejtjei képesek meghatározni az elülső / hátsó határhoz viszonyított elhelyezkedésüket, és ennek megfelelően viselkednek és fejlődnek.
Lehetséges, hogy valójában nem a Dpp diffúziója és gradiense mintázza a szöveteket, hanem a sejtek, amelyek Dpp jelet kapnak, utasítják szomszédaikat arra, hogy mi legyen, és ezek a sejtek viszont kaszkádban jelzik szomszédaikat a szöveten keresztül. Számos kísérlet történt ennek a hipotézisnek a cáfolására és annak megállapítására, hogy a mintázásért valójában a tényleges Dpp-molekulák gradiense a felelős.
A Dk receptor Tkv mutáns formái léteznek, amelyek úgy viselkednek, mintha Dpp hiányában is nagy mennyiségű Dpp jelet kapnának. Azok a sejtek, amelyek ezt a mutáns receptort tartalmazzák, úgy viselkednek, mintha magas Dpp környezetben lennének, például a Dpp-t termelő sejtek csíkja közelében. Azáltal, hogy e sejtekből kis foltokat generáltak a szárnyszövet különböző részein, a kutatók meg tudták különböztetni, hogy a Dpp hogyan hat a szövet mintázatára. Ha a Dpp jelet vevő sejtek kaszkádban utasítják szomszédaikat, akkor további szövetmintázó központoknak kell megjelenniük a mutáns sejtek helyén, amelyek úgy tűnik, hogy magas Dpp jelet kapnak, de maguk nem hoznak létre Dpp-t. Ha azonban a Dpp fizikai jelenléte szükséges, akkor a mutánsok közelében lévő sejteket egyáltalán nem szabad befolyásolni. A kísérletek a második esetet igaznak találták, jelezve, hogy a Dpp morfogénként viselkedik.
A légszárny szövetmintázatának különbségeinek felmérése általában a szárnyban lévő vénák mintázatának vizsgálata. Azokban a legyekben, ahol a Dpp diffundálódási képessége a szöveten keresztül romlik, a vénák helyzete eltolódik a normál legyek helyzetétől, és a szárny általában kisebb.
A Dpp-t a szövetek növekedésének és méretének szabályozójaként is javasolták, amely a fejlődés klasszikus problémája. A soksejtű szervekkel rendelkező organizmusok közös problémája, amelynek ki kell nőnie a kezdeti méretből, az az, hogyan lehet tudni, mikor kell megállítani a növekedést a megfelelő méret elérése után. Mivel a Dpp egy gradiensben van, elképzelhető, hogy a gradiens meredeksége lehet az a mérés, amellyel egy szövet meghatározza, hogy mekkora. Ha a Dpp mennyisége a forrásnál rögzített, és a szövet szélén lévő mennyiség nulla, akkor a gradiens meredeksége csökken, ahogy a szövet mérete, valamint a forrás és az él közötti távolság növekszik. Azok a kísérletek, amelyekben a Dpp mesterségesen meredek gradiensét indukálják a szárnyszövetben, jelentősen megnövekedett mennyiségű sejtproliferációt eredményeztek, ami alátámasztja a meredekség hipotézisét.
A Dpp gradiens kialakulása a képzeletbeli szárnylemezen
A Dpp gradiens alakját négy ligandum kinetikai paraméter határozza meg, amelyeket a biológiai paraméterek befolyásolnak:
- A hatékony diffúziós együttható , amely az extracelluláris diffúziótól, az intracelluláris transzport sebességétől és a receptor kötődési / megkötési kinetikájától függ .
- A hatékony extracelluláris és intracelluláris lebomlási sebesség.
- A termelési ráta, a Dpp termelési útjától függően.
- A mozdulatlan frakció (a Dpp kinetika mérésére használt módszerhez kapcsolódó paraméter, FRAP ).
Fontos megjegyezni, hogy egyetlen biológiai paraméter több kinetikai paraméterre is hatással lehet. Például a receptor szintek befolyásolják a diffúziós együtthatót és a lebomlási sebességet is.
A Dpp-gradiens kialakulásának mechanizmusa azonban még mindig ellentmondásos, és teljes magyarázatot nem javasoltak vagy bizonyítottak. A négy fő kategóriája elméletek mögött megalakult a gradiens szabadon diffúzió, korlátozott diffúzió, transcytosisát és cytoneme -assisted közlekedés.
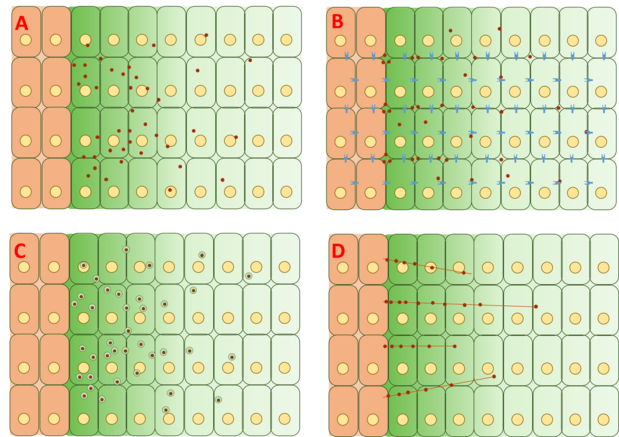
Szabad / korlátozott diffúziós modell
A szabad diffúziós modell feltételezi, hogy a Dpp szabadon diffundál az extracelluláris mátrixon keresztül, receptor által közvetített lebontási események útján lebomlik. Az FRAP-vizsgálatok ezzel a modellel vitatkoztak azzal, hogy megjegyezték, hogy a GFP-Dpp diffúziója nem egyezik meg a hasonló méretű molekulától elvárhatóval. Mások azonban azzal érveltek, hogy egy sebességkorlátozó lassú lépés a folyamat után, például a Dpp lassú immobilizálása és / vagy lassú lebomlása, figyelembe veheti a diffúzióban megfigyelt különbségeket. Egységes molekulák DPP már nyomon felhasználásával fluoreszcens korrelációs spektroszkópia (FCS), azt mutatja, hogy 65% DPP molekulák diffundálnak gyorsan (összhangban a szabad diffúzióját modell), és 35% diffúz lassan (összhangban Dpp kötött receptorokhoz vagy glypicans ).
A korlátozott diffúziós modell tartalmazza a hatásai Cell csomagolási geometria és kölcsönhatások a extracelluláris mátrix kötődésen keresztül események receptorok, mint például a TKV, és a heparin-szulfát proteoglikánok Dally és Dally-szerű .
Transcytosis modell
A transzcitózis modell feltételezi, hogy a Dpp-t az intracelluláris receptor által közvetített endocitózis ismételt fordulóin keresztül szállítják, a gradiens súlyosságát a Dpp endocitotikus válogatása határozza meg a sejteken keresztüli újrahasznosítás és a lebomlás irányába. Ez a modell eredetileg egy kezdeti megfigyelésen alapult, miszerint a Dpp nem tud felhalmozódni olyan klónokon, ahol az endocitózishoz szükséges dinaminnak nevezett kritikus fehérje mutálódott a shibire ( shi ) fenotípusba. Más kísérletek azonban azt mutatták, hogy a Dpp képes volt felhalmozódni a shi klónok fölött, kihívva a transzcitózis modellt. A modell elméletének felülvizsgálata azt sugallja, hogy az endocitózis nem elengedhetetlen a Dpp mozgáshoz, de részt vesz a Dpp jelzésben. A Dpp nem mozog a sejteken mutált dally és dally-szerű két heparin-szulfát proteoglikánnal (HSPG), amelyek általában megtalálhatók az extracelluláris mátrixban. Ennek eredményeként, ezek az eredmények arra utalnak, hogy a DPP mentén mozog sejt felületére korlátozódik extracelluláris diffúzió bevonásával dévajkodik és dévajkodik-szerű , de a szállítási DPP önmagában nem hivatkozhat transcytosisát.
Cytoneme által közvetített szállítási modell
A citonéma által közvetített modell azt sugallja, hogy a Dpp közvetlenül a célsejtekbe kerül, a Dpp-re reagáló sejtek apikális felszínétől a Dpp-termelő forrássejtekig terjedő aktin- alapú filopódiumokon keresztül, amelyeket citonémának hívnak. Ezeket a citonémákat megfigyelték, de a Dpp-gradiens citonémáktól való függése a képzeletbeli szárnylemezeken nem bizonyított véglegesen. Azonban ismert, hogy a Dpp szükséges és elegendő a citonémák kiterjesztéséhez és fenntartásához. A Dpp és a citonémák közötti dinamikát elemző kísérleteket a légzsák primordiumban végeztük, ahol a Dpp jelzés funkcionális kapcsolatot mutatott ki a citonémákkal. Ezeket a kísérleteket azonban képzeletbeli szárnylemezeken nem sikerült megismételni.
Szerep a puhatestűekben
A Dpp megtalálható a puhatestűekben is, ahol kulcsszerepet játszik a héj kialakulásában azáltal, hogy szabályozza a kagyló alakját. A kéthéjú állatokban mindaddig kifejeződik, amíg a protokonch a kívánt formát nem ölti, ezután a kifejezése megszűnik. Kapcsolódik a haslábúak héjaképződéséhez, aszimmetrikus eloszlással, amely a tekercselésükhöz társulhat: úgy tűnik, hogy a héjnövekedés gátolt, ahol a Dpp kifejeződik.
Hivatkozások
Külső linkek
- Drosophila decapentaplegic - Az interaktív légy
- dekapentaplegikus + fehérje, + Drosophila az Egyesült Államok Országos Orvostudományi Könyvtárának Medical Subject Headings (MeSH)