Difenilketén - Diphenylketene

|
|

|
|
| Nevek | |
|---|---|
|
Előnyben részesített IUPAC név
2,2-difenil-eten-1-on |
|
| Más nevek
Difenil-etenon
|
|
| Azonosítók | |
|
3D modell ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
CompTox műszerfal ( EPA )
|
|
|
|
|
|
| Tulajdonságok | |
| C 14 H 10 O | |
| Moláris tömeg | 194,233 g · mol −1 |
| Megjelenés | Vörös-narancs olaj |
| Olvadáspont | 8–9 ° C (46–48 ° F; 281–282 K) |
| Forráspont | 118 - 120 1 Hgmm nyomáson |
|
Hacsak másképp nem jelezzük, az anyagokat standard állapotukban (25 ° C-on, 100 kPa-nál) adjuk meg . |
|
|
|
|
| Infobox hivatkozások | |
Ketén egy vegyi anyag a ketén család. A difenil-ketén, mint a legtöbb diszubsztituált ketén , szobahőmérsékleten és nyomáson vörös-narancssárga olaj . Az R 1 R 2 C = C = O keténszerkezet egymás utáni kettős kötése miatt a difenil-ketén heterokumula . A difenil-ketén legfontosabb reakciója a [2 + 2] ciklusterdíció CC, CN, CO és CS többszörös kötéseknél.
Történelem
Difenil ketén először izoláljuk Hermann Staudinger 1905-ben, és azonosították, mint az első példa a kivételesen reaktív osztályát ketén általános képletű R 1 R 2 C = C = O (R 1 = R 2 = fenil-csoport).
Készítmény
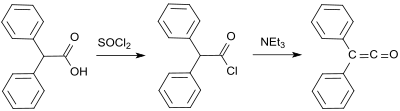
Az első szintézist a H. Staudinger alapult 2-chlorodiphenylacetyl klorid (előállítva benzilsav- és tionil-klorid ), amelyből két klóratomok hasítjuk cinkkel egy dehalogénezési reakcióban :
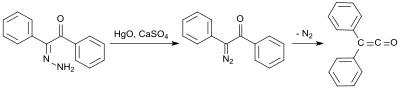
A korai szintézis során benzilmonohidrazont ( difenil- etándionból és hidrazin-hidrátból ) használnak, amelyet higany (II) -oxiddal és kalcium-szulfáttal oxidálva mono-diazoketon képződik, majd nitrogén elimináció mellett 100% -os difenil-keténné alakul, 58% -os hozammal:
További korai difenilketén-szintézis származik Eduard Wedekindtől, aki difenil-ketént már 1901-ben nyert a difenil-acetil-klorid trietil-aminnal történő dehidrohalogénezésével , izolálás és jellemzés nélkül. Ezt a változatot 1911-ben H. Staudinger is leírta.
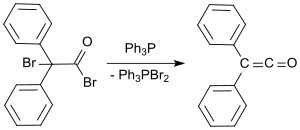
A standard laboratóriumi protokoll a Staudinger-módszeren alapul, és difenil-ketolt kap narancsolajként, 53-57% -os hozammal. Egy újabb eljárásban a 2-bróm-2,2-difenil- acetil -bromidot trifenil-foszfinnal reagáltatva difenil-ketolt kapunk 81% -os hozammal.
A közelmúltban difenil-ketén difenil-ecetsavból és a Hendrickson-reagensből (trifenil-foszfónium-anhidrid-trifluormetán-szulfonát) szintéziséről számoltak be vízzel 72% -os hozammal.
Tulajdonságok
A difenil-ketén szobahőmérsékleten narancssárga vagy vörös színű olaj (tömény kálium-dikromát oldat színével ), amely elegyedik a nem poláros szerves oldószerekkel (például dietil-éter , aceton , benzol , tetrahidrofurán , kloroform ) és hidegben megszilárdul. sárga kristályok. A vegyület levegővel könnyen oxidálható, de szorosan zárt tartályokban 0 ° C-on több hétig tárolható bomlás nélkül, vagy nitrogénatmoszférában kis mennyiségű hidrokinon, mint polimerizációs inhibitor hozzáadásával .
Reakcióképesség
A difenilketént számos nukleofil , köztük alkoholok , aminok és enolátok támadhatják meg , meglehetősen lassú sebességgel. Ezek az arányok növelhetők katalizátorok jelenlétében . Jelenleg a támadás mechanizmusa ismeretlen, de folyamatban van a pontos mechanizmus meghatározása.
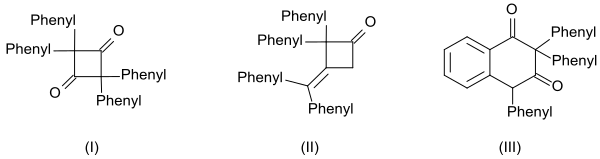
A difenil-ketén nagy reaktivitása három dimer képződésében is nyilvánvaló:
- a ciklusos diketon-2,2,4,4-tetrafenil-ciklobután-1,3-dion (I) kinolinnal történő melegítéssel
- a β-lakton-4- (difenil-metilén) -3,3-difenil-oxetán-2-on (II) nátrium-metoxiddal történő melegítésével és
- a 2,2,4-trifenil-naftalin-1,3- ( 2H , 4H ) -dion (III) tetralin-származék benzoil-kloriddal történő melegítéssel
és az abból előállított oligomerek .
Alkalmazás
Ketén (általános képletű R 1 R 2 C = C = O) sok párhuzamot izocianátokat (általános képletű RN = C = O) a saját alkotmány, valamint azok reaktivitása.
Difenil ketén vízzel reagál egy addíciós reakció képezve difenil-ecetsav , a etanollal hogy difenil-ecetsav-etil-észtert, vagy ammóniával, hogy a megfelelő amidot. A karbonsavak difenil-ecetsav vegyes anhidridjeit képezik, amelyek felhasználhatók a peptidkötéshez szükséges védett aminosavak aktiválására .
A Z-Leu-Phe-OEt védett dipeptidet (N-benzil-oxi-karbonil-L-leucil-L-fenil-alanin-etil-észter) 59% -os hozammal nyerjük a Z-leucin difenil-ketollal történő aktiválásával és ezt követően fenilalanin-etil-észterrel történő reakcióval.
A difenil-ketén hajlamos az autoxidációra , amelyben a megfelelő poliészter 60 ° C feletti hőmérsékleten képződik egy difenil-acetolakton köztitermék révén.
Egy Wittig-reakció , allének állíthatók elő difenil-ketén.
Trifenil-foszfin-difenil-metilénnel és difenil-ketennel pl. 140 ° C-on és nyomás alatt 70% -os hozammal tetrafenil-allének képződnek.
A difenil-ketén szintetikailag legérdekesebb reakciói a [2 + 2] ciklusterdíciók, például a ciklopentadiénnel végzett reakció Diels-Alder adduktumot eredményez.
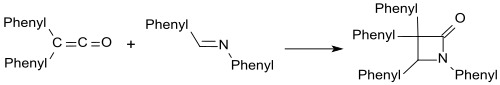
Az olyan aminok , mint a benzalanilin , difenil - ketollal alkotják a β-laktámokat .
Karbonil-vegyületekkel analóg módon alakulnak ki a β-laktonok.
A difenil-ketén fenil-acetilénnel végzett [2 + 2] ciklikus megoszlása először egy ciklobutenonhoz vezet, amely termikusan aromás állapotban fenil-vinil-keténné alakul, és [4 + 2] ciklusos adagolással ciklizálva 3,4-difenil-1-naftollá 81% -os hozammal.
Ebből az úgynevezett Smith-Hoehn reakcióból általános szintézis módszert fejlesztettek ki a szubsztituált fenolok és kinonok számára.



![{\ displaystyle {\ ce {(fenil) 2C = C = O -> [{} \ atop {\ text {Z-Leu}}] (fenil) 2CO-O-CO - {}}} {\ text {Z -Leu}} {\ ce {-> [{} \ atop {\ ce {H-Phe-OEt}}]}}} {\ text {Z-Leu}} {\ ce {-Phe-OEt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7b4b915bc917b7c77143009ead9cc799bd83acc)