Sejtciklus ellenőrzőpont - Cell cycle checkpoint
A sejtciklus ellenőrzési pontok az eukarióta sejtciklus szabályozó mechanizmusai, amelyek biztosítják annak megfelelő előrehaladását. Minden ellenőrzőpont potenciális végpontként szolgál a sejtciklus mentén , amely során felmérik a sejt körülményeit, és a sejtciklus különböző fázisain keresztül történő előrehaladás csak akkor következik be, ha a kedvező feltételek teljesülnek. A sejtciklusban sok ellenőrzőpont található, de a három fő: G1 ellenőrzőpont, más néven Start vagy korlátozás ellenőrzőpont vagy Major ellenőrzőpont; a G2/M ellenőrzőpont ; és a metafázis-anafázis átmenet, más néven az orsó ellenőrzőpontja . Az ezeken az ellenőrzési pontokon keresztül történő előrehaladást nagymértékben meghatározza a ciklinfüggő kinázok aktiválása a ciklineknek nevezett szabályozó fehérje alegységek által , amelyek különböző formái termelődnek a sejtciklus minden szakaszában, hogy ellenőrizzék az ott bekövetkező specifikus eseményeket.
Háttér
Minden élő szervezet a sejtnövekedés és -osztódás ismételt fordulóinak terméke. Ennek a sejtciklusnak nevezett folyamat során a sejt megismétli a tartalmát, majd kettéosztja. A sejtciklus célja az, hogy pontosan megismételje az egyes szervezetek DNS -ét, majd egyenletesen ossza fel a sejtet és tartalmát a két kapott sejt között. Az eukariótákban a sejtciklus négy fő szakaszból áll: G 1 , amely során egy sejt metabolikusan aktív és folyamatosan növekszik; S fázis , amely során a DNS replikációja megy végbe; G 2 , amely során a sejtnövekedés folytatódik, és a sejt különböző fehérjéket szintetizál az osztódásra való felkészülés során; és az M ( mitózis ) fázis, amelynek során a duplikált kromoszómák (más néven testvérkromatidák ) két leánymagra különülnek el, és a sejt két leánysejtre oszlik, mindegyikben a DNS teljes másolata. Az eukarióta sejtciklushoz képest a prokarióta sejtciklus ( bináris hasadás ) viszonylag egyszerű és gyors: a kromoszóma replikálódik a replikáció kezdetétől, új membránt szerelnek össze, és a sejtfal septumot képez, amely felosztja a sejtet kettő.
Mivel az eukarióta sejtciklus összetett folyamat, az eukarióták kifejlesztették a szabályozó fehérjék hálózatát, az úgynevezett sejtciklus -szabályozó rendszert , amely figyeli és diktálja a sejt előrehaladását a sejtcikluson keresztül. Ez a rendszer úgy működik, mint egy időzítő vagy egy óra, amely rögzített időt határoz meg a sejt számára a sejtciklus minden fázisában, ugyanakkor reagál az általa irányított folyamatokból kapott információkra is. A sejtciklus ellenőrzési pontok fontos szerepet játszanak a vezérlőrendszerben, mivel érzékelik az alapvető folyamatok során fellépő hibákat, például a DNS -replikációt vagy a kromoszóma -szegregációt , és válaszul sejtciklus -leállást indukálnak a hibák kijavításáig. A sejtciklus-ellenőrzési pontok fő hatásmechanizmusa a ciklinfüggő kinázok (CDK-k) néven ismert protein-kináz-család aktivitásának szabályozása , amelyek specifikus ciklinekkel kötődnek a ciklinek néven ismert szabályozófehérjék különböző osztályaihoz. CDK komplexek képződnek és aktiválódnak a sejtciklus különböző fázisaiban. Ezek a komplexek viszont különböző downstream célokat aktiválnak, hogy elősegítsék vagy megakadályozzák a sejtciklus előrehaladását.
G 1 (korlátozás) ellenőrzőpont
A G1 ellenőrzőpont, más néven restrikciós pont az emlőssejtekben és a kiindulási pont az élesztőben, az a pont, amikor a sejt elkötelezett a sejtciklusba való belépés iránt. Ahogy a sejt előrehalad G1 -en, a belső és külső körülményektől függően késleltetheti a G1 -et, nyugalmi állapotba léphet G0 néven , vagy továbbhaladhat a korlátozási ponton. A DNS -károsodás a fő jel arra, hogy a sejt "korlátozza", és nem lép be a sejtciklusba. A döntés a sejtosztódás új fordulója iránti elkötelezettségről akkor következik be, amikor a sejt aktiválja a ciklin-CDK-függő transzkripciót, ami elősegíti az S fázisba való belépést. Ez az ellenőrzési pont biztosítja a további folyamatot.
A G1 korai szakaszában három transzkripciós represszor, zsebfehérjék néven ismert, amelyek kötődnek az E2F transzkripciós faktorokhoz. Az E2F géncsalád olyan transzkripciós faktorok csoportja, amelyek sok olyan gént céloznak meg, amelyek fontosak a sejtciklus szabályozásához, beleértve a ciklineket , CDK -kat, ellenőrzőpont -szabályozókat és DNS -javító fehérjéket. Az E2F család rossz szabályozását gyakran találják rákos esetekben, ami azt bizonyítja, hogy az E2F család elengedhetetlen a DNS replikációjának és osztódásának szigorú szabályozásához. A három zseb fehérjék retinoblastoma (Rb), P107, és p130, amelyek kötődnek az E2F transzkripciós faktorok progressziójának megelőzésére már a G1 ellenőrző pont.
Az E2F géncsalád tartalmaz néhány aktiváló mechanizmussal rendelkező és néhány elnyomó mechanizmussal rendelkező fehérjét. A P107 és a p130 társrepresszorokként működnek az E2F 4 és az E2F 5 esetében, amelyek gátolják a G1-S-t elősegítő tényezők transzkripcióját. A harmadik zsebfehérje, az Rb, kötődik és elnyomja az E2F 1, E2F 2 és E2F 3 anyagokat, amelyek aktiváló képességű E2F fehérjék.
A pozitív visszacsatolás alapvető szerepet játszik a G1 -S fázisba történő előrehaladás szabályozásában, különösen az Rb Cyclin/CDK fehérjekomplex általi foszforilezésében. Az Rb foszfát nélkül, vagy foszforilálatlan Rb szabályozza a G0 sejtciklus kilépését és differenciálódását. A G1 fázis kezdetén a növekedési faktorok és a DNS károsodása jelzi a ciklin D szintjének emelkedését, amely ezután a Cdk4 és Cdk6 -hoz kötődve létrehozza a CyclinD: Cdk4/6 komplexet. Ez a komplex ismert módon inaktiválja az Rb -t foszforilezéssel. Az Rb -foszforiláció részletei azonban meglehetősen bonyolultak és specifikusak a G1 -ellenőrzési ponttal kapcsolatos korábbi ismeretekhez képest. CyclinD: A Cdk4/6 csak egy foszfátot vagy monofoszforilátumot, Rb -t helyez el a tizennégy elérhető és egyedi foszforilációs hely egyikén. A tizennégy specifikus monofoszforilált izoformának mindegyike eltérő kötési preferenciával rendelkezik az E2F család tagjaival szemben, ami valószínűleg növeli az emlős testben zajló sejtfolyamatok sokféleségét.
Az E2F 4 és az E2F 5 nukleáris lokalizációjának fenntartása érdekében a p107 és p130 függvénye. Azonban a Cyclin D: Cdk 4/6 foszforilálja a p107-et és a p130-at is, egy folyamat, amely felszabadítja kötésüket az E2F 4 és 5-ből (amelyek ezután a citoplazmába menekülnek), és lehetővé teszi, hogy az E2F 1-3 kötődjön a DNS-hez és kezdeményezze az átírást Az Rb fehérjék megtartják monofoszforilált állapotukat a korai G1 fázisban, míg a ciklin E felhalmozódik és kötődik a Cdk2-hez.
CyclinE: A Cdk2 további fontos foszforilációs szerepet játszik a G1-S átmenetben. A CyclinE: Cdk2 különösen pozitív visszacsatolási ciklust támogat, amely „mindent vagy semmit” kapcsolót hoz létre. Sok genetikai kontrollhálózatban a pozitív visszacsatolás biztosítja, hogy a sejtek ne csússzanak oda-vissza a sejtciklus fázisai között. . Az Rb hiperfoszforilációját a késői G1 restrikciós pontnak tekintik, amely után a sejt nem tud visszamenni a sejtciklusban. Ezen a ponton az E2F 1-3 fehérjék kötődnek a DNS-hez, és átírják a Cyclin A-t és a Cdc 6-ot.
Az 1B ciklinfüggő kináz inhibitor (CDKN1B), más néven p27, gátlás révén kötődik a CyclinE: Cdk2-hez és megakadályozza annak aktiválását. Mivel azonban a ciklin A felhalmozódik és kötődik a Cdk2 -hez, komplexet képeznek és gátolják a p27 -et. A G1 fázis ciklinfüggő kináza együtt működik az S fázisú ciklinfüggő kinázzal, amely a p27-et célozza meg a lebomlás érdekében. Ez viszont lehetővé teszi a Cyclin A: Cdk2 komplex teljes aktiválását, egy komplexet, amely foszforilálja az E2F 1-3-at, és elindítja azok elszakadását a DNS-promóter helyektől. Ez lehetővé teszi, hogy az E2F 6-8 kötődjön a DNS-hez és gátolja a transzkripciót. Az inhibitor, a p27 sikeres gátlásához használt negatív visszacsatolási hurok egy másik alapvető folyamat, amelyet a sejtek használnak az egyirányú mozgás biztosítására és a sejtcikluson keresztüli visszalépés biztosítására.
Amikor DNS -károsodás következik be, vagy ha a sejt olyan hibákat észlel, amelyek szükségessé teszik a G1 sejtciklus késleltetését vagy leállítását, a leállás több mechanizmuson keresztül történik. A gyors reagálás olyan foszforilációs eseményeket foglal magában, amelyek vagy a kináz ATM ( Ataxia telangiectasia mutated ) vagy ATR ( Ataxia Telangiectasia and Rad3 related ), amelyek a sérülés típusától függően szenzorként működnek. Ezek a kinázok foszforilálják és aktiválják a Chk2 és Chk1 effektor kinázokat, amelyek viszont foszforilezik a Cdc25A foszfatázt, ezáltal megjelölve az ubikvitinációt és a lebomlást. Mivel a Cdc25A aktiválja a korábban említett ciklin E-CDK2 komplexet azáltal, hogy eltávolítja a gátló foszfátokat a CDK2-ből, Cdc25A hiányában a ciklin E-CDK2 inaktív marad, és a sejt a G1-ben marad.
A letartóztatás fenntartása érdekében újabb választ indítanak, amellyel a Chk2 vagy a Chk1 foszforilálja a p53 -at, egy tumorszuppresszort, és ez stabilizálja a p53 -at, megakadályozva, hogy megkötje az Mdm2 -t, egy ubikvitin -ligázt, amely gátolja a p53 -at, lebontva. A stabil p53 ezután számos célgén transzkripciós aktivátorát fejti ki, beleértve a p21-et, amely a G1-S-promoter komplex ciklin E-CDK2 inhibitora. Ezenkívül egy másik mechanizmus, amellyel a p21 aktiválódik, a p16 felhalmozódása a DNS -károsodás hatására. A p16 megszakítja a ciklin D-CDK4 komplexeket, ezáltal a p21 felszabadulását okozza a komplexekből, ami az Rb defoszforilációjához és aktiválásához vezet, ami lehetővé teszi, hogy az Rb megkötje és gátolja az E2F 1-3-at, ezáltal megakadályozva a sejt átmenetét S fázisba. A közelmúltban ennek a modellnek néhány aspektusa vitatott.
G 2 ellenőrzőpont
A DNS replikációját követően az S fázisban a sejt egy növekedési szakaszon megy keresztül, amelyet G2 néven ismernek. Ez idő alatt a szükséges mitotikus fehérjék termelődnek, és a sejt ismét szabályozó mechanizmusoknak van kitéve, hogy biztosítsa a megfelelő állapotot a proliferációs mitotikus (M) fázisba való belépéshez. A G2-ről az M-re történő átmenetben több mechanista ellenőrzési pont vesz részt, közös ciklin-Cdk-aktivitási tényezővel.
Bár a szükséges ciklin-Cdk komplexek variációi léteznek az organizmusok között, a kinázaktivitás szükségessége konzervált, és jellemzően egyetlen párosításra összpontosít. A hasadó élesztőben a mitotikus ciklin három különböző formája létezik, és hat a bimbózó élesztőben, de az elsődlegesen használt ciklin a B ciklin. A B ciklin referenciaként szolgál a G2/M ellenőrzőpont -átmenet tárgyalásához.
Az S fázishoz hasonlóan a G2 DNS -károsodást ellenőrző pontot tapasztal. A sejtet ismét megvizsgálják a DNS -károsodás vagy a hiányos replikáció helyeit illetően, és az ATR és ATM kinázokat a károsodási helyekre toborozzák. A Chk1 és Chk2 aktiválása, valamint a p53 aktiválása is megtörténik, hogy a sejtciklus leállását indukálja és megállítsa a mitózisba való progresszióját. Az S fázis további komponensét, a Pre-Replicative Complex-et ciklin B-Cdk1 foszforilezéssel kell inaktiválni.
A korábbi ellenőrzési pontok értékelésekor a G2 fehérje felhalmozódása számos mechanizmuson keresztül aktiválja a ciklinB-Cdk1 aktivitást. A CyclinA-Cdk2 aktiválja a Cdc25-öt, a ciklinB-Cdk1 aktivátorát, amely ezután deaktiválja a ciklinB-Cdk1 inhibitort, a Wee1-et. Ez pozitív visszacsatolási ciklust eredményez, jelentősen megnövelve a ciklinB expresszióját és a Cdk1 aktiválását. Amint a sejt előrehalad a G2 -n, és eléri a G2/M átmenetet, a Plk1 kináz foszforilálja a Wee1 -et, amely a Wee1 -et célozza meg az SCF ubikvitin ligáz komplexen keresztül történő lebomlás érdekében. A Plk1 további funkciója a Cdc25 aktiválása foszforilezéssel. A Wee1 degradáció és a Cdc25 aktiválás összetett hatása a gátló foszforiláció nettó eltávolítása a cdc2 -ből, amely aktiválja a cdc2 -t. A Plk1 a G2/M átmenetnél aktiválódik az Aurora A és a Bora által, amelyek a G2 során felhalmozódnak és aktivációs komplexet képeznek. A Plk1-Cdc2-cdc25 komplex ezután pozitív visszacsatolási ciklust kezdeményez, amely a Cdc2 további aktiválását szolgálja, és a ciklin B szintjének G2 során történő növekedésével együtt a keletkező cdc2-ciklin B komplexek aktiválják a downstream célpontokat, amelyek elősegítik a mitózisba való belépést. A kapott Cdk1 aktivitás a G2/M átmeneti gén Mem1-Fkh expresszióját is aktiválja. A ciklinB-Cdk1 aktivitás gyors megugrására szükség van, mivel az M fázis iniciálása egy mindent vagy semmit jelentő esemény, amely hiszterézist okoz. A Cdk1 aktivitás hiszterézise a ciklin B -n keresztül elősegíti az M fázis belépését a ciklinB koncentráció minimális küszöbértékének meghatározásával. Ez magasabb szinten van, mint a minimum, ami szükséges az M fázis belépés utáni folytatásához, a „mindent vagy semmit” esemény védelme érdekében. Ez a belépési koncentráció tovább növekszik hiányos DNS -replikáció esetén, hozzáadva egy másik szabályozási mechanizmust a G2/M átmeneti ponthoz. A hiszterézis jelenléte lehetővé teszi az M fázis belépésének erős szabályozását a ciklinB-Cdk1 aktivitás függvényében.
Azok a mechanizmusok, amelyekkel a mitotikus behatolás megakadályozható a DNS -károsodás hatására, hasonlóak a G1/S ellenőrzési pontban leírtakhoz. A DNS -károsodás aktiválja a fent említett ATM/ATR útvonalat, amelyben az ATM/ATR foszforilál és aktiválja a Chk1/Chk2 ellenőrzőpont kinázokat. Chk1/2 foszforilálja a cdc25-t, amely amellett, hogy gátolt, a citoplazmában a 14-3-3 fehérjék által is megkötődik. A 14-3-3. A p53 szintén transzaktiválja a p21-et, és mind a p21, mind a 14-3-3 gátolja a ciklin B-cdc2 komplexeket a cdc2 foszforilezése és citoplazmatikus lekötése révén. Ezenkívül a cdc25 inaktiválása azt eredményezi, hogy képtelen defoszforilálni és aktiválni a cdc2 -t. Végül egy másik mechanizmus a károsodásokra a Plk1 ATM/ATR általi negatív szabályozása révén, ami a Wee1 és a Myt1 stabilizálódását eredményezi, ami foszforilezheti és gátolhatja a cdc2 -t, így a sejt leáll a G2 -ben mindaddig, amíg a kár meg nem áll. rögzített.
G2-M átmenet Xenopus petesejtekben
A G2 végén a sejt mitózisba megy át, ahol a mag osztódik. A G2 -M átmenet drámai; minden vagy semmi hatása van, és az átmenet visszafordíthatatlan. Ez előnyös a sejt számára, mivel a mitózisba való belépés kritikus lépés a sejt életciklusában. Ha nem teljesíti a kötelezettséget, akkor a sejt sok problémába ütközik, részben felosztva, ami végül a sejt halálához vezethet.
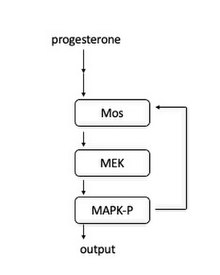
A béka petesejtekben a szignál kaszkád indukálódik, amikor a progeszteron kötődik egy membránhoz kötött receptorhoz. Lefelé, a Mos aktiválódik. A Mos ezután a MEK1 -et foszforilálja, amely a MAPK -t. A MAPK két szerepet tölt be: a CyclinB-Cdk1 komplex aktiválása a mitózisba való belépés kezdeményezésére és a Mos aktiválása. A Mos aktiválása pozitív visszacsatolási hurokhoz vezet, és ezért „váltókapcsolóként” működik, hogy létrehozza a mindent vagy semmit a mitózisba való belépést.
Ezt a visszacsatolási ciklust először úgy találták meg, hogy megmutatták, hogy a MAPK-P (foszforilált MAPK) koncentrációja növekedett a progeszteron szintjének emelkedése miatt. Az egyes sejtek szintjén minden sejt vagy teljesen foszforilált MAPK-t tartalmazott, vagy nem foszforilált MAPK-t, ami megerősíti, hogy minden sejtben kapcsolószerű mechanizmusként működik. Ezenkívül kimutatták, hogy a Mos fehérje szintézisének blokkolása fokozottabbá teszi a MAPK-P válaszokat, ami azt mutatja, hogy a Mos fehérjeszintézis szükséges a MAPK aktiválás minden vagy semmi karakteréhez.
Bistability
Ez a folyamat a bistabilitás segítségével érthető. A jobb oldalon látható grafikon segítségével a Mos szintézisének sebessége eltolódik, amint több progeszteront adnak hozzá. Minden görbénél vannak stabil fix és instabil fix pontok. Az instabil rögzített pontokon a rendszer a stabil rögzített pontok bármelyike felé fog nyomni. Tehát a rendszer lehet „be” vagy „kikapcsolt” állapotban, nem között. Ha a progeszteron szintje elég magas, a Mos görbe magasabbra tolódik, és végül csak egy pontban metszi a degradációs vonalat, így csak egy stabil „be” állapot van, ami a mitózisba való belépést jelzi.
A visszafordíthatatlanság, amit a mitózis átmeneti pontjában látunk, abból adódik, hogy elég magas progeszteronszint van a sejtben. Elég magas progeszteronszint esetén a rendszer monostabil a Mapk és Mos közötti pozitív visszacsatolási hurok eredményeként. Azt a pontot, amikor a rendszer bistabilről monostabilra vált, nyeregcsomópont -elágazásnak nevezzük.
Tehát megérthetjük a mitotikus átmenet mindent vagy semmit, visszafordíthatatlan válaszát a molekuláris szabályozók matematikai modelljével, mint egy bistabil rendszerrel, amely függ a pozitív visszacsatolás meglététől. Az „kikapcsolt állapotot” elég magas progeszteronszint semmisíti meg, és amint a sejt elhalad az kikapcsolt állapot mellett, akkor beragad az állapotba.
Hiszterézis és a Novak Tyson -modell
Ebből a bi-stabil modellből kiindulva a mitotikus átmenetet hiszterézisre támaszkodva értelmezhetjük. A hiszterézist úgy határozzák meg, mint a rendszer állapotának a történetétől való függését. A Novak Tyson -modell a sejtciklus előrehaladásának matematikai modellje, amely azt jósolja, hogy a mitózisba belépő és kilépő visszafordíthatatlan átmeneteket a hiszterézis vezérli. A modellnek három alapvető előrejelzése van, amelyeknek igaznak kell lenniük azokban a petesejt -kivonatokban, amelyek sejtciklusának előrehaladása függ a hiszterézistől:
(1) A mitózisba való belépéshez szükséges ciklin B koncentrációja magasabb, mint a mitózisban a mitotikus kivonat tartásához szükséges koncentráció.
(2) A nem replikált DNS megemeli a Cdc2 aktiválásához és ezáltal a mitózisba való belépéshez szükséges ciklinszintet.
(3) A Cdc2 aktiváció sebessége csökken a ciklin B koncentrációnál, közvetlenül az aktiválási küszöb felett.
Sha és munkatársai 2003 -ban kísérleteket végeztek a Xenopus laevis tojáskivonatokban, hogy bemutassák ezt a hisztériás természetet. Kerékpáros kivonatokat használva megfigyelték, hogy az Δciklin B aktiválási küszöbértéke 32 és 42 nM között van, míg az inaktiválási küszöb 16 és 24 nM Δciklin B között van. Ezért ezek a kísérletek megerősítették a rendszer bistabilitását és a hiszterézis fontosságát ebben a sejtben ciklus átmenet. A köztes ciklin B koncentrációknál vagy a sejt interfázisos vagy mitotikus állapota lehetséges.
Replikációs stressz válasz
Mivel a mitózisba való belépés nagy és költséges elkötelezettség a sejt számára, logikus, hogy olyan rendszerek állnak rendelkezésre, amelyek megakadályozzák a korai belépést ebbe a lépésbe. Kimutatták, hogy a korábbi lépésekben elkövetett hibák, például a nem replikált DNS -szakaszok blokkolják a sejtciklus progresszióját. A Novak Tyson -modell azt jósolja, hogy ez a mitózisba való belépéshez szükséges ciklin B szint emelkedésével történik.
Sha et al. megvizsgálta, hogy ez igaz -e a Xenopus tojáskivonatokra . Aphidicolint (APH) használtak a DNS -polimeráz gátlására és a DNS -replikáció megakadályozására. Cyclin B -vel interfázisban kezelve az aktiválási küszöb 80 és 100 nM közé emelkedett, a Novak Tyson -modell előrejelzése szerint. Tehát ezek a kísérletek megerősítik, hogy a sejtben a meg nem replikált DNS stressze befolyásolja a hiszterézis hurkot, és sokkal magasabb ciklin B küszöböt eredményez a mitózisba való belépéshez.
Metafázis ellenőrzőpont
A mitotikus orsó ellenőrzési pontja a metafázis azon pontján történik, ahol az összes kromoszómának a mitotikus lemezhez kell igazodnia, és bipoláris feszültség alatt kell lennie. Ennek a bipoláris kötődésnek a feszültsége érzékelhető, ami elindítja az anafázis belépést. Ehhez az érzékelő mechanizmus biztosítja, hogy az anafázis-elősegítő komplex (APC/C) már ne legyen gátolva, amely most szabadon lebonthatja a D-dobozt (megsemmisítő doboz) tároló ciklin B -t és lebonthatja a szekurint . Ez utóbbi egy olyan fehérje, amelynek feladata a szeparáz gátlása , ami viszont a kohéneket , a testvérkromatidok kohéziójáért felelős fehérjekompozitot vágja le . Miután ez a gátló fehérje lebomlott az ubikvitináció és az azt követő proteolízis útján, a szeparáz ezután testvérkromatid -elválasztást okoz. Miután a sejt két leánysejtjére szakadt, a sejt belép a G 1 -be .
Rák
A DNS -helyreállítási folyamatok és a sejtciklus -ellenőrzési pontok szorosan kapcsolódnak a rákhoz, a genom stabilitását és a sejtek progresszióját szabályozó funkcióik miatt. A pontos molekuláris mechanizmusokat, amelyek ezekben az utakban fellépő diszfunkciókat egyes rákos megbetegedésekhez kapcsolják, a legtöbb esetben nem ismerjük jól. Kimutatták, hogy az ATM elvesztése megelőzi a limfóma kialakulását, feltehetően a túlzott homológ rekombináció miatt, ami nagy genomi instabilitáshoz vezet. A Chk1 megszakítása egerekben a sejtciklus ellenőrzési pontjainak jelentős rossz szabályozásához, a DNS -károsodás felhalmozódásához és a daganatképződés gyakoriságának növekedéséhez vezetett. Talán a leghíresebb, hogy a BRCA1 vagy a BRCA2 egyetlen mutáns öröklődése a nőket emlő- és petefészekrákra hajlamosítja. Ismert, hogy a BRCA1 szükséges az S és G2/M átmenetekhez, és részt vesz a DNS -károsodásra adott sejtválaszban. Úgy gondolják, hogy a BRCA2 részt vesz a homológ rekombinációban és szabályozza az S-fázis ellenőrzési pontját, és a BRCA2 hiányosságainak mutációi erősen kapcsolódnak a tumor kialakulásához.
Lásd még
- Biokémiai kapcsolók a sejtciklusban
- Sejtciklus elemzés
- G2-M DNS károsodás ellenőrző pont
- A replikáció utáni ellenőrző pont
- Meiotikus rekombinációs ellenőrzőpont