PDE3 inhibitor - PDE3 inhibitor
A PDE3 inhibitor olyan gyógyszer, amely gátolja a PDE3 foszfodiészteráz enzim hatását . Akut szívelégtelenség és kardiogén sokk kezelésére használják .
Orvosi felhasználás
Szív
Az amrinont , a milrinont és az enoximont klinikailag használják a szívelégtelenség rövid távú kezelésére kardiogén sokk jelenlétében.
A katekolaminok hatástalansága esetén a PDE3 inhibitorokat inotropikumokként jelzik az akut szívelégtelenség kezelésében . Jól kontrollált vizsgálatok kimutatták, hogy ezek a gyógyszerek általában növelik a halálozást , ha akut szívelégtelenség kezelésére használják, ezért szoros megfigyelés alatt kell alkalmazni őket.
Perifériás artéria betegség
A cilostazolt az időszakos claudicatio kezelésére használják . Ennek a gyógyszernek sokkal gyengébb a pozitív inotrop hatása, mint az akut szívelégtelenség kezelésére használt gyógyszereknek, és nincs jelentős káros szívkárosító hatása.
Ellenjavallatok
Szív
Ellenjavallatok súlyos obstruktív kardiomiopátia , hipovolémia , tachycardia és kamrai aneurysma . A kezelés alatt tilos a szoptatás .
Káros hatások
Szív
Az akut szívelégtelenség kezelésére alkalmazott legfontosabb mellékhatások az aritmia , a trombocitopénia és a megnövekedett transzaminázszint .
Típusok
A jóváhagyott PDE3 inhibitorok a következőket tartalmazzák:
- amrinon
- cilostazol
- milrinon
- enoximone
- pimobendan (kutyák számára engedélyezett)
A cselekvés mechanizmusa
A PDE3 inhibitorok egy foszfodiészteráz inhibitorok . A PDE izoenzim 3 gátlása a második hírvivő ciklikus adenozin-monofoszfát (cAMP) intracelluláris koncentrációjának növekedéséhez vezet . cAMP közvetíti a foszforiláció a protein-kinázok , amely viszont aktiválja a szív kalcium csatornák . A szarkoplazmatikus retikulum (SR) megnövekedett kalcium beáramlása a szívműködési potenciál 2. fázisa (plató fázis) alatt a PDE3 inhibitorok pozitív inotrop hatásához vezet: növelik a szív összehúzódásának erejét. A platós fázist követő fokozott kalcium-visszavezetés az SR-be felelős pozitív lusitropikus hatásukért : növelik a relaxációs sebességet. Ezenkívül a PDE3 inhibitorok értágítóként hatnak .
Kémiai tulajdonságok
Első generációs PDE3 inhibitorok
Átfogó kutatáshoz vezetett annak felismerése, hogy a PDE-vel kapcsolatos ismeretek felhasználhatók olyan gyógyszerek kifejlesztésére, amelyek PDE-gátlók. A legtöbb tanulmány a nukleotid-szubsztrátok analógjait vagy a természetes termék-inhibitorok, például a xantin (pl. Teofillin ) és a papaverin származékait használta .
A PDE3 aktív helye az első generációs inhibitorokból származó receptor topográfiával kapcsolatos elképzelések összefoglalásának tekinthető. Wells és munkatársai modellje . Erhardt és Chou (1991) idézett változata a következőket tartalmazza:
- A foszfát- kötő területen
- A lipofil terület, amely befogadja a nem-poláros oldalán a ribóz -csoport
- Egy pirimidin kötőhely
- A pirimidin- kötő hely imidazol- kötő helyének része
- Szterikailag akadályozott hely
- Tömeges tűrésű terület
Második generációs PDE3 inhibitorok
Amióta a szelektív PDE3-gátlókat kardiotonikus gyógyszereknek ismerik el, nagy érdeklődés mutatkozik új gyógyszerek kifejlesztése iránt ebben a kategóriában. A kapcsolódó kutatások során nagyszámú heterociklusos vegyületet szintetizáltak. Ezek a vegyületek alkotják a PDE inhibitorok második generációját. Bár többnyire a PDE3-ra irányultak, általában a PDE-k számára jelentős szerkezet-aktivitás viszonyt mutatnak .
Úgy ítélték meg, hogy a "heterociklus-fenil-imidazol" (HPI) mintázat szükséges a szívizom pozitív inotrop aktivitásához, és sok második generációs inhibitor megfelel ennek a mintának.
A heterociklusos régió : Minden heterocikluson belül van egy dipólus és egy szomszédos sav proton (amid funkció). Úgy gondolják, hogy ezek az atomok utánozzák a foszfátcsoport elektrofil centrumát a cAMP-ben, és megerősítést nyertek, hogy ezek a kötés elsődleges helyei. A heterociklus a PDE átmeneti állapot analóg inhibitora. A metil- vagy etilcsoportra korlátozott alkilcsoportok a heterociklusos gyűrűn általában fokozzák a hatékonyságot, alkalmanként kivéve.
A fenil régió : Úgy tűnik, hogy elektronban gazdag központnak, például fenilnek kell jelen lennie. A kis alkilcsoportok jótékony hatása a heterociklusra az lehet, hogy a központi gyűrűt elfordítja a heterociklusos gyűrűvel való pontos koplanaritástól. Hasonló csavar van a cAMP-ben, és általános egyetértés van abban, hogy a nagy affinitású PDE3 inhibitoroknak olyan energetikailag kedvelt síkbeli konformációt kell elfogadniuk, amely utánozza a cAMP anti-konformációját.
Az imidazol régió : Különböző szubsztituenseket helyeztek a központi fenilgyűrű para-helyzetébe. Elektrongazdag részek, és láthatóan egy pozitív töltésű rész nem tolerálható a PDE receptor ezen régiójában. Általános az egyetértés ebben az inhibitor hatékonyságban: laktám ≥ alkil-CONH- ≥ imidazoil = piridin a központi fenil helyett nitrogénnel az analóg 4-helyzetben ≥ alkil-S-> egyszerű éter > halogenid = amin > imidazolium (amely teljesen inaktív).
A legszelektívebb inhibitorok közös jellemzőinek azonosítása "ötpontos modellhez" vezetett:
- Erős dipól ( karbonil- rész) jelenléte a molekula egyik végén.
- Egy szomszédos savas proton.
- Kis méretű alkil-szubsztituens a heterociklusos gyűrűn.
- Viszonylag lapos topográfia.
- Elektronban gazdag központ és / vagy hidrogénkötés akceptor helye a dipollal szemben.
Példák szelektív PDE3 inhibitorokra
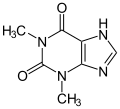
Teofillin , egy nem szelektív inhibitor
|

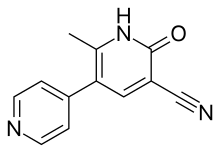
Meribendan , erősen szelektív inhibitor
|
A teofillin nem szelektív szer. Ezzel szemben a meribendán erősen szelektív inhibitor.
A meribendán szelektivitása magasabb a CI-930 kiindulási vegyülettel összehasonlítva, mivel a laktám-rész mellett szomszédos bázikus nitrogén mellett van egy másik bázikus nitrogénje (benzimidazolgyűrű), szemben az elsődleges kötőhellyel.
Kutatás
Az RPL-554 a trequinsin analógja , és a trequinsinhez hasonlóan a PDE-3 és PDE-4 foszfodiészteráz enzimek kettős inhibitora . 2015. októberétől a porlasztón keresztül szállított inhalált RPL-554 kifejlesztés alatt állt a COPD kialakulásában, és asztmában tanulmányozták.
Hivatkozások
- ^ a b c d e Mutschler, Ernst; Schäfer-Korting, Monika (1997). Arzneimittelwirkungen (németül). Stuttgart: Wissenschaftliche Verlagsgesellschaft. 454–455, 496. o.
- ^ a b c Forth; Henschler; Rummel (2002). Allgemeine und spezielle Pharmakologie und Toxikologie (németül). München. o. 457.
- ^ "A Cilostazol jóváhagyása" . FDA. 2006. szeptember 25 archivált az eredeti 2007. április 27.
- ^ Yan, Chen. "A foszfodiészteráz 3 és az indukálható cAMP korai represszor szabályozása a szívben" . Keringési kutatás . Letöltve: 2016. január 23 .
- ^ a b c d e f g Erhardt PW; Chou Y. (1991). "A c-AMP foszfodiészteráz III aktív helyének topográfiai modellje". Life Sciences, 49 (8): 553-568.
- ^ a b c d e f Fossa P .; Boggia R .; Mosti L. (1998). "A szív cGMP-gátolt foszfodiészteráz katalitikus helyének azonosítása felé". Journal of Computer-Aided Molecular Design, 12 (4): 361-372.
- ^ Boswell-Smith V és mtsai. Két új, hosszú hatású foszfodiészteráz 3/4 inhibitor, az RPL554 [9,10-dimetoxi-2 (2,4,6-trimetilfenilimino) -3- (n-karbamoil-2-aminoetil) -3,4,6, farmakológiája , 7-tetrahidro-2H-pirimido [6,1-a] izokinolin-4-on] és RPL565 [6,7-dihidro-2- (2,6-diizopropilfenoxi) -9,10-dimetoxi-4H-pirimido [ 6,1-a] izokinolin-4-on]. J Pharmacol Exp Ther. 2006. augusztus; 318 (2): 840-8. PMID 16682455
- ^ Nick Paul Taylor a FierceBiotech-hez. 2015. október 1. Verona a COPD-gyógyszer korai tárgyaláson keresztüli célkitűzéseivel foglalkozik a PhIIb-vel


