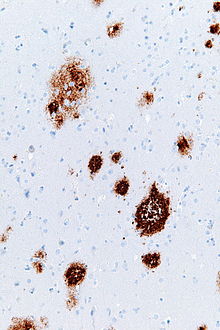
Amiloid plakkok - Amyloid plaques
Amiloid plakkok (más néven neurit plakkok , Ap plakkok vagy szenilis plakkok ) vannak extracelluláris betétek a amiloid béta (Ap) fehérje elsősorban a szürkeállomány az agyban. A degeneratív neuronális elemek, valamint a mikroglia és az asztrociták bősége összefüggésbe hozható az amiloid plakkokkal. Néhány lepedék az agyban az öregedés (öregedés) következtében jelentkezik, de a nagyszámú plakk és a neurofibrilláris gubanc az Alzheimer -kór jellemző jellemzői . Az amiloid plakkok kóros neuritjai kanyargósak, gyakran duzzadt axonok és dendritek . A neuritek különféle organellákat és sejtmaradványokat tartalmaznak, és sok közülük jellegzetes párosított spirális szálakat tartalmaz , amelyek a neurofibrilláris gubancok ultrastrukturális összetevői. A plakkok alakja és mérete nagyon változó; szöveti metszeteket immunológiaiiag Ap, ezek egy log-normál eloszlási görbe átlagos plakk területe 400-450 négyzetméter mikrométer (μm²). Különösen sok a legkisebb (200 µm² -nél kisebb) plakk, amelyek gyakran diffúz Aβ -lerakódásokból állnak. A plakkok látszólagos méretét befolyásolja az észlelésükhöz használt folt típusa, valamint az a sík, amelyen keresztül a metszeteket mikroszkóp alatt elemzik. A plakkok akkor alakulnak ki, amikor az Aβ rosszul hajlik össze, és aggregálódik oligomerekké és hosszabb polimerekké , amelyek közül az utóbbi az amiloidra jellemző . A rosszul összehajtogatott és aggregált Aβ -t neurotoxikusnak tartják , különösen oligomer állapotában.
Történelem
Paul Blocq és Gheorghe Marinescu 1892 -ben írták le először a plakkok jelenlétét a szürkeállományban. A plakkokat „neuroglialis szklerózis csomóinak” nevezték. 1898 -ban Emil Redlich három betegnél jelentett plakkokat, közülük kettőnek klinikailag igazolt demenciája volt . Redlich a „miliáris szklerózis” kifejezést használta a plakkok leírására, mert szerinte azok kölesmaghoz hasonlítottak, és ő volt az első, aki „plakknak” nevezte az elváltozásokat . A 20. század elején Oskar Fischer megjegyezte, hogy hasonlítanak az aktinomyces „Drusen” -hez (geodeszerű elváltozásokhoz), ami miatt a degeneratív folyamatot „drusige Nekrose” -nak nevezte. Alois Alzheimernek gyakran tulajdonítják a plakkok elsődleges összekapcsolását a demenciával egy 1906 -os előadásában (1907 -ben publikálták), de ez a rövid jelentés elsősorban a neurofibrilláris gubancokra összpontosított, és a plakkokat csak röviden említették. Az Alzheimer-féle első érdemi leírás a plakkokról 1911-ben jelent meg. Ezzel szemben Oskar Fischer 1907-ben, 1910-ben és 1912-ben számos átfogó tanulmányt publikált a plakkokról és a demenciáról. 1911-re Max Bielschowsky a plakklerakódások amiloid jellegét javasolta. Ezt később Paul Divry is megerősítette, aki kimutatta, hogy a Kongó Piros festékkel festett plakkok a kettős törés optikai tulajdonságát mutatják , ami általában az amiloidokra jellemző. 1911 -ben Teofil Simchowicz bevezette a „szenilis plakkok” kifejezést, hogy jelezze gyakori jelenlétüket az idősek agyában. 1968 -ban Gary Blessed, Bernard Tomlinson és Martin Roth kvantitatív elemzése megerősítette a szenilis plakkok és a demencia kapcsolatát . Henryk Wisniewski és Robert Terry 1973 -ban alkották meg a „neuritikus plakkok” kifejezést, hogy olyan plakkokat jelöljenek, amelyek kóros idegrendszeri folyamatokat (neuriteket) tartalmaznak. Fontos előrelépés volt 1984 -ben és 1985 -ben az Aβ azonosítása a plakkok magjait alkotó fehérjeként. Ez a felfedezés új eszközök létrehozásához vezetett a plakkok, különösen az Aβ elleni antitestek tanulmányozásához, és molekuláris célt mutatott be az Alzheimer -kór lehetséges terápiáinak kifejlesztésére. Az Aβ aminosavszekvenciájának ismerete lehetővé tette a tudósok számára, hogy felfedezzék az autoszomális domináns Alzheimer -kórt okozó genetikai mutációkat, amelyek mind növelik annak valószínűségét, hogy az Aβ aggregálódni fog az agyban.
A béta -amiloid generációja
Az amiloid béta (Aβ) egy kicsi, leggyakrabban 40 vagy 42 aminosav hosszúságú fehérje, amely az Aβ-prekurzor fehérje (APP) nevű hosszabb szülőfehérjéből szabadul fel . Az APP -t sokféle sejt termeli a szervezetben, de különösen bőséges az idegsejtekben . Ez egy egylépéses transzmembrán fehérje , vagyis egyszer áthalad a sejtmembránokon . Az APP Aβ szegmense részben a membránon belül, részben a membránon kívül található. Az Aβ felszabadítása érdekében az APP-t két enzim hasítja szekvenciálisan : először a béta-szekretáz (vagy β-amiloid hasító enzim (BACE)) a membránon kívül, másodszor pedig a gamma-szekretáz (γ-szekretáz), a membránon belüli enzimkomplex . Ezeknek a szekretázoknak a szekvenciális hatásai Aβ fehérje fragmentumokat eredményeznek, amelyek felszabadulnak az extracelluláris térbe. Az Aβ kibocsátását növeli a szinapszisok aktivitása . A 40 vagy 42 aminosav hosszú Aβ peptideken kívül több kevésbé bőséges Aβ fragment is keletkezik. Az Aβ kémiailag különböző módon módosítható, és a fehérje hossza és a kémiai módosítások egyaránt befolyásolhatják annak aggregációs hajlamát és toxicitását.
Azonosítás

Az amiloid plakkok láthatók a fénymikroszkóp segítségével a különböző hisztológiai festési technikák, beleértve az ezüst foltok , kongóvörös , tioflavin , krezil-ibolyával , PAS-reakció , és a lumineszcens konjugált oligothiophenes (LCOS). Ezek a módszerek gyakran megfestik a plakkok különböző összetevőit, és érzékenységük eltérő. Az immunhisztokémiai foltok különösen hasznosak, mivel érzékenyek és specifikusak a plakkokkal kapcsolatos antigénekre .
Fogalmazás
Az amiloid plakkokat tartalmazó Aβ lerakódások mérete és megjelenése változó. A fénymikroszkóp alatt a kis, óvatos, néhány mikron átmérőjű halmozódásoktól a sokkal nagyobb sűrű vagy diffúz tömegekig terjednek . Az úgynevezett „klasszikus plakkok” egy kompakt Aβ-amiloid magból állnak, amelyet kissé kevésbé sűrűn tömött Aβ koronája vesz körül. A klasszikus plakkok közé tartoznak a kóros, duzzadt neuronális folyamatok ( neuritek ) is, amelyek számos különböző típusú neuronból származnak, valamint az aktivált asztrociták és mikroglia . A kóros neuritek és az aktivált gliasejtek nem jellemzőek a legtöbb diffúz plakkra, és felmerült, hogy a diffúz lerakódások a plakkok kialakulásának korai szakaszában vannak.
Anatómiai eloszlás
Dietmar Thal és munkatársai javaslatot tettek a plakkképződés szakaszainak sorrendjére az Alzheimer -betegek agyában Az 1. fázisban plakkok jelennek meg a neocortexben ; a 2. fázisban az allocortexben , a hippocampalis képződményben és az amygdalában jelennek meg ; a 3. fázisban a bazális ganglionok és a diencephalon érintettek; a 4. fázisban plakkok jelennek meg a középagyban és a medulla oblongata -ban ; és az 5. fázisban a ponsban és a kisagyban jelennek meg . Így az Alzheimer-kór végstádiumában plakkok találhatók az agy legtöbb részén. A gerincvelőben nem gyakoriak .
Kialakulás és elterjedés
Az Aβ normál funkciója nem biztos, de plakkok keletkeznek, amikor a fehérje rosszul hajlik, és molekuláris sablonozási folyamat („magolás”) segítségével elkezd felhalmozódni az agyban. Mathias Jucker és Lary Walker ezt a folyamatot a szivacsos agyvelőbántalmaknak vagy prionbetegségeknek nevezett betegségekben a prionok kialakulásához és terjedéséhez hasonlították . A prionparadigma szerint bizonyos fehérjék rosszul formálódnak, amelyek béta-lap másodlagos szerkezetben gazdagok . Ebben az állapotban más, azonos típusú fehérjék hatására ugyanaz a kóros béta-lapban gazdag szerkezet alakul ki. A rosszul összehajtogatott fehérjék egymáshoz tapadnak, végül egymásra halmozódva oligomereket képeznek, amelyek összeolvadva az érett plakkokra jellemző amiloid szálakat képeznek.
Betegségben való részvétel
A bőséges Aβ -plakkok, valamint az aggregált tau -fehérjéből álló neurofibrilláris gubancok a két elváltozás, amelyekre szükség van az Alzheimer -kór neuropatológiai diagnózisához. Bár a neurofibrilláris gubancok száma erősebben korrelál a demencia mértékével, mint a plakkok száma, a genetikai és kóros eredmények azt jelzik, hogy az Aβ központi szerepet játszik az Alzheimer -kór kockázatában, megjelenésében és progressziójában. Különösen fontos a hosszabb (42 aminosavból álló) Aβ -faj, amelyet Aβ42 néven ismernek. Az Aβ emelkedett szintje, valamint az Aβ42 és a 40 aminosav forma (Aβ40) arányának növekedése fontos korai esemény az Alzheimer-kór patogenezisében.
Egészen a közelmúltig az Alzheimer -kór diagnosztizálásához szükség volt az agyszövetben lévő plakkok és gubancok mikroszkópos elemzésére, általában boncoláskor. Azonban az Aβ-plakkok (az agyi Aβ-amiloid angiopátiával együtt ) mostantól kimutathatók az élő alanyok agyában. Ezt úgy végezzük, hogy radioaktívan jelölt szereket készítünk , amelyek szelektíven kötődnek az agyban lévő Aβ -lerakódásokhoz, miután a véráramba beadták őket. A ligandumok átjutnak a vér-agy gáton, és az aggregált Aβ-hoz kapcsolódnak, és az agyban való visszatartásukat pozitron emissziós tomográfiával (PET) értékelik . Ezenkívül a plakkok és gubancok jelenléte megbecsülhető a cerebrospinális folyadékban lévő Aβ és tau fehérjék mennyiségének mérésével .
Esemény
Az életkor előrehaladtával nő a plakkok előfordulásának valószínűsége az agyban. 60 éves kortól (10%) 80 éves korig (60%) lineárisan nő a szenilis plakkokkal rendelkezők aránya. A nők valamivel nagyobb valószínűséggel rendelkeznek plakkokkal, mint a férfiak. Mind a plakkok, mind az Alzheimer -kór gyakoribbak a 21 -es triszómiában ( Down -szindróma ) szenvedő idős emberekben . Úgy gondolják, hogy ez az Aβ túlzott termeléséből adódik, mivel az APP gén a 21. kromoszómán található, amely három példányban létezik a Down -szindrómában.
Az amiloid plakkok természetesen előfordulnak a nem emberi fajok öregedő agyában, a madaraktól a nagy majmokig. A nem főemlős főemlősöknél, amelyek az emberek legközelebbi biológiai rokonai, plakkokat találtak minden eddig vizsgált fajnál. A neurofibrilláris gubancok azonban ritkák, és nem nem humán fajokról kimutatták, hogy demenciában szenvednének az Alzheimer -kór teljes neuropatológiájával együtt.
Kutatás
A kutatások a plakkok biokémiai , citológiai és gyulladásos jellemzőinek megértésére irányultak , annak meghatározására, hogy a plakkok hogyan keletkeznek és szaporodnak az agyban, azonosítják a genetikai és környezeti kockázati tényezőket, felfedezik az élő agyban észlelhető módszereket, és terápiás stratégiákat dolgoznak ki a megelőzésre. vagy eltávolítani őket. Az amiloid plakkok kialakulásának és proliferációjának kutatását felgyorsította a géntechnológiával módosított egérmodellek kifejlesztése. Néhány korlátozás ellenére ezek a modellek is hozzájárultak új terápiás stratégiák felfedezéséhez. Például az Aβ szintjét és az agyi plakkok számát csökkentő kezelések egyre növekvő választékát azonosították transzgenikus rágcsáló modellek segítségével. Ezek a stratégiák magukban foglalják az immunterápiás megközelítéseket és az APP -ből felszabaduló szekretázok gátlóit. Az ilyen kezeléseket jelenleg klinikailag értékelik az Alzheimer -kór kezelésére. Az eddigi eredmények azt mutatják, hogy a plakkok eltávolítása demenciában szenvedő betegeknél kevés haszonnal jár, valószínűleg azért, mert az agy súlyosan károsodott az Alzheimer -kór jeleinek és tüneteinek első megjelenésekor. A Microglia által közvetített plakkképződés valójában előnyös lehet, ha az Aβ-t sűrű plakkmagokba zárjuk. Emiatt sok kutató úgy véli, hogy az Aβ aggregáció és a plakkképződés korábbi gátlására van szükség a tauopathia és az Alzheimer -kór demenciájának lassításához vagy megelőzéséhez . Más kutatások a plakkokkal gyakran összefüggő gyulladás megértésére vagy a plakkképződés és az Alzheimer -kór környezeti, fiziológiai és genetikai kockázati tényezőinek azonosítására irányulnak.
Lásd még
Hivatkozások
- ^ a b Cras P; Kawai M; Lowery D; Gonzalez-DeWhitt P; Greenberg B; Perry G (1991. szeptember). "Az Alzheimer -kórban a szenilis plakk neuriták felhalmozzák az amiloid prekurzor fehérjét" . Az Amerikai Egyesült Államok Nemzeti Tudományos Akadémiájának közleményei . 88 (17): 7552–6. Bibcode : 1991PNAS ... 88.7552C . doi : 10.1073/pnas.88.17.7552 . PMC 52339 . PMID 1652752 .
- ^ Purves, Dale; Ágoston, George J .; Fitzpatrick, David; Hall, William C .; LaManita, Anthony-Samuel; Fehér, Leonard E .; Mooney, Richard D .; Platt, Michael L. (2012). Idegtudomány (5. kiadás). Sunderland, MA: Sinauer Associates. o. 713. ISBN 978-0-87893-695-3.
- ^ a b c d Dickson DW (1997). "A szenilis plakkok patogenezise" . J Neuropathol Exp Neurol . 56. (4): 321–339. doi : 10.1097/00005072-199704000-00001 . PMID 9100663 .
- ^ a b c d e f g h i j k l m n o Walker LC (2020). "Aβ plakkok" . Ingyenes neuropatológia . 1 (31): 31. doi : 10.17879/freeneuropathology-2020-3025 . PMC 7745791 . PMID 33345256 .
- ^ Ballard, C; Gauthier, S; Corbett, A; Brayne, C; Aarsland, D; Jones, E (2011. március 19.). "Alzheimer kór". Lancet . 377 (9770): 1019–31. doi : 10.1016/S0140-6736 (10) 61349-9 . PMID 21371747 . S2CID 20893019 .
- ^ Hyman BT; Nyugat -HL; Rebeck GW; Buldyrev SV; Mantegna RN; Ukleja M; Havlin S; Stanley HE (1995). "Az Alzheimer-kór szenilis plakkjainak mennyiségi elemzése: a log-normális méreteloszlás megfigyelése és az apolipoprotein E genotípusához és a 21. triszómiához (Down-szindróma) kapcsolódó különbségek molekuláris epidemiológiája" . Az Amerikai Egyesült Államok Nemzeti Tudományos Akadémiájának közleményei . 92. (8): 3586–3590. Bibcode : 1995PNAS ... 92.3586H . doi : 10.1073/pnas.92.8.3586 . PMC 42212 . PMID 7724603 .
- ^ a b c Röhr D, Boon BD, et al. (2020 december). "Az Alzheimer-kór különböző Aβ-plakk-típusainak címke nélküli vibrációs képalkotása a plakkok kialakulásának egymást követő eseményeit tárja fel" . Acta Neuropathologica Communications . 8. (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Haass C; Selkoe DJ (2007). "Oldható fehérje oligomerek a neurodegenerációban: tanulságok az Alzheimer-kór amiloid béta-peptidjéből". Nat Rev Mol Cell Biol . 8 (2): 101–112. doi : 10.1038/nrm2101 . PMID 17245412 . S2CID 32991755 .
- ^ Blocq, Paul; Marinesco, Georges (1892). Sur les lesions et la patogenie de l'epilepsie dite essentielle . 445–6. OCLC 492619936 .
- ^ Buda O; Arsene D; Ceausu M; Dermengiu D; Curca GC (2009. január). "Georges Marinesco és a neuropatológia korai kutatása". Neurológia . 72. (1): 88–91. doi : 10.1212/01.wnl.0000338626.93425.74 . PMID 19122036 . S2CID 45428057 .
- ^ Redlich E (1898). "Ueber miliare Sklerose der Hirnrinde bei seniler Atrophie". Jahrbücher für Psychiatrie und Neurologie . 17 : 208–216.
- ^ a b c Goedert M (2009). "Oskar Fischer és a demencia tanulmányozása" . Agy . 132. (4): 1102–1111. doi : 10.1093/brain/awn256 . PMC 2668940 . PMID 18952676 .
- ^ Alzheimer, A (1907). "Uber einen eigenartige Erkranung der Hirnrinde". Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin . 64 : 146–8.
- ^ Divry P (1927). "Etude histo-chimique des plaques séniles". Journal Belge de Neurologie et de Psychiatrie . 9 : 643–657.
- ^ Buxbaum JN; Linke RP (2012). "Az amiloidózisok molekuláris története". Journal of Molecular Biology . 421 (2–3): 142–159. doi : 10.1016/j.jmb.2012.01.024 . PMID 22321796 .
- ^ Simchowicz T .: Histologische Studien über die senile Demenz. in: Nissl F., Alzheimer A. (Hrsg.): Histologische und histopathologische Arbeiten über die Grosshirnrinde mit besonderer Berücksichtigung der patologischen Anatomie der Geisteskrankheiten . Jena: G. Fischer, 1911, p. 267–444.
- ^ Ohry A; Buda O (2015). "Teofil Simchowicz (1879-1957): a tudós, aki szenilis plakkokat alkotott a neuropatológiában". Romanian Journal of Morphology and Embryology . 56. (4): 1545–1548. PMID 26743308 .
- ^ Grzybowski A; Pieta A; Pugaczewska M (2017). "Teofil Simchowicz (1879-1957)" . Neurológiai folyóirat . 264 (8): 1831–1832. doi : 10.1007/s00415-017-8460-9 . PMC 5533842 . PMID 28315959 .
- ^ Áldott G; Tomlinson BE; Roth M (1968). "Az összefüggés a demencia mennyiségi mérései és az idős alanyok agyi szürkeállományának szenilis változása között". British Journal of Psychiatry . 114 (512): 797–811. doi : 10.1192/bjp.114.512.797 . PMID 5662937 .
- ^ Wisniewski, Henryk M .; Terry, Robert D. (1973). "1. fejezet: A szenilis plakk patogenezisének felülvizsgálata". Zimmerman, HM (szerk.). Haladás a neuropatológiában, 2. kötet . Grune és Stratton. 1–26. ISBN 978-0-808-90775-6.
- ^ Glenner GG; Wong CW (1984). "Alzheimer -kór: kezdeti jelentés egy új cerebrovaszkuláris amiloid fehérje tisztításáról és jellemzéséről". Biokémiai és biofizikai kutatási kommunikáció . 120 (3): 885–890. doi : 10.1016/s0006-291x (84) 80190-4 . PMID 6375662 .
- ^ Glenner GG; Wong CW (1984). "Alzheimer -kór és Down -szindróma: egyedülálló cerebrovaszkuláris amiloid fibrilfehérje megosztása". Biokémiai és biofizikai kutatási kommunikáció . 122 (3): 1131–1135. doi : 10.1016/0006-291x (84) 91209-9 . PMID 6236805 .
- ^ Masters CL; Simms G; Weinman NA; Multhaup G; McDonald BL; Beyreuther K (1985). "Amiloid plakk magfehérje Alzheimer -kórban és Down -szindrómában" . Az Egyesült Államok Nemzeti Tudományos Akadémiájának közleményei . 82 (12): 4245–4249. Bibcode : 1985PNAS ... 82.4245M . doi : 10.1073/pnas.82.12.4245 . PMC 397973 . PMID 3159021 .
- ^ a b c Walsh DM; Selkoe DJ (2020). "Amiloid béta-fehérje és azon túl: az Alzheimer-kór előrehaladásának útja". Aktuális vélemény a neurobiológiáról . 61 : 116–124. doi : 10.1016/j.conb.2020.02.003 . PMID 32197217 . S2CID 214600892 .
- ^ a b c d e f Hosszú JM; Holtzman DM (2019). "Alzheimer -kór: frissítés a patobiológiáról és a kezelési stratégiákról" . Cell . 179. (2): 312–339. doi : 10.1016/j.cell.2019.09.001 . PMC 6778042 . PMID 31564456 .
- ^ Walker LC (2015). "Proteopátiás törzsek és a neurodegeneratív betegségek heterogenitása" . A genetika éves áttekintése . 50 : 329–346. doi : 10.1146/annurev-genet-120215-034943 . PMC 6690197 . PMID 27893962 .
- ^ Selkoe, DJ (1999). "19. fejezet: A β-amiloid prekurzor fehérje biológiája és az Alzheimer-kór mechanizmusa". In Terry, RD; Katzman, R; Bick, KL; Sisodia, SS (szerk.). Alzheimer -kór . Lippincott Williams és Wilkins. 293–310. ISBN 0-7817-1503-2.
- ^ a b c Haass C; Kaether C; Thinakaran G; Sisodia S (2012). "Az APP kereskedelme és proteolitikus feldolgozása" . Hideg tavaszi kikötői kilátások az orvostudományban . 2 (5: a006270): a006270. doi : 10.1101/cshperspect.a006270 . PMC 3331683 . PMID 22553493 .
- ^ Suh YH; Checler F (2002. szeptember). "Amiloid prekurzor fehérje, presenilinek és alfa-sünuklein: molekuláris patogenezis és farmakológiai alkalmazások Alzheimer-kórban". Farmakológiai vélemények . 54 (3): 469–525. doi : 10.1124/pr.54.3.469 . PMID 12223532 . S2CID 86686003 .
- ^ Dunys J; Valverde A; Checler F (2018). "Az N- és C-terminálisan csonka Aβ-fajok kulcsfontosságú kóros kiváltó tényezők az Alzheimer-kórban?" . Journal of Biological Chemistry . 293 (40): 15419–15428. doi : 10.1074/jbc.R118.003999 . PMC 6177599 . PMID 30143530 .
- ^ Kummer képviselő; Heneka MT (2014). "Csonka és módosított amiloid-béta fajok" . Alzheimers -kutatás és terápia . 6. (3): 28. doi : 10.1186/alzrt258 . PMC 4055046 . PMID 25031638 .
- ^ Lamy C, Duyckaerts C, Delaere P, et al. (1989). "Hét festési módszer összehasonlítása szenilis plakkok és neurofibrilláris gubancok esetében egy 15 idős betegből álló prospektív sorozatban". Neuropatológia és alkalmazott neurobiológia . 15 (6): 563–78. doi : 10.1111/j.1365-2990.1989.tb01255.x . PMID 2482455 . S2CID 25220224 .
- ^ Klingstedt T; Nilsson KPR (2012). "Lumineszcens konjugált poli- és oligo-tiofének: optikai ligandumok rengeteg fehérje-aggregátum spektrális hozzárendeléséhez". Biokémiai Tranzakciók . 40. (4): 704-710. doi : 10.1042/BST20120009 . PMID 22817720 .
- ^ Mavrogiorgou P; Gertz HJ; Ferszt R; Wolf R; Bär KJ; Juckel G (2011. december). "Elég jók -e a rutin módszerek a szenilis plakkok és a neurofibrilláris gubancok elszíneződéséhez a demens betegek különböző agyi régióiban?" (PDF) . Pszichiátria Danubina . 23. (4): 334–9. PMID 22075733 . Archiválva az eredetiből (PDF) , 2017-08-11 . Letöltve: 2014-06-22 .
- ^ Braak H; Thal DR; Ghebremedhin E; Del Tredici K (2011). "Az Alzheimer -kór kóros folyamatának szakaszai: 1-100 éves korosztály" . Journal of Neuropathology and Experimental Neurology . 70 (11): 960–969. doi : 10.1097/NEN.0b013e318232a379 . PMID 22002422 .
- ^ Thal DR; Rüb O; Orantes M; Braak H (2002). "Az Abeta-lerakódás fázisai az emberi agyban és relevanciája az AD fejlődésében". Neurológia . 58 (12): 1791–1800. doi : 10.1212/wnl.58.12.1791 . PMID 12084879 . S2CID 41133337 .
- ^ Thal DR; Walter J; Saido TC; Fändrich M (2015). "Az Aβ és aggregátumainak neuropatológiája és biokémiája Alzheimer -kórban" . Acta Neuropathologica . 129. (2): 167–182. doi : 10.1007/s00401-014-1375-y . PMID 25534025 . S2CID 19701015 .
- ^ a b Jucker, M; Walker, LC (2013). "A patogén fehérjeaggregátumok önterjedése neurodegeneratív betegségekben" . Természet . 501 (7465): 45–51. Bibcode : 2013Natur.501 ... 45j . doi : 10.1038/nature12481 . PMC 3963807 . PMID 24005412 .
- ^ Walker LC; Jucker M (2015). "Neurodegeneratív betegségek: a prion fogalom bővítése" . Az idegtudomány éves áttekintése . 38 : 87–103. doi : 10.1146/annurev-neuro-071714-033828 . PMC 4803040 . PMID 25840008 .
- ^ Prusiner SB (1998). "Prions" . Az Egyesült Államok Nemzeti Tudományos Akadémiájának közleményei . 95 (23): 13363-13383. Bibcode : 1998PNAS ... 9513363P . doi : 10.1073/pnas.95.23.13363 . PMC 33918 . PMID 9811807 .
- ^ Eisenberg D; Jucker M (2015). "A fehérjék amiloid állapota emberi betegségekben" . Cell . 148 (6): 1188–1203. doi : 10.1016/j.cell.2012.02.022 . PMC 3353745 . PMID 22424229 .
- ^ Nelson PT, Alafuzoff I, Bigio EH, et al. (2012). "Az Alzheimer -kór neuropatológiai változásainak összefüggése a kognitív állapottal: az irodalom áttekintése" . Journal of Neuropathology and Experimental Neurology . 71 (5): 362–381. doi : 10.1097/NEN.0b013e31825018f7 . PMC 3560290 . PMID 22487856 .
- ^ a b Findeis MA (2007. november). "A 42 -es amiloid -peptid szerepe az Alzheimer -kórban". Farmakológia és terápia . 116. (2): 266–86. doi : 10.1016/j.pharmthera.2007.06.006 . PMID 17716740 .
- ^ Thal DR, Ronisz A, Tousseyn T, et al. (2019). "Az Alzheimer-kórhoz kapcsolódó amiloid β-peptid patológia különböző aspektusai és kapcsolatuk az amiloid pozitron emissziós tomográfiával és a demenciával" . Acta Neuropathologica Communications . 7. (1): 178. doi : 10.1186/s40478-019-0837-9 . PMC 6854805 . PMID 31727169 .
- ^ Mathis CA; Lopresti BJ; Ikonomovic MD; Klunk WE (2017). "Kis molekulájú PET nyomjelzők proteinopátiák képalkotására" . Szemináriumok a nukleáris medicinában . 47 (5): 553–575. doi : 10.1053/j.semnuclmed.2017.06.003 . PMC 5657567 . PMID 28826526 .
- ^ Ritchie C; Smailagic N; Noel-Storr AH; Ukoumunne O; Ladds EC; Martin S (2017). "CSF tau és a CSF tau/ABeta arány az Alzheimer -kór demenciájának és egyéb demenciáinak diagnosztizálásához enyhe kognitív károsodásban (MCI) szenvedő embereknél" . Cochrane Database of Systematic Reviews . 3 (3): CD010803. doi : 10.1002/14651858.CD010803.pub2 . PMC 6464349 . PMID 28328043 .
- ^ Hansson O; Lehmann S; Ottó M; Zetterberg H; Lewczuk P (2019). "A CSF Amyloid béta (Abeta) 42/40 arány alkalmazásának előnyei és hátrányai az Alzheimer -kór diagnosztizálásában" . Alzheimer -kór kutatása és terápiája . 11. (1): 34. doi : 10.1186/s13195-019-0485-0 . PMC 6477717 . PMID 31010420 .
- ^ a b Stam FC; Wigboldus JM; Smeulders AW (1986). "A szenilis agyi amiloidózis életkori előfordulása" (PDF) . Patológia - kutatás és gyakorlat . 181 (5): 558–562. doi : 10.1016/S0344-0338 (86) 80149-2 . PMID 3786248 .
- ^ Franke, M (1976). "Statistische Untersuchungen über die senilen Drusen im menschlichen Gehirn / Thesen" . Berlin, Németország: Neuropathologische Abteilung. Archiválva az eredetiből 2011-07-19.
- ^ a b E fej; Powell D; Arany BT; Schmitt FA (2012). "Alzheimer -kór Down -szindrómában" . European Journal of Neurodegenerative Disease . 1 (3): 353–364. PMC 4184282 . PMID 25285303 .
- ^ Heuer E; Rosen RF; Cintron A; Walker LC (2012). "Az Alzheimer-szerű agyi proteopátia nem humán főemlős modelljei" . A jelenlegi gyógyszerészeti tervezés . 18 (8): 1159–1169. doi : 10.2174/138161212799315885 . PMC 3381739 . PMID 22288403 .
- ^ Walker LC; Jucker M (2017). "Az emberek kivételes sebezhetősége az Alzheimer -kórral szemben" . Trendek a molekuláris orvoslásban . 23 (6): 534–545. doi : 10.1016/j.molmed.2017.04.001 . PMC 5521004 . PMID 28483344 .
- ^ Jucker M (2010). "Az állatmodellek előnyei és korlátai a neurodegeneratív betegségek transzlációs kutatásához". Természetgyógyászat . 16 (11): 1210–1214. doi : 10,1038/nm . 2224 . PMID 21052075 . S2CID 30167302 .
- ^ Myers A; McGonigle P (2010). "Az Alzheimer -kór transzgenikus egérmodelljeinek áttekintése". Aktuális protokollok az idegtudományban . 89 (1: e81): 1210–1214. doi : 10.1002/cpns.81 . PMID 31532917 . S2CID 202024310 .
- ^ Huang Y, Happonen KE (2021. április). "A Microglia TAM receptorokat használ az amiloid β plakkok kimutatására és elnyelésére" . Természetimmunológia . 8. (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Heppner FL; Ransohoff RM; Becher B (2015). "Immunroham: a gyulladás szerepe az Alzheimer -kórban". Nature Reviews Neuroscience . 16 (6): 358–372. doi : 10.1038/nrn3880 . PMID 25991443 . S2CID 6116253 .
- ^ De Strooper B; Karran E (2016). "Az Alzheimer -kór celluláris fázisa" . Cell . 164 (4): 603–615. doi : 10.1016/j.cell.2015.12.056 . PMID 26871627 .
- ^ Killin LOJ; Starr JM; Shiue IJ; Russ TC (2016). "A demencia környezeti kockázati tényezői: szisztematikus felülvizsgálat" . BMC Geriatrics . 16. (1): 175. doi : 10.1186/s12877-016-0342-y . PMC 5059894 . PMID 27729011 .
További irodalom
- Jellinger KA (2005). "Neurodegeneratív erkrankungen (ZNS) - Eine aktuelle Übersicht" (PDF) . Journal für Neurologie, Neurochirurgie und Psychiatrie . 6. (1): 9–18.
- Cruz L, Urbanc B, Buldyrev SV, et al. (1997. július). "A szenilis plakkok aggregációja és szétbontása az Alzheimer -kórban" . Az Amerikai Egyesült Államok Nemzeti Tudományos Akadémiájának közleményei . 94 (14): 7612–6. Bibcode : 1997PNAS ... 94.7612C . doi : 10.1073/pnas.94.14.7612 . PMC 23870 . PMID 9207140 .