Áramlási citometria - Flow cytometry
 Áramlási citométer cső szívószállal
| |
| Osztályozás | Citometria |
|---|---|
| Elemzők | Sejtek vagy részecskék |
| Más technikák | |
| Összefüggő | Csoroszlyaszámláló |
Az áramlási citometria (FC) egy olyan módszer, amelyet a sejtek vagy részecskék populációjának fizikai és kémiai jellemzőinek kimutatására és mérésére használnak .
Ebben a folyamatban a sejteket vagy részecskéket tartalmazó mintát folyadékban szuszpendálják, és az áramlási citométer műszerbe fecskendezik. A minta arra összpontosít, hogy ideális esetben egy -egy cellát áramoljon át egy lézersugáron, ahol a szórt fény jellemző a sejtekre és azok összetevőire. A sejteket gyakran fluoreszkáló markerekkel jelzik, így a fény elnyelődik, majd hullámhosszú sávban bocsát ki. Több tízezer cella gyorsan megvizsgálható, és az összegyűjtött adatokat számítógép dolgozza fel.
Az áramlási citometriát rendszeresen használják az alapkutatásban, a klinikai gyakorlatban és a klinikai vizsgálatokban . Az áramlási citometria felhasználási területei a következők:
- Sejtszámlálás
- Sejtválogatás
- A sejtek jellemzőinek és működésének meghatározása
- Mikroorganizmusok kimutatása
- Biomarker érzékelés
- Fehérje mérnöki észlelés
- Egészségügyi rendellenességek, például vérrák diagnosztizálása
Az áramlási citometriai elemző olyan eszköz, amely számszerűsíthető adatokat szolgáltat a mintából. Az áramlási citometriát használó egyéb műszerek közé tartoznak a sejtszortírozók, amelyek fizikailag szétválasztják és ezáltal tisztítják az érdeklődő sejteket optikai tulajdonságaik alapján.
Történelem
Az első impedanciaalapú áramlási citometriás eszközt Coulter elvét alkalmazva ismertették az 1953 -ban kiadott 2 656 508 számú amerikai egyesült államokbeli szabadalmi leírásban, Wallace H. Coulter számára . Mack Fulwyler volt a mai áramlási citométerek - különösen a sejtválogatók - előfutára. Fulwyler ezt 1965 -ben fejlesztette ki a Science című publikációjával . Az első fluoreszcencia-alapú áramlási citometriai eszközt (ICP 11) 1968-ban fejlesztette ki Wolfgang Göhde a Münsteri Egyetemről , amelyet 1968. december 18-án nyújtottak be szabadalomra, és először 1968/69-ben kereskedelmi forgalomba hozta a német fejlesztő és gyártó Partec a göttingeni Phywe AG-n keresztül . Abban az időben más tudósok még mindig széles körben kedvelték az abszorpciós módszereket a fluoreszcens módszerekkel szemben. Nem sokkal később áramlási citometriai műszereket fejlesztettek ki, beleértve a Cytofluorograph-ot (1971) a Bio/Physics Systems Inc.-től (később: Ortho Diagnostics), a PAS 8000-et (1973) a Partec-től, az első FACS (fluoreszcenciával aktivált sejtválogató) műszert. Becton Dickinson (1974), az ICP 22 (1975) a Partec/Phywe -től és az Epics Coulter -től (1977/78). Az első címke nélküli nagyfrekvenciás impedanciájú áramlási citométert , amely szabadalmaztatott mikrofluidikus "lab-on-chip" -en, az Ampha Z30-on alapult, Amphasys (2012) mutatta be.
A technológia neve
A fluoreszcencia-alapú áramlási citometria-technológia eredeti neve "impulzus-citofotometria" ( németül : Impulszytophotometrie ) volt, amely a fluoreszcencia-alapú áramlási citometriára vonatkozó első szabadalmi bejelentésen alapult. Az Amerikai Mérnöki Alapítvány ötödik konferenciáján az automatizált citológiáról Pensacola -ban (Florida) 1976 -ban - nyolc évvel az első fluoreszcencia -alapú áramlási citométer bevezetése után (1968) - megállapodtak az "áramlási citometria" elnevezés általános használatáról. ami gyorsan népszerűvé vált.
Áramlási citométerek
A modern áramlási citométerek másodpercenként sok ezer részecskét képesek elemezni "valós időben", és ha sejtválogatóként vannak konfigurálva, akkor hasonló sebességgel képesek aktívan szétválasztani és elkülöníteni a meghatározott optikai tulajdonságokkal rendelkező részecskéket. Az áramlási citométer hasonlít a mikroszkóphoz , azzal a különbséggel, hogy a sejt képének előállítása helyett az áramlási citometria nagy teljesítményű, automatizált számszerűsítést kínál a meghatározott optikai paraméterekről cellánként. A szilárd szövetek elemzéséhez először egysejtű szuszpenziót kell elkészíteni.
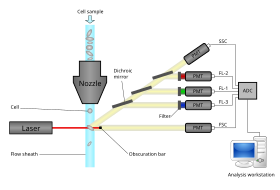
Az áramlási citométer öt fő alkotóelemből áll: áramlási cella, mérőrendszer, detektor, erősítőrendszer és számítógép a jelek elemzésére. Az áramlási cella folyadékárammal (hüvelyfolyadék) rendelkezik, amely hordozza és igazítja a cellákat úgy, hogy egyetlen reszelőt engedjenek át a fénysugáron az érzékelés érdekében. A mérőrendszer általában impedancia (vagy vezetőképesség) és optikai rendszerek - lámpák ( higany , xenon ) mérését használja ; nagy teljesítményű vízhűtéses lézerek ( argon , kripton , festéklézer); kis teljesítményű léghűtéses lézerek (argon (488 nm), vörös-HeNe (633 nm), zöld-HeNe, HeCd (UV)); dióda lézerek (kék, zöld, piros, lila) fényjeleket eredményeznek. Az érzékelő és analóg-digitális átalakító (ADC) rendszer az előre szórt fény (FSC) és az oldalsó szórt fény (SSC) analóg méréseit, valamint a festékspecifikus fluoreszcencia jeleket digitális jelekké alakítja, amelyeket számítógép képes feldolgozni . Az erősítőrendszer lehet lineáris vagy logaritmikus .
Az adatgyűjtés folyamatát a mintákból az áramlási citométer segítségével "gyűjtésnek" nevezik. Az akvizíciót az áramlási citométerhez fizikailag csatlakoztatott számítógép, valamint a digitális interfészt a citométerrel kezelő szoftver közvetíti. A szoftver képes a vizsgált minta paramétereinek (pl. Feszültség, kompenzáció) beállítására, és segít a kezdeti mintainformációk megjelenítésében, miközben mintaadatokat gyűjt, hogy biztosítsa a paraméterek helyes beállítását. A korai áramlási citométerek általában kísérleti eszközök voltak, de a technológiai fejlődés lehetővé tette széles körű alkalmazásokat mind klinikai, mind kutatási célokra. E fejlesztéseknek köszönhetően jelentős piacot fejlesztettek ki a műszerek, az elemző szoftverek, valamint a beszerzéshez használt reagensek, például a fluoreszkálóan jelzett antitestek számára.
A modern műszerek általában több lézerrel és fluoreszcencia -érzékelővel rendelkeznek. A kereskedelmi műszerek jelenlegi rekordja tíz lézer és 30 fluoreszcens detektor. A lézerek és detektorok számának növelése lehetővé teszi az antitestek többszörös jelölését, és pontosabban azonosítani tudja a célpopulációt fenotípusos markereik alapján. Bizonyos műszerek akár digitális képeket is készíthetnek az egyes sejtekről, lehetővé téve a fluoreszkáló jel elhelyezkedésének elemzését a sejteken belül vagy azok felületén.
Hardver
Áramlási citométer folyadékrendszer
A sejteknek egyenletesen kell áthaladniuk a fókuszált lézersugarak közepén, hogy pontosan mérjék a sejtek optikai tulajdonságait bármely áramlási citométerben. A folyadékrendszer célja, hogy egyenként mozgassa a sejteket a lézersugáron és a műszer egészében. A sejtválogatási képességekkel rendelkező áramlási citométerben lévő folyadékok szintén a folyamot használják a rendezett sejtek gyűjtőcsövekbe vagy lyukakba történő szállítására.
Hidrodinamikai fókuszálás
A sejtek pontos pozicionálásához folyadéksugárban a legtöbb citométerben hidrodinamikai fókuszálást alkalmaznak. A szuszpenzióban lévő sejtek egy külső burokfolyadékkal bezárt műszerbe kerülnek. A minta magját a hüvelyfolyadék közepén tartják. A mintabeviteli sebességet vagy azt, hogy a sejtek milyen gyorsan áramlanak át a lézeres lekérdezéshez, a burkolati folyadék nyomása a minta magjára szabályozhatja. Optimális körülmények között a központi folyadékáram és a hüvelyfolyadék nem keveredik.
Akusztikus hidrodinamikai fókuszálás
Néhány áramlási citométerben akusztikus fókuszálási technológiát alkalmaznak a hidrodinamikai fókuszálás támogatására. Akusztikus hullámok (> 2 MHz) előfókuszálják a mintát a hüvelyfolyadékba való bevezetés előtt. Az előre fókuszált mintát ezután injektálják a hidrodinamikai magba, és átfolyják a műszeren. Ez segíthet az adatok pontosságának növelésében magas mintabeviteli sebesség mellett.
Optika és elektronika
Optikai szűrők
A fluoroforokból kibocsátott fény hullámhossz -spektrumban van, ezért több fluorofor kombinálása átfedést okozhat. A specifikusság növelése érdekében optikai szűrőket és dikroikus tükröket használnak a fény szűrésére és áthelyezésére az érzékelőkbe, például fotomulti -szorzó csövekbe (PMT -k) vagy lavina -fotodiodákba (APD). Az optikai szűrőket sávos (BP), hosszú (LP) vagy rövid (SP) szűrőként tervezték. A legtöbb áramlási citométer dikroikus tükröket és sávszűrőket használ az optikai spektrum bizonyos sávjainak kiválasztására.
Prizmák, rácsok és spektrális áramlási citometria
A spektrális áramlási citometria prizmákat vagy diffrakciós rácsokat használ a marker által kibocsátott fény eloszlatására az érzékelő tömbön. Ez lehetővé teszi az egyes részecskék teljes spektrumának mérését. Az egyes sejtekből származó mért spektrumokat ezt követően összekeverjük az összes használt festék referencia spektrumának és az autofluoreszcens spektrumnak a felhasználásával. Ez lehetővé teheti a panel szélesebb kialakítását és új biológiai markerek alkalmazását.
Képáramlás áramlási citometria
A képalkotó áramlási citometria (IFC) többcsatornás képeket készít a sejtekről. A képalkotó platformokon használt érzékelőket fel lehet szerelni töltéssel csatolt eszközzel (CCD) vagy kiegészítő fém-oxid-félvezetővel (CMOS) az egyes cellák képeinek rögzítéséhez.
Adatelemzés
Kártérítés
Minden fluorokróm széles fluoreszcencia spektrummal rendelkezik. Egynél több fluorokróm használata esetén előfordulhat, hogy átfedés van a fluorokrómok között. Ezt a helyzetet spektrumátfedésnek nevezik. Ezt a helyzetet le kell küzdeni. Például a FITC és a PE emissziós spektruma az, hogy a fluoreszcein által kibocsátott fény átfedi ugyanazt a hullámhosszat, mint ahogy áthalad a PE -hez használt szűrőn. Ezt a spektrális átfedést úgy korrigálják, hogy eltávolítják a FITC jel egy részét a PE jelekből, vagy fordítva. Ezt a folyamatot színkompenzációnak nevezik, amely kiszámítja a fluorokróm százalékát, hogy megmérje magát.
A kompenzáció az a matematikai folyamat, amellyel a többparaméteres áramlási citometriai adatok spektrális átfedését korrigálják. Mivel a fluorokrómok széles spektrumúak lehetnek, átfedhetik egymást, ami az adatok elemzése során a zűrzavar nemkívánatos eredményét okozza. Ezt az átfedést, amelyet átszórás néven ismernek, és amelyet az áteresztési együtthatóban számszerűsítenek, általában egy bizonyos fluorokróm detektorjai okozzák, amelyek jelentős hullámhosszú csúcsot mérnek egy másik fluorokrómból. A korrekcióhoz leggyakrabban lineáris algebrát használnak.
Általánosságban elmondható, hogy egy vagy több paraméter grafikonjainak megjelenítésekor azt kell megmutatni, hogy a többi paraméter nem járul hozzá a megjelenített eloszláshoz. Ez a probléma különösen súlyos, ha több mint kétszeres paramétereket használ. Jelenleg nem találtak eszközöket a többdimenziós paraméterek hatékony megjelenítésére. A kompenzáció nagyon fontos a sejtek közötti különbség meglátásához.
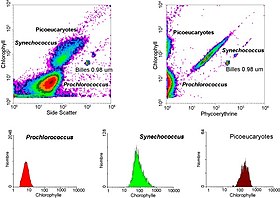
Gating
Az áramlási citométerek által generált adatok ábrázolhatók egyetlen dimenzióban , hisztogram előállításához , vagy kétdimenziós pontrajzokban, vagy akár három dimenzióban is. Ezeken a parcellákon lévő régiók a fluoreszcencia intenzitása alapján szekvenciálisan elválaszthatók egy részhalmazkivonás sorozatának, "kapuknak" létrehozásával. Speciális kapuzási protokollok léteznek diagnosztikai és klinikai célokra, különösen a hematológiával kapcsolatban . Az egyes egyes sejteket gyakran megkülönböztetik a sejtdublettektől vagy magasabb aggregátumoktól a "repülési idő" (amelyet "impulzusszélességnek" is neveznek) a szűkre fókuszált lézersugáron keresztül
A diagramok gyakran logaritmikus skálákon készülnek. Mivel a különböző fluoreszkáló festékek emissziós spektrumai átfedésben vannak, az érzékelők jeleit elektronikusan és számítással is kompenzálni kell. Az áramlási citométerrel összegyűjtött adatok szoftverrel elemezhetők. Az adatok összegyűjtése után nincs szükség az áramlási citométerrel való kapcsolattartásra, és az elemzést leggyakrabban külön számítógépen végzik. Ez különösen szükséges azokban az alapvető létesítményekben, ahol e gépek használata nagy igényű.
Számítási elemzés
A számítástechnikai módszerekkel végzett automatizált népesség -azonosítás terén elért haladás alternatívát kínál a hagyományos kapuzási stratégiákhoz. Az automatizált azonosító rendszerek potenciálisan segíthetnek a ritka és rejtett populációk felfedezésében. A reprezentatív automatizált módszerek közé tartozik a FLOCK az Immunology Database and Analysis Portal (ImmPort), a SamSPECTRAL és a flowClust a Bioconductorban , és a FLAME a GenePatternben . A T-elosztott sztochasztikus szomszédbeágyazás (tSNE) egy algoritmus, amely dimenziócsökkentést hajt végre, lehetővé téve a komplex többdimenziós adatok megjelenítését kétdimenziós "térképen". A közös erőfeszítések eredményeként létrejött a FlowCAP (Flow Cytometry: Critical Assessment of Population Identification Methods) elnevezésű nyílt projekt, amelynek célja objektív módon összehasonlítani és értékelni az áramlási citometriás adatok csoportosítási módszereit, valamint útmutatást adni ezek megfelelő használatáról és alkalmazásáról. mód.
FMO vezérlők
A fluoreszcencia mínusz egy (FMO) vezérlőelemek fontosak az adatok értelmezéséhez többszínű panelek építésekor - amikor egy sejtet egyszerre több fluorokrómmal festenek meg. Az FMO vezérlők a fluoreszcencia átterjedésének mértékét biztosítják egy adott csatornában, és lehetővé teszik a kompenzációt. Az FMO -kontroll létrehozásához a mintát minden fluorokrómmal megfestik, kivéve a vizsgálandóat - vagyis ha 4 különböző fluorokrómot használ, akkor az FMO -kontroll csak 3 -at tartalmazhat (például: fluorokróm - A, B, C, D; FMO -k - ABC_, AB_D, A_CD, _BCD).
Sejtválogatás áramlási citometriával
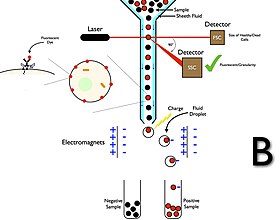
A sejtválogatás egy módszer a sejtpopulációk megtisztítására specifikus fizikai jellemzők jelenléte vagy hiánya alapján. A rendezési lehetőségekkel rendelkező áramlási citométerekben a műszer a sejteket olyan paraméterek segítségével észleli, mint a sejtek mérete, morfológiája és fehérje expressziója, majd csepptechnológiával rendezi a sejteket és visszanyeri az alhalmazokat kísérleti használatra.
Az első prototípus -válogató 1965 -ben , a Los Alamos Nemzeti Laboratóriumban (LANL) épült Mack J. Fulwyler fizikus által, a Coulter hangerőszenzorral az újonnan feltalált tintasugaras nyomtatóval. Az élősejt-válogatót vagy a fluoreszcenciával aktivált sejtválogatót (FACS) Len Herzenberg állította elő , aki 2006-ban elnyerte a kiotói díjat kiemelkedő munkájáért.
Az áramlási citometriás sejtválogatók gyűjtőrendszerrel rendelkeznek, ellentétben az áramlási citometriai elemzőkkel. A gyűjtési folyamat akkor kezdődik, amikor egy mintát fecskendeznek a hüvelyfolyadék -áramba, amely áthalad az áramlási cellán és a lézer elfogja. A patak ezután egy vibráló fúvókán keresztül viszi a sejtet, amely cseppecskéket generál, a legtöbb pedig egy sejtet vagy semmiféle cellát tartalmaz. Az elektromos töltőgyűrűt éppen azon a helyen helyezik el, ahol az áram cseppekre törik, és a gyűrűre töltést helyeznek közvetlenül a fluoreszcencia intenzitásának mérése előtt; az ellenkező töltés csapdába esik a cseppen, amikor az az áramból elszakad, és a cseppek ezért feltöltődnek. A feltöltött cseppek ezután elektrosztatikus eltérítő rendszeren esnek át, amely töltésük alapján a cseppeket tartályokba tereli. Egyes rendszerekben a töltés közvetlenül a folyamra kerül, és a csepp letörése ugyanazt a jelet tartja, mint a folyam. A csepp leválása után az áramot semlegesre állítják vissza. A gyűjtés után ezeket a sejteket tovább lehet tenyészteni, manipulálni és tanulmányozni.
Címkék

Az áramlási citometria a sejtekből vagy részecskékből szétszórt fénytulajdonságokat használja a fizikai tulajdonságok azonosítására vagy mennyiségi mérésére. Címkék, festékek és foltok használhatók többparaméteres elemzéshez (értse meg a sejt további tulajdonságait). Az immunofenotipizálás a sejtek heterogén populációinak elemzése jelzett antitestek és más fluorofórt tartalmazó reagensek, például festékek és festékek felhasználásával.
Fluoreszkáló címkék
A fluoroforok széles választéka használható címkékként az áramlási citometriában. A fluoroforok, vagy egyszerűen "fluorok", tipikusan olyan antitesthez kapcsolódnak, amely felismeri a céltárgyat a sejtben vagy a sejtben; a sejtmembránhoz vagy más sejtszerkezethez affinitással rendelkező kémiai egységhez is kapcsolódhatnak . Minden fluorofornak van egy jellegzetes gerjesztési csúcsa és emissziós hullámhossza, és az emissziós spektrumok gyakran átfedik egymást. Következésképpen a használható címkék kombinációja a fluorokrómok gerjesztésére használt lámpa (k) vagy lézer (ek) hullámhosszától és a rendelkezésre álló detektoroktól függ. A megkülönböztethető fluoreszkáló címkék maximális száma 17 vagy 18, és ez a komplexitási szint fáradságos optimalizálást tesz szükségessé a műtermékek korlátozása érdekében, valamint bonyolult dekonvolúciós algoritmusokat az átfedő spektrumok elkülönítésére. Az áramlási citometria mennyiségi eszközként fluoreszcenciát használ; az áramlási citometria legnagyobb érzékenységét más fluoreszcens detektáló platformok, mint például a konfokális mikroszkópia, páratlanok . Az abszolút fluoreszcencia érzékenység általában alacsonyabb a konfokális mikroszkópiában, mivel a fókuszon kívüli jeleket a konfokális optikai rendszer elutasítja, és mivel a kép sorozatonként épül fel az egyes mérésekből a sejt minden pontján, csökkentve a jelgyűjtésre rendelkezésre álló időt .
Kvantumpontok
A kvantumpontokat néha a hagyományos fluoroforok helyett használják szűkebb kibocsátási csúcsuk miatt.
Izotóp címkézés
A tömegcitometria legyőzi a fluoreszcens jelölési határt az antitestekhez kapcsolódó lantanid izotópok felhasználásával . Ez a módszer elméletileg lehetővé tenné 40-60 megkülönböztethető címke használatát, és 30 címke esetében bizonyították. A tömegcitometria alapvetően különbözik az áramlási citometriától: a sejteket plazmába vezetik , ionizálják, és a kapcsolódó izotópokat mennyiségileg meghatározzák a repülési idő tömegspektrometriájával . Bár ez a módszer lehetővé teszi nagyszámú címke használatát, jelenleg alacsonyabb az átviteli kapacitása, mint az áramlási citometria. Ezenkívül elpusztítja az elemzett sejteket, kizárva azok rendezéssel történő helyreállítását.
Citometrikus gyöngytömb
Az egyes sejtek fluoreszcens antitestekkel történő megjelölésének és azonosításának képessége mellett a celluláris termékek, például citokinek, fehérjék és egyéb tényezők is mérhetők. Az ELISA szendvicsvizsgálatokhoz hasonlóan a citometrikus gyöngytömb ( CBA ) vizsgálatok több gyöngypopulációt használnak, amelyek jellemzően méret és differenciált fluoreszcencia -intenzitás szerint differenciáltak, hogy több vizsgálatot végezzenek el egyetlen vizsgálatban. A befogott analit mennyiségét a fehérje másodlagos epitópja elleni biotinilezett antitesten keresztül detektáljuk, majd sztreptavidin-R-fikoeritrin-kezelést követünk. Az R-fikoeritrin fluoreszkáló intenzitását a gyöngyökön 488 nm-es gerjesztőforrással ellátott áramlási citométeren számszerűsítik. Az érdeklődésre számot tartó fehérje koncentrációját a mintákban úgy kaphatjuk meg, hogy összehasonlítjuk a fluoreszcens jeleket az analit ismert koncentrációjának sorozatos hígításából származó standard görbével. Általában citokingyöngy -tömbnek (CBA) is nevezik.
Impedancia áramlási citometria
Az impedancia alapú egycellás elemző rendszereket Coulter számlálóként ismerik . Jól bevált módszert képviselnek gyakorlatilag bármilyen sejt és részecske számlálására és méretezésére. A címke nélküli technológiát a közelmúltban továbbfejlesztették a " lab-on-a-chip " alapú megközelítéssel, és a nagyfrekvenciás váltakozó áram (AC) alkalmazásával a rádiófrekvencia tartományban (100 kHz és 30 MHz között) a statikus közvetlen helyett áram (DC) vagy alacsony frekvenciájú váltakozó áramú mező. Ez a szabadalmaztatott technológia lehetővé teszi a rendkívül pontos cellaelemzést, és további információkat nyújt, mint például a membrán kapacitása és életképessége . A viszonylag kis méret és robusztusság lehetővé teszi az akkumulátoros helyszíni használatot terepen.
Mérhető paraméterek
- Apoptózis (számszerűsítés, DNS -degradáció mérése, mitokondriális membránpotenciál, permeabilitási változások, kaszpáz aktivitás)
- Sejttapadás (például kórokozó-gazdasejt tapadás)
- Cell pigmentek , mint például a klorofill vagy fikoeritrinnel
- Sejtfelszíni antigének ( differenciálódási klaszter (CD) markerek)
- A sejtek életképessége
- Keringő tumorsejtek : izolálás és tisztítás
- A multirezisztencia (MDR) jellemzése a rákos sejtekben
- Kromoszóma -elemzés és válogatás (könyvtárépítés, kromoszómafesték)
- DNS- másolatszám variáció ( Flow-FISH vagy BACs-on-Beads technológiával)
- Enzimatikus tevékenység
- Glutation
- Intracelluláris antigének (különböző citokinek , másodlagos közvetítők stb.)
- Membrán folyékonyság
- A sejtek elektropermeabilizációjának ellenőrzése
- Nukleáris antigének
- Oxidatív kitörés
- pH , intracelluláris ionizált kalcium , magnézium , membránpotenciál
- Fehérje expresszió és lokalizáció
- Fehérje módosítások, foszfo-fehérjék
- A fényszórással mérhető a sejtek vagy más részecskék térfogata ( előre szórással ) és morfológiai összetettsége (oldalsó szórás mellett), még azok is, amelyek nem fluoreszkálóak. Ezeket hagyományosan FSC, illetve SSC rövidítésként használják.
- Teljes DNS -tartalom ( sejtciklus -elemzés , sejtkinetika , proliferáció , ploidia , aneuploidia , endoreduplikáció stb.)
- Teljes RNS -tartalom
- Transzgenikus termékek in vivo , különösen a zöld fluoreszcens fehérje vagy rokon fluoreszkáló fehérjék
- Különféle kombinációk (DNS/felületi antigének stb.)
Alkalmazások
A technológia számos területen alkalmazható, beleértve a molekuláris biológiát , a patológiát , az immunológiát , a virológiát, a növénybiológiát és a tengerbiológiát . Széles körben alkalmazzák az orvostudományban, különösen a transzplantációban, a hematológiában, a tumorimmunológiában és a kemoterápiában, a prenatális diagnózisban, a genetikában és a spermiumok szelektálásában a nemi előválasztáshoz . Az áramlási citometriát széles körben alkalmazzák a hím termékenységi vizsgálatokban a DNS -fragmentációhoz kapcsolódó spermasejtek rendellenességének kimutatására. Ezenkívül széles körben használják a DNS -károsodás , a kaszpázhasítás és az apoptózis kimutatására irányuló kutatásokban . A fotoakusztikus áramlási citometriát a több gyógyszerrel szemben rezisztens baktériumok (leggyakrabban MRSA) vizsgálatára használják a festett bakteriofágokkal jelölt vérben található baktériumok kimutatására, megkülönböztetésére és számszerűsítésére. Az idegtudományban a sejtfelszín és az intracelluláris antigének együttes expressziója is elemezhető. A mikrobiológiában felhasználható a GFP-kódoló transzpozonnal (TnMHA) felépített transzpozon mutáns könyvtárak szűrésére és rendezésére, vagy az életképesség felmérésére. A fehérjegyártásban az áramlási citometriát élesztő kijelzővel és bakteriális kijelzővel együtt alkalmazzák a kívánt tulajdonságokkal rendelkező sejtfelszínen megjelenített fehérjevariánsok azonosítására. Az áramlási citometria fő előnyei a szövettanhoz és az IHC-hez képest az antigének mennyiségének pontos mérésének lehetősége és az egyes sejtek több antitest-fluorofórral történő festésének lehetősége, a jelenlegi laboratóriumokban körülbelül 10 antitest köthető minden sejthez. Ez sokkal kevesebb, mint a tömegcitométer, ahol jelenleg akár 40 is mérhető, de magasabb áron és lassabb ütemben.
Vízi kutatások
Vízi rendszerekben az áramlási citometriát autofluoreszkáló sejtek vagy olyan sejtek elemzésére használják, amelyek fluoreszkálóan vannak megjelölve hozzáadott foltokkal. Ez a kutatás 1981 -ben kezdődött, amikor Clarice Yentsch áramlási citometriával mérte a fluoreszcenciát egy vörös dagályt termelő dinoflagellate -ben. A következő évben a kutatók több algafaj áramlási citometriai mérését tették közzé, amelyeket fluoreszcens tulajdonságaik alapján meg lehetett különböztetni. 1983-ra a tengeri kutatók összeszerelték saját áramláscitométereiket, vagy kereskedelmi forgalomban kapható áramlási citométereket használtak a Bermuda-partról gyűjtött tengervízmintákon annak bizonyítására, hogy a fitoplankton sejteket meg lehet különböztetni az élő anyagtól, és hogy a cianobaktériumokat vegyes közösségből lehet válogatni, majd tenyészteni a labor. Az áramlási citometria lehetővé tette a tengeri kutatók számára, hogy különbséget tegyenek a halványan fluoreszkáló Prochlorococcus és a heterotróf mikroorganizmusok között, ami nehéz megkülönböztetni a mikroszkópián alapuló értékelésekkel. A technológia fejlődése lehetővé teszi, hogy a vízi tudósok folyamatosan használhassák az áramlási citométereket a kutatóút során, és az áramlási citométereket az egyes fitoplankton sejtek képeinek készítésére használják. Tengeri tudósok az áramlási citométerek válogatási képességét használják a sejtek aktivitásának és sokféleségének diszkrét mérésére, a közeli élő mikroorganizmusok közötti kölcsönös kapcsolatok vizsgálatára, valamint az óceánban zajló folyamatok biogeokémiai arányának mérésére.
Sejtproliferációs vizsgálat
A sejtek szaporodása az immunrendszer fő funkciója. Gyakran szükséges a sejtek proliferációs jellegének elemzése bizonyos következtetések levonásához. Az egyik ilyen vizsgálat a sejtproliferáció meghatározására a nyomkövető festék karboxi -fluorescein -diacetát -szukcinimidil -észter (CFSE). Segít a proliferációs sejtek megfigyelésében. Ez a vizsgálat mennyiségi és minőségi adatokat is ad az idősoros kísérletek során. Ez a festék kovalensen kötődik a sejtben lévő hosszú életű molekulákhoz. Amikor a sejtek osztódnak, a molekulák is osztódnak, és a leánysejtek fele festékkel rendelkeznek, mint az anyapopuláció. Ez az intenzitáscsökkenés áramlási citometriával látható. Az irodalomban ezt az erőteljes áramlási citometriai és CFSE technikát használták a T-sejtek hatékonyságának megállapítására a célsejtek elpusztításában rák, például leukémia esetén. A célsejt gyors és lassú halálának vizualizálása érdekében a tudósok CFSE jelölést alkalmaztak bizonyos típusú sejtek antitestfestésével és fluoreszkálóan jelzett mikrogyöngyökkel. Ez is információt adott a célsejtek proliferációjáról bizonyos citokinek kezelése során.
Lásd még
- Az annexin A5 affinitásvizsgálat , az apoptózis alatt álló sejtek tesztje, gyakran áramlási citometriát alkalmaz
- Sejtciklus elemzés
- Csoroszlyaszámláló
- Citometria
- Dielektroforézis
- Áramlási citometria szabvány
- Tömeges citometria
- Mikrofluorimetria
- Életképességi vizsgálat
Megjegyzések
Hivatkozások
További irodalom
- Carey JL, McCoy Jr JP, Keren DF (2007). Áramlási citometria a klinikai diagnózisban (4. kiadás). Chicago, IL: American Society for Clinical Pathology (ASCP) Press. ISBN 978-0-89189-548-0.
- Darzynkiewicz Z, Roederer M, Tanke HJ, szerk. (2004). Sejtbiológiai módszerek, citometria . 75 (4. kiadás). Elsevier /Academic Press. ISBN 0-12-480283-4.
- Darzynkiewicz Z, Robinson JP, Roederer M (2009). Alapvető citometriai módszerek (1. kiadás). Amszterdam: Elsevier/Academic Press. ISBN 978-0-12-375045-7.
- Darzynkiewicz Z, et al., Szerk. (2011). A citometria legújabb eredményei. A rész . A sejtbiológia módszerei. 102 . Elsevier/Academic Press. ISBN 978-0-12-374912-3.
- Darzynkiewicz Z, et al., Szerk. (2011). A citometria legújabb eredményei. B rész . A sejtbiológia módszerei. 103 . Elsevier/Academic Press. ISBN 978-0-12-385493-3.
- Lloyd D (1993). Áramlási citometria a mikrobiológiában . London: Springer-Verlag. ISBN 978-3-540-19796-6.
- Ormerod MG (1999). Áramlási citometria (2. kiadás). Oxford, Egyesült Királyság: Bios Scientific Publishers. ISBN 978-1-85996-107-0.
- Ormerod MG, szerk. (2000). Áramlási citometria: gyakorlati megközelítés (3. kiadás). Oxford [Anglia]: Oxford University Press. ISBN 978-0-19-963824-6.
- Ormerod MG (2008). Áramlási citometria: alapvető bevezetés . Redhill: MG Ormerod. ISBN 978-0-9559812-0-3.
- Robinson JP és mtsai. (1993). Az áramlási citometriai módszerek kézikönyve . New York: Wiley-Liss. ISBN 978-0-471-59634-9.
- Shapiro HM (2003). Gyakorlati áramlási citometria (4. kiadás). New York: Wiley-Liss. ISBN 978-0-471-41125-3.
- Sklar LA (2005). Áramlási citometria a biotechnológiához . New York: Oxford University Press. ISBN 978-0-19-515234-0.
Külső linkek
|
Könyvtári források az áramlási citometriáról |
-
 A Wikimedia Commons Flow citometriájához kapcsolódó média
A Wikimedia Commons Flow citometriájához kapcsolódó média - Áramlás+citometria az Egyesült Államok Országos Orvostudományi Könyvtárában orvosi tantárgyi címek (MeSH)