Mielin oligodendrocita glikoprotein - Myelin oligodendrocyte glycoprotein
Mielin oligodendrocita glikoprotein ( MOG ) egy glikoprotein tartják, hogy fontosak a mielinizáció a idegek a központi idegrendszer (CNS). Emberben ezt a fehérjét a MOG gén kódolja . Úgy gondolják, hogy szükséges "adhéziós molekulaként" szolgál a mielinhüvely szerkezeti integritásának biztosításához, és ismert, hogy későn fejlődik az oligodendrocitákon .
Molekuláris funkció
Míg a MOG elsődleges molekuláris funkciója még nem ismert, valószínű szerepe a mielinhüvelyben vagy a burok "befejezésében és/vagy karbantartásában". Pontosabban, a MOG feltételezések szerint "szükséges", mint "tapadási molekula" a központi idegrendszer mielinhüvelyén, hogy biztosítsa a mielinhüvely szerkezeti integritását. "
Kimutatták, hogy a MOG cDNS -kódoló régiója emberben "erősen homológ" a patkányokkal, egerekkel és szarvasmarhákkal szemben, és ezért nagyon konzervált. Ez arra utal, hogy "ennek a fehérjének fontos biológiai szerepe van".
Fiziológia
A MOG génjét, amely a 6. kromoszómán található, a p21.3-p22, először 1995-ben szekvenálták. Ez egy transzmembrán fehérje, amely az oligodendrocita sejtek felszínén és a mielinhüvelyek legkülső felületén expresszálódik . "A MOG mennyiségileg kismértékű I. típusú transzmembrán fehérje, és kizárólag a központi idegrendszerben található meg." Egyetlen Ig-domén van kitéve az extracelluláris térnek ", következésképpen lehetővé teszi az autoantitestek könnyű hozzáférését. És ezért könnyen hozzáférhetőek az autoantitestek számára. A MOG" elsődleges nukleáris transzkriptum ... van 15.561 nukleotid hosszúságú „és, az emberre, nyolc exont , amelyeket»elválasztott hét intronok «. A intronokat»tartalmaznak számos reptitive [ sic ] DNS«szekvenciák, amelyek között” 14 Alu-en belüli szekvenciák 3 intronok ", és tartományuk 242 és 6484 bp között változik.
Szerkezet
Alternatívaként a MOG gén humán mRNS -ből összeillesztve legalább kilenc izoformát képez.
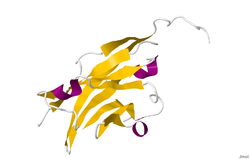
A mielin oligodendrocita glikoprotein kristályszerkezetét röntgendiffrakcióval határoztuk meg 1,45 Angstrom felbontásban, norvég patkányból származó fehérje felhasználásával. Ez a fehérje 139 maradék hosszú, és az immunglobulin szupercsalád tagja. A fehérje dssp másodlagos szerkezete 6% spirális és 43% béta lap: három rövid spirális szegmens és tíz béta szál van. A béta szálak két párhuzamos anti-béta lapban vannak, amelyek immunglobulin-szerű béta-szendvics redőt képeznek. A fehérje szerkezetének számos jellemzője azt sugallja, hogy a MOG "ragasztóként" játszik szerepet a mielinhüvely kitöltésében és/vagy tömörítésében. Van egy "jelentős csík" az elektronegatív töltésből, amely az N-terminál közelében kezdődik, és körülbelül a molekula felének fut. Ezenkívül kimutatták, hogy a MOG oldatban dimerizálódik, és az alak komplementaritási index magas a dimer interfészen, ami "biológiailag releváns MOG dimerre" utal.
Szintézis
Fejlődés szempontjából a MOG "nagyon későn képződik az oligodendrocitákon és a mielinhüvelyen".
Szerep a betegségben
Nem gyulladásos demielinizáló betegségek
A MOG iránti érdeklődés középpontjában a demielinizáló betegségekben betöltött szerepe áll . Néhányuk nem gyulladásos, mint például az adrenoleukodystrophia , az eltűnő fehérállomány-betegség és a rubeola okozta mentális retardáció.
Anti-MOG-hoz kapcsolódó gyulladásos demielinizáló betegségek
A MOG laboratóriumi figyelmének nagy részét MS -vel foglalkozó tanulmányokban kapta. Számos tanulmány kimutatta a MOG elleni antitestek szerepét az SM patogenezisében , bár legtöbbjük az NMO-IgG és a betegségek NMO spektrumának felfedezése előtt íródott .
Az anti-MOG állapot eltérő attól függően, hogy ELISA-val vagy microarray-vel ( CBA ) mérik . Az azonosítás megfelelő módja a mikroarray, a beteg szérumának reagálása élő sejtekkel, és a kötő IgG kimutatása egy fluoreszcens jelzésű másodlagos antitesten keresztül.
Állatmodellekben
Az MS, az EAE állatmodelljei kimutatták, hogy "a (különböző állati törzsekből származó) MOG-specifikus EAE-modellek megjelenítik/tükrözik az emberi szklerózis multiplexet", de alapvetően megmagyarázza az optikai ideggyulladásban érintett részt. Ezeket a modelleket anti-MOG antitestekkel vizsgálták széles körben és az egyetlen demielinizáló képességű antitestnek tekintik, de az EAE patológia közelebb áll az NMO -hoz és az ADEM -hez, mint az MS -ben megfigyelt összefolyó demielinizációhoz.
Az anti-MOG által közvetített demielinizáció állatmodellekben az NMO-hoz hasonlóan viselkedett, és jelenleg még az MS diagnózis elleni biomarkernek is tekinthető
Seronegatív neuromyelitis optica esetén
Úgy találták, hogy az anti-MOG autoimmunitás szerepet játszik a szeronegatív NMO-ban, valamint az optikai neuritisben, és az ADEM MOG antitestek néhány fulmináns formája az NMOSD-ben változó a szeropozitivitás állapotától függően
Más körülmények között
Az anti-MOG autoantitestek jelenlétét az alábbi állapotokkal hozták összefüggésbe
- Az aquaporin-4-szeronegatív neuromyelitis optica néhány esete: NMO, amely egy antiMOG-hoz kapcsolódó encephalomyelitisből származik ,
- Az akut disszeminált encephalomyelitis néhány esete , különösen a visszatérő (MDEM) és a fulmináns kurzusok
- A sclerosis multiplex néhány esete
- izolált látóideggyulladás vagy keresztirányú mielitis
Hivatkozások
Külső linkek
- Online Mendeli örökség emberben (OMIM): 159465
- Az előzetes tájékoztatóban az UniProt : Q61885 (egér mielin-oligodendrocita glikoprotein) összes strukturális információjának áttekintése a PDBe-KB-ban .