Pontmutáció - Point mutation

A pontmutáció vagy szubsztitúció olyan genetikai mutáció, amelyben egyetlen nukleotidbázist megváltoztatnak, beillesztenek vagy törölnek egy szervezet genomjának DNS- vagy RNS -szekvenciájából. A pontmutációk sokféle hatással vannak a downstream fehérjetermékre - a mutáció sajátosságai alapján közepesen megjósolható következmények. Ezek a következmények a hatástalanságtól (pl. Szinonim mutációk ) a káros hatásokig (pl. Frame -shift mutációk ) terjedhetnek a fehérjetermelésre, összetételre és működésre vonatkozóan.
Okoz
A pontmutációk általában a DNS replikációja során játszódnak le . A DNS-replikáció akkor következik be, amikor egy kettős szálú DNS-molekula két egyedi DNS-szálat hoz létre, amelyek mindegyike sablon a komplementer szál létrehozásához. Egyetlen mutáció megváltoztathatja a teljes DNS -szekvenciát. Egy purin vagy pirimidin megváltoztatása megváltoztathatja a nukleotidok által kódolt aminosavat .
A pontmutációk a DNS replikációja során fellépő spontán mutációkból származhatnak . A mutáció sebességét a mutagének növelhetik . A mutagének lehetnek fizikai jellegűek, például UV-sugárzás , röntgensugárzás vagy extrém hő hatására, vagy vegyi anyagok (molekulák, amelyek rosszul helyezik el az alappárokat vagy megzavarják a DNS spirális alakját). A rákos megbetegedésekkel kapcsolatos mutagéneket gyakran tanulmányozzák, hogy megismerjék a rákot és annak megelőzését.
A pontmutációknak több módja is van. Először is, az ultraibolya (UV) fény és a magasabb frekvenciájú fény képes elektronokat ionizálni, ami viszont hatással lehet a DNS-re. A szabad gyököket tartalmazó reaktív oxigénmolekulák, amelyek a sejtanyagcsere melléktermékei, szintén nagyon károsak lehetnek a DNS -re. Ezek a reagensek egyszálú DNS-töréshez és kétszálú DNS-töréshez is vezethetnek. Harmadszor, a DNS -ben lévő kötések végül lebomlanak, ami újabb problémát okoz a DNS integritásának magas színvonalon tartásához. Replikációs hibák is előfordulhatnak, amelyek szubsztitúciós, inszerciós vagy deléciós mutációkhoz vezetnek.
Kategorizálás
Átmenet/transzverzió kategorizálása

1959 -ben Ernst Freese megalkotta az "átmenetek" vagy "transzverziók" kifejezéseket, hogy kategorizálja a különböző pontmutációkat. Az átmenetek a purinbázis cseréje egy másik purinnal vagy a pirimidin helyettesítése egy másik pirimidinnel. A transzverziók a purin helyettesítését pirimidinnel vagy fordítva. Az átmenetek (alfa) és transzverziók (béta) mutációs arányában szisztematikus különbség van . Az átmeneti mutációk körülbelül tízszer gyakoribbak, mint a transzverziók.
Funkcionális kategorizálás
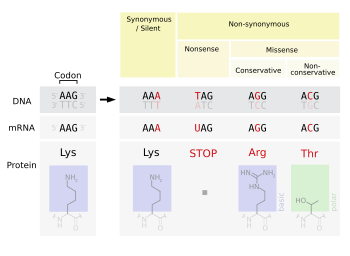
Az értelmetlen mutációk közé tartozik a stop-gain és a start-loss. A stop-gain egy olyan mutáció, amely idő előtti terminációs kodont eredményez ( stop lett ), ami a fordítás végét jelzi. Ez a megszakítás a fehérje rendellenes lerövidülését eredményezi. Az elveszett aminosavak száma közvetíti a fehérje funkcionalitására gyakorolt hatást és azt, hogy működik -e egyáltalán. A stop-loss egy mutáció az eredeti terminációs kodonban ( a stop elveszett ), ami a fehérje karboxilvégének kóros kiterjedését eredményezi. A Start-gain egy AUG start kodont hoz létre az eredeti kezdőhelytől felfelé. Ha az új AUG az eredeti kezdőhely közelében van, a feldolgozott átiraton belül és a riboszómális kötőhely után lefelé, akkor a fordítás kezdeményezésére használható. A valószínű hatás további aminosavak hozzáadása az eredeti fehérje aminosavához. Frame-shift mutációk is lehetségesek a start-gain mutációkban, de jellemzően nem befolyásolják az eredeti fehérje transzlációját. A start-loss egy pontmutáció az átirat AUG start kodonjában, ami a fehérjetermelés csökkenését vagy megszüntetését eredményezi.
A Missense mutációk egy másik aminosavat kódolnak. A missense mutáció megváltoztatja a kodont, így más fehérje jön létre, ami nem szinonim változás. A konzervatív mutációk aminosavváltozást eredményeznek. Az aminosav tulajdonságai azonban változatlanok maradnak (pl. Hidrofób, hidrofil stb.). Időnként a fehérje egy aminosavra történő változása nem káros a szervezet egészére. A legtöbb fehérje ellenáll egy vagy két pontmutációnak, mielőtt funkciójuk megváltozik. A nem konzervatív mutációk aminosavváltozást eredményeznek, amely más tulajdonságokkal rendelkezik, mint a vad típus . A fehérje elveszítheti funkcióját, ami betegséghez vezethet a szervezetben. Például a sarlósejtes betegséget a béta- hemoglobin gén egyetlen pontmutációja (missense mutáció) okozza , amely a GAG kodont GUG- vé alakítja , amely a valin aminosavat kódolja, nem pedig a glutaminsavat . A fehérje "funkciónövekedést" is mutathat, vagy aktiválódhat, ilyen például a mutáció, amikor a BRAF génben egy valin glutaminsavvá változik ; ez a RAF fehérje aktiválásához vezet, amely korlátlan proliferációs jelátvitelt okoz a rákos sejtekben. Mindkettő példa a nem konzervatív (missense) mutációra.
A néma mutációk ugyanazt az aminosavat kódolják (" szinonim szubsztitúció "). A csendes mutáció nem befolyásolja a fehérje működését . Egyetlen nukleotid is megváltozhat, de az új kodon ugyanazt az aminosavat határozza meg, ami nem módosított fehérjét eredményez. Ezt a fajta változást szinonim változásnak nevezik, mivel ugyanazon aminosav régi és új kodon kódja. Ez azért lehetséges, mert 64 kodon csak 20 aminosavat határoz meg. A különböző kodonok azonban eltérő fehérje expressziós szintekhez vezethetnek.
Egyetlen bázispár beillesztések és törlések
Előfordul, hogy a kifejezés pontmutáció leírására használjuk, inszerciókat vagy deléciókat egyetlen bázispár (amely több káros hatással a szintetizált fehérje miatt a nukleotidok még mindig olvasható hármasok, de különböző keretek: olyan mutáció úgynevezett frameshift mutáció ).
Általános következmények
A nem kódoló szekvenciákban előforduló pontmutációk leggyakrabban következmények nélküliek, bár vannak kivételek. Ha a mutált bázispár egy gén promoter szekvenciájában van, akkor a gén expressziója megváltozhat. Továbbá, ha a mutáció egy intron splicing helyén fordul elő , ez akadályozhatja az átírt pre-mRNS helyes splicingjét .
Csak egy aminosav megváltoztatásával a teljes peptid megváltozhat, ezáltal a teljes fehérje. Az új fehérjét fehérje variánsnak nevezik . Ha az eredeti fehérje a sejtek reprodukciójában működik, akkor ez az egypontos mutáció megváltoztathatja a szervezet sejttermelési folyamatát.
A pontcsíra -mutációk előnyös és káros tulajdonságokhoz vagy betegségekhez vezethetnek. Ez az élőlény környezetéhez igazodó adaptációkhoz vezet . Egy előnyös mutáció előnyt teremthet az adott szervezet számára, és ahhoz vezethet, hogy a tulajdonság nemzedékről nemzedékre öröklődik, javítva és javítva az egész populációt. Az evolúció tudományos elmélete nagymértékben függ a sejtek pontmutációitól . Az elmélet megmagyarázza a Földön élő szervezetek sokszínűségét és történetét. A pontmutációkkal kapcsolatban azt állítja, hogy a jótékony mutációk lehetővé teszik a szervezet fejlődését és szaporodását, ezáltal a pozitívan befolyásolt mutált géneket továbbadják a következő generációnak. Másrészt a káros mutációk hatására a szervezet elpusztul, vagy kisebb valószínűséggel szaporodik a természetes szelekció néven ismert jelenségben .
A mutációk különböző rövid- és hosszú távú hatásokat okozhatnak. A kisebbek a sejtciklus megállítását jelentik számos ponton. Ez azt jelenti, hogy a glicin aminosavat kódoló kodont le lehet állítani stop kodonná, ami azt eredményezi, hogy a termelt fehérjék deformálódnak, és nem tudják elvégezni a kívánt feladatokat. Mivel a mutációk befolyásolhatják a DNS -t és ezáltal a kromatint , megakadályozhatják a mitózis kialakulását a teljes kromoszóma hiánya miatt. Problémák merülhetnek fel a DNS transzkripciója és replikációja során is. Ezek mind megakadályozzák a sejt szaporodását, és ezáltal a sejt halálához vezetnek. A hosszú távú hatások a kromoszóma végleges megváltozását jelenthetik, ami mutációhoz vezethet. Ezek a mutációk előnyösek vagy károsak lehetnek. A rák egy példa arra, hogyan lehetnek károsak.
A pontmutációk vagy a DNS -ben lévő egyetlen nukleotid polimorfizmus egyéb hatásai a mutáció génen belüli helyétől függenek. Például, ha a mutáció a kódolásért felelős gén régiójában fordul elő, akkor a kódolt fehérje aminosav -szekvenciája megváltozhat, ami változást okoz a fehérje vagy fehérjekomplex funkciójában, lokalizációjában, stabilitásában. Számos módszert javasoltak a missense mutációk fehérjékre gyakorolt hatásának előrejelzésére. A gépi tanulási algoritmusok arra képezik modelljeiket, hogy megkülönböztessék az ismert betegségekkel kapcsolatos neutrális mutációkat, míg más módszerek nem kifejezetten képezik modelljeiket, de szinte minden módszer kihasználja az evolúciós megőrzést, feltételezve, hogy a konzervált pozíciókban bekövetkező változások károsabbak. Míg a módszerek többsége binárisan osztályozza a mutációk hatásait károsító és jóindulatúakra, új szintű annotációra van szükség annak magyarázatához, hogy miért és hogyan károsítják ezek a mutációk a fehérjéket.
Továbbá, ha a mutáció a gén azon régiójában következik be, ahol a transzkripciós gépezet a fehérjéhez kötődik, a mutáció befolyásolhatja a transzkripciós faktorok kötődését, mivel a transzkripciós faktorok által felismert rövid nukleotidszekvenciák megváltoznak. Ebben a régióban a mutációk befolyásolhatják a géntranszkripció hatékonyságát, ami viszont megváltoztathatja az mRNS szintjét és ezáltal a fehérje szintjét általában.
A pontmutációk számos hatással lehetnek a fehérje viselkedésére és reprodukciójára attól függően, hogy a mutáció hol fordul elő a fehérje aminosavszekvenciájában. Ha a mutáció a fehérje kódolásáért felelős gén régiójában fordul elő, az aminosav megváltozhat. Ez az enyhe változás az aminosavak sorrendjében változást okozhat a funkcióban, aktiválhatja a fehérjét, vagyis azt, hogyan kötődik egy adott enzimhez, hol található a fehérje a sejtben, vagy a fehérjében tárolt szabad energia mennyiségét .
Ha a mutáció a gén azon régiójában fordul elő, ahol a transzkripciós gépezet a fehérjéhez kötődik, a mutáció befolyásolhatja a transzkripciós faktorok fehérjéhez való kötődésének módját. A transzkripciós mechanizmusok rövid nukleotidszekvenciák felismerése révén kötődnek egy fehérjéhez. Egy mutáció ezen a területen megváltoztathatja ezeket a szekvenciákat, és így megváltoztathatja a transzkripciós faktorok fehérjéhez való kötődését. Ebben a régióban a mutációk befolyásolhatják a géntranszkripció hatékonyságát, amely szabályozza mind az mRNS szintjét, mind az általános fehérje szintet.
Pontmutációk által okozott specifikus betegségek
Rák
A több mutációt elnyomó fehérjék pontmutációi rákot okoznak . Például az Adenomatous Polyposis Coli pontmutációi elősegítik a tumor kialakulását. Egy új teszt, a Gyors párhuzamos proteolízis (FASTpp) segíthet a rákos betegek specifikus stabilitási hibáinak gyors szűrésében.
Neurofibromatosis
A neurofibromatózist a Neurofibromin 1 vagy Neurofibromin 2 gén pontmutációi okozzák .
Sarlósejtes vérszegénység
A sarlósejtes vérszegénységet a hemoglobin β-globin láncának pontmutációja okozza, amelynek hatására a hidrofil aminosav-glutaminsavat a hatodik pozícióban lévő valin hidrofób aminosavval helyettesítik.
A β-globin gén a 11. kromoszóma rövid karján található. Két vad típusú α-globin alegység és két mutáns β-globin alegység társulása hemoglobin S-t (HbS) képez. Alacsony oxigéntartalmú körülmények között (például nagy magasságban) a poláris aminosav hiánya a β-globin lánc hatodik pozíciójában elősegíti a hemoglobin nem kovalens polimerizációját (aggregációját), ami a vörösvértesteket torzítja sarló alakú és csökkenti rugalmasságukat.
A hemoglobin a vörösvértestekben található fehérje, és felelős az oxigén szállításáért a szervezetben. A hemoglobin fehérjét két alegység alkotja: a béta-globinok és az alfa-globinok . A béta-hemoglobin a HBB genetikai információiból, vagy a "hemoglobin, béta" génből jön létre, amely a 11p15.5 kromoszómán található. Ebben a 147 aminosav hosszúságú polipeptidlánc egyetlen pont mutációja a sarlósejtes anaemia néven ismert betegséget eredményezi. A sarlósejtes vérszegénység egy autoszomális recesszív rendellenesség, amely 500 afroamerikai közül 1-et érint, és az Egyesült Államokban az egyik leggyakoribb vérbetegség. A béta-globin hatodik aminosavának, a glutaminsavnak valinnal történő egyszeri cseréje deformált vörösvértesteket eredményez. Ezek a sarló alakú sejtek közel annyi oxigént nem tudnak szállítani, mint a normál vörösvérsejtek, és könnyebben elkapnak a hajszálerekben, megszakítva a létfontosságú szervek vérellátását. A béta-globin egyetlen nukleotidváltozása azt jelenti, hogy a hordozó legkisebb megerőltetése is súlyos fájdalmat, sőt szívrohamot eredményez. Az alábbiakban a normál és abnormális sarlósejtes polipeptidlánc első tizenhárom aminosavát ábrázoló diagram látható .
| AUGUSZTUS | GUG | CAC | CUG | ACU | CCU | G A G | GAG | AAG | UCU | GCC | GUU | ACU |
| RAJT | Val | Övé | Leu | Thr | Pro | Glu | Glu | Lys | Ser | Ala | Val | Thr |
| AUGUSZTUS | GUG | CAC | CUG | ACU | CCU | G U G | GAG | AAG | UCU | GCC | GUU | ACU |
| RAJT | Val | Övé | Leu | Thr | Pro | Val | Glu | Lys | Ser | Ala | Val | Thr |
Tay -Sachs -kór
A Tay -Sachs -betegség oka genetikai hiba, amelyet szülőről gyermekre adnak át. Ez a genetikai hiba a HEXA génben található, amely a 15. kromoszómán található.
A HEXA gén a béta-hexosaminidase A nevű enzim részét képezi, amely kritikus szerepet játszik az idegrendszerben. Ez az enzim segít lebontani a GM2 gangliozid nevű zsíros anyagot az idegsejtekben. A HEXA gén mutációi megzavarják a béta-hexosaminidase A aktivitását, megakadályozva a zsíros anyagok lebomlását. Ennek eredményeként a zsíros anyagok halálos szintre halmozódnak fel az agyban és a gerincvelőben. A GM2 gangliozid felhalmozódása progresszív károsodást okoz az idegsejtekben. Ez az oka a Tay-Sachs-kór tüneteinek.
Színvakság
A színtévesztő emberek génjeiben olyan mutációk vannak, amelyek vörös vagy zöld kúp elvesztését okozzák, ezért nehezen tudnak különbséget tenni a színek között. Az emberi szemnek háromféle kúpja van: piros, zöld és kék. Most a kutatók felfedezték, hogy néhány ember, akinek a génmutációja a színvakságot okozza, elveszíti a "színes" kúpok teljes halmazát, és nem változtat a látásuk tisztaságán.
Ismétlés által kiváltott pontmutáció
A molekuláris biológia , ismételje indukált pontmutációt vagy RIP egy olyan folyamat, amely DNS felhalmozódik G : C , hogy A : T átmenet mutációk. A genetikai bizonyítékok azt mutatják, hogy a RIP különböző gombákban fordul elő vagy bekövetkezett, míg a kísérleti bizonyítékok azt mutatják, hogy a RIP aktív a Neurospora crassa , Podospora anserina , Magnaporthe grisea , Leptosphaeria maculans , Gibberella zeae és Nectria haematococca esetében . A Neurospora crassa -ban a RIP által mutált szekvenciákat gyakran de novo metilálják .
A RIP a szexuális szakaszban fordul elő a haploid magokban a megtermékenyítés után, de a meiotikus DNS replikáció előtt . A Neurospora crassa -ban a legalább 400 bázispár hosszúságú ismétlődő szekvenciák érzékenyek a RIP -re. Az ismétlődések akár 80% -os nukleotid -azonossággal is alávethetők a RIP -nek. Bár az ismétlődő felismerés és a mutagenezis pontos mechanizmusa rosszul ismert, a RIP többszörös átmeneti mutáción átesett szekvenciákat eredményez .
Úgy tűnik, hogy a RIP mutációk nem korlátozódnak az ismétlődő szekvenciákra. Valóban, például a L. maculans fitopatogén gomba esetében a RIP mutációk egyetlen példányban találhatók, az ismételt elemek mellett. Ezek a régiók vagy nem kódoló régiók, vagy kis szekretált fehérjéket kódoló gének, beleértve az avirulencia géneket. A RIP mértéke ezekben az egyetlen példány régiókban arányos volt az ismétlődő elemek közelségével.
Rep és Kistler feltételezték, hogy a transzpozonokat tartalmazó, nagyon ismétlődő régiók jelenléte elősegítheti a rezidens effektor gének mutációját. Tehát az effektor gének jelenléte az ilyen régiókban javasolt, hogy elősegítsék azok alkalmazkodását és diverzifikálódását, ha erős szelekciós nyomásnak vannak kitéve.
Mivel a RIP mutáció hagyományosan megfigyelhető, hogy az ismétlődő régiókra korlátozódik, és nem egyetlen példányra, Fudal et al. azt sugallta, hogy a RIP mutáció szivárgása viszonylag rövid távolságon belül előfordulhat a RIP által érintett ismétlődéstől. Valóban, erről számoltak be az N. crassa -ban, ahol a RIP szivárgását észlelték egyetlen példányos szekvenciákban, legalább 930 bp távolságra a szomszédos duplikált szekvenciák határától. A RIP -hez vezető ismétlődő szekvenciák észlelési mechanizmusának tisztázása lehetővé teszi annak megértését, hogy a szomszédos szekvenciák is hatással lehetnek.
Gépezet
A RIP G : C - A : T átmeneti mutációkat okoz az ismétlődéseken belül, azonban az ismétlődő szekvenciákat észlelő mechanizmus ismeretlen. A RID az egyetlen ismert fehérje, amely nélkülözhetetlen a RIP -hez. Ez egy DNS-metiltranszferáz-szerű fehérje, amely mutáció vagy kiütés esetén a RIP elvesztését eredményezi. A rid homológ törlése Aspergillus nidulans , dmtA esetén a termékenység csökkenését eredményezi, míg a rid homológ törlése az Ascobolus immersens , masc1 termékenységi hibákat és a premeiotikusan (MIP) indukált metiláció elvesztését eredményezi .
Következmények
Úgy gondolják, hogy a RIP védekezési mechanizmusként alakult ki az átültethető elemek ellen , amelyek a genomba belé hatolva és szaporodva hasonlítanak a parazitákra . A RIP több hibás és értelmetlen mutációt hoz létre a kódoló szekvenciában. A GC -nek ez a hipermutációja AT -ként az ismétlődő szekvenciákban kiküszöböli a szekvencia funkcionális géntermékeit (ha voltak, amelyekkel kezdeni kell). Ezenkívül a C-hordozó nukleotidok közül sok metileződik , ezáltal csökken a transzkripció.
Használat a molekuláris biológiában
Mivel a RIP nagyon hatékonyan észleli és mutálja az ismétlődéseket, a gombabizológusok gyakran használják a mutagenezis eszközeként . Az egypéldányos gén második példányát először a genomba transzformálják . A gombának ezután párosodnia kell , és végig kell mennie szexuális ciklusán, hogy aktiválja a RIP gépezetet. A duplikált génen belül számos különböző mutációt nyernek akár egyetlen megtermékenyítési eseményből is, így az inaktivált allélokat, általában a nonszensz mutációk miatt , valamint a missense mutációkat tartalmazó allélokat is meg lehet szerezni.
Történelem
A meiózis sejtszaporodási folyamatát Oscar Hertwig fedezte fel 1876 -ban. A mitózist számos évvel később, 1882 -ben fedezte fel Walther Flemming .
Hertwig tanulmányozta a tengeri süneket, és észrevette, hogy minden tojás egy magot tartalmaz a megtermékenyítés előtt, és két magot azután. Ez a felfedezés bebizonyította, hogy egy spermium megtermékenyítheti a petesejtet, és így bizonyította a meiózis folyamatát. Hermann Fol folytatta Hertwig kutatását azzal, hogy tesztelte a több spermium tojásba történő befecskendezésének hatásait, és megállapította, hogy az eljárás nem működik több mint egy spermiummal.
Flemming 1868 -ban kezdte a sejtosztódással kapcsolatos kutatásait. A sejtek tanulmányozása egyre népszerűbb téma volt ebben az időszakban. Schneider 1873 -ra már elkezdte leírni a sejtosztódás lépéseit. Flemming tovább folytatta ezt a leírást 1874 -ben és 1875 -ben, miközben részletesebben elmagyarázta a lépéseket. Azt is vitatta Schneider megállapításaival, hogy a mag rúdszerű struktúrákra különült el, azt sugallva, hogy a mag valójában szálakra szakadt, amelyek viszont elváltak. Flemming arra a következtetésre jutott, hogy a sejtek a sejtosztódás révén replikálódnak, hogy pontosabb mitózis legyen.
Matthew Meselson és Franklin Stahl nevéhez fűződik a DNS -replikáció felfedezése . Watson és Crick elismerték, hogy a DNS szerkezete azt jelzi, hogy létezik valamilyen replikációs folyamat. Azonban nem sok kutatást végeztek a DNS ezen aspektusával kapcsolatban, csak Watson és Crick után. Az emberek minden lehetséges módszert mérlegeltek a DNS replikációs folyamatának meghatározására, de egyik sem volt sikeres Meselson és Stahl előtt. Meselson és Stahl nehéz izotópot vezettek be néhány DNS -be, és nyomon követték annak eloszlását. Ezzel a kísérlettel Meselson és Stahl be tudták bizonyítani, hogy a DNS félkonzervatív módon szaporodik.
Lásd még
Hivatkozások
Külső linkek
- Pont+mutáció az Amerikai Egyesült Államok Országos Orvostudományi Könyvtárának orvosi tantárgyaiban (MeSH)