nátrium-klorid -Sodium chloride
 Nátrium-klorid kristályok halit formájában
|
|
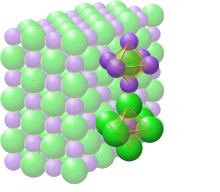
 Kristályszerkezet lilában nátriummal és zöldben kloriddal
|
|
| Nevek | |
|---|---|
|
IUPAC név
Nátrium-klorid
|
|
| Más nevek
|
|
| Azonosítók | |
|
3D modell ( JSmol )
|
|
| 3534976 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA információs kártya | 100.028.726 |
| EK-szám | |
| 13673 | |
| KEGG | |
| Háló | Nátrium+klorid |
|
PubChem ügyfél -azonosító
|
|
| RTECS szám | |
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Tulajdonságok | |
| NaCl | |
| Moláris tömeg | 58,443 g/mol |
| Kinézet | Színtelen köbös kristályok |
| Szag | Szagtalan |
| Sűrűség | 2,17 g/ cm3 |
| Olvadáspont | 800,7 °C (1473,3 °F; 1073,8 K) |
| Forráspont | 1465 °C (2669 °F; 1738 K) |
| 360 g/1000 g tiszta víz T = 25 °C-on | |
| Oldhatóság ammóniában _ | 21,5 g/l T = ? |
| Oldhatóság metanolban _ | 14,9 g/l, T = ? |
| −30,2·10 −6 cm 3 /mol | |
|
Törésmutató ( n D )
|
1,5441 (589 nm-en) |
| Szerkezet | |
| Arcközpontú kocka ( lásd a szöveget ), cF8 |
|
| Fm 3 m (225. sz.) | |
|
a = 564,02 pm
|
|
|
Képlet mértékegységei ( Z )
|
4 |
| oktaéder a Na + oktaéder a Cl − |
|
| Termokémia | |
|
Hőkapacitás ( C )
|
50,5 J/(K·mol) |
|
Std moláris
entrópia ( S ⦵ 298 ) |
72,10 J/(K·mol) |
| −411,120 kJ/mol | |
| Gyógyszertan | |
| A12CA01 ( WHO ) B05CB01 ( WHO ), B05XA03 ( WHO ), S01XA03 ( WHO ) | |
| Veszélyek | |
| NFPA 704 (tűz gyémánt) | |
| Halálos dózis vagy koncentráció (LD, LC): | |
|
LD 50 ( medián dózis )
|
3 g/kg (szájon át, patkányok) |
| Rokon vegyületek | |
|
Egyéb anionok
|
Nátrium-fluorid Nátrium-bromid Nátrium-jodid Nátrium-asztatid |
|
Egyéb kationok
|
Lítium-klorid Kálium-klorid Rubídium-klorid Cézium-klorid Francium-klorid |
| Kiegészítő adatok oldal | |
| Nátrium-klorid (adatoldal) | |
|
Hacsak másképp nem jelezzük, az adatok standard állapotukban (25 °C [77 °F], 100 kPa) lévő anyagokra vonatkoznak.
|
|
A nátrium-klorid / ˌ s oʊ d i ə m ˈ k l ɔːr aɪ d / , közismert nevén só (bár a tengeri só más kémiai sókat is tartalmaz ), egy ionos vegyület , amelynek kémiai képlete NaCl , amely 1:1 arányt képvisel. nátrium- és kloridionok . A 22,99 és 35,45 g/mol moláris tömegű NaCl 100 g 39,34 g Na-t és 60,66 g Cl-t tartalmaz. A nátrium-klorid a tengervíz sótartalmáért és számos többsejtű szervezet extracelluláris folyadékának sótartalmáért leginkább felelős só . Ehető formájában a sót (más néven asztali sót ) általában fűszerként és élelmiszer-tartósítószerként használják . Számos ipari folyamatban nagy mennyiségű nátrium-kloridot használnak fel, és ez a nátrium- és klórvegyületek fő forrása, amelyet további kémiai szintézisek alapanyagaként használnak . A nátrium-klorid másik fő alkalmazása az utak jégmentesítése fagypont alatti időben.
Felhasználások
Az évi kb. 250 millió tonnás termelés (2008-as adatok) dominánsabb felhasználási területei a só megszokott hazai felhasználása mellett a vegyszerek és a jégmentesítés.
Kémiai funkciók
A sót közvetve vagy közvetlenül számos vegyi anyag előállításához használják fel, amelyek a világ termelésének legnagyobb részét fogyasztják.
Klór-alkáli ipar
Ez a klóralkáli eljárás kiindulópontja, a klór és nátrium-hidroxid előállításának ipari folyamata a kémiai egyenlet szerint.
Ezt az elektrolízist higanycellában, membráncellában vagy membráncellában végzik. Mindegyik más módszert alkalmaz a klór és a nátrium-hidroxid elválasztására. Más technológiák fejlesztés alatt állnak az elektrolízis magas energiafogyasztása miatt, így a hatékonyság kismértékű javulása nagy gazdasági megtérüléssel járhat. A klór egyes alkalmazásai közé tartozik a PVC hőre lágyuló műanyagok gyártása, fertőtlenítőszerek és oldószerek.
A nátrium-hidroxidot széles körben használják számos különféle iparágban, amelyek lehetővé teszik papír, szappan, alumínium stb. gyártását.
Szóda-hamu ipar
A nátrium - kloridot a Solvay - eljárásban nátrium - karbonát és kalcium - klorid előállítására használják . A nátrium-karbonátot pedig üveg , nátrium-hidrogén-karbonát és színezékek , valamint számtalan egyéb vegyi anyag előállítására használják. A mannheimi eljárásban a nátrium-kloridot nátrium-szulfát és sósav előállítására használják .
Alapértelmezett
A nátrium-kloridnak van egy nemzetközi szabványa, amelyet az ASTM International hozott létre . A szabvány neve ASTM E534-13 , és a nátrium-klorid kémiai elemzésének standard vizsgálati módszere. Ezek a felsorolt módszerek eljárásokat biztosítanak a nátrium-klorid elemzésére annak meghatározására, hogy az alkalmas-e a tervezett felhasználásra és alkalmazásra.
Különféle ipari felhasználások
A nátrium-kloridot erősen használják, így még a viszonylag kisebb alkalmazások is jelentős mennyiségeket fogyaszthatnak. Az olaj- és gázkutatásban a só a fúrófolyadékok fontos összetevője a kútfúrások során. A fúrófolyadék flokkulálására és sűrűségének növelésére szolgál, hogy leküzdje a magas lefolyógáznyomást. Amikor egy fúró sóképződménybe ütközik, sót adnak a fúrófolyadékhoz, hogy telítsék az oldatot, hogy minimalizálják a sórétegen belüli feloldódást. A sót a cementkötésű burkolatokban lévő beton keményedésének fokozására is használják.
A textíliákban és a festésben a sót sós öblítőként használják a szerves szennyeződések elkülönítésére, a színezékcsapadékok "kisózásának" elősegítésére, valamint koncentrált színezékekkel való keverésre a szabványosítás érdekében. Egyik fő feladata a pozitív iontöltés biztosítása a festékek negatív töltésű ionjainak abszorpciójának elősegítése érdekében.
Alumínium , berillium , réz , acél és vanádium feldolgozására is használják . A cellulóz- és papíriparban a fapép fehérítésére sót használnak. Nátrium-klorát előállítására is használják , amelyet kénsawal és vízzel együtt klór-dioxid előállításához adnak , amely kiváló oxigén alapú fehérítő vegyszer. A klór-dioxid-eljárás, amely az első világháború után Németországból indult ki, egyre népszerűbb a klórozott fehérítő vegyületek csökkentésére vagy megszüntetésére irányuló környezeti nyomás miatt. A cserzés és a bőrkezelés során sót adnak az állati bőrökhöz , hogy megakadályozzák a mikrobiális aktivitást a bőr alsó oldalán, és visszavonják a nedvességet a bőrbe.
A gumigyártásban a sót buna , neoprén és fehér gumitípusok készítésére használják. Sós sóoldatot és kénsavat használnak a klórozott butadiénből készült emulgeált latex koagulálására .
Sót is adnak hozzá, hogy rögzítse a talajt, és szilárdabbá tegye az alapot, amelyre az autópályákat építik. A só minimálisra csökkenti a nedvesség és a forgalmi terhelés változása miatt a felszín alatti elmozdulások hatásait.
A nátrium-kloridot néha olcsó és biztonságos szárítószerként használják higroszkópos tulajdonságai miatt , így a sózás történelmileg az élelmiszerek tartós tartósításának hatékony módszere ; a só az ozmotikus nyomáson keresztül vizet von ki a baktériumokból , megakadályozva a szaporodást, ami az élelmiszerromlás egyik fő forrása. Annak ellenére, hogy hatékonyabb szárítószerek állnak rendelkezésre, kevés biztonságos az ember számára.
Vízlágyítás
A kemény víz kalcium- és magnéziumionokat tartalmaz, amelyek megzavarják a szappan hatását, és hozzájárulnak a lúgos ásványi lerakódások vízkő vagy filmrétegének felhalmozásához a háztartási és ipari berendezésekben és csövekben. A kereskedelmi és lakossági vízlágyító egységek ioncserélő gyantákat használnak a keménységet okozó ionok eltávolítására. Ezeket a gyantákat nátrium-klorid segítségével állítják elő és regenerálják.
Útsó
A só második fő alkalmazása az utak síkosságmentesítésére és jégmentesítésére szolgál, mind a szemetestartályokban , mind a téli szolgálati járművek által szórva . A havazásra számítva az utakat optimális esetben sóoldattal (tömény sóoldattal ) „jegesedik el” , amely megakadályozza a hó-jég és az útfelület közötti kötést. Ezzel az eljárással elkerülhető az erős sóhasználat a hóesés után. A jégmentesítéshez sóoldat és só keverékét használják, néha további szerekkel, például kalcium-kloriddal és/vagy magnézium-kloriddal . A só vagy sóoldat használata –10 °C (14 °F) alatt hatástalanná válik.
Az Egyesült Királyságban a jégmentesítéshez használt só túlnyomórészt egyetlen bányából származik a cheshire - i Winsfordban . A forgalmazás előtt összekeverik <100 ppm nátrium-ferrocianiddal , mint csomósodást gátló szerrel, amely lehetővé teszi a kősó szabad kiáramlását a szemcséző járművekből annak ellenére, hogy használat előtt felhalmozták. Az utóbbi években ezt az adalékanyagot az asztali sóban is használták. Más adalékanyagokat használtak az útsóban a teljes költség csökkentése érdekében. Például az Egyesült Államokban a cukorrépa-feldolgozás során keletkező melléktermék szénhidrát oldatot kősóval keverték össze, és körülbelül 40%-kal jobban tapadt az útfelületekhez, mint a laza kősó önmagában. Mivel tovább maradt az úton, a kezelést nem kellett többször megismételni, így időt és pénzt takarított meg.
A fizikai kémia szakkifejezése szerint a víz-só keverék minimális fagyáspontja -21,12 °C (-6,02 °F) 23,31 tömeg% só esetében. Ennek a koncentrációnak a közelében a fagyás azonban olyan lassú, hogy a -22,4 °C-os (-8,3 °F) eutektikus pont körülbelül 25 tömeg% sóval elérhető.
Környezeti hatások
Az útsó édesvízi testekbe kerül, és károsíthatja a vízi növényeket és állatokat azáltal, hogy megzavarja azok ozmoregulációs képességét. A só mindenütt jelenléte problémát jelent minden part menti bevonat alkalmazásakor, mivel a beszorult sók nagy tapadási problémákat okoznak. A haditengerészeti hatóságok és a hajóépítők figyelik a sókoncentrációt a felületeken az építkezés során. A felületeken a maximális sókoncentráció a jogosultságtól és az alkalmazástól függ. Leginkább az IMO -rendeletet használják, és a sószinteket legfeljebb 50 mg/m 2 oldható sókban határozzák meg nátrium-kloridban mérve. Ezeket a méréseket Bresle-teszttel végezzük . A szikesedés (növekvő sótartalom, más néven édesvízi szikesedési szindróma ) és az ezt követő fokozott fémkimosódás folyamatos probléma Észak-Amerikában és az európai édesvízi utakon.
Az autópályák síkosságmentesítésénél a sót összefüggésbe hozták a hídfedélzetek , a gépjárművek, a merevítőrudak és -huzalok, valamint az útépítésben használt védtelen acélszerkezetek korróziójával. A felszíni lefolyás , a járművek permetezése és a szélfútta tevékenységek szintén hatással vannak a talajra, az út menti növényzetre, valamint a helyi felszíni és talajvízkészletekre. Bár bizonyítékot találtak a só környezetterhelésére a csúcshasználat során, a tavaszi esők és olvadások általában felhígítják a nátrium koncentrációját azon a területen, ahol sót használtak. Egy 2009-es tanulmány megállapította, hogy a Minneapolis-St Paul metróövezetben alkalmazott útsó körülbelül 70%-a a helyi vízgyűjtőben marad.
Helyettesítés
Egyes ügynökségek a sört , a melaszt és a répalét helyettesítik az útsó helyett . A légitársaságok több glikolt és cukrot használnak a jégmentesítéshez , nem pedig sóalapú oldatokat .
Élelmiszeripar és mezőgazdaság
Sok mikroorganizmus nem tud sós környezetben élni: ozmózis útján vizet vonnak ki a sejtekből . Emiatt a sót bizonyos élelmiszerek, például szalonna, hal vagy káposzta tartósítására használják.
A sót ízfokozóként, tartósítószerként, kötőanyagként, fermentációt szabályozó adalékanyagként, állagszabályozó szerként és színelőhívóként adják az élelmiszerekhez, akár az élelmiszer-előállító, akár a fogyasztó. Az élelmiszeripari sófelhasználás a fogyasztás csökkenő sorrendjében más élelmiszer-feldolgozási, húscsomagoló, konzervipari , sütőipari, tej- és gabonamalmi termékekre oszlik. Sót adnak hozzá, hogy elősegítse a szalonna, sonka és más feldolgozott hústermékek színének kialakulását. Tartósítószerként a só gátolja a baktériumok szaporodását. A só kötőanyagként működik a kolbászokban , és kötőgélt képez, amely húsból, zsírból és nedvességből áll. A só ízfokozóként és lágyítóként is működik .
Sok tejiparban sót adnak a sajtokhoz szín-, erjesztés- és állagszabályozó szerként. A tejipari alágazatba tejszínes vajat, sűrített és párolt tejet, fagyasztott desszerteket, fagylaltot, natúr és ömlesztett sajtokat, valamint speciális tejtermékeket gyártó cégek tartoznak. A konzervgyártás során a sót elsősorban ízfokozóként és tartósítószerként adják hozzá . Más összetevők hordozójaként, dehidratálószerként, enzimgátlóként és lágyítóként is használják. A sütés során sót adnak hozzá, hogy szabályozzák a kenyértészta erjedési sebességét. Használják a glutén (bizonyos tésztákban a rugalmas fehérje-víz komplex) erősítésére és ízfokozóként, például pékáruk feltétére. Az élelmiszer-feldolgozó kategória gabonamalmi termékeket is tartalmaz. Ezek a termékek őrlési lisztből és rizsből, valamint gabonapelyhes reggeli ételekből és kevert vagy elkészített lisztből állnak. A sót fűszerként is használják, pl. burgonya chipsben, perecben , macska- és kutyaeledelben.
A nátrium-kloridot az állatgyógyászatban hányást okozó szerként használják. Meleg telített oldat formájában adjuk. A hányást kis mennyiségű sima só vagy sókristályok garatba történő elhelyezése is okozhatja .
Gyógyszer
A nátrium - kloridot vízzel együtt használják az intravénás terápia egyik elsődleges oldataként . Az orrspray gyakran tartalmaz sóoldatot .
Tűzoltás
A nátrium-klorid a tűzoltó készülékek (Met-LX, Super D) fő oltóanyaga, amelyet éghető fémtüzeknél, például magnézium-, kálium-, nátrium- és NaK-ötvözeteknél (D osztály) használnak. A keverékhez hőre lágyuló port, valamint vízszigetelő anyagot (fém-sztearátok) és csomósodást gátló anyagokat (trikalcium-foszfát) adnak az oltóanyag előállításához. Amikor felviszik a tűzre, a só hűtőbordaként működik, elvezeti a hőt a tűzből, és oxigénkizáró kérget képez, amely elfojtja a tüzet. A műanyag adalékanyag megolvad, és segít a kéregnek megőrizni sértetlenségét, amíg az égő fém gyulladási hőmérséklete alá nem hűl. Ezt a fajta tűzoltó készüléket az 1940-es évek végén találták fel patronral működő egységként, bár manapság népszerűek a tárolt nyomású változatok. Általános méretek: 30 font (14 kg) hordozható és 350 font (160 kg) kerekes.
Tisztítószer
Legalábbis a középkor óta az emberek a sót tisztítószerként használták a háztartási felületekre dörzsölve. Számos sampon és fogkrém márkájában is használják, és gyakran használják felhajtók és jégfoltok jégmentesítésére.
Optikai használat
A hibamentes NaCl kristályok optikai áteresztőképessége körülbelül 90% infravörös fény esetén, különösen 200 nm és 20 µm között . Ezért olyan optikai alkatrészekben (ablakokban és prizmákban) használták őket, amelyek abban a spektrumtartományban működtek, ahol kevés nem elnyelő alternatíva létezik, és ahol a mikroszkopikus inhomogenitások hiányára vonatkozó követelmények kevésbé szigorúak, mint a látható tartományban. Noha olcsók, a NaCl kristályok puhák és higroszkóposak – a környezeti levegő hatására fokozatosan "dér" borítja be őket. Ez korlátozza a NaCl alkalmazását száraz környezetben, vákuummal lezárt összeszerelési területeken vagy rövid távú felhasználásra, például prototípuskészítésre. Napjainkban az infravörös spektrumtartományban NaCl helyett olyan anyagokat használnak, mint a cink-szelenid (ZnSe), amelyek mechanikailag erősebbek és kevésbé érzékenyek a nedvességre.
Kémia
Szilárd nátrium-klorid
A szilárd nátrium-kloridban minden iont hat ellentétes töltésű ion vesz körül, ahogy az elektrosztatikus alapon várható. A környező ionok egy szabályos oktaéder csúcsaiban helyezkednek el . A szoros tömörítés nyelvén a nagyobb (167 pm méretű) kloridionok egy köbös tömbben vannak elrendezve, míg a kisebb nátriumionok (116 pm) kitöltik a köztük lévő összes köbös rést (oktaéderes üregeket) . Ugyanez az alapszerkezet sok más vegyületben is megtalálható, és közismert nevén halit vagy kősó kristályszerkezet. Képezhető kétatomos felületközpontú köbös (fcc) rácsként vagy két egymásba hatoló, felületközpontú köbös rácsként. Az első atom minden rácspontban, a második atom pedig félúton helyezkedik el a rácspontok között az fcc egységcella éle mentén.
A szilárd nátrium-klorid olvadáspontja 801 °C. A nátrium-klorid hővezető képessége a hőmérséklet függvényében 8 K (–265,15 °C; –445,27 °F) hőmérsékleten maximum 2,03 W/(cm K), és 314 K (41 °C; 106 °F) hőmérsékleten 0,069-re csökken ). Doppinggal is csökken .
Az atomi felbontású valós idejű videoképalkotás lehetővé teszi a nátrium-klorid kristálymagképződésének kezdeti szakaszának megjelenítését.
Vizes oldatok
| A NaCl oldhatósága (g NaCl / 1 kg oldószer 25 °C-on (77 °F)) |
|
|---|---|
| Víz | 360 |
| formamid | 94 |
| Glicerin | 83 |
| Propilén-glikol | 71 |
| Hangyasav | 52 |
| Folyékony ammónia | 30.2 |
| Metanol | 14 |
| Etanol | 0,65 |
| Dimetil-formamid | 0.4 |
| Propán-1-ol | 0,124 |
| Szulfolán | 0,05 |
| Bután-1-ol | 0,05 |
| Propán-2-ol | 0,03 |
| Pentán-1-ol | 0,018 |
| Acetonitril | 0,003 |
| Aceton | 0,00042 |
A szilárd anyagban lévő Na + és Cl - ionok vonzása olyan erős, hogy csak az erősen poláris oldószerek, például a víz oldják jól a NaCl-t.
Vízben oldva a nátrium-klorid váz szétesik, amikor a Na + és Cl - ionokat poláris vízmolekulák veszik körül. Ezek az oldatok [Na(H 2 O) 8 ] + képletű fém aquo komplexből állnak, Na-O távolsággal 250 pm . A kloridionok szintén erősen szolvatáltak, mindegyiket átlagosan hat molekula víz veszi körül. A nátrium-klorid oldatok tulajdonságai nagyon különböznek a tiszta víztől. Az eutektikus pont -21,12 °C (-6,02 °F) a só 23,31 tömegszázalékánál , a telített sóoldat forráspontja pedig közel 108,7 °C (227,7 °F). Hideg oldatokból a só NaCl·2H 2 O dihidrát formájában kristályosodik .
A nátrium-klorid oldatok pH-ja
A nátrium-klorid oldat pH-ja ≈7 marad a Cl − ion rendkívül gyenge bázikussága miatt, amely az erős sav HCl konjugált bázisa. Más szavakkal, a NaCl nincs hatással a rendszer pH-jára olyan hígított oldatokban, ahol az ionerősség és az aktivitási együtthatók hatása elhanyagolható.
Sztöchiometriai és szerkezeti változatok
A konyhasóban a nátrium és a klór mólaránya 1:1. 2013-ban különböző sztöchiometriájú nátrium- és kloridvegyületeket fedeztek fel; öt új vegyületet jósoltak (pl. Na 3 Cl, Na 2 Cl, Na 3 Cl 2 , NaCl 3 és NaCl 7 ). Néhányuk létezését nagy nyomáson és egyéb körülmények között kísérletileg igazolták: köbös és ortorombos NaCl 3 , kétdimenziós fémes tetragonális Na 3 Cl és egzotikus hatszögletű NaCl. Ez azt jelzi, hogy a kémiai intuíciót megsértő vegyületek lehetségesek egyszerű rendszerekben, nem környezeti körülmények között.
Esemény
A világ sójának nagy része az óceánban van feloldva . Kisebb mennyiségben található a földkéregben vízben oldódó ásványi halit (kősó) formájában, kis mennyiségben pedig lebegő tengeri só részecskék formájában a légkörben. Ezek a részecskék a domináns felhőkondenzációs magok messze a tengeren, amelyek lehetővé teszik a felhők képződését az egyébként nem szennyezett levegőben .
Termelés
A sót jelenleg tömegesen állítják elő a tengervíz vagy sósvíz elpárologtatásával sósvízkutakból és sóstavakból . A kősó bányászata szintén jelentős forrás. Kína a világ fő sószállítója. 2017-ben a világtermelést 280 millió tonnára becsülték , az öt legnagyobb termelő (millió tonnában) Kína (68,0), az Egyesült Államok (43,0), India (26,0), Németország (13,0) és Kanada (13,0) volt. A só a káliumbányászat mellékterméke is .
Modern kősóbánya Mount Morris közelében , New York , Egyesült Államok
Jordániai és izraeli sópárologtató tavak a Holt-tenger déli végén .
Sóhalmok, Salar de Uyuni , Bolívia .
Lásd még
- Biosótartalom
- Étkezési só (étkezési só)
- Halit , a nátrium-klorid ásványi formája
- A só egészségügyi hatásai
- Sótartalom
- A föld sózása
- Sómérgezés
Hivatkozások
-
 Ez a cikk köztulajdonban lévő anyagokat tartalmaz a Saltból (PDF) . Egyesült Államok Geológiai Szolgálata .
Ez a cikk köztulajdonban lévő anyagokat tartalmaz a Saltból (PDF) . Egyesült Államok Geológiai Szolgálata .
Idézett források
- Haynes, William M., szerk. (2011). CRC Handbook of Chemistry and Physics (92. kiadás). CRC Nyomja meg a gombot . ISBN 978-1439855119.
Külső linkek
- Salt United States Geological Survey statisztika és információ
- "Só és homok használata a téli útkarbantartáshoz" . Útkezelési Lap . 1997. december. Az eredetiből archiválva: 2016. szeptember 21 .. Letöltve: 2007. február 13 .
- Számológépek: a vizes NaCl (és más sók) felületi feszültségei és sűrűségei, molaritásai és molalitásai
- JtBaker MSDS


![{\displaystyle {\ce {2 NaCl + 2 H2O ->[elektrolízis] Cl2 + H2 + 2 NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6175336b0ecf3b2032d6a60ac2a534b10e6f61f3)