Kétpórusú csatorna - Two-pore channel
| két pórusú szegmens 1 | |||||||
|---|---|---|---|---|---|---|---|
| Azonosítók | |||||||
| Szimbólum | TPCN1 | ||||||
| IUPHAR | 392 | ||||||
| NCBI gén | 53373 | ||||||
| HGNC | 18182 | ||||||
| OMIM | 609666 | ||||||
| RefSeq | NM_017901 | ||||||
| UniProt | Q9ULQ1 | ||||||
| Egyéb adatok | |||||||
| Lokusz | Chr. 12 q24.21 | ||||||
| |||||||
| két pórusú szegmens 2. csatorna | |||||||
|---|---|---|---|---|---|---|---|
| Azonosítók | |||||||
| Szimbólum | TPCN2 | ||||||
| IUPHAR | 393 | ||||||
| NCBI gén | 219931 | ||||||
| HGNC | 20820 | ||||||
| RefSeq | NM_139075 | ||||||
| UniProt | Q8NHX9 | ||||||
| Egyéb adatok | |||||||
| Lokusz | Chr. 11 q13.1 | ||||||
| |||||||
Két-póruscsatornáinak (TPCS) vannak eukarióta intracelluláris feszültségfüggő és ligand kapuzott kationszelektív ioncsatornák . Az emberi genomban két paralóg ismert , a TPC1 és a TPC2. Emberben a TPC1 -ek nátriumszelektívek, a TPC2 -k pedig nátriumionokat, kalciumionokat és esetleg hidrogénionokat vezetnek. Az üzemi TPC1-ek nem szelektív csatornák. Expressziója találmány szerinti elrendezés találhatók mindkét növényi vakuolumok és állati savas organellumok . Ezek az organellák endoszómákból és lizoszómákból állnak . A TPC-k két transzmembrán, nem ekvivalens tandem Shaker- szerű, pórusképző alegységből képződnek, amelyeket kvázi- tetramerek képzésére dimerizálnak . A kvázi-tetramerek nagyon hasonlóak a tetramerekhez, de nem teljesen egyformák. A TPC -k kulcsfontosságú szerepei közé tartoznak a kalciumfüggő válaszok az izomösszehúzódásban, hormonszekrécióban, megtermékenyítésben és differenciálódásban. A TPC -khez kapcsolódó rendellenességek közé tartozik a membránkereskedelem , a Parkinson -kór , az Ebola és a zsíros máj .
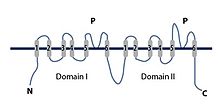
Ahogy a nevükből következik, a TPC csatornáknak két pórusuk van, és a két Shaker-szerű ismétlésükről kaptak nevet, amelyek mindegyike pórustartománnyal rendelkezik. Ez ellentétben áll a két pórusú domén káliumcsatornákkal , amelyek zavaros módon csak egy pórusúak, és azért kaptak nevet, mert minden alegységnek két P (pórus) doménje van az elsődleges szekvenciájában.
Történelem és felfedezés
Bár sok mindent kell még felfedezni a TPC funkcióval kapcsolatban, ezeket alaposan tanulmányozták eddig. Sok kérdés merült fel a TPC csatornák sajátos funkciójával kapcsolatban, valamint azokkal az ionokkal és molekulákkal kapcsolatban, amelyek a legszorosabb kapcsolatban állnak ezekkel a csatornákkal. Ezen ionok egy része nátrium, kalcium és NAADP . A TPC -k jelenlegi ismerete egereken és növényeken, különösen Arabidopsis thaliana -n végzett kísérletekből származik . Ezen túlmenően, mivel ezek a csatornák emlősökben lokalizálódnak, nehéz elektrofiziológiai felvételeket használni rajtuk. Ezért ezeket a TPC csatornákat a sejt alternatív részeiben vagy organelláiban kell kifejezni, például növényi vakuolákban, amelyeket elektrofiziológiai módszerekkel kell vizsgálni - különösen a patch clamp technikával . A növényi vakuolák egyértelmű megjelenítése érdekében a tudósok a fluoreszcens mikroszkópiára támaszkodtak kísérleteik során. Ezen technikák alkalmazásával a tudósok jelentős minőségi adatokat tudtak összegyűjteni annak érdekében, hogy következtetéseket vonjanak le az emlős TPC funkcióiról. Pontosabban, a tudósok arra a következtetésre jutottak, hogy az emberi TPC túlnyomórészt feszültségfüggő nátriumcsatornák, és hogy a PI (3,5) P2, egy endolizoszóma-specifikus foszfoinozitid (PIP), közvetlen aktiválója a TPC csatornáknak, míg az NAADP valójában nem aktivátor, ahogy korábban feltételezték.
Szerkezet és területek
A TPC pórusának torkolatánál négy aminosavmaradék található negatív töltéssel, amelyek kölcsönhatásba léphetnek az áthaladó ionokkal. Ez a webhely túl széles az ionok kiválasztásához. A negatív töltések csoportja alatt található a szelektivitási szűrő, amely nagyrészt hidrofób. Két nem azonos Shaker-szerű pórusképző alegység létezik. Az 1. alegység az 1. feszültségérzékelő tartományból (VSD1), a 2. alegység pedig a 2. feszültségérzékelő tartományból (VSD2) áll. A két alegység tartományt egy EF-kéz domén választja el, amely kalciumion-kötő motívummal rendelkezik. Ez a kötési motívum megkönnyítheti a csatornaaktivációt a citoszol kalciumionok által. A két alegység mindegyike 12 transzmembrán spirálból épül fel. A két központi pórustartomány a feszültségérzékelő tartományokból, a VSD1 és a VSD2 kombinálódik. Mind az N-terminális domén (NTD), mind a C-terminális domén (CTD) a citoszolikus oldalon nyúlik ki, a közepén lévő EF-kéz doménnel együtt, amely a citoplazmába nyúlik. Az EF-kéz domén a VSD1 és VSD2 között elhelyezkedő citoszolba nyúlik be, ahol citoszolos kalcium aktiválhatja. A VSD2 tartomány feszültségérzékeny, és a lumenben lévő kalcium gátolhatja. Ez a konformáció változása az aktiválási állapotból az inaktív állapotba. A hidrofób maradékok két gyűrűje lezárja a pórusüreget a citoplazmától; ez a póruskapu kialakulását eredményezi. A feszültségérzékelők, a szelektivitási szűrő és a kapu összehangoltan működnek együtt, hogy kinyissák és bezárják a TPC -ket az ionvezetés szabályozására.
A VSD2 tartomány normál feszültségérzékelő motívumot, R1, R2 és R3 argininmaradékokat és S10 alfa-hélixet tartalmaz más feszültségfüggő ioncsatorna-struktúrák tekintetében, de ez a tartomány különálló konformációt alkalmaz a feszültségérzékelő nyugalmi állapotában. A luminális kalcium TPC1 inhibitorként működik, megakadályozva az ionvezetést. A luminális oldalon két kalciumkötő hely található a VSD2 számára. Az első webhely nem érinti a csatornát. A 2. hely, amely a VSD2 és a pórustartomány maradékaiból áll, gátolja a csatornát azáltal, hogy a feszültségfüggést pozitívabb feszültségekre helyezi át.
A TPC -k aktiválódását a transzmembrán potenciál csökkenése vagy a citoszol kalciumkoncentrációjának növekedése indukálja. Az alacsony lumen pH és alacsony kalciumkoncentráció gátolhatja ezeket a csatornákat. A TPC-k foszforilációs csatornák is mind az állatokban, mind a növényekben. A foszforilációs helyek az N-terminális és a C-terminális doménben találhatók. Ezek a terminálok úgy vannak elhelyezve, hogy alloszterikus változást biztosítsanak annak érdekében, hogy a citoszolból származó kalcium aktiválja őket.
Az emberi és növényi TPC-k multimodálisak a vezetőképesség szempontjából. A csatornanyitási mechanizmus valószínűleg hozzájárul a kalciumkoncentrációk, a feszültség és a foszforreguláció integrációjának kombinációjához annak érdekében, hogy szabályozza az ionok TPC -n keresztüli vezetését.
Biológiai szerepek (funkció/diszfunkció)
A kétpórusú csatornákat sejtbiológiai módszerekkel, endolizoszomális tapaszfogó technikákkal és számos más módszerrel elemezték funkcióik tanulmányozására. Ezekből azt sugallták, hogy a TPC -k némi erővel rendelkeznek az endolizoszomális vezikulák luminális pH -jának szabályozásában. Ha a TPC2 expressziója csökken vagy kiüt, a melanin termelődése és ezáltal a melanoszomális pH megnövekszik, és ha a TPC2 expressziója megnő, akkor kevesebb a melanin.
A TPC -k is részt vesznek a tápanyagok kimutatásában, mivel alkotóelemként aktívak a tápanyagok állapotának azonosításában. Ezt a TPC -k és a rapamicin (mTOR) emlős/mechanisztikus célpontjai közötti közvetlen kommunikáció teszi lehetővé, amelyek a sejtek oxigén-, tápanyag- és energiaszintjének kimutatásához kapcsolódnak, és ezáltal segítik az anyagcsere szabályozását. A TPC -k így játszanak szerepet ebben a fiziológiai szabályozásban ezen interakció révén.
A TPC -k szabályozzák a nátrium- és kalciumion -vezetőképességet, az intravaszkuláris pH -t és az emberkereskedelem ingerlékenységét. Kimutatták, hogy a második hírvivő nikotinsav -adenin -dinukleotid -foszfát ( NAADP ) közvetíti a kalcium felszabadulást ezekből a savas organellákból a TPC -n keresztül. A TPC2-k NAADP-kapualizált kalcium-felszabadító csatornák, ahol ezeket a TPC-áramokat blokkolhatják az NAADP-antagonisták. A TCP2 kritikus szerepet játszik az endocitózisban, lehetővé téve a SARS-CoV-2 vírus sejtekbe jutását .
Ezeknek a csatornáknak a leütéséből különböző betegségek fordulhatnak elő, az anyagcsere- és általános fertőző betegségektől a rákig. A TPC hiánya miatti kóros állapotokat a következő szakaszok tárgyalják.
Membránkereskedelem
A TPC -k szerves szerepet játszanak a membránkereskedelem útjaiban. Ezek endoszómákra és lizoszómákra tagolódnak , különösen endo-lizoszomális fúziókban. A TPC -kereskedelem tevékenységét megőrizték; módosítja találmány szerinti elrendezés befolyásolja közlekedés a sejten belüli útvonal. A TPC -k pontos szerepe a sejttípusra és a kontextusra jellemző. Ezek a csatornák átjárják a kalciumot, így Ca2+ ioncsatornaként működnek. Amikor a NAADP - a TPC -k második hírvivője - stimulálja, a kalcium felszabadul a citoszolba. A kalcium beáramlása szabályozza az endoszóma és a lizoszómák közötti fúziót, és közvetíti az emberkereskedelem eseményeit. Amikor a TPC funkciók elvesznek, a szubsztrátok felhalmozódnak, és torlódást okoznak. Amikor a TPC -k funkciója megnő, a lizoszóma megnagyobbodik - ami logikusan összefügg az endoszóma és a lizoszóma közötti megnövekedett fúziós eseményekkel.
Parkinson kór
A membránkereskedelem diszfunkciójának egyik következménye Parkinson -kórhoz vezet . Az LRRK2 enzim mutációi megváltoztatják az NAADP -tól és a TPC2 -től függő autofágiat . A mutáció NAADP által kiváltott jelekkel növeli a Ca2+ áramlását a TPC2 -n keresztül. Ez a jelátviteli növekedés a lizoszómák méretének növekedéséhez vezet a megnövekedett fúziós sebesség és mennyiség miatt. A lizoszóma tehát nem képes úgy lebontani az összetevőket, ahogy kellene. Ez a képtelenség a betegség kialakulásával jár. Mivel a TPC2 létfontosságú szerepet játszik a Parkinson -kór ezen specifikus mechanizmusában, potenciálisan terápiás célpont lehet.
Ebola
Az ebolavírus kihasználja a gazdasejt endocitotikus membrán kereskedelmét, így a TPC -k potenciális gyógyszercélpontként maradnak. Ebolavírus lép be a sejtekbe micropinocytosis az endoszomális hólyagocskák. Az endoszomális vezikulába való belépés után az Ebolavirus membrán összeolvad az endoszomális membránnal, hogy a vírustartalmat a citoszolba engedje, mielőtt az endoszóma összeolvadhat a lizoszómával. A vírus endoszómákban való mozgásához Ca2+ szükséges. Mivel a NAADP szabályozza az endoszómák érését a kalcium TPC -n keresztül történő felszabadulása révén, a TPC -k normális működése lehetővé teszi az ebolavírus elmenekülését. Ezért, amikor a TPC -k nem működnek, az ebolavírus nem tud menekülni, mielőtt az endoszóma és a lizoszóma összeolvad. Valójában, ha az egereket tetradinnal kezelik, a fertőzés gátolt. Ez azért van, mert a tetradin blokkolja a kalcium felszabadulásának TPC működését, és így az ebolavírusok a lizoszóma által lebontandó endoszomális hálózatban vannak.
Kövér máj
A TPC -k részt vettek a zsíros májbetegségekben, mint például a NAFLD és a NASH . Mivel a TPC2 kationcsatorna az endocitotikus membránkereskedelemhez, a TPC -k hozzájárulnak az LDL -molekulák forgalmazásához azok lebontásához és újrahasznosításához. Ez elsősorban a májban fordul elő. A lebomlási út miatt az LDL endoszómákba és lizoszómákba kerül - ahol a TPC -k találhatók. A TPC mechanizmus ismét lehetővé teszi a kalcium beáramlását az endoszómák és a lizoszómák (ahol az LDL lebomlik) fúziójához. Ha a TPC -k nincsenek jelen, vagy nem működnek megfelelően, a degradációs útvonal hibás forgalmat eredményez. Fúziós esemény nélkül az LDL felhalmozódik a májsejtekben. A TPC -k elvesztése a máj sárga elszíneződésének oka, amely a zsíros máj kifejeződése, amely májkárosodást jelez.
Hivatkozások
Külső linkek
- TPCN1+fehérje,+humán az Egyesült Államok Országos Orvostudományi Könyvtárának orvosi tantárgyai (MeSH)
- AtTPC1+csatorna,+Arabidopsis az Egyesült Államok Országos Orvostudományi Könyvtárának orvosi tantárgyai (MeSH)
- "CatSper és kétpórusú csatornák" . IUPHAR receptorok és ioncsatornák adatbázisa . Nemzetközi Alap- és Klinikai Farmakológiai Szövetség.