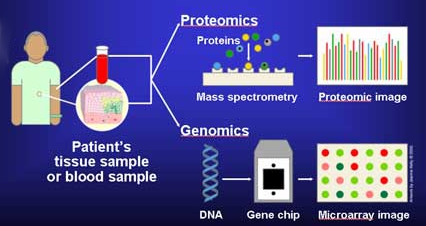
Molekuláris diagnosztika - Molecular diagnostics
A molekuláris diagnosztika olyan technikák gyűjteménye, amelyeket a genomban és a proteomban található biológiai markerek elemzésére használnak , és hogy sejtjeik hogyan fejezik ki génjeiket fehérjékként , alkalmazva a molekuláris biológiát az orvosi vizsgálatokra . Az orvostudományban ezt a technikát használják a betegségek diagnosztizálására és nyomon követésére, a kockázatok felderítésére és annak eldöntésére, hogy melyik terápia a legjobban működik az egyes betegek számára, a mezőgazdasági biológiai biztonságban pedig hasonlóan a növény- és állatállomány betegségeinek nyomon követésére , a kockázat becslésére és a karantén- intézkedések meghozatalára. .
A páciens sajátosságainak és betegségének elemzésével a molekuláris diagnosztika a személyre szabott orvoslás kilátásait kínálja . Ezek a tesztek számos orvosi szakterületen hasznosak , beleértve a fertőző betegségeket , az onkológiát , a humán leukocita -antigén -tipizálást (amely az immunfunkciót vizsgálja és megjósolja ), a véralvadást és a farmakogenomikát - ezeknek a gyógyszereknek a genetikai előrejelzése. Ezek átfedésben vannak a klinikai kémiával (testnedvek orvosi vizsgálatai).
Történelem
A molekuláris biológia területe a huszadik század végén nőtt, ahogy klinikai alkalmazása is. 1980 -ban Yuet Wai Kan és mtsai . olyan prenatális genetikai tesztet javasolt a thalassémiára, amely nem a DNS -szekvenáláson alapult - akkor még gyermekkorában -, hanem a restrikciós enzimeken, amelyek elvágják a DNS -t, ahol felismerik a specifikus rövid szekvenciákat, és különböző hosszúságú DNS -szálat hoznak létre, attól függően, hogy melyik allél (genetikai variáció) a magzat megszállott. A nyolcvanas években ezt a kifejezést olyan cégek nevében használták, mint a Molecular Diagnostics Incorporated és a Bethseda Research Laboraties Molecular Diagnostics .
A kilencvenes években az újonnan felfedezett gének azonosítása és a DNS -szekvenálás új technikái a molekuláris és genomiális laboratóriumi orvoslás külön területének megjelenéséhez vezettek; 1995 -ben megalakult a Molekuláris Patológia Szövetsége (AMP), hogy felépítse. 1999-ben az AMP társalapította a The Journal of Medical Diagnostics-t . Az Informa Healthcare 2001-ben indította el a szakértői véleményeket az orvosi diagnosztikában . 2002-től kezdődően a HapMap projekt információkat gyűjtött az emberi populációban ismétlődő egybetűs genetikai különbségekről-az egyetlen nukleotid polimorfizmusokról- és a betegséghez való viszonyukról. 2012 -ben a Thalassemia molekuláris diagnosztikai technikái genetikai hibridizációs teszteket alkalmaznak az egyén betegségét okozó specifikus egyetlen nukleotid polimorfizmus azonosítására .
Ahogy a molekuláris diagnosztika kereskedelmi alkalmazása egyre fontosabbá vált, úgy a genetikai felfedezések szabadalmaztatásáról szóló vita is a középpontjában áll . 1998-ban az Európai Unió által a 98/44 / ECclarified hogy szabadalmakat DNS-szekvenciák voltak megengedhető. 2010 -ben az Egyesült Államokban az AMP beperelte a Myriad Genetics -et, hogy megkérdőjelezze az utóbbi szabadalmait két, a mellrákhoz kapcsolódó BRCA1 , BRCA2 gén tekintetében . 2013 -ban az Egyesült Államok Legfelsőbb Bírósága részben egyetértett azzal , hogy a természetben előforduló génszekvencia nem szabadalmaztatható.
Technikák
Fejlesztés kutatási eszközökből
A molekuláris biológiai vizsgálati eszközök iparosítása praktikussá tette ezek használatát klinikákon. A miniatürizálás egyetlen kézi eszközzé orvosi diagnosztikát hozhat a klinikára és az irodába vagy otthonba. A klinikai laboratórium magas szintű megbízhatóságot követel meg; A diagnosztika akkreditációt igényelhet, vagy az orvosi eszközökre vonatkozó előírások hatálya alá tartozik. 2011 -től néhány amerikai klinikai laboratórium ennek ellenére "csak kutatási célokra" értékesített vizsgálatokat használt.
A laboratóriumi folyamatoknak meg kell felelniük az előírásoknak, mint például a klinikai laboratórium javításának módosításai , az egészségbiztosítás hordozhatóságáról és elszámoltathatóságáról szóló törvény , a jó laboratóriumi gyakorlat , valamint az Amerikai Egyesült Államok Élelmezési és Gyógyszerügyi Hatóságának előírásai. A laboratóriumi információkezelő rendszerek segítenek ezeknek a folyamatoknak a nyomon követésében. A szabályozás a személyzetre és az ellátmányra is vonatkozik. 2012 -től tizenkét amerikai állam megköveteli a molekuláris patológusok engedélyét; számos tanács, például az Amerikai Orvosi Genetikai Tanács és az Amerikai Patológiai Tanács igazolja a technológusokat, a felügyelőket és a laboratóriumi igazgatókat.
Az automatizálás és a minta vonalkódja maximalizálja az átvitelt, és csökkenti a hiba vagy szennyeződés lehetőségét a kézi kezelés és az eredményjelentés során. Már rendelkezésre állnak olyan eszközök, amelyek elvégzik a vizsgálatot az elejétől a végéig.
Vizsgálatok
A molekuláris diagnosztika in vitro biológiai vizsgálatokat , például PCR- ELISA-t vagy fluoreszcens in situ hibridizációt alkalmaz . A vizsgálat kimutat egy molekulát, gyakran alacsony koncentrációban, amely a betegség vagy a kockázat jelzője a betegtől vett mintában. A minta elemzése előtti megőrzése kritikus. A kézi kezelést minimálisra kell csökkenteni. A törékeny RNS -molekula bizonyos kihívásokat jelent. A gének fehérjeként történő expressziójának celluláris folyamatának részeként a génexpresszió mértékét kínálja, de sebezhető a hidrolízissel és az állandóan jelenlévő RNS-enzimekkel történő lebontással . A mintákat gyorsan lefagyaszthatjuk folyékony nitrogénben, vagy inkubálhatjuk tartósítószerekben.
Mivel a molekuláris diagnosztikai módszerek érzékeny markereket képesek kimutatni, ezek a vizsgálatok kevésbé tolakodóak, mint a hagyományos biopsziák . Például, mivel sejtmentes nukleinsavak léteznek az emberi plazmában , elegendő egy egyszerű vérminta a daganatokból, transzplantátumokból vagy egy magzatból származó genetikai információk mintavételéhez. Sok, de nem minden, nukleinsav -kimutatáson alapuló molekuláris diagnosztikai módszer polimeráz láncreakciót (PCR) használ a nukleinsavmolekulák számának nagymértékű növelésére, ezáltal felerősítve a betegmintában lévő célszekvenciát (szekvenciákat). A PCR olyan módszer, amelynek segítségével a templát DNS -t szintetikus primerek, DNS -polimeráz és dNTP -k segítségével amplifikálják. A keveréket legalább 2 hőmérséklet között ciklizáljuk: magas hőmérséklet a kétszálú DNS egyszálú molekulákká való denaturálásához, és alacsony hőmérséklet ahhoz, hogy a primer hibridizáljon a templáthoz, és a polimeráz meghosszabbítsa a primert. Minden hőmérsékleti ciklus elméletileg megduplázza a célszekvencia mennyiségét. A szekvenciavariációk PCR alkalmazásával történő kimutatása jellemzően olyan oligonukleotid reagensek tervezését és használatát foglalja magában, amelyek hatékonyabban felerősítik a kérdéses változatot, mint a vad típusú szekvencia. A PCR jelenleg a legszélesebb körben alkalmazott módszer a DNS -szekvenciák kimutatására. A marker detektálása valós idejű PCR-t, közvetlen szekvenálást, microarray-chipeket- előre gyártott chipeket, amelyek sok markert tesztelnek egyszerre, vagy MALDI-TOF-t-használhat. Ugyanez az elv vonatkozik a proteómra és a genomra is . A nagy áteresztőképességű fehérje tömbök komplementer DNS-t vagy antitesteket használhatnak a kötéshez, és így sok különböző fehérjét tudnak párhuzamosan kimutatni. A molekuláris diagnosztikai tesztek érzékenysége, fordulata, költsége, lefedettsége és hatósági jóváhagyása igen eltérő. Különbözőek az őket használó laboratóriumokban alkalmazott validációs szintben is. Ezért szükség van a hatósági követelményeknek megfelelő, erős helyi érvényesítésre és a megfelelő kontrollok alkalmazására, különösen akkor, ha az eredmény felhasználható a beteg kezelési döntésének megalapozására.
Előnyök
Születés előtti
A hagyományos prenatális tesztek a kromoszóma -rendellenességek, például a Down -szindróma kimutatására a kromoszómák számának és megjelenésének - a kariotípusnak - az elemzésén alapulnak . A molekuláris diagnosztikai tesztek, mint például a microarray összehasonlító genomiális hibridizáció, helyette egy DNS-mintát vizsgálnak, és a plazmában lévő sejtmentes DNS miatt kevésbé invazívak lehetnek, de 2013-tól még mindig kiegészítik a hagyományos teszteket.
Kezelés
A páciens egyes nukleotid polimorfizmusai közül néhány - a DNS -ében mutatkozó kis különbségek - segíthet megjósolni, hogy milyen gyorsan metabolizálják az egyes gyógyszereket; ezt farmakogenomikának hívják . Például a CYP2C19 enzim számos gyógyszert, például a Clopidogrel elleni véralvadásgátlót metabolizálja aktív formájukba. Néhány beteg polimorfizmussal rendelkezik a 2C19 gén bizonyos helyein, amelyek gyengébb metabolizálóvá teszik ezeket a gyógyszereket; az orvosok megvizsgálhatják ezeket a polimorfizmusokat, és megtudhatják, hogy a gyógyszerek teljes mértékben hatékonyak lesznek -e az adott beteg számára. A molekuláris biológia fejlődése segített kimutatni, hogy egyes szindrómák, amelyeket korábban egyetlen betegségnek minősítettek, valójában több altípus, teljesen különböző okokkal és kezeléssel. A molekuláris diagnosztika segíthet az altípus-például fertőzések és rákok-diagnosztizálásában, vagy egy öröklött összetevővel rendelkező betegség genetikai elemzésében, például Silver-Russell-szindrómában .
Fertőző betegség
A molekuláris diagnosztikát olyan fertőző betegségek azonosítására használják, mint a chlamydia , az influenza vírus és a tuberkulózis ; vagy specifikus törzsek, például a H1N1 vírus vagy a SARS-CoV-2 . A genetikai azonosítás gyors lehet; például egy hurok által közvetített izoterm amplifikációs teszt diagnosztizálja a malária parazitát, és elég strapabíró a fejlődő országok számára. De a genom -elemzés ezen fejlődése ellenére 2013 -ban még mindig gyakrabban azonosítják a fertőzéseket más módszerekkel - proteómjuk, bakteriofágjuk vagy kromatográfiás profiljuk. A molekuláris diagnosztikát arra is használják, hogy megértsék a kórokozó specifikus törzsét - például azáltal, hogy kimutatják, hogy mely gyógyszerrezisztencia -gének birtokában vannak -, és ezáltal milyen terápiákat kell kerülni. Ezenkívül metagenomikus, következő generációs szekvenáláson alapuló vizsgálatok is végrehajthatók a patogén szervezetek torzítás nélküli azonosítására.
Betegségkockázat -kezelés
A beteg genomja tartalmazhat öröklött vagy véletlenszerű mutációt, amely befolyásolja a betegség kialakulásának valószínűségét a jövőben. Például, Lynch-szindróma egy genetikai betegség , amely hajlamossá teszi a betegek a kolorektális és más rákos betegségek; a korai felismerés szoros megfigyeléshez vezethet, amely javítja a beteg esélyét a jó eredményre. A szív- és érrendszeri kockázatot biológiai markerek jelzik, és a szűréssel mérhető annak kockázata, hogy egy gyermek genetikai betegséggel, például cisztás fibrózissal születik . A genetikai vizsgálat etikailag összetett: előfordulhat, hogy a betegek nem akarják azt a stresszt, hogy ismerik a kockázatukat. Azokban az országokban, ahol nincs általános egészségügyi ellátás, egy ismert kockázat növelheti a biztosítási díjakat.
Rák
A rák a sejtfolyamatokban bekövetkező változás, amely miatt a daganat ellenőrizetlenül nő ki. A rákos sejtek néha mutációkat mutatnak az onkogénekben , például a KRAS-ban és a CTNNB1-ben (β-katenin). A rákos sejtek molekuláris aláírásának - a DNS -nek és a hírvivő RNS -en keresztüli expressziós szintjének - elemzése lehetővé teszi az orvosok számára, hogy jellemezzék a rákot, és kiválaszthassák betegeik számára a legjobb terápiát. 2010 -től kezdve feltörekvő technológia az olyan vizsgálatok, amelyek specifikus fehérje marker molekulák elleni antitesteket tartalmaznak; reményeket fűznek ezekhez a multiplex vizsgálatokhoz, amelyek egyszerre sok markert képesek mérni. További lehetséges jövőbeni biomarkerek közé tartoznak a mikro RNS molekulák , amelyekből a rákos sejtek többet expresszálnak, mint az egészségesek.
A rák túlzott molekuláris okokkal és állandó fejlődéssel járó betegség. A betegség heterogenitása is fennáll még egyénben is. A rák molekuláris vizsgálatai bizonyították a vezetőmutációk jelentőségét a daganatok növekedésében és áttéteiben. A szekvenciaváltozások észlelésére számos technológiát fejlesztettek ki a rákkutatáshoz. Ezeket a technológiákat általában három megközelítésbe lehet csoportosítani: polimeráz láncreakció (PCR), hibridizáció és következő generációs szekvenálás (NGS). Jelenleg sok PCR és hibridizációs vizsgálatot hagyott jóvá az FDA in vitro diagnosztikaként. Az NGS vizsgálatok azonban még a klinikai diagnosztika korai szakaszában vannak.
A rák molekuláris diagnosztikai tesztjének elvégzéséhez az egyik jelentős probléma a DNS -szekvencia -variációk észlelése. A diagnosztikához használt daganatbiopsziás minták mindig 5% -ban tartalmazzák a célváltozatot a vad típusú szekvenciához képest. Továbbá a perifériás vérből vagy vizeletből származó, nem invazív alkalmazásokhoz a DNS -tesztnek elég specifikusnak kell lennie ahhoz, hogy mutációkat észleljen 0,1%-nál kisebb variáns allél gyakorisággal.
Jelenleg a hagyományos PCR optimalizálásával új találmány született, az amplifikáció-refrakter mutációs rendszer (ARMS) egy módszer a DNS-szekvencia-variánsok rákos kimutatására. Az ARMS elve az, hogy a DNS -polimerázok enzimatikus kiterjesztési aktivitása nagyon érzékeny a primer 3 'vége közelében lévő eltérésekre. Sok különböző vállalat fejlesztett ki diagnosztikai teszteket ARMS PCR primerek alapján. Például a Qiagen therascreen, a Roche cobas és a Biomerieux THxID kifejlesztett FDA által jóváhagyott PCR teszteket a tüdő-, vastagbélrák- és áttétes melanoma mutációk kimutatására a KRAS, EGFR és BRAF génekben. IVD készleteiket alapvetően az FFPE szövetből kivont genomiális DNS -en validálták.
Vannak olyan mikrotömbök is, amelyek hibridizációs mechanizmust használnak a rák diagnosztizálására. Több mint egymillió különböző szondát lehet szintetizálni egy tömbön az Affymetrix Genechip technológiájával, kimutatási határa egy -tíz mRNS -példány lyukanként. Az optimalizált mikrotömbök jellemzően úgy tekinthetők, hogy megismételhető relatív mennyiségi meghatározást eredményeznek a különböző célpontok között. Jelenleg az FDA már jóváhagyott számos diagnosztikai vizsgálatot, amelyek mikrotömböket használnak: Az Agendia MammaPrint vizsgálatai tájékoztathatják az emlőrák kiújulásának kockázatát azáltal, hogy profilozzák az emlőrákhoz kapcsolódó 70 gén expresszióját; Az autogenomikai INFNITI CYP2C19 vizsgálat profilozhatja a genetikai polimorfizmusokat, amelyek hatása nagymértékben befolyásolja az antidepresszánsokra adott terápiás választ; és az Affymetrix CytoScan Dx a kromoszómális mutációk elemzésével értékelheti az értelmi fogyatékosságokat és a veleszületett rendellenességeket.
A jövőben a rák diagnosztikai eszközei valószínűleg a következő generációs szekvenálásra (NGS) fognak összpontosítani. A DNS- és RNS -szekvenálás felhasználásával a rákdiagnosztikában a molekuláris diagnosztikai eszközök területén a technológia jobban fejlődik. Bár az NGS áteresztőképessége és ára drámaian csökkent az elmúlt 10 évben, nagyjából 100-szorosára, legalább 6 nagyságrenddel távol vagyunk attól, hogy teljes genomszinten mély szekvenálást végezzünk. Jelenleg az Ion Torrent fejlesztett ki néhány NGS panelt a transzlációs AmpliSeq alapján, például az Oncomine Comprehensive Assay. A rákkal kapcsolatos gének mély szekvenálásának felhasználására összpontosítanak a ritka szekvenciaváltozatok kimutatására.
A molekuláris diagnosztikai eszköz használható a rák kockázatának felmérésére. Például a Myriad Genetics által készített BRCA1/2 teszt felméri a nőket az emlőrák élettartamára. Ezenkívül egyes rákos megbetegedéseket nem mindig alkalmaznak egyértelmű tünetekkel. Hasznos elemezni az embereket, ha nem mutatnak nyilvánvaló tüneteket, és így korai stádiumban fel tudják fedezni a rákot. Például a ColoGuard teszt felhasználható az 55 év feletti emberek vastagbélrák szűrésére . A rák hosszú távú betegség, különböző progresszió lépésekkel, molekuláris diagnosztikai eszközök használhatók a rák progressziójának előrejelzésére. Például a Genomic Health által végzett OncoType Dx teszt megbecsülheti az emlőrák kockázatát. Technológiájuk tájékoztathatja a betegeket, hogy szükség esetén vegyenek igénybe kemoterápiát azáltal, hogy megvizsgálják az emlőrák biopsziás szövetének RNS -expressziós szintjét.
A DNS molekuláris diagnosztikájának növekvő kormányzati támogatásával várhatóan hamarosan egyre több klinikai DNS -kimutatási vizsgálat lesz elérhető a rákos megbetegedések esetében. Jelenleg a rákdiagnosztikai kutatások gyorsan fejlődnek, célja az alacsonyabb költségek, kevesebb időfogyasztás és egyszerűbb módszerek az orvosok és a betegek számára.
Lásd még
- Molekuláris medicina (a betegségek molekuláris megértésének tágabb területe)
- Molekuláris patológia
- Laboratórium által kifejlesztett teszt
- Patogenezis
- Patogenológia
- Patológia
- Precíziós gyógyszer
- Személyre szabott orvoslás