Nemfém - Nonmetal
A kémiában a nemfém olyan kémiai elem, amely általában egy vagy több elektronot nyer, amikor egy fémmel reagál, és savat képez oxigénnel és hidrogénnel kombinálva . Szobahőmérsékleten a fele gáz, egy ( bróm ) folyadék, a többi szilárd anyag. A legtöbb szilárd nemfém fényes, míg a bróm színes, a többi gáznemű nemfém pedig színes vagy színtelen. A szilárd anyagok vagy kemények és törékenyek, vagy lágyak és omlósak, és általában rossz hő- és áramvezetők, és nem rendelkeznek szerkezeti felhasználással (mint általában a nemfémek esetében).
Nincs egyetemes egyetértés arról, hogy mely elemek nemfémek; a számok általában tizennégytől huszonháromig terjednek, az érdeklődési kritériumtól vagy kritériumoktól függően.
A nemfémes elemek különféle fajtái közé tartozik például az i. Nemesgáz ; (ii) halogének ; (iii) olyan elemek, mint a szilícium , amelyeket néha helyette metalloidoknak neveznek ; és (iv) több megmaradt nemfém, például hidrogén és szelén . Ez utóbbiaknak nincs széles körben elismert gyűjtőneve, és a továbbiakban informálisan "nem besorolt nemfémek" -nek nevezzük őket. A metalloidok túlnyomórészt (gyenge) nemfémes kémiával rendelkeznek. A nem besorolt nemfémek nettó alapon mérsékelten nemfémesek. A halogéneket, például a brómot, erősebb nemfémes tulajdonságok jellemzik, és hajlamosak túlnyomórészt ionos vegyületeket képezni fémekkel. Az olyan nemesgázokat, mint a xenon , megkülönbözteti az a vonakodásuk, hogy vegyületeket alkossanak.
A különböző nemfémek közötti megkülönböztetés nem abszolút. A határátfedések, beleértve a metalloidokat is, külső elemként fordulnak elő a nemfémek minden fajtája között, amelyek kevésbé egyértelmű, hibridszerű vagy atipikus tulajdonságokat mutatnak vagy kezdenek mutatni.
Bár ötször több elem fém, mint nemfém, a nemfémek közül kettő - hidrogén és hélium - a megfigyelhető világegyetem tömegének körülbelül 99% -át teszi ki . Egy másik nemfém, az oxigén teszi ki a földkéreg , az óceánok és a légkör majdnem felét .
A nemfémek nagyrészt sok szerepet töltenek be az élet fenntartásában. Az élő szervezetek szinte teljes egészében nemfémekből, hidrogénből, oxigénből, szénből és nitrogénből állnak . A nemfémek szinte univerzális felhasználása az orvostudományban és a gyógyszeriparban történik.
Meghatározás és alkalmazható elemek
A nemfémnek nincs szigorú meghatározása. Általánosságban elmondható, hogy minden olyan elem, amely nem rendelkezik túlsúlyban olyan fémes tulajdonságokkal, mint a csillogás, a deformálhatóság és a jó elektromos vezetőképesség, nem fémnek tekinthető. A szerzők között némi eltéréssel találkozhatunk azzal kapcsolatban, hogy mely elemeket tekintjük nemfémnek.
A tizennégy, ténylegesen nem fémként elismert elem a hidrogén, az oxigén, a nitrogén és a kén; a korrozív halogének, fluor , klór , bróm és jód; és a nemesgázok hélium, neon , argon , kripton , xenon és radon . További kilenc elem számolható nemfémként, beleértve a szenet, a foszfort és a szelént ; és az egyébként általánosan metalloidként elismert elemek, nevezetesen a bór ; szilícium és germánium ; arzén és antimon ; és tellúr , összesen huszonhárom nemfémet hozva.
Az asztatint , az ötödik halogént ritkán és intenzív radioaktivitása miatt gyakran figyelmen kívül hagyják; itt fémnek tekintik. A szupersúlyos elemek, a kopernicium (Z = 112) és az oganesson (118) nemfémesek lehetnek; tényleges állapotuk nem ismert.
Mivel 118 elem ismert, 2021. szeptemberétől a nemfémeket többszörösen felülmúlják a fémek.
Bór, itt β- romboéderes fázisa formájában látható (termodinamikailag legstabilabb formája )
Szén (mint grafit ). A grafit rétegeiben lévő delokalizált vegyérték -elektronok fémes megjelenést kölcsönöznek.
Folyékony oxigén (LOX) forráspontja. A LOX nagyobb sűrűsége növeli a gerjesztő kölcsönhatások valószínűségét két O 2 molekula és egy foton között, amelyek kék színt eredményeznek.
Halványsárga folyékony fluort tartalmazó kémcső kriogén fürdőben . Ellentétben a szomszédos oxigénnel, amely színtelen, mint a gáz, a fluor gáz formájában megőrzi sárga színét.
A kifejezés eredete és használata

A fémek és a nemfémek közötti különbség bonyolult módon a természetes anyagok nyers felismeréséből adódott . Így az anyag tiszta anyagokra és keverékekre osztható; a tiszta anyagokat végül vegyületekként és elemekként lehetett megkülönböztetni; és a „fém” elemeket úgy tűnt, hogy nagyjából megkülönböztethető attribútumokat, hogy más elemek nem, ilyen például a jól vezetik a hőt , vagy azok „ földből ” ( oxidok ), így az alap vizes oldatok, égetett (CaO), például. A nemfém szó használata egészen Lavoisier 1789 -es Traité élémentaire de chimie című művéhez vezethető vissza, amelyben megkülönböztette az egyszerű fémes és a nemfémes anyagokat.
A koncepció finomítása
A fémek és a nemfémek közötti különbség finomítására a tulajdonságok egy vagy több típusát használták, többek között:
- Fizikai - olvaszthatóság , alakíthatóság és hajlékonyság ; homályosság ; tömeges koordinációs szám ; minimális gerjesztési potenciál ; hangzás ; fizikai állapot ; kritikus hőmérséklet ; Goldhammer-Herzfeld fémességi kritériumarány ; a párolgás entalpiája ; folyadéktartomány ; az ellenállás hőmérsékleti együtthatója ; atomi vezetőképesség ; csomagolási hatékonyság ; 3D elektromos vezetőképesség; elektromos vezetőképesség abszolút nullánál; hővezető képesség ;
- Kémiai - kation kialakulását; oxidok sav-bázis jellege ; szulfátképződés ; savakban való oldhatóság; vagy
- Elektromos - elektronkonfiguráció és sávszerkezet .
Johnson megjegyezte, hogy a fizikai tulajdonságok mutathatják legjobban az elem fémes vagy nemfémes tulajdonságait, azzal a megkötéssel, hogy számos kétértelmű esetben más tulajdonságokra lesz szükség.
Kneen és al. hozzátette, hogy:
- „Csupán a fémesség kritériumának megállapítására és alkalmazására van szükség… sok tetszőleges osztályozás lehetséges, amelyek többsége, ha ésszerűen választják, hasonlóak, de nem feltétlenül azonosak… a kritérium relevanciáját csak a hasznosság alapján lehet megítélni. a kapcsolódó osztályozás. "
Miután létrejött a "két nagy elemosztály" megkülönböztetésének alapja, a nemfémek azok, amelyek kisebb -nagyobb mértékben nem rendelkeznek a fémek tulajdonságaival.
Tulajdonságok
Fizikai
| Csoport | ||||
|---|---|---|---|---|
| 13 | 14 | 15 | 16 | 17 |
| B 38 | C 17 | |||
| Al 74 | Si 34 | S 19 | ||
| Ga 39 | Ge 34 | Ahogy 38 | Se 24 | Br 15 |
| 68 -ban | Sn 53 | Sb 41 | Te 36 | Én 24 |
| Tl 74 | 74. oldal | Bi 43 | Po 53 | 74 évesen |
| A legtöbb fém, például a szürke cellában lévő fémek, szorosan tömörített, centrikus szimmetrikus szerkezetűek, fém kötéssel és legalább 68%-os csomagolási hatékonysággal. A nemfémek és egyes közeli fémek (Ga, Sn, Bi, Po) nyitottabb irányú szerkezetekkel rendelkeznek, amelyek kovalens vagy részleges kovalens kötéssel rendelkeznek, és ezt követően alacsonyabb tömörítési sűrűséggel rendelkeznek . | ||||
Fizikailag a nemfémek a legstabilabb formájukban léteznek vagy poliatomikus szilárd anyagként (például szén), nyílt csomagolású formában; kétatomos molekulák, például hidrogén (gáz) és bróm (folyadék); vagy egyatomos gázok (például neon). Általában kis atomi sugaruk van. A fémek ezzel szemben szinte mind szilárdak és szorosan csomagoltak, és többnyire nagyobb atom sugarúak. Más, mint a kén, a szilárd nemfémek van egy submetallic megjelenése és törékeny , szemben a fémek, amelyek fényes , és általában képlékeny vagy képlékeny . A nemfémek általában kisebb sűrűségűek, mint a fémek; többnyire rosszabb hő- és villamosvezetők ; és általában lényegesen alacsonyabb az olvadáspontjuk és forráspontjuk .
A fémek és a nemfémek közötti fizikai különbségek a belső és külső atomi erőkből fakadnak. Belsőleg az atom nukleáris töltése a valenciaelektronjait tartja a helyén. Külsőleg ugyanazok az elektronok vonzó erőknek vannak kitéve a közeli atomok nukleáris töltéseiből. Ha a külső erők nagyobbak vagy egyenlők, mint a belső erő, akkor a valenciaelektronok várhatóan vándorlóvá válnak, és fémes tulajdonságokat jósolnak. Ellenkező esetben nemfémes tulajdonságok várhatók.
Kémiai
Kémiai szempontból a nemfémek többnyire nagyobb ionizációs energiával , nagyobb elektron affinitással , magasabb elektronegativitási értékekkel és magasabb standard redukciós potenciállal rendelkeznek, mint a fémek. Itt és általában, minél nagyobb egy elem ionizációs energiája, elektron -affinitása, elektronegativitása vagy standard redukciós potenciálja, annál nemfémesebb az elem.
A kémiai reakciók során a nemfémek hajlamosak elektronok megszerzésére vagy megosztására, ellentétben a fémekkel, amelyek hajlamosak elektronokat adni. Pontosabban, és mivel a stabilitás a nemesgázok, nemfémek általában szert elektronok száma elegendő ahhoz, hogy ezek a elektronszerkezet az alábbi nemesgáz mivel fémek hajlamosak elveszteni elektronok elegendő hagyja azokat az elektron konfiguráció az előző nemesgáz . A nemfémes elemeknél ezt a tendenciát a duett és az oktett hüvelykujjszabályai foglalják magukba (a fémek esetében pedig kevésbé szigorúan követett 18 elektron szabály ). A nemfémek egyik legfontosabb tulajdonsága, hogy soha nem képeznek bázikus oxidokat; oxidjaik általában savasak. Ezenkívül a szilárd nemfémek (beleértve a metalloidokat) salétromsavval reagálva oxidot (szén, szilícium, kén, antimon és tellúr) vagy savat (bór, foszfor, germánium, szelén, arzén, jód) képeznek.
| Vonatkozás | Nemfémek | Fémek |
|---|---|---|
| A vizes oldatban |
Anionok vagy oxianionok formájában léteznek |
Léteznek kationok |
|
Az oxidációs állapotok |
Negatív vagy pozitív | Pozitív |
| Kötés |
Kovalens a nemfémek között |
Fémek a fémek között ( ötvözetképzés révén ) |
| Ion a nemfémek és a fémek között | ||
| Oxidok | Savas |
Bázikus alacsonyabb oxidokban; egyre savasabb a magasabb oxidokban |
A fémek és a nemfémek közötti kémiai különbségek nagyrészt az egyes atomok pozitív töltése és a negatív töltésű vegyértékű elektronok közötti vonzó erőből fakadnak. Balról jobbra a periódusos rendszer minden periódusában a nukleáris töltés növekszik, ahogy a magban lévő protonok száma növekszik. Ezzel összefüggésben csökken az atomi sugár, mivel a növekvő nukleáris töltés közelebb húzza a vegyértékű elektronokat a maghoz. Fémekben a nukleáris töltés általában gyengébb, mint a nemfémes elemeké. A kémiai kötés során tehát a fémek hajlamosak az elektronok elvesztésére, és pozitív töltésű vagy polarizált atomokat vagy ionokat képeznek, míg a nemfémek hajlamosak ugyanazokat az elektronokat szerezni az erősebb nukleáris töltésük miatt, és negatív töltésű ionokat vagy polarizált atomokat képeznek.
A nemfémek által képzett vegyületek száma óriási. A "legjobb 20" táblázat első kilenc helyét a 8 427 300 vegyületben leggyakrabban előforduló elemek táblázatában, amint azt a Chemical Abstracts Service 1987. júliusi nyilvántartása tartalmazza, nemfémek foglalták el. A vegyületek többségében (több mint 64%) hidrogént, szenet, oxigént és nitrogént találtak. A szilícium, egy metalloid, a 10. helyen állt. A legmagasabb minősítésű fém, 2,3%-os előfordulási gyakorisággal a vas volt, a 11. helyen. Nemfém vegyületek például a következők: bórsav H
3BO
3, kerámiamázakhoz használják ; szelenocisztein ; C
3H
7NEM
2Se , az élet 21. aminosava; foszfor -szeszkviszulfid (P 4 S 3 ), sztrájkban bárhol ; és teflon (C.
2F
4) n .
Szövődmények
A nemfémek kémiáját bonyolítják azok a rendellenességek, amelyek az egyes periódusos rendszerblokkok első sorában láthatók , különösen a hidrogén, (bór), a szén, a nitrogén, az oxigén és a fluor tekintetében; másodlagos periodicitás vagy nem egységes periodikus tendenciák, amelyek a p-blokkcsoportok többségét csökkentik; és szokatlan vegyértékállapotok a nehezebb nemfémekben.
Az első sor rendellenessége. Az első sor anomáliája nagyrészt az érintett elemek elektronkonfigurációjából adódik. A hidrogén a kötések kialakításának különböző módjairól ismert. Leggyakrabban kovalens kötéseket hoz létre. Vizes oldatban elveszítheti egyetlen vegyértékű elektronját, és óriási polarizációs erővel rendelkező csupasz protont hagy maga után. Ez később a vízmolekula oxigénatomjának magányos elektronpárjához kapcsolódik, és ezáltal a sav-bázis kémia alapját képezi . A hidrogénatom egy molekulában egy második, gyengébb kötést hozhat létre egy másik molekula atomjával vagy atomcsoportjával. Az ilyen kötés "segít a hópelyhek hatszögletű szimmetriájának megadásában, a DNS- t kettős spirálba köti ; formálja a fehérjék háromdimenziós formáit ; és még a víz forráspontját is elég magasra emeli ahhoz, hogy tisztességes teát készítsen".
A bórtól a neonig, mivel a 2p alhéjnak nincs belső analógja, és nem tapasztal elektron -taszító hatásokat, viszonylag kis sugarú, ellentétben a nehezebb elemek 3p, 4p és 5p alhéjaival. Következésképpen ezen elemek közötti ionizációs energiák és elektronegativitások magasabbak, mint az egyébként várható, figyelembe véve az időszakos tendenciákat . A szén, a nitrogén és az oxigén kis atom sugarai megkönnyítik a hármas vagy kettős kötések kialakulását.
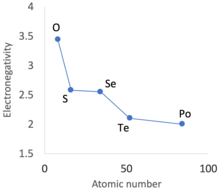
Másodlagos periodicitás. Közvetlenül az átmeneti fémek első sora után a periódusos rendszer elemeinek negyedik sorában, azaz galliumban (fémben), germániumban, arzénben, szelénben és brómban található 3d elektronok nem olyan hatékonyak a megnövekedett nukleáris töltés védelmében. A nettó eredmény, különösen a 13–15 csoportos elemek esetében, hogy a 13–17.
Szokatlan vegyértékállapotok . A nehezebb, 15-18 éves nemfémes csoport nagyobb atom sugarai nagyobb tömeges koordinációs számokat tesznek lehetővé , és alacsonyabb elektronegativitási értékeket eredményeznek, amelyek jobban tolerálják a magasabb pozitív töltéseket. Az érintett elemek tehát a csoportjuk legalacsonyabb értékétől (azaz 3, 2, 1 vagy 0) eltérő valenciákat mutathatnak , például foszfor -pentakloridban (PCl 5 ), kén -hexafluoridban (SF 6 ), jód -heptafluoridban (IF 7 ) és xenon -difluorid (XeF 2 ).
Alosztályok

Míg a hidrogént (H) általában az 1. csoport tetején, a kivonat bal szélén helyezik el, néha helyette F fölé helyezik, mint itt.
A keresztmetszetű vastag határvonal olyan nemfémeket foglal magában, amelyek mérsékelt vagy nagy szilárdságukról ismertek oxidálószerként, és amelyek-a jód kivételével-halvány megjelenésűek.
A közeli fémek megjelennek a kontextusban.
A hat metalloid mindkét oldalán futó szaggatott lépcsős vonal azt jelzi, hogy a vonal bal alsó részén lévő elemek általában növekvő fémes viselkedést mutatnak, és a jobb felső részen lévő elemek fokozzák a nemfémes viselkedést. Az ilyen vonalat, amely különböző konfigurációkban jelenhet meg, néha " választóvonalnak fémek és nemfémek között " nevezik . A vonal homályos, mivel nincs általánosan elfogadott különbség a fémek és a nemfémek között.
A nemfémek osztályozásának megközelítései akár két alosztálytól akár hat -hét osztályig terjedhetnek. Például az Encyclopedia Britannica periodikus táblázat nemesgázokat, halogéneket és más nemfémeket tartalmaz, és felosztja az általánosan metalloidként elismert elemeket a "többi fém" és a "többi nemfém" között; a Royal Society of Chemistry periodikus táblázat a nemfémes elemeket hét csoportot foglalja el.
Periodikus táblázatban jobbról balra három vagy négyféle nemfémet lehet felismerni. Ezek:
- a viszonylag inert nemesgázok;
- kémiailag erős halogén elemek halmaza - fluor, klór, bróm és jód -, amelyeket néha nemfém halogéneknek (az itt használt kifejezést) vagy stabil halogéneknek neveznek;
- osztályozatlan nemfémek halmaza, beleértve olyan elemeket, mint a hidrogén, szén, nitrogén és oxigén, széles körben elismert gyűjtőnév nélkül; és
- a kémiailag gyenge nemfémes metalloidok, amelyeket néha nemfémeknek tartanak, néha nem.
Mivel a metalloidok határterületet foglalnak el, ahol a fémek nemfémekkel találkoznak, kezelésük szerzőnként eltérő. Egyesek úgy vélik, hogy külön vannak a fémektől és a nemfémektől; egyesek nem fémnek vagy a nemfémek alosztályának tekintik őket; mások közülük néhányat fémnek számítanak, például arzént és antimont a nehézfémekkel való hasonlóságuk miatt . A metalloidokat itt kémiai viselkedésük fényében és összehasonlítás céljából nemfémként kezelik.
A metalloidokon kívül némi határmosás és átfedés (mint általában az osztályozási sémáknál) észlelhető a többi nemfém alosztály között. A szén, a foszfor, a szelén, a jód határolja a metalloidokat és némi fémes jelleget mutat, akárcsak a hidrogén. A nemesgázok közül a radon a legfémesebb, és kezd kationos viselkedést mutatni, ami szokatlan egy nemfém esetében.
nemesgázok
| Ingatlan | Félfém | Osztályozatlan nemfém |
Nemfém halogén |
nemes gázok |
|---|---|---|---|---|
| Atomsugarak (Å), 2–4 | ||||
| Span | 2,05-2,31 | 1,9-2,24 | 1,63-2,19 | 1,56-2,12 |
| Átlagos | 2.25 | 2.04 | 1.96 | 1,88 |
| Ionizációs energia (kJ mol -1 ) | ||||
| Span | 768-953 | 947-1320 | 1,015–1687 | 1037-2372 |
| Átlagos | 855 | 1 158 | 1276 | 1,590 |
| Elektron affinitás (kJ mol −1 ) | ||||
| Span | 27 és 190 között | -0,07-200 | 295-349 | −120 és −50 között |
| Átlagos | 108 | 134 | 324 | −79 |
| Elektronegativitás (Allred-Rochow) | ||||
| Span | 1,9-2,18 | 2,19-3,44 | 2,66-3,98 | 2.1 - 5.2 |
| Átlagos | 2.05 | 2.65 | 3.19 | 3.38 |
| Standard csökkentési potenciál (V) | ||||
| Span | -0,91-0,93 | 0,00 és 2,08 között | 0,53-2,87 | 2,12-2,26 |
| Átlagos | –0,09 | 0,55 | 1.48 | 2.26 |
| Átlagos | 4,77 | 6,76 | 8.5 | 8.6 |
| Goldhammer-Herzfeld kritériumarány (egység kevesebb) | ||||
| Span | 0,87–1,09 | 0,07–0,95 | 0,1–0,77 | 0,02–0,16 |
| Átlagos | 0,99 | 0,50 | 0,39 | 0,16 |
| Az atomi sugár, az ionizációs energia, az elektron -affinitás, az elektronegativitás és a standard redukciós potenciál átlagos értékei általában balról jobbra történő növekedést mutatnak, összhangban a megnövekedett nemfémes karakterrel. Az elektron affinitási értékek összeomlanak a nemesgázoknál a kitöltött külső pályák miatt. Az elektron -affinitás úgy határozható meg, mint "az az energia, amely ahhoz szükséges, hogy eltávolítsuk az −1 töltésű gáz -halmazállapotú anion elektronját az adott elem gázgázatomjának előállításához, pl. Cl - (g) → e - = 348,8 kJ mol -1 "; más szóval a nulla ionizációs energia. A standard redukciós potenciál a vízben lévő stabil fajokra vonatkozik, 0 pH -n, -3 és 3 V közötti tartományban. A nemesgáz oszlopban szereplő értékek csak a xenonra vonatkoznak. Az A Goldhammer- Herzfeld arány hozzávetőleges (nem relativisztikus) mértéke annak, hogy egy elem mennyire fémes, a fémek értéke ≥ 1. Számszerűsíti a fémek és nemfémek közötti különbségek magyarázatát, amelyeket a Tulajdonságok szakasz végén talál . |
||||
Hat nemfémet minősítenek nemesgáznak: hélium , neon, argon, kripton, xenon és a radioaktív radon. A hagyományos periodikus táblázatokban a jobb szélső oszlopot foglalják el. Nemesgázoknak nevezik őket jellemzően nagyon alacsony kémiai reaktivitásuk fényében .
Nagyon hasonló tulajdonságokkal rendelkeznek, mindegyik színtelen, szagtalan és nem gyúlékony. A nemesgázok zárt valenciahéjaikkal gyenge atomközi vonzóerővel rendelkeznek, ami nagyon alacsony olvadás- és forráspontot eredményez. Ezért mindegyik gáz szabványos körülmények között , még azok is, amelyek atomtömege nagyobb, mint sok normál szilárd elem.
Kémiai szempontból a nemesgázok viszonylag nagy ionizációs energiával rendelkeznek, nulla vagy negatív elektron affinitással rendelkeznek, és viszonylag nagy elektronegativitással rendelkeznek. A nemesgázok vegyületei több százat számlálnak, bár a lista tovább bővül, a legtöbbjük oxigén vagy fluor útján, kriptonnal, xenonnal vagy radonnal kombinálva fordul elő.
A periódusos rendszerben analógiát lehet vonni a nemesgázok és a nemesfémek, például a platina és az arany között, ez utóbbiak ugyanúgy vonakodnak a kémiai kombinációtól.
Nemfém halogének
Míg a nemfém halogének korrozív és kifejezetten reakcióképes elemek, megtalálhatók olyan ártalmatlan vegyületekben, mint a szokásos konyhasó NaCl. Figyelemre méltó kémiai aktivitásuk nemfémként szembeállítható az alkálifémek, például a nátrium és a kálium ugyanolyan figyelemre méltó kémiai aktivitásával, amelyek a periódusos rendszer bal szélén találhatók.
Fizikailag a fluor és a klór halványsárga és sárgászöld gázok; a bróm vörösesbarna folyadék; és a jód ezüstös fémes szilárd anyag. Elektromosan az első három szigetelő, míg a jód félvezető (síkjai mentén).
Kémiailag nagy ionizációs energiával, elektron affinitással és elektronegativitással rendelkeznek, és többnyire viszonylag erős oxidálószerek . Ennek az állapotnak a megnyilvánulásai magukban foglalják a maguk maró jellegét. Mind a négy hajlamos arra, hogy túlnyomórészt ionos vegyületeket képezzen fémekkel, míg a többi nemfém, az oxigénszármazék hajlamos túlnyomórészt kovalens vegyületeket képezni a fémekkel. A nemfém halogének reaktív és erősen elektronegatív jellege a nemfémes jelleg megtestesítője.
A periódusos rendszerben az erősen nemfémes halogének megfelelői a 17. csoportban a nagyon reakcióképes alkálifémek, például nátrium és kálium.
Osztályozatlan nemfémek
Miután a nemfémes elemeket nemesgázoknak, halogéneknek vagy metalloidoknak minősítették (a következőkben), a fennmaradó hét nemfém hidrogén, szén, nitrogén, oxigén, foszfor, kén és szelén. Három színtelen gáz (H, N, O); három fémszerű megjelenésű (C, P, Se); és az egyik sárga (S). Elektromosan a grafitos szén félmetál (síkjai mentén); a foszfor és a szelén félvezetők; és hidrogén, nitrogén, oxigén és kén szigetelők.
Ezek általában úgy tekintik, hogy túlságosan változatos ahhoz, hogy kiérdemelje a kollektív vizsgálat és már nevezzük más nemfémek , vagy több legvilágosabban nemfémek között helyezkedik el, félfémek és halogének. Következésképpen kémiájukat általában külön -külön tanítják, a négy periodikus táblázat szerinti csoport szerint, például: hidrogén az 1. csoportban; a 14. csoportba tartozó nemfémek (szén, esetleg szilícium és germánium); a 15. csoportba tartozó pnictogen nemfémek (nitrogén, foszfor, esetleg arzén és antimon); és a 16. csoport kalkogén nemfémek (oxigén, kén, szelén és esetleg tellúr). A szerzők egyéni preferenciái szerint más felosztások is lehetségesek.
A hidrogén különösen bizonyos szempontból úgy viselkedik, mint egy fém, más részeiben pedig nemfémként. A fémhez hasonlóan (először) elveszítheti egyetlen vegyértékű elektronját; tipikus alkálifémszerkezetekben alkálifémek helyett állhat; és ötvözetszerű hidridek képzésére képes , amelyek fémes kötéssel rendelkeznek, néhány átmeneti fémmel . Másrészt ez egy szigetelő kétatomos gáz, mint egy tipikus nemfém, és a kémiai reakciókban általában véve hajlamos a hélium elektronkonfigurációjának elérésére. Ez úgy történik, hogy kovalens vagy ionos kötést hoz létre, vagy ha elveszítette vegyértékelektronját, akkor magányos elektronpárhoz kapcsolódik.
Ezen nemfémek némelyike vagy mindegyike azonban számos közös tulajdonsággal rendelkezik. Fizikai és kémiai jellegük "mérsékelten nem fémes", nettó alapon. Mivel kevésbé reagálóak, mint a halogének, legtöbbjük, kivéve a foszfort, természetesen előfordulhat a környezetben. Kiemelkedő biológiai és geokémiai vonatkozásaik vannak. Halogénnel kombinálva a nem osztályozott nemfémek (poláris) kovalens kötéseket képeznek. Fémekkel kombinálva kemény ( intersticiális vagy tűzálló ) vegyületeket képezhetnek , viszonylag kis atomi sugaruk és kellően alacsony ionizációs energiaértékük fényében. A halogénekkel ellentétben a nem osztályozott nemfémek hajlamosak a katenizálódásra , különösen a szilárd halmazállapotú vegyületekben. A nemfémek közötti átlós kapcsolatok a metalloidok közötti hasonló kapcsolatokat tükrözik.
A periódusos rendszerben földrajzi analógia látható a nem osztályozott nemfémek és az átmenetifémek között. A nem besorolt nemfémek területet foglalnak el a jobb oldalon erősen nemfémes halogének és a bal oldalon a gyengén nemfémes metalloidok között. Az átmeneti fémek területet foglalnak el, "a periódusos rendszer bal oldalán található" virulens és erőszakos "fémek és a jobb oldali" nyugodt és elégedett "fémek között ... [és] ... átmeneti hidat képeznek a kettő".
Metalloidok
A hat elem, amelyet közelebbről metalloidoknak ismernek el, a bór, a szilícium, a germánium, az arzén, az antimon és a tellúr, mindegyik fém megjelenésű. Egy szabványos periódusos rendszerben a p-blokkban egy átlós területet foglalnak el, amely a bal felső sarokban lévő bórtól a jobb oldali tellúriumig terjed , egyes periódusos táblázatok fém- és nemfém-választóvonala mentén .
Törékenyek és csak tisztességes villamos- és hővezetők. A bór, a szilícium, a germánium, a tellúr félvezetők. Az arzén és az antimon a félfémek elektronikus sávos szerkezetével rendelkezik , bár mindkettő kevésbé stabil félvezető allotrópokkal rendelkezik .
Kémiai szempontból a metalloidok általában (gyenge) nemfémekként viselkednek. A nemfémes elemek közül általában a legalacsonyabb ionizációs energiával, elektron affinitással és elektronegativitással rendelkeznek; és viszonylag gyenge oxidálószerek. Továbbá azt mutatják, hogy hajlamosak ötvözeteket képezni fémekkel.
Mint a hidrogén a nem osztályozott nemfémek között, a bór bizonyos szempontból kémiailag hasonlít a fémekhez. Kevesebb elektronja van, mint a kötéshez rendelkezésre álló pályák. Az átmenetifémekkel analógiák fordulnak elő komplexek és adduktumok képzésében (például BH 3 + CO → BH 3 CO és hasonlóan Fe (CO) 4 + CO → Fe (CO) 5 ), valamint a geometriai és a klaszterfajok elektronikus szerkezetei, mint a [B 6 H 6 ] 2− és [Ru 6 (CO) 18 ] 2− .
A gyengén nemfémes metalloidoktól balra, a periódusos rendszerben, a gyengén fémes fémek (például ón , ólom és bizmut ) határozatlan halmaza található, amelyet néha átmenetet követő fémeknek is neveznek .
Összehasonlítás
A fémek és a metalloidok, a nem osztályozott nemfémek, a nemfém halogének és a nemesgázok (al) osztályainak tulajdonságait az alábbi két táblázat foglalja össze. A fizikai tulajdonságok a környezeti körülmények között a legstabilabb formájú elemekre vonatkoznak, hacsak másképp nem jelezzük, és a könnyű meghatározhatóság érdekében laza sorrendben vannak felsorolva. A kémiai tulajdonságok az általánostól a specifikusig, majd a leíró jellegűek. A metalloidok körüli szaggatott vonal azt jelzi, hogy a szerzőtől függően az érintett elemeket fel lehet ismerni az elemek külön osztályának vagy alosztályának. A fémek referenciapontként szerepelnek.
Fizikai
| Néhány alosztályon átnyúló fizikai tulajdonság | |||||
|---|---|---|---|---|---|
| Fizikai tulajdonság | Fémek | Metalloidok | Osztályozatlan nemfémek | Nemfém halogének | nemesgázok |
| Alkáli , alkáliföldfém , lantanid , aktinid , átmeneti és átmenet utáni fémek | Bór , szilícium , germánium , arzén , antimon (Sb) , tellúr | Hidrogén , szén , nitrogén , foszfor , oxigén , kén , szelén | Fluor , klór , bróm , jód | Hélium , neon , argon , kripton , xenon , radon | |
| Forma | szilárd (Hg folyékony) | szilárd | szilárd anyag: C, P, S, Se gáznemű: H, N, O |
szilárd: I folyékony: Br gáznemű: F, Cl |
gáznemű |
| Megjelenés | csillogó | félfényes | félfényes: C, P, Se színtelen: H, N, O színű: S |
színes: F, Cl, Br félfényes: I |
színtelen |
| Rugalmasság | többnyire képlékeny és képlékeny (a Hg folyékony) | törékeny |
• C, fekete P, S és Se törékeny • ugyanaz a négy kevésbé stabil, nem törékeny |
a jód törékeny | nem alkalmazható |
| Szerkezet | főleg szorosan becsomagolt centroszimmetrikus | többatomos | poliatomikus: C, P, S, Se diatomi: H, N, O |
kétatomos | monatomikus |
| Tömeges koordinációs szám | többnyire 8-12, vagy több | 6, 4, 3 vagy 2 | 3, 2 vagy 1 | 1 | 0 |
| Allotrópok | • gyakori a hőmérséklet- vagy nyomásváltozásoknál | minden formában | ismert C, P, O, S, Se | a jód amorf formában ismert
|
egyik sem jelentette |
| Elektromos vezetőképesség | magas | mérsékelt: B, Si, Ge, Te magas: As, Sb |
alacsony: H, N, O, S mérsékelt: P, Se magas: C |
alacsony: F, Cl, Br mérsékelt: I |
alacsony |
| Volatilitás |
• alacsony • A Hg a kategóriájában a leginkább ingadozó |
• alacsony • Mint a legalacsonyabb az osztályban |
alacsony: C, P, S, Se magas: H, N, O |
magas | magasabb |
| Elektronikus szerkezet | fémes (Bi félfém) | félfém (As, Sb) vagy félvezető | félfém (C), félvezető (P, Se) vagy szigetelő (H, N, O, S) | félvezető (I) vagy szigetelő | szigetelő |
| Külső elektronok | 1–8 vegyérték | 3–6 | 4–6 (H -nak 1) | 7 | 8 (van 2) |
| Kristályszerkezet | főleg köbös vagy hatszögletű | romboéder: B, As, Sb köbös: Si, Ge hatszögletű: Te |
köbös: P, O hatszögletű: H, C, N, lásd ortorombikus: S |
köbös: F ortorombikus: Cl, Br, I |
köbös: Ne, Ar, Kr, Xe, Rn hatszögletű: He |
Fekete foszfor kristályai , a legstabilabb forma, lezárt ampullában
Kis darab gyorsan olvadó szilárd argon. Ez a harmadik leggyakoribb gáz a Föld légkörében , a nitrogén és az oxigén után.
A jódkristályok fehér fényben fémes fényűek.
Kémiai
| Néhány alosztályon keresztüli kémiai tulajdonság | |||||
|---|---|---|---|---|---|
| Kémiai tulajdonság | Fémek | Metalloidok | Osztályozatlan nemfémek | Nemfém halogének | nemesgázok |
| Alkáli , alkáliföldfém , lantanid , aktinid , átmeneti és átmenet utáni fémek | Bór , szilícium , germánium , arzén , antimon (Sb) , tellúr | Hidrogén , szén , nitrogén , foszfor , oxigén , kén , szelén | Fluor , klór , bróm , jód | Hélium , neon , argon , kripton , xenon , radon | |
| Általános kémiai viselkedés |
• erős vagy gyengén fémes • nemesfémek hajlamosak a reakcióra |
gyengén nemfémes | közepesen nemfémes | erősen nemfémes |
• közömbös a nemfémeshez képest • Rn kationos viselkedést mutat |
| Ionizációs energia ‡ |
• viszonylag alacsony • magasabb a nemesfémeknél • az ionizációs energia Hg és esetleg Rg, Ds, Cn esetén meghaladja egyes nemfémekét • a nemesfémek elektronegativitási értéke meghaladja a P értékét |
mérsékelt | közepes vagy magas | magas | magas - nagyon magas |
| Elektron-affinitása ‡ | mérsékelt | mérsékelt: H, C, O, P (N c. nulla) • magasabb: S, Se |
magas | nulla vagy kevesebb | |
| elektronegativitás ‡ | mérsékelt: Si <Ge ≈ B ≈ Sb <Te <As |
mérsékelt (P) - magas: P <Se ≈ C <S <N <O |
magas: I <Br <Cl <F |
közepes (Rn) - nagyon magas | |
|
Standard redukció lehetséges ‡ |
mérsékelt | közepes vagy magas | magas | magas Xe -nek | |
| Nem nulla oxidációs állapotok |
• nagyrészt pozitív • negatív anionos állapotok, amelyek a legtöbb alkáli- és alkáliföldfémről ismertek; Pt, Au |
mindenki számára ismert negatív és pozitív |
• negatív állapotok ismert az összes, de H ez instabil állapotban • pozitív ismert az összes, de csak kivételesen az F és O • -5 B a +7 a Cl, Br, I, és At |
• csak pozitív oxidációs állapotok ismertek, és csak nehezebb nemesgázok esetén • +2 -től Kr, Xe és Rn -től +8 -ig Xe esetén |
|
| Katenációs hajlam | a 8–11. átmeneti fémek csoportjáról ismert; és Hg, Ga, In, Sn és Bi |
• szignifikáns: B, Si; Te • kevésbé: Ge, As, Sb |
túlsúlyban: C szignifikáns: P, S, Se kevésbé: H, N, O |
kationos (Cl, Br, I) és anionos formában ismert | nem ismert; katenációt nem jelentettek |
| Biológiai kölcsönhatások (emberi élet) |
• A természetben előforduló fémek 17% -a jelentős vagy nyomokban nélkülözhetetlen • A legtöbb nehezebb fém , köztük Cr, Cd, Hg és Pb, mérgező hatásukról ismert |
• 33% (hatból kettő) nélkülözhetetlen nyomelemek: B, Si • Amint azt a toxicitása miatt jegyzik |
• 100% elengedhetetlen: H, C, N, O képezik az élet alapját; P és S fő elemek; A selenociszteinben , az élet 21. aminosavában nyomelemként fordul elő • Az O, P és Se potenciálisan mérgező |
• 100% elengedhetetlen: Cl, mint fő összetevő; F, Br, I mint nyomelemek • elemi formában korrozív |
• 0% elengedhetetlen • Légúti gyógyászatban és búvárgázkeverékekben használják ; Az Ar -t humán vizsgálatokban használták, míg a Xe -t számos orvosi felhasználásra; Az Rn -t korábban daganatok kezelésére használták |
| Vegyületek fémekkel | ötvözetek vagy fémközi vegyületek | általában ötvözeteket vagy fémközi vegyületeket képeznek |
• sószerű-kovalens: H †, C, N, P, S, Se • főleg ionos: O |
főleg ionos: F, Cl, Br, I | egyszerű vegyületek környezeti körülmények között nem ismertek |
| Oxidok |
• ionos, polimer, réteg, lánc és molekuláris szerkezetek • V; Mo, W; Al, In, Tl; Sn, Pb; Bi üvegképzők • alap; némi amfoter vagy savas |
• polimer szerkezetű • B, Si, Ge, As, Sb, Te üvegképzők • amfoter vagy gyengén savas |
• többnyire molekuláris • C, P, S, Se legalább egy polimer formában ismert • P, S, Se üvegképzők; A CO 2 üveget képez 40 GPa • savas ( NO 2, N 2O 5, SO 3és SeO 3erősen) vagy semleges (H 2 O, CO, NO, N 2 O) |
• molekuláris • jód legalább egy polimer formában ismert, I 2 O 5 • nem jelentettek üvegképző anyagokat • savas; ClO 2, Cl 2O 7, és én 2O 5 erősen így |
• molekuláris • A XeO 2 polimer • nem jelentettek üvegképzőket • a metastabil XeO 3 savas; stabil XeO 4 erősen így |
| Reakció konc. salétromsav | a legtöbb nitrátot képez |
• B bórsavat képez ; Ahogy formák arzénsav • Si, Ge, Sb, és Te formában oxidok |
• C, S oxidokat képez • P, Se foszforsavat és szelénsavat |
• F nitroxifluoridot képez NO 3 F • I jódsavat képez |
nulla; reakciót nem jelentettek |
| Reakció konc. kénsav | legtöbbjük szulfátokat képez |
• B formák bórsav • Si nem reagál • Ge, Sb formában szulfátok • Mint formák egy oxid • Te képezi szulfoxid TESO 3 |
• C, S oxidokat képez • P (piros) foszforsavat képez • Se képezi a SeSO 3 szulfoxidot |
• jód képezhet egy polimer sárga-szulfát (IO) 2 SO 4 jelenlétében I 2 O 5 | nulla; reakciót nem jelentettek |
|
† hidrogén is képeznek ötvözet-szerű hidridek ‡ A címkék közepes, magas, magasabb , és a nagyon magas alapulnak érték ível a táblázatban felsorolt „ Tulajdonság átfogja és átlagos értékek a alosztályait nemfémes elemeket ” |
|||||
Allotrópok
A legtöbb nemfémes elem allotróp formában létezik. A szén például grafitként és gyémántként fordul elő. Az ilyen allotrópok fizikai tulajdonságokkal rendelkeznek, amelyek fémesebbek vagy kevésbé nemfémesek.
A nemfém halogének és a nem osztályozott nemfémek közül:
- A jód félvezető amorf formában ismert .
- A grafit, a szén szokásos állapota, meglehetősen jó elektromos vezető. A szén gyémánt allotrópja egyértelműen nemfémes, áttetsző és rendkívül rossz elektromos vezető. A szén több más allotróp formában is ismert, beleértve a félvezető buckminsterfullerene -t (C 60 ).
- A nitrogén gáznemű tetranitrogént (N 4 ) képezhet , amely instabil poliaatomikus molekula, élettartama körülbelül egy mikroszekundum.
- Az oxigén normál állapotú kétatomos molekula; ózonként (O 3 ) is létezik, instabil nemfém allotróp, felezési ideje körülbelül fél óra.
- A foszfor egyedülállóan számos allotróp formában létezik, amelyek stabilabbak, mint a normál állapotú fehér foszfor (P 4 ). A fehér , piros és fekete allotropes talán a legismertebb; az első egy szigetelő; az utóbbi kettő félvezető. A foszfor difoszforként (P 2 ) is létezik, instabil kétatomos allotróp.
- A kén több allotrópot tartalmaz, mint bármely más elem. Az amorf kén , az ilyen allotrópok metastabil keveréke, rugalmasságáról ismert.
- A szelén számos nemfém allotrópot tartalmaz, amelyek mindegyike sokkal kevésbé vezeti az elektromosságot, mint a szürke "fémes" szelén standard állapota.
A leggyakrabban metalloidként felismert elemek allotrópokat alkotnak. A bór számos kristályos és amorf formában ismert . A kvázi gömb alakú allotróp molekula, a boroszféra (B 40 ) felfedezését 2014-ben jelentették be. A szilíciumot legutóbb csak kristályos és amorf formájában ismerték. Ezt követően 2014 -ben jelentették az Si 24 ortorombikus allotróp szintézisét . 10–11 GPa, a germánium fémes fázissá alakul, ugyanazzal a tetragonális szerkezettel, mint az ón; bomláskor - és a nyomáskibocsátás sebességétől függően - a fémes germánium allotrópok sorozatát képezi, amelyek környezeti körülmények között metastabil . Az arzén és az antimon számos jól ismert allotrópot (sárga, szürke és fekete) alkot. A tellúr kristályos és amorf formában ismert.
A nemfémes elemek más allotróp formái is ismertek, nyomás alatt vagy egyrétegben . Megfelelően magas nyomáson a nemfémes elemek legalább fele, amelyek félvezetők vagy szigetelők, kezdve 1,7 GPa foszforral, fémes allotrópokat képeznek. Egyrétegű kétdimenziós formája nemfémes közé borophene (bór), grafén (szén), silicene (szilícium), phosphorene (foszfor), germanene (germánium), arsenene (arzén), antimonene (antimon) és tellurene (tellúr), együttesen " xenes " -nek nevezik .
Bőség, előfordulás, kitermelés és költségek
Bőség
A hidrogén és a hélium a becslések szerint a világegyetem összes közönséges anyagának körülbelül 99% -át és atomjainak több mint 99,9% -át teszi ki. Az oxigént a következő leggyakoribb elemnek tartják, kb. 0,1%. A világegyetem kevesebb, mint öt százaléka állítólag közönséges anyagból, amelyet csillagok, bolygók és élőlények képviselnek. A mérleg sötét energiából és sötét anyagból áll , mindkettő jelenleg rosszul érthető.
A hidrogén, szén, nitrogén és oxigén alkotja a Föld légkörének, óceánjainak, kéregének és bioszférájának nagy részét ; a fennmaradó nemfémek 0,5% vagy annál kisebb mennyiségben fordulnak elő. Ehhez képest a kéreg 35% -át nátrium , magnézium , alumínium , kálium és vas alkotja ; metalloiddal, szilíciummal együtt. Minden más fémben és metalloidban a kéregben, az óceánokban vagy a bioszférában 0,2% vagy kevesebb található.
Esemény
nemesgázok
A Föld légkörében körülbelül 10 15 tonna nemesgáz található. Ezenkívül a hélium akár 7%-ban is megtalálható a földgázban . A radon tovább diffundál a kőzetekből, ahol az urán és a tórium természetes bomlási folyamata során keletkezik . 2014 -ben jelentették, hogy a Föld magja c. 10 13 tonna xenon, stabil XeFe 3 és XeNi 3 intermetallikus vegyületek formájában . Ez megmagyarázhatja, miért "a Föld légkörének vizsgálatai kimutatták, hogy a Xe várható mennyiségének több mint 90% -a kimerült".
Nemfém halogének
A nemfém halogének megtalálhatók a sóhoz kapcsolódó ásványokban. A fluor a fluoritban fordul elő , ez egy széles körben elterjedt ásvány. A klór, a bróm és a jód megtalálható a sóoldatokban . Egy 2012 -es tanulmány kivételesen 0,04% natív fluort ( F.
2) az antozonit tömegére vonatkoztatva , ezeket a zárványokat a kis mennyiségű urán jelenlétéből származó sugárzásnak tulajdonítva .
Osztályozatlan nemfémek

A nem osztályozott nemfémek jellemzően elemi formában (oxigén, kén) fordulnak elő, vagy e két elem bármelyikével együtt fordulnak elő.
- A hidrogén a világ óceánjaiban a víz, a földgázban pedig a metán és a hidrogén -szulfid összetevőjeként fordul elő .
- A szén, mint grafit, főként metamorf szilikát kőzetekben fordul elő üledékes szénvegyületek összenyomódása és hevítése következtében .
- Oxigén található a légkörben; az óceánokban a víz összetevőjeként; és a kéregben oxid ásványokként .
- A foszfor ásványok széles körben elterjedtek, általában foszfor-oxigén foszfátok formájában .
- Elemi kén található a világ számos részén a meleg források és vulkáni régiók közelében; a kénásványok széles körben elterjedtek, általában szulfidok vagy oxigén-kén- szulfátok formájában .
- A szelén fémszulfid ércekben fordul elő, ahol részben helyettesíti a kénet; időnként elemi szelén található.
Metalloidok
A metalloidok általában oxigénnel vagy kénnel, vagy tellúr esetében arany vagy ezüsttel kombinált formában fordulnak elő. A bór megtalálható a bór-oxigén borát ásványokban, beleértve a vulkanikus forrásvizeket is. A szilícium a szilícium-oxigén ásványi szilícium- dioxidban (homok) fordul elő . A germánium, az arzén és az antimon elsősorban a szulfidércek összetevői . A tellúr arany vagy ezüst tellurid ásványokban fordul elő . Az arzén, az antimon és a tellúr natív formáiról számoltak be.
Kivonás
A nemfémeket és a metalloidokat nyers formában nyerik ki:
- sóoldat - klór, bróm, jód;
- folyékony levegő - nitrogén, oxigén, neon, argon, kripton, xenon;
- ásványok - bór ( borát ásványok ); szén (szén; gyémánt; grafit); fluor ( fluorit ); szilícium ( szilícium -dioxid ); foszfor (foszfátok); antimon ( stibnit , tetrahedrit ); jód ( nátrium -jodátban és nátrium -jodidban );
- földgáz - hidrogén, hélium, kén; és
- ércek , mint feldolgozási melléktermékek - germánium ( cinkércek ); arzén ( réz és ólom ércek); szelén, tellúr (rézércek); és radon ( urántartalmú ércek).
Költség
Bár a nem radioaktív nemfémek viszonylag olcsók, vannak kivételek. 2021 júliusától a bór, a germánium, az arzén és a bróm ára 3–10 amerikai dollár lehet grammonként (vö. Ezüst, körülbelül 1 dollár grammonként). Az árak drámaian csökkenhetnek, ha nagy mennyiségben vesznek részt. A fekete foszfort csak gramm mennyiségben állítják elő a butik -beszállítók - a kémiai gőzszállítás révén előállított egykristály akár 1000 dollárba is kerülhet grammonként (az arany ára körülbelül tizenhétszerese); ezzel szemben a vörös foszfor grammonként körülbelül 50 centbe, azaz fontba 227 dollárba kerül. 2013 -ig a radon beszerezhető volt a Nemzeti Szabványügyi és Technológiai Intézettől 1636 dollárért 0,2 ml -es kibocsátási egységért, ami kb. 86 000 000 dollár grammonként (ömlesztett mennyiségekre vonatkozó kedvezmény nélkül).
| Terület | Elemek |
|---|---|
| légcsere (inert) | H, He, C, N, O, F ( SF 6 -ban ), P, S és Ar |
| kriogén és hűtőközeg | H, Ő, N, O, F, Ne, S, Cl és Ar |
| műtrágyák | H, B, C, N, O, Si, P, S |
| égésgátló vagy tűzoltó készülékek | H, B, C (beleértve a grafitot is), N, O, F, Si, P, S, Cl, Ar, Br és Sb |
| háztartási felszerelések | H (a víz elsődleges összetevője); Ő (parti léggömbök); B ( mosószerekben ); C ( ceruzában , grafit formájában); N ( sör kütyü ); O ( peroxid formájában , mosószerekben ); F ( fluoridként , fogkrémben ); Ne (világítás); Si (üvegáru); P ( gyufák ); S (kerti kezelések); Cl ( fehérítő összetevő); Ar ( hőszigetelt ablakok ); Ge ( széles látószögű kameralencsékben ); Se ( üveg ; napelemek ); Br ( bromidként , gyógyvíz tisztítására); Kr (energiatakarékos fénycsövek ); Sb (elemekben); Te ( kerámiában , napelemekben, átírható DVD-kben ); I ( antiszeptikus oldatokban); Xe ( plazma TV -kijelzőcellákban ez a technológia később feleslegessé vált olcsó LED -ek és OLED -kijelzők miatt ) |
| lézerek és világítás | H, He, C (szén -dioxid lézerekben, CO 2 ); N, O ( kémiai oxigén -jód lézerben ); F ( hidrogén -fluorid lézerben , HF); Ne, Si, P, S ( kénlámpában ); Cl, Ar, Ge, As, Se, Br, Kr, Te, I és Xe |
| gyógyszer és gyógyszeripar | H, Ő, B, C, N, O, F, Si, P, S, Cl, Ar, As, Se, Br, Kr, Sb, Te, I, Xe és Rn |
| ásványi savak | H, B, C, N, O, F, Si, P, S, Cl, Ge, As, Sb, Br, Te, I és Xe |
| plug-in hibrid járművek | H, Ő, B, C, N, O, F, Si, P, S, Cl, Ar, Br, Sb, Te és én |
| hegesztő gázok | H, He, C (CO 2 -ben ), N, O, Ar |
| okos telefonok | H, Ő, B, C, N, O, F, Si, P, S, Cl, Ge, As, Se, Br, Sb |
A nemfémek szinte egyetemes felhasználási területei a háztartási kellékek; lézerek és világítás; valamint az orvostudomány és a gyógyszeripar . Egy vagy két germánium, arzén vagy radon hiányzik. Hasonló módon a legtöbb fém szerkezeti felhasználású. Amennyiben a metalloidok fémes jelleget mutatnak, speciális felhasználási területeik kiterjednek (például) oxidüvegekre, ötvöző alkatrészekre és félvezetőkre.
A nemfémek különböző részhalmazainak további megosztott felhasználásai magukban foglalják a jelenlétüket a levegőben, vagy a levegő helyettesítésének speciális felhasználását (inert); kriogén és hűtőközegek ; műtrágyák ; égésgátlók vagy tűzoltó készülékek ; ásványi savak ; plug-in hibrid járművek; hegesztőgázok ; és okos telefonok .
A gőzölgő salétromsavat , amely itt sárga nitrogén -dioxiddal szennyezett , gyakran használják a robbanóanyag -iparban.
Nagyfeszültségű megszakító, amely kén-hexafluoridot (SF 6 ) használ közömbös (levegőpótló) megszakító közegként
COIL ( kémiai oxigén-jód lézer ) rendszer, amely a YAL-1 Airborne Laser néven ismert Boeing 747 változatra van felszerelve
Argongázt tartalmazó palackok tűzoltáshoz, számítógép -kiszolgáló berendezések károsítása nélkül
Felfedezés

A legtöbb nemfémes elemet csak azután fedezték fel, hogy 1669 -ben Hennig Brand foszfort izolált a vizeletből. Azelőtt a szén, a kén és az antimon ismert volt az ókorban , és az arzént a középkorban fedezték fel ( Albertus Magnus ). A fennmaradó részeket a 18. és a 19. században izolálták. A hélium (1868) volt az első elem, amelyet nem fedeztek fel a Földön. A radont a 19. század végén fedezték fel.
Az ezt követően felfedezett arzént, foszfort és nemfémes elemeket vegyészek vagy fizikusok egy vagy több eszközével, nevezetesen spektroszkópiával izolálták ; frakcionált desztilláció ; sugárzás észlelése ; elektrolízis ; sav hozzáadása az érchez; égés ; elmozdulási reakciók ; vagy fűtés:
- A nemesgázok közül a héliumot sárga vonalán keresztül detektálták a nap koronális spektrumában , majd később a savban oldott urán UO 2 -ből kiszökő buborékok megfigyelésével ; a neont a xenonon keresztül a levegő frakcionált desztillálásával nyertük ; és radioaktív radont figyeltek meg a tóriumvegyületekből , négy évvel a sugárzás felfedezése után, 1895 -ben, Henri Becquerel által .
- A nemfém halogéneket halogenidjeikből nyertük , vagy elektrolízissel ; sav hozzáadása; vagy elmozdulás . Néhány vegyész meghalt a fluort izoláló kísérleteik eredményeként.
- A nem osztályozott nemfémek közül nitrogént figyeltek meg a levegőben, amelyből oxigént távolítottak el; oxigént nyerünk higany -oxid hevítésével ; a foszfor a vizeletben megtalálható ammónium -nátrium -hidrogén -foszfát Na (NH 4 ) HPO 4 hevítésével szabadult fel ; és a szelént kénsavban maradékként detektálták .
- Az általánosan metalloidként elismert elemeket oxidjaik ( bór , szilícium , arzén , tellúr ) vagy szulfid ( germánium ) hevítésével izolálták .
Lásd még
Megjegyzések
Hivatkozások
Idézetek
Bibliográfia
- Abbott D 1966, Bevezetés a periódusos rendszerbe, JM Dent & Sons, London
- Addison WE 1964, Az elemek allotrópiája , Oldbourne, London
- Allen LC & Huheey JE 1980, "Az elektronegativitás meghatározása és a nemesgázok kémiája", Journal of Inorganic and Nuclear Chemistry , vol. 42, nem. 10, doi : 10.1016/0022-1902 (80) 80132-1
- Ambrose M et al. 1967, General Chemistry , Harcourt, Brace & World, New York
- Atkins PA 2001, Periodikus Királyság: Utazás a kémiai elemek földjére , Phoenix, London, ISBN 978-1-85799-449-0
- Atkins és mtsai. 2006, Shriver & Atkins 'Inorganic Chemistry , 4. kiadás, Oxford University Press, Oxford, ISBN 978-0-7167-4878-6
- Atkins P & Overton T 2010, Shriver & Atkins 'Inorganic Chemistry , 5. kiadás, Oxford University Press, Oxford, ISBN 978-0-19-923617-6
- Aylward G & Findlay T 2008, SI Chemical Data, John Wiley & Sons, Ausztrália: Brisbane, ISBN 978-0-470-81638-7
- Bailar és mtsai. 1989, Kémia , 3. kiadás, Harcourt Brace Jovanovich, San Diego, ISBN 978-0-15-506456-0
- Baird C & Cann M 2012, Environmental Chemistry , 5. kiadás, WH Freeman and Company, New York, ISBN 978-1-4292-7704-4
- Barton AFM 2021, Anyagállapotok, Elmeállapotok, CRC Press, Boca Raton, ISBN 978-0-7503-0418-4
- Beach FC (szerk.) 1911, The Americana: A universal reference library, vol. XIII, Mel – New, Metalloid, Scientific American Compiling Department, New York
- Beard A, Battenberg, C & Sutker BJ 2021, "Lángálló anyagok", in Ullmann's Encyclopedia of Industrial Chemistry, doi : 10.1002/14356007.a11_123.pub2
- Bell RL & Garofalo J 2005, Tudományos egységek a 9–12. Osztályokhoz , Nemzetközi Oktatási Technológiai Társaság, ISBN 978-1-56484-217-6
- Benner SA, Ricardo A & Carrigan MA 2018, "Van -e közös kémiai modell az univerzumban?", Cleland CE & Bedau MA (szerk.), The Life of Life: Classical and Contemporary Perspectives from Philosophy and Science , Cambridge University Press, Cambridge, ISBN 978-1-108-72206-3
- Berger LI 1997, Félvezető anyagok, CRC Press, Boca Raton, ISBN 978-0-8493-8912-2
- Berzelius JJ & Bache AD 1832, "Esszé a kémiai nómenklatúráról, a kémiai értekezés előtagjában ", The American Journal of Science and Arts , 22. kötet
- Betke U & Wickleder MS 2011, "A tűzálló fémek szulfátjai: Nb 2 O 2 (SO 4 ) 3 , MoO 2 (SO 4 ), WO (SO 4 ) 2 és a Re 2 két módosítása kristályszerkezete és termikus viselkedése O 5 (SO 4 ) 2 ", Szervetlen kémia, vol. 50, nem. 3., 858–872. O., Doi : 10.1021/ic101455z
- Bettelheim és mtsai. 2016, Bevezetés az általános, szerves és biokémiába , 11. kiadás, Cengage Learning, Boston, ISBN 978-1-285-86975-9
- Bevan D 2015, Cambridge International AS és A Level Chemistry Revision Guide , 2. kiadás, Hodder Education, London, ISBN 978-1-4718-2942-0
- Bhuwalka és mtsai. 2021, "A járművek villamosításából adódó anyagfelhasználásbeli változások jellemzése", Environmental Science & Technology vol. 55, nem. 14, doi : 10.1021/acs.est.1c00970
- Bird A & Tobin E 2018, "Natural kind" , a The Stanford Encyclopedia of Philosophy -ban , hozzáférve 2021. július 10 -én
- Bodner GM & Pardue HL 1993, Chemistry, An Experimental Science , John Wiley & Sons, New York, ISBN 0-471-59386-9
- Bogoroditskii NP & Pasynkov VV 1967, Rádió és elektronikus anyagok , Iliffe Books, London
- Bohlmann R 1992, "Synthesis of halogenides", in Winterfeldt E (szerk.), Heteroatom manipulation , Pergamon Press, Oxford, ISBN 978-0-08-091249-3
- Boise State University 2020, "Költséghatékony gyártási módszerek új életet lehelnek a fekete foszfor kutatásába" , hozzáférhető 2021. július 9-én
- Bolin P 2017, "Gázszigetelt alállomások", in McDonald JD (szerk.), Electric Power Substations Engineering , 3., szerk., CRC Press, Boca Raton, FL, ISBN 978-1-4398-5638-3
- Borg RG & Dienes GJ 1992, The Physical Chemistry of Solids, Academic Press, Boston, ISBN 978-0-12-118420-9
- Boyd R 2011, "Selenium stories", Nature Chemistry , vol. 3, doi : 10.1038/nchem.1076
- Brady JE & Senese F 2009, Chemistry: The study of Matter and its Changes , 5. kiadás, John Wiley & Sons, New York, ISBN 978-0-470-57642-7
- Brande WT 1821, A Manual of Chemistry, vol. II, John Murray, London
- Brandt HG & Weiler H, 2000, "Hegesztés és vágás", Ullmann Encyclopedia of Industrial Chemistry, doi : 10.1002/14356007.a28_203
- Braunstein P & Danopoulos AA 2021, "Átmeneti fém lánc komplexek lágy donor összeszerelő ligandumokkal támogatva", Chemical Reviews , vol. 121, nem. 13, doi : 10.1021/acs.chemrev.0c01197
- Brodsky MH, Gambino RJ, Smith JE Jr & Yacoby Y 1972, "The Raman spektrum of amorpho tellurium", Physica Status Solidi (b) , vol. 52., doi : 10.1002/pssb.2220520229
- Brown és mtsai. 2014, Chemistry: The Central Science, 3. kiadás, Pearson Australia: Sydney, ISBN 978-1-4425-5460-3
- Brown L & Holme T 2006, Kémia mérnökhallgatóknak , Thomson Brooks/Cole, Belmont California, ISBN 978-0-495-01718-9
- Burford N, Passmore J & Sanders JCP 1989, "A 16. csoport (a kalkogének) és a 17. (a halogének) homopoliatomikus kationjainak előkészítése, szerkezete és energetikája, Liebman JF & Greenberg A, Atomoktól a polimerekig: izoelektronikai analógiák, VCH: New York, ISBN 978-0-89573-711-3
- Cacace F, de Petris G & Troiani A 2002, "Tetranitrogén kísérleti kimutatása", Science , vol. 295, nem. 5554, doi : 10.1126/science.1067681
- A Cambridge Enterprise 2013, "Carbon" candy floss "segíthet megelőzni az energiaszüneteket" , Cambridge University, hozzáférés: 2013. augusztus 28.
- Cao és mtsai. 2021, "Understanding periodic and non-periodic chemistry in periodic table", Frontiers in Chemistry , évfolyam. 8. cikk, 813. cikk, doi : 10.3389/fchem.2020.00813
- Carapella SC 1968, "Arsenic" a Hampel CA -ban (szerk.), The Encyclopedia of the Chemical Elements , Reinhold, New York
- Čenčariková H & Legut D 2018, "A relativitás hatása a kopernicium fázisok stabilitására, elektronikus szerkezete és mechanikai tulajdonságai", Physica B , vol. 536, doi : 10.1016/j.physb.2017.11.035
- Csele M 2016, Lasers , in Ullmann's Encyclopedia of Industrial Chemistry, doi : 10.1002/14356007.a15_165.pub2
- Challoner J 2014, The Elements: The New Guide to the Building Blocks of our Universe , Carlton Publishing Group, ISBN 978-0-233-00436-5
- Chambers C & Holliday AK 1982, Inorganic Chemistry , Butterworth & Co., London, ISBN 978-0-408-10822-5
- Chen K 1990, Ipari áramelosztó és világító rendszerek, Marcel Dekker, New York, ISBN 978-0-8247-8237-5
- Cherim SM 1971, Kémia laboratóriumi technikusok számára , Saunders, Philadelphia, ISBN 978-0-7216-2515-7
- Chung DD 1987, "Review of exfoliated graphite", Journal of Materials Science , évf . 22, doi : 10.1007/BF01132008
- Clugston MJ & Flemming R 2000, Advanced Chemistry , Oxford University Press, Oxford, ISBN 978-0-19-914633-8
- Cockell C 2019, Az élet egyenletei: Hogyan alakítja a fizika az evolúciót , Atlantic Books: London, ISBN 978-1-78649-304-0
- Cotton SA 1994, "Scandium, ittrium és a lantanidok: Szervetlen és koordinációs kémia", RB King (szerk.), Encyclopedia of Inorganic Chemistry, 2. kiadás, vol. 7, John Wiley & Sons, New York, 3595–3616, ISBN 978-0-470-86078-6
- Cotton et al. 1999, Advanced Inorganic Chemistry , 6. kiadás, Wiley, New York, ISBN 978-0-471-19957-1
- Cotton FA & Wilkinson G 1976, Alapvető szervetlen kémia , Wiley, New York, ISBN 978-0-471-17557-5
- Cousins DM, Davidson MG & García-Vivó D 2013, "Négykoordinátás hidrogénatom példátlan részvétele a lítium- és nátrium-fenolátok kubai magjában", Chemical Communications , vol. 49., doi : 10.1039/C3CC47393G
- Cox AN (szerk.) 2000, Allen Astrophysical Quantities , 4. kiadás, AIP Press, New York, ISBN 978-0-387-98746-0
- Cox PA 1997, The Elements: Origins, Abundance, and Distribution , Oxford University Press, Oxford, Oxford, ISBN 978-0-19-855298-7
- Cox T 2004, Szervetlen kémia , 2. kiadás, BIOS Scientific Publishers, London, ISBN 978-1-85996-289-3
- Crawford FH 1968, Bevezetés a fizika tudományába , Harcourt, Brace & World, New York
- Crichton R 2012, Biological Inorganic Chemistry: A New Introduction to Molecular Structure and Function , 2. kiadás, Elsevier, Amsterdam, ISBN 978-0-444-53783-6
- Cressey 2010, " Vegyészek újra definiálják a hidrogénkötést ", Nature newsblog , 2017. augusztus 23
- Cronyn MW 2003, "A hidrogén megfelelő helye a periódusos rendszerben", Journal of Chemical Education , vol. 80, nem. 8, doi : 10.1021/ed080p947
- Dalton L 2019, " Argon reagál a nikkelrel nyomásfőző körülmények között" , Chemical & Engineering News , hozzáférés: 2019. november 6.
- Daniel PL & Rapp RA 1976, "Fémek halogén korróziója", Fontana MG & Staehle RW (eds), Advances in Corrosion Science and Technology , Springer, Boston, doi : 10.1007/978-1-4615-9062-0_2
- Darken L & Gurry R 1953, Physical chemistry of Metals , McGraw-Hill, New York
- Davis és mtsai. 2006, "Atomic jód lézerek", in Endo M & Walter RF (eds) 2006, Gas Lasers, CRC Press, Boca Raton, Florida, ISBN 978-0-470-19565-9
- Deming HG 1923, Általános kémia: elemi felmérés, John Wiley & Sons, New York
- Desai PD, James HM & Ho CY 1984, "Electrical Resistivity of Aluminium and Manganese" , Journal of Physical and Chemical Reference Data , vol. 13, nem. 4, doi : 10.1063/1.555725
- Donohue J 1982, The Structures of the Elements , Robert E. Krieger, Malabar, Florida, ISBN 978-0-89874-230-5
- Dupasquier A 1844, Traité élémentaire de chimie industrielle , Charles Savy Juene, Lyon.
- Eagleson M 1994, Concise Encyclopedia Chemistry , Walter de Gruyter, Berlin, ISBN 978-3-11-011451-5
- Edwards PP 1999, "Az anyag fémes, szigetelő és szupravezető állapotának kémiai tervezése", in Seddon KR & Zaworotko M (szerk.), Crystal Engineering: The Design and Application of Functional Solids , Kluwer Academic, Dordrecht, ISBN 978-0-7923 -5905-0
- Edwards PP 2000, "What, why and when is a metal?", In N Hall (szerk.), The New Chemistry , Cambridge University, Cambridge, ISBN 978-0-521-45224-3
- Edwards PP és mtsai. 2010, "… egy fém dirigál, egy nemfém pedig nem", Philosophical Transactions of the Royal Society A, 2010, 368. kötet, 3. sz. 1914, doi : 10.1098/rsta.2009.0282
- Edwards PP & Sienko MJ 1983, "A fémes karakter előfordulásáról az elemek periódusos rendszerében", Journal of Chemical Education , vol. 60, nem. 9, doi : 10.1021ed060p691 , PMID 25666074
- Eichler és mtsai. 2008, "A 112 elem termokémiai és fizikai tulajdonságai", Angewandte Chemie , vol. 47, nem. 17, doi : 10.1002/anie.200705019
- Elatresh SF & Bonev SA 2020, "A szilárd oxigén stabilitása és fémezése magas nyomáson", Fizikai kémia Chemical Physics , vol. 22, nem. 22, doi : 10.1039/C9CP05267D
- Ellis JE 2006, "Kalandok olyan anyagokkal, amelyek fémeket tartalmaznak negatív oxidációs állapotban", Inorganic Chemistry , vol. 45, nem. 8, doi : 10.1021/ic052110i , PMID 16602773
- Emsley J 2011, A természet építőkövei: A – Z útmutató az elemekhez , Oxford University Press, Oxford, ISBN 978-0-19-850341-5
- Encyclopaedia Britannica 2021, Periodic table , hozzáférés szeptember 21
- Encyclopaedia Britannica, Or Dictionary of Arts, Sciences, and Miscellaneous Literature 1810, Archibald Constable, Edinburgh
- Errandonea D 2020, "Nyomás okozta fázistranszformációk", Crystals, vol. 10, doi : 10.3390/crystal10070595
- Faraday M 1853, Hat előadás tanfolyama tárgya a nemfémes elemekről ( John Scoffern rendezése ), Longman, Brown, Green és Longmans, London
- Farooq MA & Dietz KJ 2015, "A szilícium mint a növény- és humánbiológia sokoldalú szereplője: figyelmen kívül hagyva és rosszul értve", Frontiers of Plant Science , vol. 6. cikk, 994. cikk, doi : 10.3389/fpls.2015.00994
- Fehlner TP 1990, "The metallic Face of Boron", AG Sykes (szerk.), Advances in Inorganic Chemistry , vol. 35, Academic Press, Orlando, 199–233
- Fraps GS 1913, A mezőgazdasági kémia alapelvei , The Chemical Publishing Company, Easton, PA
- Fraústo da Silva JJR & Williams RJP 2001, The Elements Biological Chemistry: The Anorganic Chemistry of Life, 2. kiadás, Oxford University Press, Oxford, ISBN 978-0-19-850848-9
- Furuseth S, Selte K, Hope H, Kjekshus A & Klewe B 1974 "Jód-oxidok. V. rész A kristályszerkezetét (IO) 2 SO 4 ", Acta Chemica Scandinavica A, vol. 28., 71–76. O. , Doi : 10.3891/acta.chem.scand.28a-0071
- Gaffney J & Marley N 2017, General Chemistry for Engineers , Elsevier, Amszterdam, ISBN 978-0-12-810444-6
- Gargaud és mtsai. (szerk.) 2006, Lectures in Astrobiology, vol. 1. rész, 1. rész: A korai föld és más kozmikus élőhelyek az élethez , Springer, Berlin, ISBN 978-3-540-29005-6
- Glinka N 1965, Általános kémia , ford. D Sobolev, Gordon & Breach, New York
- Godfrin H & Lauter HJ 1995, "Experimental properties of 3 He adsorbed on graphite", Halperin WP (szerk.), Progress in Low Temperature Physics, 14. kötet , Elsevier Science BV, Amsterdam, ISBN 978-0-08-053993- 5
- Goldsmith RH 1982, 'Metalloids', Journal of Chemical Education , évf . 59, nem. 6., 526–27. O., Doi : 10.1021/ed059p526
- Goldstein N 1975, "Radon mag implantátumok: maradék radioaktivitás 33 év után", Archives of Dermatology , vol. 111, nem. 6, doi : 10.1001/archderm.1975.01630180085013
- Goodrich BG 1844, A Glance at the Physical Sciences , Bradbury, Soden & Co., Boston
- Kanada kormánya 2015, Az elemek időszakos táblázata , hozzáférés: 2015. augusztus 30.
- Greenwood NN 2001, "Main group element chemistry at the Millennium", Journal of the Chemical Society, Dalton Transactions , 14. szám, 2055–66. O., Doi : 10.1039/b103917m
- Greenwood NN & Earnshaw A 2002, Chemistry of the Elements , 2. kiadás, Butterworth-Heinemann, ISBN 978-0-7506-3365-9
- Grondzik WT et al. 2010, Mechanikai és elektromos berendezések épületekhez, 11. kiadás, John Wiley & Sons, Hoboken, ISBN 978-0-470-19565-9
- GSI 2015, Research Program - Highlights , December 14, hozzáférve 2016. november 9
- Gusmão R, Sofer, Z & Pumera M 2017, "Újra felfedezett fekete foszfor: Az ömlesztett anyagtól az egyrétegűig", Angewandte Chemie International Edition , vol. 56, nem. 28, doi : 10.1002/anie.201610512
- Gyanchandani J, Mishra V & Sikka SK 2018, "Super heavy element copernicium: Cohesive and electronic properties revisited", Solid State Communications , vol. 269, doi : 10.1016/j.ssc.2017.10.009
- Hall RA 2021, Pop Goes the Decade: The 2000s, ABC-CLIO, Santa Barbara, Kalifornia, ISBN 978-1-4408-6812-2
- Hampel CA & Hawley GG 1976, Glossary of Chemical kifejezések , Van Nostrand Reinhold, New York, ISBN 978-0-442-23238-2
- Hanley JJ & Koga KT 2018, "Halogének a földi és kozmikus geokémiai rendszerekben: bőség, geokémiai viselkedések és analitikai módszerek", a The Role of Halogens in Terrestrial and Extraterrestrial Geochemical Processes: Surface, Crust, and Mantle , Harlov DE & Aranovich L szerk.), Springer, Cham, ISBN 978-3-319-61667-4
- Harbison RD, Bourgeois MM & Johnson GT 2015, Hamilton and Hardy's Industrial Toxicology , 6. kiadás, John Wiley & Sons, Hoboken, ISBN 978-0-470-92973-5
- Hashemian SM & Fallahian F 2014, "A heliox használata a kritikus ellátásban", International Journal of Critical Illness and Injury Science , vol. 4, nem. 2, doi : 10.4103/2229-5151.134153
- Hawkes SJ 2001, 'Semimetallicity', Journal of Chemical Education , évf . 78, nem. 12., 1686–87. O., Doi : 10.1021/ed078p1686
- Hengeveld R & Fedonkin MA 2007, "Bootstrapping the energy flow in the life of life", Acta Biotheoretica, vol. 55, doi : 10.1007/s10441-007-9019-4
- Herman ZS 1999, "A fémek, ötvözetek és intermetallikus vegyületek kémiai kötésének jellege, Linus Pauling szerint", in Maksić, ZB, Orville-Thomas WJ (szerk.), 1999, Pauling's Legacy: Modern Modeling of the Chemical Bond , Elsevier, Amszterdam, doi : 10.1016/S1380-7323 (99) 80030-2
- Hermann A, Hoffmann R & Ashcroft NW 2013, "Condensed Astatine: Monatomic and metallic", Physical Review Letters , vol. 111, doi : 10.1103/PhysRevLett.111.116404
- Hérold A 2006, "A kémiai elemek elrendezése a periódusos rendszer több osztályában, közös tulajdonságaik szerint" , Comptes Rendus Chimie , vol. 9, nem. 1, doi : 10.1016/j.crci.2005.10.002
- Herzfeld K 1927, "Az atomi tulajdonságokról, amelyek egy elemet fémmé tesznek", Physical Review , vol. 29, nem. 5, doi : 10.1103PhysRev.29.701
- Hill MS 2010, "Homocatenation of metal and metalloid main group elements", in Parkin G (szerk.), Metal-Metal Bonding. Structure and Bonding , vol 136. Springer, Berlin, doi : 10.1007/978-3-642-05243-9_6
- Hill G & Holman J 2000, Chemistry in Context , 5. kiadás, Nelson Thornes, Cheltenham, ISBN 978-0-17-448307-6
- Hoffman DC, Lee DM & Pershina V 2006, "Transactinides and the future elements", in Morss E, Norman M & Fuger J (szerk.), The Chemistry of the Actinide and Transactinide Elements , 3. kiadás, Springer Science+Business Media, Dordrecht, Hollandia, ISBN 978-1-4020-3555-5
- Holderness A & Berry M 1979, Advanced Level Inorganic Chemistry , 3. kiadás, Heinemann Educational Books, London, ISBN 978-0-435-65435-1
- Holliday AK, Hughes G & Walker SM 1973, "Carbon", Bailar et al. (szerk.), Comprehensive Inorganic Chemistry, vol. 1, Pergamon Press, Oxford, ISBN 978-0-08-015655-2
- Horvath AL 1973, "Az elemek kritikus hőmérséklete és a periodikus rendszer", Journal of Chemical Education, vol. 50, nem. 5, doi : 10.1021/ed050p335
- Houghton RP 1979, Fémkomplexek a szerves kémiában , Cambridge University Press, Cambridge, ISBN 978-0-521-21992-1
- House JE 2008, Szervetlen kémia , Elsevier, Amszterdam, ISBN 978-0-12-356786-4
- Housecroft CE & Sharpe AG 2008, Szervetlen kémia, 3. kiadás, Prentice-Hall, Harlow, ISBN 978-0-13-175553-6
- Hurlbut Jr CS 1961, Manual of Mineralogy , 15. kiadás, John Wiley & Sons, New York
- Iler RK 1979, The Chemistry of Silica: Solubility, Polymerization, Colloid and Surface properties, and Biochemistry , John Wiley, New York, ISBN 978-0-471-02404-0
- Imberti C & Sadler PJ, 2020, "A periódusos rendszer 150 éve: új gyógyszerek és diagnosztikai szerek", Sadler PJ & van Eldik R 2020, Advances in Inorganic Chemistry , vol. 75, Academic Press, ISBN 978-0-12-819196-5
- Az IUPAC Periodic Table of the Elements , elérhető 2021. október 11 -én
- Jenkins GM & Kawamura K 1976, Polimer szén-szénszál, üveg és szén , Cambridge University Press, Cambridge, ISBN 978-0-521-20693-8
- Jentzsch AV & Matile S 2015, "Aniontranszport halogénkötésekkel", in Metrangolo P & Resnati G (eds), Halogen Bonding I: Impact on Materials Chemistry and Life Sciences , Springer, Cham, ISBN 978-3-319-14057- 5
- Jesperson ND, Brady JE, Hyslop A 2012, Chemistry: The Molecular Nature of Matter , 6. kiadás, John Wiley & Sons, Hoboken NY, ISBN 978-0-470-57771-4
- Johnson D (szerk.) 2007, Metals and Chemical Change, RSC Publishing, Cambridge, ISBN 978-0-85404-665-2
- Johnson RC 1966, Bevezető leíró kémia , WA Benjamin, New York
- Jolly WL 1966, A nem fémek kémiája , Prentice-Hall, Englewood Cliffs, New Jersey
- Jones BW 2010, Pluto: Sentinel of the Outer Solar System , Cambridge University, Cambridge, ISBN 978-0-521-19436-5
- Jones K 1973, "Nitrogén", Bailar et al. (szerk.), Comprehensive Inorganic Chemistry, vol. 2, Pergamon Press, Oxford, ISBN 978-0-08-016988-0
- Jones L & Atkins P 2000, Chemistry: Molecules, Matter, and Change , 4. kiadás, WH Freeman and Company, New York, ISBN 978-0-7167-3254-9
- Kaiho T 2017, egyszerű jód , CRC Press, e-könyv, doi : 10.1201/9781315158310
- Keeler J & Wothers P 2013, Kémiai szerkezet és reaktivitás: integrált megközelítés , Oxford University Press, Oxford, ISBN 978-0-19-960413-5
- Kendall EA 1811, Pocket enciklopædia, 2. kiadás, vol. III., Longman, Hurst, Rees, Orme és társai, London
- Kent JA 2007, Kent és Riegel kézikönyve az ipari kémiáról és biotechnológiáról , 11. kiadás, évf. 1, Springer, New York, ISBN 978-0-387-27842-1
- Keogh DW 2005, "Actinides: Inorganic & koordinációs kémia", RB King (szerk.), Encyclopedia of Inorganic Chemistry , 2. kiadás, köt. 1, John Wiley & Sons, New York, 2–32. Oldal, ISBN 978-0-470-86078-6
- Kiiski és mtsai. 2016, "Fertilizers, 1. General", Ullmann's Encyclopedia of Industrial Chemistry, doi : 10.1002/14356007.a10_323.pub4
- King AH 2019, "Elementális lábnyomunk", Nature Materials , vol. 18, doi : 10.1038/s41563-019-0334-3
- King RB 1994, Encyclopedia of Anorganic Chemistry , vol. 3, John Wiley & Sons, New York, ISBN 978-0-471-93620-6
- King RB 1995, Anorganic Chemistry of Main Group Elements , VCH, New York, ISBN 978-1-56081-679-9
- King GB & Caldwell WE 1954, The Fundamentals of College Chemistry , American Book Company, New York
- Kitaĭgorodski AI 1961, Organic Chemical Crystallography , Consultants Bureau, New York
- Kläning UK & Appelman EH 1988, "Perxenic acid Protolytic properties", Inorganic Chemistry , vol. 27, nem. 21, doi : 10.1021/ic00294a018
- Kneen WR, Rogers MJW & Simpson P 1972, Kémia: tények, minták és elvek , Addison-Wesley, London, ISBN 978-0-201-03779-1
- Knight J 2002, Science of Everyday Things: Real-life chemistry , Gale Group, Detroit, ISBN 9780787656324
- Koziel JA 2002, "Mintavétel és mintaelőkészítés beltéri levegő elemzéséhez", in Pawliszyn J (szerk.), Comprehensive Analytical Chemistry , vol. 37, Elsevier Science BV, Amszterdam, ISBN 978-0-444-50510-1
- Kubaschewski O 1949, "Az elemek entrópiájának, térfogatának és kötési állapotának változása olvadáskor", Transactions of the Faraday Society, vol. 45, doi : 10.1039/TF9494500931
- Labinger JA 2019, "A nemesgázok felfedezésének és kémiájának története (és előtörténete)", Giunta CJ, Mainz VV & Girolami GS (szerk.), 150 Years of the Periodic Table: A Commemorative Symposium , Springer Nature , Cham, Svájc, ISBN 978-3-030-67910-1
- Lanford OE 1959, Using Chemistry , McGraw-Hill, New York
- Lavoisier A 1789, Traité Élémentaire de Chimie, présenté dans un ordre nouveau, et d'après des découvertes modernes , Cuchet, Párizs
- Leach RB & Ewing GW 1966, Kémia, Doubleday, New York
- Lee JD 1996, Concise Inorganic Chemistry , 5. kiadás, Blackwell Science, Oxford, ISBN 978-0-632-05293-6
- Lewis RJ 1993, Hawley's Condensed Chemical Dictionary , 12. kiadás, Van Nostrand Reinhold, New York, ISBN 978-0-442-01131-4
- Lide DR (szerk.) 2003, CRC Handbook of Chemistry and Physics , 84. kiadás, CRC Press, Boca Raton, Florida, 6. szakasz, Fluid Properties; Gőznyomás
- Lidin RA 1996, Szervetlen anyagok kézikönyve , Begell House, New York, ISBN 978-0-8493-0485-9
- Liptrot GF 1983, Modern Inorganic Chemistry , 4. kiadás, Bell & Hyman, ISBN 978-0-7135-1357-8
- Los Alamos National Laboratory 2021, Periodic Table of Elements: A Resource for Elementary, Middle School, and High School Students , hozzáférve 2021. szeptember 19 -én
- Luchinskii GP & Trifonov DN 1981, "A kémiai elemek osztályozásának néhány problémája és a periodikus rendszer szerkezete", Uchenie o Periodichnosti. Istoriya i Sovremennoct , (orosz) Nauka, Moszkva
- MacKay KM, MacKay RA & Henderson W 2002, Introduction to Modern Inorganic Chemistry , 6. kiadás, Nelson Thornes, Cheltenham, ISBN 978-0-7487-6420-4
- Mackin M 2014, Tanulmányi útmutató a kémia kísérő alapjaihoz , Elsevier Science, Saint Louis, ISBN 978-0-323-14652-4
- Manahan SE 2001, Fundamentals of Environmental Chemistry , 2. kiadás, CRC Press, Boca Raton, Florida, ISBN 978-1-56670-491-5
- Maosheng M 2020, "A szilárd vegyületekben lévő nemesgázok a kémia gazdag megjelenését mutatják kellő nyomással", Frontiers in Chemistry , vol. 8, doi : 10.3389/fchem.2020.570492
- Maroni M, Seifert B & Lindvall T (eds) 1995, "Physical pollutants", in Indoor Air Quality: A Comprehensive Reference Book , Elsevier, Amsterdam, ISBN 978-0-444-81642-9
- Masterton W, Hurley C & Neth E 2011, Chemistry: Principles and Reactions , 7. kiadás, Brooks/Cole, Belmont, California, ISBN 978-1-111-42710-8
- Matson M & Orbaek AW 2013, Inorganic Chemistry for Dummies, John Wiley & Sons: Hoboken, ISBN 978-1-118-21794-8
- Matula RA 1979, "Réz, arany, palládium és ezüst elektromos ellenállása", Journal of Physical and Chemical Reference Data , vol. 8, nem. 4, doi : 10.1063/1.555614
- Mazej Z 2020, "Nemesgáz-kémia több mint fél évszázaddal a nemesgáz-vegyület első jelentése után", Molecules , vol. 25, nem. 13, doi : 10.3390/molekulák25133014 , PMID 32630333 , PMC 7412050
- McCall és mtsai, 2014, A bróm elengedhetetlen nyomelem a kollagén IV állványok összeszereléséhez a szövetek fejlődésében és építészetében, Cell , vol. 157, nem. 6, doi : 10.1016/j.cell.2014.05.009 , PMID 24906154 , PMC 4144415
- McCue JJ 1963, World of Atoms: An Introduction to Physical Science , Ronald Press, New York
- McKetta Jr JJ (szerk.), Encyclopedia of Chemical Processing and Design, 36. kötet-Phosphorus to Pipeline Failure: Subidence Strains , CRC Press, Boca Raton, ISBN 978-0-8247-2486-3
- McMillan P 2006, "Egy pohár szén -dioxid", Nature , vol. 441, doi : 10.1038/441823a
- Messler JR RW 2011, The Essence of Materials for Engineers , Jones and Bartlett Learning, Sudbury, Massachusetts, ISBN 978-0-7637-7833-0
- Mewes és mtsai. 2019, "A Copernicium relativista nemes folyadék", Angewandte Chemie International Edition , vol. 58, doi : 10.1002/anie.201906966
- Meyer és mtsai. (szerk.) 2005, Toxicity of Dietborne Metals to Aquatic Organisms , Proceedings from the Pellston Workshop on Toxicity of Dietborne Metals to Aquatic Organises, 2002. július 27. – augusztus 1., Fairmont Hot Springs, British Columbia, Canada, Society of Environmental Toxicology and Chemistry, Pensacola, Florida, ISBN 978-1-880611-70-8
- Mikla VI és Mikla VV 2012, Amorf kalkogenidák: A múlt, jelen és jövő , Elsevier, Boston, ISBN 978-0-12-388429-9
- Mingos DMP 2019, "Az elemek felfedezése a periódusos rendszerben", Mingos DMP (szerk.), The Periodic Table I. Structure and Bonding , Springer Nature, Cham, doi : 10.1007/978-3-030-40025- 5
- Moeller T és mtsai. 2012, Kémia: Szervetlen minőségi elemzéssel , Academic Press, New York, ISBN 978-0-12-503350-3
- Möller D 2003, Luft: Chemie, Physik, Biologie, Reinhaltung, Recht , Walter de Gruyter, Berlin, ISBN 978-3-11-016431-2
- Monteil Y & Vincent H 1976, "Foszforvegyületek a VI B csoport elemeivel", Zeitschrift für Naturforschung B , doi : 10.1515/znb-1976-0520
- Moody B 1991, Comparative Inorganic Chemistry , 3. kiadás, Edward Arnold, London, ISBN 978-0-7131-3679-1
- Moore JT 2016, Chemistry for Dummies, 2. kiadás, fejezet. 16, Periodikus trendek követése, John Wiley & Sons: Hoboken, ISBN 978-1-119-29728-4
- Moss, TS 1952, Photoconductivity in the Elements , Butterworths Scientific, London
- Nakao Y 1992, "Nemesfémek feloldása halogén -halogenid – poláris szerves oldószerrendszerekben", Journal of the Chemical Society, Chemical Communications , no. 5, doi : 10.1039/C39920000426
- Nash CS 2005, "112, 114 és 118 elemek atomi és molekuláris tulajdonságai", Journal of Physical Chemistry A , vol. 109, doi : 10.1021/jp050736o
- National Center for Biotechnology Information 2021, " PubChem összetétel összefoglaló a CID 402 -hez, hidrogén -szulfid ", hozzáférhető 2021. augusztus 31 -én
- Nemzeti Szabványügyi és Technológiai Intézet 2013, SRM 4972-Radon-222 Emanation Standard , letöltve az Internet Archívumból , 2021. augusztus 1.
- Nemzeti Fizikai Laboratórium, Kaye és Laby táblázatok a fizikai és kémiai állandókról , 3.4.4. Szakasz, Gőznyomás 0,2 és 101,325 kPa között, hozzáférve 2021. július 22 -én
- Nelson PG 1987, "Fontos elemek", Journal of Chemical Education , vol. 68, nem. 9, doi : 10.1021/ed068p732
- Neuburger MC 1936, 'Gitterkonstanten für das Jahr 1936' (németül), Zeitschrift für Kristallographie , vol. 93., 1–36. O. , ISSN 0044-2968
- Oderberg DS 2007, Real Essentialism , Routledge, New York, ISBN 978-1-134-34885-5
- Oganov és mtsai. 2009, "Az elemi bór ionos nagynyomású formája", Nature , vol. 457, Doi : 10.1038 / nature07736 , arXiv : 0.911,3192 , PMID 19.182.772
- Okajima Y & Shomoji M 1972, "Híg amalgámok viszkozitása", Transactions of the Japan Institute of Metals , vol. 13, nem. 4., 255–58. O., Doi : 10.2320/matertrans1960.13.255
- Ostriker JP & Steinhardt PJ 2001, "The quintessential Universum", Scientific American , vol. 284, sz. 1, 46–53. Oldal PMID 11132422 , doi : 10.1038/scientificamerican0101-46
- Oxford English Dictionary , hozzáférve 2021. október 19 -én
- Oxtoby DW, Gillis HP & Butler LJ 2015, Principles of Modern Chemistry , 8. kiadás, Cengage Learning, Boston, ISBN 978-1-305-07911-3
- Parameswaran és mtsai. 2020, "Mechanikusan ötvözött hexanáris Al 16,6 Mg 16,6 Ni 16,6 Cr 16,6 Ti 16,6 Mn 16,6 nagy entrópiájú ötvözet fázisfejlődése és jellemzése ", Metal Powder Report , vol. 75, nem. 4, doi : 10.1016/j.mprp.2019.08.001
- Parish RV 1977, The Metallic Elements , Longman, London, ISBN 978-0-582-44278-8
- Partington JR 1944, A szervetlen kémia tankönyve , 5. kiadás, Macmillan & Co., London
- Pearson WB 1972, The Crystal Chemistry and Physics of Metals and Alloys , Wiley-Interscience, New York, ISBN 978-0-471-67540-2
- Phillips CSG & Williams RJP 1965, Szervetlen kémia , vol. 1, Elvek és nemfémek, Clarendon Press, Oxford
- Pilar FL 1979, Kémia: The Universal Science , Addison-Wesley, Reading, Massachusetts, ISBN 978-0-201-05768-3
- Piro NA, Figueroa JS, McKellar JT & Troiani CC 2006, "Triple-bond reaktivitás a difoszfor molekulák", Science , vol. 313, sz. 5791, doi : 10.1126/science.1129630 , PMID 16946068
- Pitts CR, Holl MG & Lectka T 2018, "[C -F -C] + fluoróniumion spektroszkópos jellemzése oldatban", Angewandte Chemie International Edition , vol. 57., doi : 10.1002/anie.201712021
- Pitzer K 1975, "Fluoridok a radonból és elemekből 118", Journal of the Chemical Society, Chemical Communications , no. 18, doi : 10.1039/C3975000760B
- Porterfield WW 1993, Szervetlen kémia , Academic Press, San Diego, ISBN 978-0-12-562980-5
- Povh B & Rosina M 2017, Scattering and Structures: Essentials and Analogies in Quantum Physics, 2. kiadás, Springer, Berlin, doi : 10.1007/978-3-662-54515-7
- Prinessa C & Sadler PJ 2015, "Az élet elemei és a gyógyszerek", Philosophical Transactions of the Royal Society A , vol. 373, nem. 2037, doi : 10.1098/rsta.2014.0182 , PMID 25666066 , PMC 4342972
- Puddephatt RJ & Monaghan PK 1989, Az elemek periódusos rendszere , 2. kiadás, Clarendon Press, Oxford, ISBN 978-0-19-855516-2
- Pyykkö P 2012, "Relativisztikus hatások a kémiában: gyakoribb, mint gondolnátok", Annual Review of Physical Chemistry , vol. 63, doi : 10.1146/annurev-physchem-032511-143755 , PMID 22404585
- Rahm M, Hoffmann R & Ashcroft NW 2016. "Atomic and ionis sugar of elements 1-96", Chemistry: A European Journal , vol. 22, doi : 10.1002/chem.201602949
- Rao KY 2002, szemüvegszerkezeti kémia , Elsevier, Oxford, ISBN 978-0-08-043958-7
- Rao CNR & Ganguly PA 1986, "Az elemek fémes jellegének új kritériuma", Solid State Communications, vol. 57, nem. 1. o. 5–6, doi : 10.1016/0038-1098 (86) 90659-9
- Raub CJ & Griffith WP 1980, "Osmium and sulfur", in Gmelin Handbook of Inorganic Chemistry, 8. kiadás, Os, Osmium: Supplement, Swars K, (szerk.), Sz. 66., Springer-Verlag, Berlin, 166–170. Oldal, ISBN 3-540-93420-0
- Rayner-Canham G 2011, "Izodiagonalitás a periódusos rendszerben", Foundations of Chemistry , vol. 13, nem. 2, doi : 10.1007/s10698-011-9108-y
- Rayner-Canham G 2018, "Az átmeneti fémek szervezése", in Scerri E & Restrepo G, Mendeleev to Oganesson: A multidiszciplináris perspektíva a periódusos rendszerben , Oxford University, New York, ISBN 978-0-190-668532
- Rayner-Canham 2021, A periódusos rendszer: múlt, jelen és jövő , World Scientific, New Jersey, ISBN 978-981-121-850-7
- Rees A (szerk.) 1819, The Cyclopaedia ; Vagy a Művészetek, Tudományok és Irodalom Egyetemes Szótára Harminckilenc kötetben. Ta - Toleration , vol. 35, Longman, Hurst, Rees, Orme és Brown, London
- Regnault MV 1853, Elements of Chemistry , vol. 1, 2. kiadás, Clark & Hesser, Philadelphia
- Reilly C 2002, Élelmiszer fémszennyezése , Blackwell Science, Oxford, ISBN 978-0-632-05927-0
- Reinhardt és mtsai. 2015, Inerting in the vegyipar , Linde, Pullach, Németország, hozzáférve 2021. október 19 -én
- Remy H 1956, Traktátus a szervetlen kémiáról, Anderson JS (ford.), Kleinberg J (szerk.), Köt. II, Elsevier, Amszterdam
- Renouf E 1901, "Lehrbuch der anorganischen Chemie", Science , vol. 13, nem. 320, doi : 10.1126/science.13.320.268
- Restrepo G, Llanos EJ & Mesa H 2006, "A kémiai elemek topológiai tere és tulajdonságai", Journal of Mathematical Chemistry , vol. 39, doi : 10.1007/s10910-005-9041-1
- Riley és mtsai. 2020, "A nehézfémek láncot hoznak létre: A katenizált bizmutvegyület", European Chemistry Journal , vol. 26, doi : 10.1002/chem.202001295 , PMID 32298506
- Ritter SK 2011, "Az eltűnt xenon esete" , Chemical & Engineering News , vol. 89, nem. 9, ISSN 0009-2347
- Rochow EG 1966, The Metalloids , DC Heath and Company, Boston
- Rochow EG 1973, "Silicon", Bailar et al. (szerk.), Comprehensive Inorganic Chemistry, vol. 1, Pergamon Press, Oxford, ISBN 978-0-08-015655-2
- Rochow EG 1977, Modern leíró kémia , Saunders, Philadelphia, ISBN 978-0-7216-7628-9
- Rodgers GE 2012, Descriptive Inorganic, Coordination, and Solid State Chemistry , 3. kiadás, Brooks/Cole, Belmont, California, ISBN 978-0-8400-6846-0
- Roher GS 2001, Structure and Bonding in Crystalline Materials , Cambridge University Press, Cambridge, ISBN 978-0-521-66379-3
- Royal Society of Chemistry 2021, Periodic Table: Non-metal , hozzáférés: 2021. szeptember 3.
- Royal Society of Chemistry and Compound Interest 2013, Elements infographics , Group 4 - The Crystallogens, hozzáférve 2021. szeptember 2 -án
- Rudolph J 1974, Chemistry for the Modern Mind , Macmillan, New York
- Ruff O & Kwasnik W 1935, "A salétromsav fluorozása. A nitroxifluorid, NO 3 F", Angewandte Chemie, vol. 48., 238–240. Oldal, doi : 10.1002/ange.19350481604
- Russell AM & Lee KL 2005, Struktúra-tulajdonság kapcsolatok a színesfémekben , Wiley-Interscience, New York, ISBN 0-471-64952-X
- Sanderson RT 1957, "Elektronikus megkülönböztetés a fémek és a nemfémek között", Journal of Chemical Education, vol. 34, nem. 5, doi : 10.1021/ed034p229
- Sanderson RT 1967, Szervetlen kémia , Reinhold, New York
- Scerri E (szerk.) 2013, 30 másodperces elemek: Az 50 legjelentősebb elem, mindegyik fél perc alatt megmagyarázva , Ivy Press, London, ISBN 978-1-84831-616-4
- Scerri E 2013, A Tale of Seven Elements , Oxford University Press, Oxford, ISBN 978-0-19-539131-2
- Scerri E 2020, A periódusos rendszer, története és jelentősége, 2. kiadás, Oxford University Press, New York, ISBN 978-0-19-091436-3 | csoport = n}}
- Schaefer JC 1968, "Boron", Hampel CA (szerk.), The Encyclopedia of the Chemical Elements , Reinhold, New York
- Schenk J & Prins J 1953, "Plastic sulfur", Nature , vol. 172, doi : 10.1038/172957a0
- Schmedt auf der Günne J, Mangstl M & Kraus F 2012, "Difluor F 2 előfordulása a természetben - In situ bizonyítás és számszerűsítés NMR spektroszkópiával", Angewandte Chemie International Edition , vol. 51, nem. 31, doi : 10.1002/anie.201203515
- Schulze-Makuch D & Irwin LN 2008, Life in the Universe: Expectations and Constraints , 2. kiadás, Springer-Verlag, Berlin, ISBN 978-3-540-76816-6
- Schweitzer GK & Pesterfield LL 2010, Az elemek vizes kémiája , Oxford University Press, Oxford, ISBN 978-0-19-539335-4
- Science Learning Hub – Pokapū Akoranga Pūtaiao 2021, " The essential elements ", hozzáférve 2021. augusztus 14 -én
- Scott D 2015, Around the World in 18 Elements , Royal Society of Chemistry, e-book, ISBN 978-1-78262-509-4
- Scott EC & Kanda FA 1962, The Nature of Atoms and Molecules: A General Chemistry , Harper & Row, New York
- Seaborg GT 1969, "A periódusos rendszer további jelentős kiterjesztésének kilátásai", Journal of Chemical Education , vol. 46, nem. 10, doi : 10.1021/ed046p626
- Seese WS & Daub GH 1985, Basic Chemistry , 4. kiadás, Prentice-Hall, Englewood Cliffs, NJ, ISBN 978-0-13-057811-2
- Shakhashiri BZ, Dirreen E & Williams LG 1989, "Paramagnetizmus és a folyékony oxigén színe: előadás -bemutató", Journal of Chemical Education , vol. 57, nem. 5, doi : 10.1021/ed057p373
- Shanabrook BV, Lannin JS & Hisatsune IC 1981, "Rugalmatlan fényszórás egy egyszer koordinált amorf félvezetőben", Physical Review Letters , vol. 46, nem. 2., január 12., doi : 10.1103/PhysRevLett.46.130
- Sharp DWA 1981, "Metalloids", Miall's Dictionary of Chemistry , 5. kiadás, Longman, Harlow, ISBN 0-582-35152-9
- Shiell és mtsai. 2021, "Tömeges kristályos 4H-szilícium metastabil allotróp átmenet útján", Physical Review Letters , vol. 26, 215701 o., Doi : 10.1103/PhysRevLett.126.215701
- Sidorov TA 1960, "A kapcsolat a szerkezeti oxidok és azok hajlama az üvegképződésre", Glass and Ceramics , vol. 17, nem. 11, doi : 10.1007BF00670116
- Siebring BR & Schaff ME 1980, General Chemistry , Wadsworth Publishing, Belmont, CA, ISBN 978-0-534-00802-4
- Siekierski S & Burgess J 2002, Concise Chemistry of the Elements , Horwood Press, Chichester, ISBN 978-1-898563-71-6
- Slye OM Jr 2008, "Tűzoltószerek", az Ullmann's Encyclopedia of Industrial Chemistry, doi : 10.1002/14356007.a11_113.pub2
- Smith A & Dwyer C 1991, Key Chemistry: Investigating Chemistry in the Contemporary World: 1. könyv: Anyagok és mindennapi élet, Melbourne University Press, Carlton, Victoria, ISBN 978-0-522-84450-4
- Smulders E & Sung E 2011, "Mosodai mosószerek, 2, Összetevők és termékek", In Ullmann's Encyclopedia of Industrial Chemistry, doi : 10.1002/14356007.o15_o13
- Stein L 1969, "Oxidált radon halogén -fluorid oldatokban", Journal of the American Chemical Society , vol. 19, nem. 19, doi : 10.1021/ja01047a042
- Stein L 1983, "The chemistry of radon", Radiochimica Acta , vol. 32, doi : 10.1524/ract.1983.32.13.163
- Stellman JM (szerk.) 1998, Encyclopaedia of Occupational Health and Safety , vol. 4, 4. kiadás, Nemzetközi Munkaügyi Hivatal, Genf, ISBN 978-92-2-109817-1
- Steudel R 1977, A nemfémek kémiája: Bevezetés az atomi szerkezetbe és a kémiai kötésbe , Walter de Gruyter, Berlin, ISBN 978-3-11-004882-7
- Steudel R & Eckert B 2003, "Solid sulfur allotropes", in Steudel R (ed.), Elemental Sulphur and Sulphur-Rich Compounds I , Springer-Verlag, Berlin, ISBN 978-3-540-40191-9
- Steurer W 2007, "Az elemek kristályszerkezetei", Marin JW (szerk.), Concise Encyclopedia of the Structure of Materials , Elsevier, Oxford, ISBN 978-0-08-045127-5
- Stewart D, Chemicool Periodic Table , www.chemicool.com. Hozzáférés: 2021. július 10
- Stott RWA 1956, társa a fizikai és szervetlen kémiának, Longmans, Green and Co, London
- Su és mtsai. 2020 „Az előleget a foton a közelmúltban kifejlesztett Xenes” nanofotonikát , vol. 9, nem. 7, doi : 10.1515/nanoph-2019-0561
- Suresh CH & Koga NA 2001, " Egységes megközelítés az atomi sugarak felé", Journal of Physical Chemistry A, 105. kötet, 24. szám. Doi : 10.1021/jp010432b
- Sutton M 2016, " A noble quest ", Chemistry World , szeptember 9, hozzáférve 2021. szeptember 8 -án
- Szpunar J, Bouyssiere B & Lobinski R 2004, 'Advances in Analytical Methods for Speciation of Trace Elements in the Environment', in AV Hirner & H Emons (szerk.), Organic Metal and Metalloid Species in the Environment: Analysis, Distribution Processes and Toxicological Értékelés , Springer-Verlag, Berlin, 17–40. Oldal, ISBN 978-3-540-20829-7
- Tantardini C & Oganov AR 2021, "Az elemek termokémiai elektronegativitása", Nature Communications , vol. 12. cikk, sz. 2087, doi : 10.1038/s41467-021-22429-0 , PMID 33828104 , PMC 8027013
- The Chemical News and Journal of Physical Science 1864, "Notices of books: Manual of the Metalloids", január 9.
- The Chemical News 1897, "Notices of books: A Manual of Chemistry, Theoretical and Practical, by WA Tilden", köt. 75, nem. 1951
- Thornton BF & Burdette SC 2010, " Finding eka-jodine: Discovery priority in modern times ", Bulletin for the history of chemistry , évf. 35, nem. 2, hozzáférve 2021. szeptember 14 -én
- Tregarthen L 2003, Előzetes kémia, Macmillan Oktatás: Melbourne, ISBN 978-0-7329-9011-4
- Trenberth KE & Smith L 2005, "A légkör tömege: A globális elemzések korlátozása" , Journal of Climate , vol. 18, nem. 6, doi : 10.1175/JCLI-3299.1
- Tshitoyan és mtsai. 2019, "A felügyelet nélküli szóbeágyazások az anyagtudományi irodalom rejtett tudását rögzítik." Nature , vol. 571, doi : 10.1038/s41586-019-1335-8
- Tyler PM 1948, Az alapoktól kezdve: Tények és adatok az Egyesült Államok ásványiparáról, McGraw-Hill, New York
- Van Setten és mtsai. 2007, "A bór termodinamikai stabilitása: A hibák szerepe és a nulla pont mozgása" , Journal of the American Chemical Society , vol. 129, nem. 9, doi : 10.1021/ja0631246
- Vassilakis AA, Kalemos A & Mavridis A 2014, "Pontos első elvek számítások a klór -fluorid ClF -ről és ionjairól ClF ± ", Theoretical Chemistry Accounts , vol. 133. cikk, sz. 1436, doi : 10.1007/s00214-013-1436-7
- Vernon R 2013, "Mely elemek a metalloidok?", Journal of Chemical Education , vol. 90, nem. 12, 1703-1707, doi : 10.1021/ed3008457
- Vernon R 2020, "A fémek és nemfémek szervezése", Foundations of Chemistry , vol. 22, doi : 10.1007/s10698-020-09356-6
- Vernon R 2021, "A periódusos rendszer 3. csoportjának helye és összetétele", Foundations of Chemistry , vol. 23., doi : 10.1007/s10698-020-09384-2
- Wächtershäuser G 2014, "A kémiai invarianciától a genetikai variabilitásig", Weigand W és Schollhammer P (szerk.), Bioinspired Catalysis: Metal Sulphur Complexes , Wiley-VCH, Weinheim, doi : 10.1002/9783527664160.ch1
- Walker P & Tarn WH 1996, CRC Handbook of Metal Etchants , Boca Raton, FL, ISBN 978-0-8493-3623-2
- Wakeman TH 1899, "Szabad gondolat - múlt, jelen és jövő", Free Thought Magazine , vol. 17
- Watts H 1871, A Dictionary of Chemistry and the Allied Branches of Other Sciences, vol. 3, Longmans, Green és Co, London, p. 934
- Weeks ME 1948, Discovery of the Elements , 5. kiadás, Journal of Chemical Education, Easton, Pennsylvania
- Welcher SH 2001, Magas jegyek: Regents Chemistry Made Easy , 2. kiadás, High Marks Made Easy, New York, ISBN 978-0-9714662-4-1
- Wells AF 1984, Structural Inorganic Chemistry , 5. kiadás, Clarendon Press, Oxford, ISBN 978-0-19-855370-0
- West DC 1953, "A jód fotoelektromos állandói", Canadian Journal of Physics , vol. 31, nem. 5, doi : 10.1139/p53-065
- White JH 1962, Szervetlen kémia: haladó és ösztöndíjszintek , University of London Press, London
- Wiberg N 2001, Szervetlen kémia , Academic Press, San Diego, ISBN 978-0-12-352651-9
- Wickleder MS, Pley M & Büchner O 2006, „Nemesfémek szulfátjai: a potenciális anyagok lenyűgöző kémiája”, Zeitschrift für Anorganische und Allgemeine Chemie, vol. 632, sz. 12–13, p. 2080, doi : 10.1002/zaac.200670009
- Wickleder MS 2007, "Chalcogen-oxigen chemistry", Devillanova FA (szerk.), Chalcogen Chemistry Handbook: New Perspectives in Sulphur, Selenium and Tellurium, RSC, Cambridge, 344–377, ISBN 978-0-85404- 366-8
- Williams RPJ 2007, "Élet, környezet és ökoszisztéma", Journal of Inorganic Biochemistry , vol. 101, sz. 11–12, doi : 10.1016/j.jinorgbio.2007.07.006
- Windmeier C & Barron RF 2013, "Cryogenic technology", in Ullmann's Encyclopedia of Industrial Chemistry, doi : 10.1002/14356007.b03_20.pub2
- Winkler és mtsai. 2016, "A vegyileg inert nemesgázok változatos biológiai tulajdonságai", Pharmacology & Therapeutics , vol. 160, doi : 10.1016/j.pharmthera.2016.02.002
- Winstel G 2000, Elektrolumineszcens anyagok és eszközök, az Ullmann's Encyclopedia of Industrial Chemistry, doi : 10.1002/14356007.a09_255
- Woodward és mtsai. 1999, "A fém -oxidok elektronikus szerkezete". Fierro JLG (szerk.), Metal Oxides: Chemistry and Applications , CRC Press, Boca Raton, ISBN 1-4200-2812-X
- Wulfsberg G 1987, Principles of Descriptive Chemistry , Brooks/Cole, Belmont CA, ISBN 978-0-534-07494-4
- Wulfsberg G 2000, Szervetlen kémia , University Science Books, Sausalito, California, ISBN 978-1-891389-01-6
- Yamaguchi M & Shirai Y 1996, "Defect strutures", in Stoloff NS & Sikka VK (eds) Physical Metallurgy and Processing of Intermetallic Compounds , Chapman & Hall, New York, ISBN 978-1-4613-1215-4
- Yoder CH, Suydam FH & Snavely FA 1975, Kémia , 2. kiadás, Harcourt Brace Jovanovich, New York, ISBN 978-0-15-506470-6
- Yost DM és Russell H 1946, Az ötödik és hatodik csoport nemfémes elemeinek szisztematikus szervetlen kémiája, Prentice-Hall, New York
- Young és mtsai. Botch B 2018, Általános kémia: Először atomok, Cengage Learning: Boston, ISBN 978-1-337-61229-6
- Young JA 2006, "Jód", Journal of Chemical Education , évf . 83, nem. 9, doi : 10.1021/ed083p1285
- Yousuf M 1998, "Diamond üllősejtek a félvezetők nagynyomású vizsgálatában", Suski T & Paul W (szerk.), High Pressure in Semiconductor Physics II , Semiconductors and Semimetals, vol. 55, Academic Press, San Diego, ISBN 978-0-08-086453-2
- Zhao, Z, Zhang H, Kim D. et al. 2017, "Az egzotikus metastabil ST12 germánium allotrop tulajdonságai", Nature Communications , vol. 8, doi : 10.1038/ncomms13909 , PMID 28045027 , PMC 5216117
- Zhu és mtsai. 2014, "A xenon vassal és nikkelrel történő reakcióit a Föld belső magjában jósolják", Nature Chemistry , vol. 6, doi : 10.1038/nchem.1925 , PMID 24950336
- Zoroddu és mtsai. 2019, "Az alapvető fémek az emberek számára: rövid áttekintés", Journal of Inorganic Biochemistry , vol. 195, doi : 10.1016/j.jinorgbio.2019.03.013 , PMID 30939379
- Zumdahll SS & DeCoste DJ 2019, Bevezető kémia: Alapítvány, 9. kiadás, Cengage Learning, Boston, ISBN 978-1-337-39942-5
- Zumdahl SS & Zumdahl SA 2009, Kémia , 7. kiadás, Houghton Mifflin, Boston, ISBN 978-1-111-80828-0
Monográfiák
- Steudel R 2020, A nemfémek kémiája: szintézisek - szerkezetek - kötés - alkalmazások , együttműködésben D Scheschkewitz, Berlin, Walter de Gruyter, doi : 10.1515/9783110578065 .
- Huszonhárom nemfém, köztük B, Si, Ge, As, Se, Te és At, de nem Sb (sem Po). A nemfémeket abszolút nulla elektromos vezetőképességük alapján azonosítják, feltételezhetően nullához közeli, nem pedig véges, mint a fémek esetében. Ez azonban nem működik az As esetében, amelynek elektronikus szerkezete egy félfém (például Sb).
- Halka M & Nordstrom B 2010, "Nemfémek" , Facts on File, New York, ISBN 978-0-8160-7367-2
- 9+ olvasási szintű könyv, amely H, C, N, O, P, S, Se. Ugyanazon szerzők kiegészítő könyvei vizsgálják a) az átmenet utáni fémeket (Al, Ga, In, Tl, Sn, Pb és Bi) és a metalloidokat (B, Si, Ge, As, Sb, Te és Po); és b) a halogének és nemesgázok.
- Woolins JD 1988, nemfém gyűrűk, ketrecek és fürtök , John Wiley & Sons, Chichester, ISBN 978-0-471-91592-8 .
- Egy fejlettebb szöveg, amely lefedi a H -t; B; C, Si, Ge; N, P, As, Sb; O, S, Se és Te.
- Steudel R 1977, Chemistry of the Non-metall: With Introduction to Atomic Structure and Chemical Bonding , angol kiadás: FC Nachod & JJ Zuckerman, Berlin, Walter de Gruyter, ISBN 978-3-11-004882-7 .
- Huszonhárom nemfém, köztük B, Si, Ge, As, Se, Te és Po.
- Powell P & Timms PL 1974, The Chemistry of the Non-metall , Chapman & Hall, London, ISBN 978-0-470-69570-8 .
- Huszonkét nemfém, köztük B, Si, Ge, As és Te. Az ón és az antimon köztes a fémek és a nemfémek között; később fémként vagy nemfémként jelennek meg. Az asztatint fémnek tekintik.
- Emsley J 1971, The Inorganic Chemistry of the Non-fém , Methuen Educational, London, ISBN 978-0-423-86120-4 .
- Húsz nemfém. H az F fölé kerül; B és Si nemfémnek számít; Ge, As, Sb és Te metalloidoknak számítanak.
- Johnson RC 1966, Bevezető leíró kémia: kiválasztott nemfémek, tulajdonságaik és viselkedésük , WA Benjamin, New York.
- Tizennyolc nemfém. H a B és C fölött lebegve látható. A szilícium, Ge, As, Sb, Te, Po és At félfémként jelenik meg. Az at később nemfémként jelenik meg (133. o.).
- Jolly WL 1966, A nem fémek kémiája , Prentice-Hall, Englewood Cliffs, New Jersey.
- Huszonnégy nemfém, köztük B, Si, Ge, As, Sb, Te és At. H az F fölé kerül.
- Sherwin E & Weston GJ 1966, Chemistry of the Non-metallic Elements , Pergamon Press, Oxford.
- Huszonhárom nemfém. H jelentése Li és F; A germániumot, As -t, Se -t és Te -t később metalloidoknak nevezik; Az Sb nemfémként jelenik meg, de később fémként említik. Azt írják: "Bár ezek a nehezebb elemek [Se és Te] fémesnek tűnnek, megmutatják a nemfémek kémiai tulajdonságait, és ezért a" metalloidok "kategóriájába tartoznak (64. o.).
- Phillips CSG & Williams RJP 1965, Szervetlen kémia , vol. 1, Elvek és nemfémek, Oxford University Press, Clarendon.
- Huszonhárom nemfém, az Sb kivételével, beleértve az At. A maga korában fejlett munka, amely a szervetlen kémiát mutatja be, mint nehéz és összetett témát, sok új meglátással.
- Yost DM & Russell Jr, H 1946 Az ötödik és hatodik csoport nemfémes elemeinek szisztematikus szervetlen kémiája , Prentice-Hall, New York, hozzáférés 2021. augusztus 8-án.
- Tellúrumot tartalmaz nemfémes elemként.
- Bailey GH 1918, The Tutorial Chemistry, Part 1: The Non-Metals , 4. kiadás, W Briggs (szerk.), University Tutorial Press, London.
- Tizennégy nemfém (a nemesgázok kivételével), köztük B, Si, Se és Te. A szerző azt írja, hogy az arzén és az antimon csillogásukban és hő- és villamosenergia-vezetőképességükben a fémekhez hasonlítanak, de kémiai tulajdonságaikban a nemfémekhez hasonlítanak, mivel savas oxidokat képeznek és híg ásványi savakban nem oldódnak; "az ilyen elemeket metalloidoknak nevezik " (530. o.).
- Appleton JH 1897, A nemfémek kémiája: elemi tankönyv iskoláknak és főiskoláknak , Snow & Farnham nyomtatók, Providence, Rhode Island
- Tizennyolc nemfém: Ő, Ar; F, Cl, Br, I; O, S, Se, Te; N, P, As, Sb; C, Si; B; H. A neon, a germánium, a kripton és a xenon új vagy kétes elemként szerepel. Az Sb esetében Appleton ezt írja:
- "Az antimonot néha fémnek, néha nemfémnek minősítik. Több más elem esetében a besorolás kérdése nehéz-sőt, a besorolás a kényelem, bizonyos értelemben több, mint az abszolút tudományos bizonyosság. Egyes kapcsolataiban, különösen fizikai tulajdonságaiban az antimon a jól meghatározott fémekhez hasonlít-kémiai viszonyaiban a bórt, nitrogént, foszfort, arzént, jól meghatározott nemfémeket tartalmazó csoportba tartozik. " (166. o.).
- Appleton JH 1888, Kezdők kémiai kézikönyve: A tárgy, amelyet elsősorban a nemfémekből származó tények és elvek alapján fejlesztettek ki , Chautauqua Press, New York.
- Tizenöt nemfém, köztük B, Si, As, Sb és Se (a hat nemesgázt akkor még nem ismerték; Ge -t csak 1886 -ban fedezték fel). Te szerepel a kémiai elemek listájában, de máshol nem említik.
-
Gmelin L 1849, kémiai kézikönyv , évf. 2, Nemfémes elemek, H Watts (ford.), Cavendish Society, London.
- Tizenkét nemfém (akkor még "metalloidoknak" nevezték): H, B, C, N, O, F, P, S, Cl, Se, Br, I.
Külső linkek
-
 A nemfémekkel kapcsolatos média a Wikimedia Commonsban
A nemfémekkel kapcsolatos média a Wikimedia Commonsban

















