Riboszóma biogenezis - Ribosome biogenesis
A riboszóma biogenezis a riboszómák előállításának folyamata . A prokariótákban ez a folyamat a citoplazmában megy végbe sok riboszóma gén operon transzkripciójával . Az eukariótákban mind a citoplazmában , mind a sejtmagban játszódik le . Ez magában foglalja több mint 200 fehérje összehangolt funkcióját a három prokarióta vagy négy eukarióta rRNS szintézisében és feldolgozásában , valamint ezen rRNS -ek összekapcsolását a riboszómális fehérjékkel. A legtöbb riboszómális fehérje különböző energiafogyasztó enzimcsaládokba tartozik, beleértve az ATP-függő RNS- helikázokat , AAA-ATPázokat , GTPázokat és kinázokat . A sejt energiájának körülbelül 60% -át riboszómák előállítására és karbantartására fordítják.
A riboszóma biogenezis nagyon szigorúan szabályozott folyamat, és szorosan kapcsolódik más sejtes tevékenységekhez, például a növekedéshez és az osztódáshoz.
Néhányan azt feltételezték, hogy az élet eredetében a riboszóma biogenezis megelőzi a sejteket, és hogy a gének és sejtek úgy fejlődtek ki, hogy fokozzák a riboszómák reprodukciós képességét.
Riboszómák
A riboszómák a makromolekuláris gépeket, amelyek felelősek mRNS fordítás a fehérjék. Az eukarióta riboszóma, amelyet 80S riboszómának is neveznek, két alegységből áll - a nagy 60S alegységből (amely a 25S -t [növényekben] vagy a 28S -t [emlősökben], az 5,8S és 5S rRNS -t és 46 riboszómális fehérjét tartalmazza) és egy kis 40S alegység (amely tartalmazza a 18S rRNS -t és 33 riboszómás fehérjét). A riboszómás fehérjéket riboszómális gének kódolják.
| típus | Méret | Nagy alegység ( LSU rRNS ) | Kis alegység ( SSU rRNS ) |
| prokarióta | 70S | 50S ( 5S : 120 nt, 23S : 2906 nt) | 30S ( 16S : 1542 nt) |
| eukarióta | 80S | 60S ( 5S : 121 nt, 5,8S : 156 nt, 28S : 5070 nt) | 40S ( 18S : 1869 nt) |
Prokarióták
52 gén kódolja a riboszómás fehérjéket, és ezek 20 operonban találhatók a prokarióta DNS -en belül. A riboszóma szintézis szabályozása az rRNS szabályozásától függ .
Először is, az aminoacil-tRNS csökkenése miatt a prokarióta sejt reagál a transzkripció és a transzláció csökkentésével . Ez egy sor lépésben történik, kezdve a szigorú faktorokkal, amelyek a riboszómákhoz kötődnek és katalizálják a reakciót:
GTP + ATP -> pppGpp + AMP
A γ-foszfátot ezután eltávolítjuk, és a ppGpp kötődik és gátolja az RNS-polimerázt. Ez a kötődés az rRNS transzkripció csökkenését okozza. A csökkentett mennyiségű rRNS azt jelenti, hogy a riboszómális fehérjék (r-fehérjék) le lesznek fordítva, de nem rendelkeznek rRNS-sel, amelyhez kötődniük kell. Ehelyett negatívan visszacsatolnak, és kötődnek saját mRNS-jükhöz, elnyomva az r-fehérjeszintézist. Megjegyezzük, hogy az r-fehérjék előnyösen kötődnek a komplementer rRNS-hez, ha az jelen van, és nem az mRNS-hez.
A riboszóma operonok magukban foglalják az RNS polimeráz génjeit és a megnyúlási faktorokat is (amelyeket RNS transzlációban használnak). Mindezen gének egyszerre történő szabályozása szemlélteti a transzkripció és a transzkripció közötti kapcsolatot a prokariótákban.
Eukarióták
A riboszómális fehérjeszintézis az eukariótákban fontos metabolikus tevékenység. A legtöbb fehérjeszintézishez hasonlóan a sejtmagon kívül, a citoplazmában fordul elő. Az egyes riboszómás fehérjék szintetizálódnak, és nukleáris pórusokon keresztül importálódnak a sejtmagba . Lásd a nukleáris importot, ha többet szeretne megtudni a riboszómális fehérjék magba történő mozgásáról.
A DNS átíródik, nagy sebességgel, a nukleoláris , amely tartalmazza az összes 45S rRNS-gének. Az egyetlen kivétel az 5S rRNS, amely a sejtmagon kívül íródik át . A transzkripció után az rRNS -ek a riboszómális fehérjékhez társulnak, és kétféle (nagy és kicsi) riboszómális alegységet alkotnak. Ezek később összeállnak a citoszolban, hogy működő riboszómát hozzanak létre. Lásd a nukleáris exportot, ha többet szeretne megtudni a riboszómális alegységeknek a magból való mozgásáról.
Feldolgozás
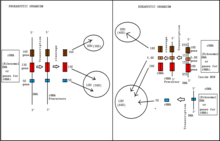
Az eukarióta sejtek három, érett rRNS-fajt együtt írnak át. Az rRNS-ek érési folyamata és az r-fehérjék toborzásának folyamata a prekurzor riboszómális részecskékben történik, amelyeket néha pre-riboszómáknak neveznek, és a nukleuszban , nukleoplazmában és citoplazmában zajlik . Az élesztő, S. cerevisiae az eukarióta modell szervezet a riboszóma biogenezis vizsgálatához. A riboszóma biogenesis kezdődik a nucleolus . Ott az rRNS 18S, 5,8S és 25S alegységei a riboszómális génekből, az RNS-polimeráz I által policisztronikus átiratként együtt vannak átírva , és 35S pre-RNS-nek nevezik.
Az I polimeráz transzkripciója egy Pol I iniciációs komplexummal kezdődik, amely az rDNS promoterhez kötődik . Ennek a komplexnek a kialakulásához szükség van egy upstream aktiváló faktor vagy UAF segítségére, amely a TATA-box kötő fehérjéhez és a core faktorhoz (CF) társul. A két transzkripciós faktor együttesen lehetővé teszi az RNS pol I komplex kötődését a polimeráz I iniciációs faktorhoz, az Rrn3 -hoz. A pol I transzkriptum előállítása során megközelítőleg 75 kis nukleoláris ribonukleopartikulum (snoRNP) elősegíti a > 100 rRNS-maradék ko-transzkripciós kovalens módosítását. Ezek snoRNPs szabályozzák 2'-O-ribóz metilezésével nukleotidok és is segíti a létrehozását pseudouridines . Az rRNS transzkriptumok 5 'végén kis alegységű riboszómás fehérjék (Rps) és nem riboszómális faktorok gyűlnek össze a pre-RNS transzkriptumokkal, hogy gömbszerű gombokat hozzanak létre. Ezek a gombok az első riboszóma előtti részecskék a kis (40S) riboszómális alegységútban. Az rRNS transzkript az A2 helyen hasad, és ez elválasztja a korai 40S pre-riboszómát a fennmaradó pre-rRNS-től, amely nagy alegységű riboszómális fehérjékkel (Rpl) és más nem riboszómális faktorokkal kombinálva létrehozza a 60S előtti riboszómás részecskéket .
40S alegység
A 40 S alegység-prekurzor, más néven kis alegység-folyamat (SSU) vagy 90S-részecske néven emlegetett transzkripciós összeállítása hierarchikus módon történik-lényegében az UTP-A, UTP-B és UTP-C alkomplexek fokozatos beépítése. Ezek az alkomplexek több mint 30 nem riboszómális fehérjefaktorból, az U3 snoRNP részecskéből, néhány Rps fehérjéből és a 35S pre-rRNS-ből állnak. Pontos szerepük azonban nem derült ki. A 40S előtti részecske összetétele drasztikusan megváltozik, ha az U3 snoRNPA-függő helyeken (A0, A1 és A2 helyek) hasítás történik. Ez a hasítási esemény létrehozza a 20S pre-rRNS-t, és a riboszómális faktorok disszociációját okozza a 40S előtti részecskéktől. Az U3 -at a Dhr1 helikáz kiszorítja a születő 40S -ből. A riboszóma biogenezis folyamatának ezen a pontján a 40S pre-riboszóma már az érett 40S alegység „fej” és „test” szerkezetét mutatja. A 40S pre-riboszómát a sejtmagból a citoplazmába szállítják. A citoplazmatikus 40S pre-riboszóma most riboszómás fehérjéket, a 20-as évek rRNS-ét és néhány nem riboszómális faktort tartalmaz. A 40S alegység „csőr” szerkezetének végső kialakulása az Enp1-Ltv1-Rps3 komplexet és a Hrr25 kinázt érintő foszforilezési és defoszforilációs esemény után következik be . A 20S pre-rRNS hasítása a D-helyen létrehozza az érett 18-as évekbeli rRNS-t. Ez a hasítási esemény számos nem riboszómális tényezőtől függ, mint például a Nob1, Rio1, Rio2, Tsr1 és Fap7.
60S alegység
A 60S előtti alegység érett 60S alegységgé történő érleléséhez sok biogenezis faktor szükséges, amelyek társulnak és szétválnak. Ezenkívül egyes összeszerelési tényezők a 60S alegységhez társulnak, míg mások csak átmenetileg lépnek kapcsolatba vele. Általános tendencia, hogy a 60S előtti alegység érése a komplexitás fokozatos csökkenésével jár. Az alegység érlelődik, amikor a sejtmagból a citoplazmába mozog, és fokozatosan csökken a transz-hatású tényezők száma. A 60S alegység érlelése mintegy 80 tényező segítségét igényli. E tényezők közül nyolc közvetlenül kapcsolódik a 27S A3 pre-rRNS feldolgozásához, ami valójában befejezi az 5,8S rRNS érett 5'-végének kialakulását. Az A3 faktorok a pre-RNS távoli helyeihez és egymáshoz is kötődnek. Ezt követően közel hozzák egymáshoz az rRNS területeit, és elősegítik a pre-rRNS feldolgozását és a riboszómális fehérjék toborzását. Három AAA típusú ATPáz működik, hogy leválassza a tényezőket az érő 60S pre-riboszómáról. Az egyik ATPáz egy dynein-szerű Rea1 fehérje, amely 6 különböző ATPáz doménből áll, amelyek gyűrűs szerkezetet alkotnak. A gyűrűszerkezet egy rugalmas farokhoz van rögzítve, amelynek történetesen MIDAS (fémion-függő tapadási hely) hegye van. A Rea1 a gyűrűjén keresztül lép kapcsolatba a 60S elő-riboszómával, míg két szubsztrát , az Ytm1 és az Rsa1, a MIDAS-hegyén keresztül lép kölcsönhatásba a Rea1-gyel. Ezen szubsztrátumok szerepét még nem határozták meg. Mindkettőt azonban kölcsönhatásaikkal együtt eltávolítják a 60S pre-riboszóma érési folyamatából. A másik két ATPáz, a Rix7 és a Drg1 szintén arra szolgál, hogy eltávolítsa a szerelési tényezőket az érő 60S alegységből. A helikázok és a GTPázok szintén részt vesznek az összeszerelési faktorok eltávolításában és az RNS átrendeződésében, hogy az elkészült 60S alegységet képezze. A 60S alegység a citoplazmába kerülve (lásd nukleáris export) tovább feldolgozásra kerül annak érdekében, hogy működőképes legyen. A többi nagy alegység riboszómás részecskéje a 60S egységhez kapcsolódik, és a többi, nem riboszómális összeszerelési faktor disszociál. A biogenezis faktorok felszabadulását többnyire a GTPázok, például az Lsg1 és az ATPázok, például a Drg1 közvetítik. Ezen események pontos sorrendje továbbra sem világos. A 60S citoplazmatikus érés útja a jelenlegi ismeretek tekintetében hiányos.
Nukleáris export
Annak érdekében, hogy a pre-riboszómális egységek teljesen kifejlődjenek, exportálni kell őket a citoplazmába . Annak érdekében, hogy hatékonyan eljussanak a nukleoluszból a citoplazmába, a pre-riboszómák kölcsönhatásba lépnek az exportreceptorokkal, és áthaladnak a nukleáris póruskomplex hidrofób központi csatornáján. A karyopherin Crm1 mindkét riboszómális alegység receptora, és Ran-GTP- függő módon közvetíti az exportot . Felismeri azokat a molekulákat, amelyek leucinban gazdag nukleáris exportjelekkel rendelkeznek. A Crm1 -et az Nmd3 nevű adapterfehérje segítségével húzzák a nagy 60S alegységhez. A 40S egység adapterfehérje ismeretlen. A Crm1 mellett más tényezők is szerepet játszanak a pre-riboszómák nukleáris exportjában. Egy általános mRNS exportreceptor, az úgynevezett Mex67, valamint egy HEAT-ismétlődő tartalmú fehérje, az Rrp12, megkönnyíti mindkét alegység exportját. Ezek a tényezők nem esszenciális fehérjék, és segítenek optimalizálni a pre-riboszómák exportját, mivel nagy molekulák.
Minőség ellenőrzés
Mivel a riboszómák annyira összetettek, bizonyos számú riboszóma helytelenül van összeszerelve, és potenciálisan pazarolhatja a sejt energiáját és erőforrásait a nem funkcionális fehérjék szintetizálása során. Ennek megakadályozása érdekében a sejtek aktív felügyeleti rendszerrel rendelkeznek, amelyek felismerik a sérült vagy hibás riboszómákat, és megcélozzák őket a lebomlás érdekében. A felügyeleti mechanizmus működik a nem működő pre-riboszómák, valamint a nem működő érett riboszómák kimutatására. Ezenkívül a felügyeleti rendszer hozza a szükséges degradációs berendezéseket, és ténylegesen lebontja a nem működő riboszómákat. A magban felhalmozódó pre-riboszómákat az exoszóma elpusztítja , amely exonukleáz aktivitással rendelkező multisubunit komplex . Ha a hibás riboszómális alegységek mégis előkerülnek a sejtmagból és a citoplazmába, akkor van egy második megfigyelő rendszer, amely a citoplazma hibásan működő riboszómáit célozza meg a lebomlás érdekében. A nagy riboszóma alegységek maradékainak bizonyos mutációi valójában RNS -bomlást és ezáltal az egység lebomlását eredményezik. Mivel a riboszómák összeszerelésében lehetséges hibák nagyok, még mindig nem tudni, hogy a felügyeleti rendszer hogyan észleli az összes hibát, de feltételezték, hogy ahelyett, hogy konkrét hibákat célozna meg, a felügyeleti rendszer felismeri e hibák következményeit - például szerelési késések. Ez azt jelenti, hogy ha megszakad az érett riboszóma összeállítása vagy érése, akkor a felügyeleti rendszer úgy működik, mintha az alegység hibás lenne.
Emberi betegség
A riboszóma biogenezis mutációi számos humán riboszomopátia genetikai betegséghez kapcsolódnak , beleértve az öröklött csontvelő -elégtelenség szindrómákat, amelyeket a rákra való hajlam és a vérsejtek számának csökkenése jellemez. A riboszomális diszreguláció is szerepet játszhat az izomvesztésben .
Lásd még
Hivatkozások
- ^ a b c d e f g Kressler, Dieter; Hurt, Ed; Babler, Jochen (2009). "Vezető riboszóma összeállítás" (PDF) . Biochimica et Biophysica Acta (BBA) - Molekuláris sejtkutatás . 1803 (6): 673–683. doi : 10.1016/j.bbamcr.2009.10.009 . PMID 19879902 .
- ^ Krista Conger (2017. június 26.). "A kutatók szerint a génszabályozás újonnan azonosított folyamata elfogadja a tudományt." A Stanford Medicina belsejében . 9. (12). Stanford Egyetem.
- ^ a b c d e f g h Thomson, Emma; Ferreira-Cerca, Sebastien; Hurt, Ed (2013). "Eukarióta riboszóma biogenezis egy pillantásra" . Journal of Cell Science . 126 (21): 4815–4821. doi : 10.1242/jcs.111948 . PMID 24172536 .
- ^ Lu T, Stroot PG, Oerther DB (2009). "A 16S rRNS fordított átírása a környezetben lévő riboszómát szintetizáló baktériumpopulációk megfigyelésére" . Alkalmazott és környezeti mikrobiológia . 75 (13): 4589–4598. Bibcode : 2009ApEnM..75.4589L . doi : 10.1128/AEM.02970-08 . PMC 2704851 . PMID 19395563 .
- ^ Gyökér-Bernstein, Meredith; Root-Bernstein, Robert (2015. február 21.). "A riboszóma, mint hiányzó láncszem az élet fejlődésében" . Journal of Theoretical Biology . 367 : 130–158. doi : 10.1016/j.jtbi.2014.11.025 . PMID 25500179 .
- ^ Thomson, E .; Ferreira-Cerca, S .; Hurt, E. (2013). "Eukarióta riboszóma biogenezis egy pillantásra" . Journal of Cell Science . 126 (21): 4815–4821. doi : 10.1242/jcs.111948 . PMID 24172536 .
-
^ " Homo sapiens 5S riboszómális RNS" . 2018-05-24. Az idézetnapló igényel
|journal=( segítséget ) -
^ " Homo sapiens 5.8S riboszómális RNS" . 2017-02-10. Az idézetnapló igényel
|journal=( segítséget ) -
^ " Homo sapiens 28S riboszómális RNS" . 2017-02-04. Az idézetnapló igényel
|journal=( segítséget ) -
^ " Homo sapiens 18S riboszómális RNS" . 2017-02-04. Az idézetnapló igényel
|journal=( segítséget ) - ^ Lafontaine, Denis LJ (2010). "Egy" szemetes "a riboszómák számára: hogyan rontják le az eukarióták a riboszómáikat". Trends Biochem Sci . 35 (5): 267–77. doi : 10.1016/j.tibs.2009.12.006 . PMID 20097077 .
- ^ Sardana, R; Liu, X; Granneman, S; Zhu, J; Gill, M; Papoulas, O; Marcotte, EM; Tollervey, D; Correll, CC; Johnson, AW (2015. február). "A DEAH-doboz hellikáz Dhr1 leválasztja az U3-at a pre-rRNS-ről, hogy elősegítse a központi pszeudoknot kialakulását" . PLOS biológia . 13 (2): e1002083. doi : 10.1371/journal.pbio.1002083 . PMC 4340053 . PMID 25710520 .
- ^ Connolly, Martin (2017). "A miR-424-5p csökkenti a riboszómális RNS-t és a fehérjeszintézist az izomsorvadásban" . Cachexia, Sarcopenia and Muscle folyóirat . 9. (2): 400–416. doi : 10.1002/jcsm.12266 . PMC 5879973 . PMID 29215200 .
