Hasi aorta aneurizma - Abdominal aortic aneurysm
| Hasi aorta aneurizma | |
|---|---|
| Más nevek | Triple-A |
 | |
| A hasi aorta aneurizma CT rekonstrukciós képe (fehér nyilak) | |
| Különlegesség | Érsebészet |
| Tünetek | Nincs, hasi, hát- vagy lábfájdalom |
| Szokásos kezdet | Több mint 50 éves hímek |
| Rizikó faktorok | Dohányzás , magas vérnyomás , egyéb szív- vagy érbetegségek , családtörténet , Marfan -szindróma |
| Diagnosztikai módszer | Orvosi képalkotás ( hasi aorta átmérője> 3 cm) |
| Megelőzés | Nem dohányzás, kockázati tényezők kezelése |
| Kezelés | Sebészet ( nyílt műtét vagy endovaszkuláris aneurizma javítása ) |
| Frekvencia | ~ 5% (65 év feletti férfiak) |
| Halálozások | 168 200 aorta aneurizma (2015) |
A hasi aorta aneurizma ( AAA vagy tripla A ) a hasi aorta lokalizált megnagyobbodása , amelynek átmérője 3 cm -nél nagyobb vagy több mint 50% -kal nagyobb a normálnál. Általában nem okoznak tüneteket, kivéve a szakadást. Időnként hasi, hát- vagy lábfájdalom jelentkezhet. A nagy aneurizmákat néha a hasra nyomva lehet érezni. A szakadás hasi vagy hátfájdalmat, alacsony vérnyomást vagy eszméletvesztést okozhat , és gyakran halált is okozhat.
Az AAA leggyakrabban az 50 év felettieknél, a férfiaknál és a családtörténetben szenvedőknél fordul elő. További kockázati tényezők a dohányzás , a magas vérnyomás és más szív- vagy érbetegségek . A fokozott kockázatú genetikai állapotok közé tartozik a Marfan-szindróma és az Ehlers-Danlos-szindróma . Az AAA az aorta aneurizma leggyakoribb formája . Körülbelül 85% a vesék alatt , a többi a vesék szintjén vagy fölött fordul elő . Az Egyesült Államokban , szűrés és hasi ultrahang ajánlott férfiak között 65 és 75 éves kor feletti dohányzott. Az Egyesült Királyságban és Svédországban minden 65 év feletti férfi szűrése ajánlott. Az aneurizma megtalálása után általában rendszeresen végeznek további ultrahangot.
A dohányzás nem az egyetlen legjobb módszer a betegség megelőzésére. A megelőzés egyéb módszerei közé tartozik a magas vérnyomás kezelése, a magas koleszterinszint kezelése és a túlsúly hiánya . A műtétet általában akkor javasolják, ha az AAA átmérője hímeknél> 5,5 cm -re, nőknél> 5,0 cm -re nő. A javítás egyéb okai közé tartozik a tünetek jelenléte és a méret gyors növekedése, amelyet évente több mint egy centiméternek határoznak meg. A javítás történhet nyílt műtéttel vagy endovaszkuláris aneurizma javítással (EVAR). A nyílt műtéthez képest az EVAR -nak alacsonyabb a halálozási kockázata rövid távon, és rövidebb a kórházi tartózkodás, de nem mindig választható. Úgy tűnik, nincs különbség a kettő között a hosszabb távú eredmények között. Az ismétlődő eljárások gyakoribbak az EVAR esetében.
Az AAA-k a 65 év feletti férfiak 2-8% -át érintik. A nők körében az arányok egynegyede magasabb. Azoknál, akiknek aneurizmája kisebb, mint 5,5 cm, a következő évben a repedés kockázata 1%alatt van. Az 5,5 és 7 cm közötti aneurizmával rendelkezők körében a kockázat körülbelül 10%, míg a 7 cm -nél nagyobb aneurizmával rendelkezőknél a kockázat körülbelül 33%. Ha elhalnak, a halálozás 85-90%. 2013 -ban az aorta aneurizma 168 200 halálesetet eredményezett, szemben az 1990 -es 100 000 -vel. Az Egyesült Államokban az AAA -k 10 000 és 18 000 halálesetet eredményeztek 2009 -ben.
jelek és tünetek
Az aneurizmák túlnyomó többsége tünetmentes. Ahogy azonban a hasi aorta kitágul és/vagy felszakad, az aneurizma fájdalmassá válhat, és pulzáló érzéseket okozhat a hasban, vagy fájdalmat okozhat a mellkasban, a hát alsó részén, a lábakban vagy a herezacskóban.
Bonyodalmak
A szövődmények közé tartozik a szakadás, a perifériás embolizáció , az akut aorta elzáródása és az aortocaval (az aorta és az alsó vena cava között ) vagy az aortoduodenális (az aorta és a duodenum között ) fistulák . A fizikális vizsgálat során tapintható és lüktető hasi tömeget lehet megfigyelni. Vese- vagy zsigeri artériás szűkület esetén bruitok jelenhetnek meg .
A repedt AAA jelei és tünetei súlyos fájdalmat okozhatnak a hát alsó részén, az oldalán, a hasán vagy az ágyékban. A szívveréssel lüktető tömeg is érezhető. A vérzés vezethet hipovolémiás sokk és alacsony vérnyomás és a szapora szívverés . Ez rövid kimerültséghez vezethet . Az AAA -szakadás halálozási aránya eléri a 90 százalékot. A betegek 65-75 százaléka meghal, mielőtt megérkezik a kórházba, és akár 90 százaléka meghal, mielőtt a műtőbe ér. A vérzés lehet retroperitoneális vagy a hasüregbe . A szakadás kapcsolatot is létrehozhat az aorta és a bél vagy az alsó vena cava között . A hátoldali ekchimózis (zúzódás megjelenése) a retroperitoneális vérzés jele , és Szürke Turner jelének is nevezik .
Okoz
A degeneratív folyamat pontos okai továbbra sem tisztázottak. Vannak azonban hipotézisek és jól meghatározott kockázati tényezők .
- Dohányzás: Az AAA -t kifejlesztő emberek több mint 90% -a életének egy szakaszában dohányzott .
- Alkohol és magas vérnyomás: Az alkohol hosszú távú használata és a hasi ödéma hipertóniás hatásai által okozott gyulladás, amely aranyérhez , nyelőcső varicákhoz és egyéb állapotokhoz vezet, szintén az AAA hosszú távú oka.
- Genetikai hatások: A genetikai tényezők hatása nagy. Az AAA négy -hatszor gyakoribb az ismert betegek férfi testvéreinél, 20-30%-os kockázattal. A magas családi prevalencia leginkább a férfi egyedekben figyelhető meg. Számos hipotézis létezik a pontos genetikai rendellenességről, amely az AAA gyakoribb előfordulását okozhatja az érintett családok férfi tagjai körében. Néhányan azt feltételezték, hogy az alfa-1-antitripszinhiány hatása döntő fontosságú lehet, míg más kísérleti munkák az X-hez kapcsolódó mutáció hipotézisét részesítették előnyben , ami megmagyarázná a heterozigóta nők alacsonyabb előfordulását . A genetikai okok más hipotéziseit is megfogalmazták. A kötőszöveti rendellenességeket, például a Marfan-szindrómát és az Ehlers-Danlos-szindrómát szintén erősen összefüggésbe hozták az AAA-val. Mind a relapszáló polychondritis, mind a pseudoxanthoma elastum hasi aorta aneurizmát okozhat.
- Érelmeszesedés: Az AAA -t sokáig atherosclerosis okozta , mivel az AAA falai gyakran érelmeszesedést okoznak . Ezzel a hipotézissel azonban nem lehet magyarázni a folyamat során megfigyelhető kezdeti hibát és az elzáródás kialakulását.
- Az AAA kialakulásának egyéb okai a következők: fertőzés , trauma , arteritis és cisztás mediális nekrózis .
Patofiziológia

Az aneurizmatikus aorta legszembetűnőbb szövettani elváltozásai a tunica media és az intima rétegekben figyelhetők meg . Ezek a változások magukban foglalják a lipidek felhalmozódását a habsejtekben , az extracelluláris szabad koleszterin -kristályokat, a meszesedést , a trombózist , valamint a rétegek fekélyeit és szakadásait. Adventitialis gyulladásos infiltrátum van jelen. Mindazonáltal úgy tűnik, hogy az AAA -fejlődés alapvető patofiziológiai mechanizmusa a tunika -közeg proteolitikus eljárással történő lebomlása . Egyes kutatók a mátrix metalloproteinázok fokozott expressziójáról és aktivitásáról számolnak be AAA -s egyénekben. Ez az elasztin kiürüléséhez vezet a közegből, így az aorta fala érzékenyebb a vérnyomás hatására . Más jelentések azt sugallják, hogy a szerin proteáz granzyme B hozzájárulhat az aorta aneurizma felszakadásához a decorin hasítása révén , ami megzavarja a kollagén szervezetét és csökkenti az adventitia szakítószilárdságát. A hasi aortában is csökken a vasa vasorum mennyisége (a mellkasi aortához képest); következésképpen a tunica médiának a táplálkozás során leginkább a diffúzióra kell támaszkodnia, ami érzékenyebbé teszi a károsodást.
A hemodinamika befolyásolja az AAA kialakulását, amely hajlamos az infrarenális aortára. Az infrarenális aorta szövettani szerkezete és mechanikai jellemzői eltérnek a mellkasi aortától . Az átmérő a gyökértől az aorta kettéágazásáig csökken , és az infrarenális aorta fala is kisebb arányban tartalmaz elasztint . A hasi aorta falának mechanikai feszültsége ezért nagyobb, mint a mellkasi aorta falában. A rugalmasság és a tágulékonyság is csökken az életkorral, ami azt eredményezheti, fokozatos dilatáció a szegmens. Az artériás hipertóniában szenvedő betegek magasabb intraluminális nyomása jelentősen hozzájárul a kóros folyamat előrehaladásához. A megfelelő hemodinamikai állapotok az aorta lumen mentén specifikus intraluminalis thrombus (ILT) mintákhoz köthetők, ami viszont befolyásolhatja az AAA fejlődését.
Diagnózis
A hasi aorta aneurizmát általában fizikai vizsgálattal , hasi ultrahanggal vagy CT -vel diagnosztizálják . A sima hasi röntgenfelvételeken az aneurizma körvonalai láthatók, amikor a falak meszesednek. A körvonal azonban az összes aneurizma kevesebb mint felében látható lesz a röntgenfelvételen. Az ultrahangvizsgálatot az aneurizma szűrésére és a jelenlét méretének meghatározására használják. Ezenkívül szabad peritoneális folyadék is kimutatható. Nem invazív és érzékeny, de a bélgáz vagy az elhízás korlátozhatja annak hasznosságát. A CT -vizsgálat közel 100% -os érzékenységgel rendelkezik az aneurizma szempontjából, és hasznos a műtét előtti tervezésben is, részletezve az anatómiát és az endovaszkuláris javítás lehetőségét. Szakadás gyanúja esetén a retroperitoneális folyadékot is megbízhatóan érzékeli. Az aneurizma vizualizálására alternatív, ritkábban használt módszerek közé tartozik az MRI és az angiográfia .
Az aneurizma megszakad, ha a mechanikai igénybevétel (területenkénti feszültség) meghaladja a helyi falszilárdságot; következésképpen a csúcsfalfeszültség (PWS) és a csúcsfalszakadás kockázata (PWRR) megbízhatóbb paramétereknek bizonyultak, mint az átmérő az AAA szakadási kockázat értékeléséhez. Az orvosi szoftver lehetővé teszi ezen töréskockázat-indexek kiszámítását a standard klinikai CT-adatokból, és páciens-specifikus AAA-szakadási kockázat-diagnózist biztosít. Ez a fajta biomechanikai megközelítés kimutatta, hogy pontosan megjósolja az AAA szakadás helyét.
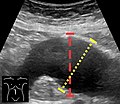
Aorta mérés hasi ultrahang , a tengelyirányú síkban a külső peremén az aorta fal.
Ultrahangvizsgálat a sagittalis síkban , amely az axiális sík mértékét (szaggatott piros vonal), valamint a maximális átmérőt (szaggatott sárga vonal) mutatja.
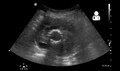
Ultrahang, amely egy korábban megjavított AAA -t mutat, amely szivárog a graft körül
Osztályozás
| Ektatikus vagy enyhe tágulat |
> 2,0 cm és <3,0 cm |
| Mérsékelt | 3,0 - 5,0 cm |
| Nagy vagy súlyos | > 5,0 vagy 5,5 cm |
A hasi aorta aneurizmákat általában méretük és tüneteik szerint osztják fel. Az aneurizmát általában úgy határozzák meg, mint a külső aorta átmérője 3 cm felett (az aorta normál átmérője körülbelül 2 cm), vagy a normál átmérő több mint 50% -a. Ha a külső átmérő meghaladja az 5,5 cm -t, akkor az aneurizma nagynak tekinthető. A repedt AAA-t minden idősebb (60 évnél idősebb) személynél gyanítani kell, ha összeesik, megmagyarázhatatlanul alacsony a vérnyomása, vagy hirtelen fellépő hát- vagy hasi fájdalma van. Hasi fájdalom, sokk és lüktető tömeg csak az esetek kisebb részében van jelen. Bár egy ismert aneurizmával rendelkező instabil személy műtéten eshet át további képalkotás nélkül, a diagnózist általában CT vagy ultrahang vizsgálat segítségével erősítik meg.
A suprarenalis aorta általában körülbelül 0,5 cm -rel nagyobb, mint az infrarenalis aorta.
Megkülönböztető diagnózis
Az aorta aneurizma szakadása összetéveszthető a vesekövek fájdalmával vagy az izmokkal kapcsolatos hátfájással .
Megelőzés
- A dohányzás abbahagyása
- A magas vérnyomás kezelése
Szűrés
A US Preventive Services Task Force (USPSTF) javasolja egyetlen szűrés hasi ultrahang hasi aorta aneurizma férfiaknál 65 éves és 75 év között, akik a dohányzás. Ebből a csoportból, akik nem dohányoznak, a szűrés szelektív lehet. Nem világos, hogy a szűrés hasznos -e dohányzó nőknél, és az USPSTF azt javasolja, hogy ne vizsgálják azokat a nőket, akik soha nem dohányoztak.
Az Egyesült Királyságban az NHS AAA szűrőprogramja 65 éves korukban szűrésre hívja az angliai férfiakat. A 65 év feletti férfiak kapcsolatba léphetnek a programmal a szűrés megszervezése érdekében.
Svédországban egyszeri szűrést javasolnak minden 65 év feletti férfinak. Úgy találták, hogy ez 42% -kal csökkenti az AAA -ból származó halálozás kockázatát, és a szűrés valamivel több, mint 200. Azoknál, akiknek közeli hozzátartozójuknál diagnosztizáltak aorta -aneurizmát, a svéd irányelvek 60 év körüli ultrahangot javasolnak.
Ausztráliának nincs irányelve a szűrésre.
Ismételt ultrahangot kell végezni azoknál, akiknek az aorta mérete nagyobb, mint 3,0 cm. Azoknál, akiknek az aortája 3,0 és 3,9 cm között van, ezt háromévente kell elvégezni, ha kétévente 4,0 és 4,4 cm között, és ha évente 4,5 és 5,4 cm között.
Menedzsment
A tünetmentes AAA kezelési lehetőségei a konzervatív kezelés, a felügyelet az esetleges javítás érdekében és az azonnali javítás. Az AAA esetében kétféle javítási mód áll rendelkezésre: nyílt aneurizma -javítás és endovaszkuláris aneurizma -javítás ( EVAR ). Gyakran javasolt beavatkozás, ha az aneurizma évente több mint 1 cm -rel nő, vagy nagyobb, mint 5,5 cm. A javítás tüneti aneurizmák esetén is javasolt. Tíz évvel a nyílt AAA javítás után a teljes túlélési arány 59%volt.
Konzervatív
A konzervatív kezelést olyan embereknél javasolják, akiknél a javítás magas halálozási kockázatot hordoz, és olyan betegeknél, akiknél a javítás nem valószínű, hogy javítja a várható élettartamot. A konzervatív kezelés alappillére a dohányzásról való leszokás.
A felügyeletet kis tünetmentes aneurizmákban (kevesebb, mint 5,5 cm) jelzik, ahol a javítás kockázata meghaladja a szakadás kockázatát. Ahogy az AAA átmérője növekszik, a repedés kockázata nő. A megfigyelés, amíg az aneurizma el nem éri az 5,5 cm átmérőt, nem mutatott nagyobb kockázatot a korai beavatkozáshoz képest.
Gyógyszer
Egyetlen orvosi terápia sem bizonyult hatékonynak a tünetmentes AAA -k növekedési vagy törési arányának csökkentésében. A vérnyomást és a lipideket azonban a szokásos módon kell kezelni.
Sebészet
A javítás küszöbértéke egyénenként kismértékben változik, a javítás és a folyamatos felügyelet mérlegelésekor a kockázatok és előnyök egyensúlyától függően. Az egyén natív aortájának mérete befolyásolhatja ezt, valamint a társbetegségek jelenléte, amelyek növelik a működési kockázatot vagy csökkentik a várható élettartamot. A bizonyítékok azonban általában nem támogatják a javítást, ha a méret kisebb, mint 5,5 cm.
Nyitott javítás
A nyílt javítást fiatal betegeknél szabadon választják, vagy növekvő vagy nagy, tüneti vagy szakadt aneurizmában. A javítás során le kell szorítani az aortát, megtagadva a vért a hasi szervekből és a gerincvelő szakaszaiból ; ez számos komplikációt okozhat. Alapvető fontosságú, hogy a művelet kritikus része gyors legyen, ezért a metszést általában elég nagyra teszik, hogy megkönnyítsék a leggyorsabb javítást. A nyílt AAA műtét utáni helyreállítás jelentős időt vesz igénybe. A minimum minimum néhány nap az intenzív osztályon, egy hét a kórházban és néhány hónap a teljes gyógyulás előtt.
Endovaszkuláris javítás
Az endovaszkuláris javítás először az 1990 -es években vált praktikussá, és bár mára a nyílt javítás alternatívája, szerepe még nem egyértelmű. Általában idősebb, magas kockázatú betegeknél vagy nyílt javításra alkalmatlan betegeknél javasolt. Az endovaszkuláris javítás azonban csak az AAA -k egy része számára lehetséges, az aneurizma morfológiájától függően. A fő előny a nyílt javítással szemben az, hogy kevesebb a perioperatív mortalitás, kevesebb az intenzív osztályon , kevesebb a kórházban, és hamarabb visszatér a normális tevékenységhez. Az endovaszkuláris javítás hátrányai közé tartozik a gyakrabban folyó kórházi felülvizsgálat követelménye, valamint a további eljárások nagyobb valószínűsége. A legújabb tanulmányok szerint az EVAR eljárás nem kínál semmilyen előnyt a teljes túléléshez vagy az egészséggel kapcsolatos életminőséghez képest a nyílt műtéthez képest, bár az aneurizmával összefüggő halálozás alacsonyabb. A nyílt javításra alkalmatlan betegeknél az EVAR plusz konzervatív kezelés semmilyen előnnyel, több komplikációval, későbbi eljárással és magasabb költségekkel járt, mint a konzervatív kezelés. Az aortobiiliac rekonstrukciót követően a paraanastomoticus aneurysma endovaszkuláris kezelése is lehetséges. A Cochrane 2017 -es felülvizsgálata kísérleti bizonyítékot talált arra, hogy az első hónapban nincs különbség az endovascularis és a repedt AAA helyreállítása között.
Törés
Azoknál, akiknél az AAA aorta szakadt , a kezelés azonnali sebészeti helyreállítás. Úgy tűnik, előnyei vannak a megengedő hipotenzió engedélyezésének és az intravénás folyadékok használatának korlátozásának a műtőbe történő szállítás során.
Prognózis
| AAA méret (cm) | Növekedési sebesség (cm/év) | Éves törési kockázat (%) |
|---|---|---|
| 3,0-3,9 | 0,39 | 0 |
| 4,0-4,9 | 0,36 | 0,5-5 |
| 5,0-5,9 | 0,43 | 3-15 |
| 6,0-6,9 | 0,64 | 10-20 |
| > = 7,0 | - | 20-50 |
Bár a szakadási kockázat meghatározásának jelenlegi szabványa a maximális átmérőn alapul, ismert, hogy a kisebb AAA -k, amelyek e küszöb alá esnek (átmérő <5,5 cm), szintén felszakadhatnak, és a nagyobb AAA -k (átmérő> 5,5 cm) stabilak maradhatnak. Egy jelentés kimutatta, hogy a repedt AAA -k 10–24% -a 5 cm -nél kisebb átmérőjű volt. Arról is beszámoltak, hogy a boncolási jelentésekből megvizsgált 473 nem javított AAA-ból 118 eset volt a szakadás, amelyek 13% -a 5 cm-nél kisebb átmérőjű volt. Ez a tanulmány azt is kimutatta, hogy az 5 cm -nél nagyobb AAA -k 60% -a (beleértve a 7,1 és 10 cm közötti AAA -k 54% -át) soha nem tapasztalt szakadást. Vorp és mtsai. később Darling et al. hogy ha a maximális átmérő kritériumot betartják a 473 alany esetében, akkor az esetek mindössze 7% -a (34/473) esett volna szakadásra a műtéti beavatkozás előtt, mivel az átmérő kisebb volt, mint 5 cm, 25% -kal (116/473) esetenként szükségtelen műtéten esnek át, mivel ezek az AAA -k soha nem szakadtak fel.
A szakadás értékelésének alternatív módszereiről nemrégiben számoltak be. E megközelítések többsége magában foglalja az AAA -k numerikus elemzését, a végeselemes módszer (FEM) közös mérnöki technikáját alkalmazva a falfeszültség -eloszlások meghatározására. A legújabb jelentések kimutatták, hogy ezek a feszültségeloszlások inkább az AAA általános geometriájához, semmint a maximális átmérőhöz kapcsolódnak. Az is ismert, hogy a falfeszültség önmagában nem szabályozza teljesen a meghibásodást, mivel az AAA rendszerint felszakad, ha a fal feszültsége meghaladja a fal szilárdságát. Ennek fényében a szakadás felmérése pontosabb lehet, ha mind a betegspecifikus falfeszültség, mind a betegspecifikus falszilárdság összekapcsolódik. Nemrégiben egy nem invazív módszerről számoltak be a páciensfüggő falszilárdság meghatározására, hagyományosabb módszerekkel az erősség meghatározására szakterületi más kutatók végeztek szakítóvizsgálatokat. A közelmúltban javasolt AAA szakadási kockázatértékelési módszerek közül néhány: AAA falfeszültség; AAA bővítési sebesség; aszimmetria foka; intraluminalis trombus (ILT) jelenléte; szakadási potenciál index (RPI); végeselem -elemzési törési index (FEARI); biomechanikai tényezők számítógépes elemzéssel párosulva; az ILT növekedése; az AAA geometriai paraméterei; valamint az AAA növekedésének és törésének meghatározására szolgáló módszer matematikai modellek alapján.
A műtét utáni mortalitás a már megrepedt AAA miatt több évtized alatt lassan csökkent, de továbbra is meghaladja a 40%-ot. Ha azonban az AAA-t sebészeti úton megjavítják a szakadás előtt, a műtét utáni halálozási arány lényegesen alacsonyabb: körülbelül 1-6%.
Járványtan
Az AAA előfordulása etnikumonként változik. Az Egyesült Királyságban az AAA aránya a 65 évnél idősebb kaukázusi férfiaknál körülbelül 4,7%, míg az ázsiai férfiaknál 0,45%. Ritkábban fordul elő az afrikai és a spanyol örökségű egyéneknél is. Férfiaknál négyszer gyakrabban fordulnak elő, mint nők.
Az Egyesült Államokban évente legalább 13 000 haláleset történik az AAA -szakadás következtében. A férfiaknál évente a legmagasabb az új megbetegedések száma 70 év körül, a 60 év feletti férfiak aránya 2–6%. A gyakoriság sokkal magasabb a dohányosoknál, mint a nemdohányzóknál (8: 1), és a kockázat lassan csökken a dohányzás abbahagyása után . Az Egyesült Államokban az AAA előfordulási gyakorisága 2–4% a felnőtt lakosság körében.
Az AAA szakadása a 65 éves vagy annál idősebb férfiak 1-3% -ánál fordul elő, a halálozás 70-95%.
Történelem
Az első történelmi feljegyzések mintegy AAA származnak ókori Róma a 2. században, amikor a görög sebész Antyllus próbálta kezelni az AAA a proximális és disztális ligatúra , központi bemetszése és eltávolítását trombózisos anyagot a aneurizma . Az AAA műtéti kezelésének kísérletei azonban 1923 -ig sikertelenek voltak. Ebben az évben Rudolph Matas (aki az endoaneurysmorrhaphy fogalmát is javasolta) elvégezte az első sikeres aorta -ligációt egy embernél. Az AAA kezelésének további sikeres módszerei közé tartozott az aorta polietilén -celofánnal való becsomagolása , ami fibrózist indukált és korlátozta az aneurizma növekedését. Az endovaszkuláris aneurizma javítását először az 1980 -as évek végén végezték el, és a következő évtizedekben széles körben elterjedt. Az endovaszkuláris javítást először 1994 -ben alkalmazták a repedt aneurizma kezelésére Nottinghamben.
Társadalom és kultúra
Albert Einsteint, az elméleti fizikust hasi aorta aneurizma miatt műtötték meg 1949 -ben Rudolph Nissen , aki polietilén -celofánnal csomagolta az aortát . Einstein aneurizmája 1955. április 13 -án szakadt meg. Elutasította a műtétet, mondván: "Akkor akarok menni, amikor akarok. Ízléstelen meghosszabbítani az életet mesterségesen. Megtettem a magam részét, ideje mennem. Elegánsan fogom csinálni. " Öt nappal később, 76 éves korában meghalt.
Lucille Ball színésznő 1989. április 26 -án halt meg a hasi aorta aneurizmájában. Halálakor a Cedars-Sinai Orvosi Központban volt, és felépült a mindössze hat nappal korábban elvégzett sürgősségi műtétből, mert a szívéhez közeli boncoló aorta-aneurizma volt . Ball nagyobb kockázatnak volt kitéve, mivel évtizedek óta erős dohányos volt.
Conway Twitty zenész 1993 júniusában halt meg 59 éves korában a hasi aorta aneurizmájában, két hónappal az utolsó stúdióalbuma, a Final Touches megjelenése előtt .
George C. Scott színész 1999 -ben, 71 éves korában halt meg hasi aorta aneurizma szakadása miatt.
2001 -ben Bob Dole volt elnökjelöltet megműtötték egy hasi aorta aneurizma miatt, amelyben Kenneth Ouriel érsebész vezette csapata stentgraftot ültetett be:
Ouriel elmondta, hogy a csapat egy Y alakú csövet vezetett be Dole lábának bemetszésén, és az aorta legyengült részébe helyezte. Az aneurizma végül összehúzódik a stent körül, amely Dole egész életében a helyén marad.
Robert Jacks színész , aki a Leatherface -t játszotta a Texas Chainsaw Massacre: The Next Generation című filmben , 2001. augusztus 8 -án halt meg hasi aneurizmában, alig egy napja szégyellve 42. születésnapját. Apja is ugyanezen okból halt meg, amikor Robert kicsi volt.
Tommy Ford színész 52 éves korában halt meg hasi aneurizmában 2016 októberében.
Gary Gygax, a Dungeons and Dragons alkotója, 2008 -ban 69 éves korában halt meg hasi aorta aneurizmában.
Kutatás
Kockázatértékelés
Az elmúlt években számos felszólítás volt a szakadási kockázatértékelés alternatív megközelítéseire, sokan úgy vélik, hogy a biomechanika-alapú megközelítés alkalmasabb lehet a jelenlegi átmérőjű megközelítésre. A numerikus modellezés értékes eszköz a kutatók számára, lehetővé téve a hozzávetőleges falfeszültségek kiszámítását, így feltárva egy adott aneurizma szakadási potenciálját. Kísérleti modellekre van szükség ezen számszerű eredmények validálásához és további betekintést nyújtani az AAA biomechanikai viselkedéséhez. In vivo az AAA -k különböző erősségű anyagokkal rendelkeznek, a lokalizált gyenge hipoxiás régióktól a sokkal erősebb régiókig és a meszesedési területekig.
A jövőbeni AAA növekedés előrejelzésének módszereit kutatási prioritásnak tekintik.
Kísérleti modellek
Kísérleti modellek gyárthatók most egy új technikával, amely magában foglalja a fröccsöntött elveszett viasz gyártási folyamatát, hogy pácienspecifikus anatómiailag helyes AAA replikákat hozzon létre. A munka középpontjában az in vivo reálisabb anyag analógok kifejlesztése is állt , és a közelmúltban új szilikongumi-sorozatot hoztak létre, amely lehetővé teszi az AAA különböző anyagtulajdonságainak pontosabb megjelenítését. Ezek a gumi modellek különféle kísérleti helyzetekben is alkalmazhatók, a fotoelasztikus módszerrel végzett stressz -elemzéstől kezdve Új endovaszkuláris eszközöket fejlesztenek ki, amelyek képesek összetettebb és kanyargóbb anatómiák kezelésére .
Megelőzés és kezelés
Egy állatkísérlet kimutatta, hogy egyetlen fehérje eltávolítása megakadályozza a véredények korai károsodását, ami későbbi szövődményeket okozhat. A ciklofilin A (CypA) nevű jelzőfehérje génjének egér törzsből történő eltávolításával a kutatók teljes védelmet tudtak nyújtani a hasi aorta aneurizma ellen.
Más közelmúltbeli kutatások szerint a Granzyme B ( GZMB ) (fehérjebontó enzim) potenciális célpont lehet a hasi aorta aneurizmák kezelésében. Ennek az enzimnek az egérmodellekben történő eliminálása lelassította az aneurizma progresszióját és javította a túlélést.
Preklinikai kutatás
Az AAA kialakulásához vezető mechanizmusok még mindig nem teljesen érthetők sejt- és molekuláris szinten. Az AAA patofiziológiájának jobb megértése érdekében gyakran szükség van kísérleti állatmodellek alkalmazására. Gyakran felmerül a kérdés, hogy ezek a modellek mennyire képesek lefordítani az emberi betegségeket. Annak ellenére, hogy nincs olyan állatmodell, amely pontosan reprezentálja az emberi állapotot, az összes létező a betegség egy másik patofiziológiai aspektusára összpontosít. A különböző állatmodellek eredményeinek klinikai kutatásokkal való kombinálása jobb áttekintést nyújthat az AAA patofiziológiáról. A leggyakoribb állatmodellek a rágcsálók (egerek és patkányok), bár bizonyos vizsgálatokhoz, például preklinikai eszközök vagy sebészeti beavatkozások teszteléséhez gyakrabban használnak nagy állatmodelleket (sertés, juh). Az AAA rágcsáló modelljei különböző szempontok szerint osztályozhatók. Vannak boncolási és nem boncoló modellek, valamint genetikailag meghatározott modellek a kémiailag indukált modellek. A leggyakrabban használt modellek az angiotenzin-II infúzió ApoE knockout egerekbe (boncolási modell, kémiailag indukált), a kalcium-klorid modell (nem boncolás, kémiai indukció) és az elasztáz modell (nem boncolási, kémiai indukált modell).
Hivatkozások
Külső linkek
| Osztályozás | |
|---|---|
| Külső erőforrások |