Heparin - Heparin
 | |
 | |
| Klinikai adatok | |
|---|---|
| Kiejtés | / H ɛ p ər ɪ n / HEP -ər-in |
| AHFS / Drugs.com | Monográfia |
| Licencadatok | |
| Az adminisztráció módjai |
Intravénás terápia , szubkután injekció |
| ATC kód | |
| Jogi státusz | |
| Jogi státusz | |
| Farmakokinetikai adatok | |
| Biológiai hozzáférhetőség | Akadozó |
| Anyagcsere | Máj |
| Eliminációs felezési idő | 1,5 óra |
| Kiválasztás | Vizelet |
| Azonosítók | |
| |
| CAS -szám | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| CHEMBL | |
| CompTox műszerfal ( EPA ) | |
| ECHA InfoCard |
100.029.698 |
| Kémiai és fizikai adatok | |
| Képlet | C 12 H 19 N O 20 S 3 |
| Moláris tömeg | 593,45 g · mol −1 |
| |
|
| |
A heparin , más néven frakcionálatlan heparin ( UFH ), egy gyógyszer és természetesen előforduló glikozaminoglikán . Gyógyszerként antikoagulánsként használják . Pontosabban szívrohamok és instabil angina kezelésére is használják . Úgy adják vénás injekció formájában vagy bőr alá . Egyéb felhasználási területek közé tartoznak a kémcsövek és a vese dialízis gépek .
Gyakori mellékhatások: vérzés, fájdalom az injekció beadásának helyén és alacsony vérlemezkeszám . Súlyos mellékhatások közé tartozik a heparin által kiváltott thrombocytopenia . Nagyobb gondosságra van szükség a rossz vesefunkciójú betegeknél .
A heparin ellenjavallt a SARS-CoV-2 vakcinázás másodlagos, vakcinával kiváltott pro-trombotikus immun thrombocytopenia (VIPIT) gyanúja esetén , mivel a heparin tovább növelheti a vérzés kockázatát anti-PF4/heparin komplex autoimmun módon, a alternatív véralvadásgátló gyógyszerek (például argatroban vagy danaparoid).
A heparin viszonylag biztonságosnak tűnik terhesség és szoptatás alatt . A heparint minden emlősben bazofilek és hízósejtek állítják elő .
A heparin felfedezését 1916 -ban jelentették be. Az Egészségügyi Világszervezet alapvető gyógyszerek listáján szerepel . A heparin frakcionált változata, alacsony molekulatömegű heparin néven is elérhető.
Történelem
A heparint Jay McLean és William Henry Howell fedezte fel 1916 -ban, bár klinikai vizsgálatokba csak 1935 -ben lépett be. Eredetileg kutya májsejtjeiből izolálták , ezért a neve ( hepar vagy "ήπαρ" görögül "máj"; hepar + -ben ).
McLean a Johns Hopkins Egyetem másodéves orvostanhallgatója volt, és Howell vezetésével dolgozott a véralvadásgátló készítmények vizsgálatán, amikor egy zsírban oldódó foszfatid antikoagulánst izolált a kutya májszövetében. 1918-ban Howell megalkotta a „heparin” kifejezést az ilyen típusú zsírban oldódó antikoagulánsok számára. Az 1920-as évek elején Howell izolált egy vízben oldódó poliszacharid antikoagulánst, amelyet „heparinnak” is nevezett, bár ez különbözött a korábban felfedezett foszfatidkészítményektől. McLean sebészként végzett munkája valószínűleg megváltoztatta a Howell csoport fókuszát az antikoagulánsok keresésére, ami végül a poliszacharid felfedezéséhez vezetett.
Az 1930 -as években több kutató vizsgálta a heparint. Erik Jorpes a Karolinska Intézetben 1935 -ben publikálta a heparin szerkezetére vonatkozó kutatását, amely lehetővé tette a svéd Vitrum AB cég számára, hogy 1936 -ban piacra dobja az első intravénás használatra szánt heparin terméket . 1933 és 1936 között a Connaught Medical Research Laboratories , majd a Torontói Egyetem része, tökéletesítette a biztonságos, nem toxikus heparin előállításának technikáját, amelyet a betegeknek be lehetett adni sóoldatban. A heparin első emberi kísérletei 1935 májusában kezdődtek, és 1937 -re egyértelművé vált, hogy a Connaught heparinja biztonságos, könnyen hozzáférhető és hatékony véralvadásgátló. 1933 előtt a heparin kis mennyiségben volt kapható, rendkívül drága és mérgező, és ennek következtében nem volt orvosi értéke.
Orvosi felhasználás
A heparin véralvadásgátló hatású, megakadályozza a vérrögök képződését és a meglévő vérrögök kiterjesztését a vérben. Bár a heparin önmagában nem bontja le a már kialakult vérrögöket (ellentétben a szöveti plazminogén aktivátorral ), lehetővé teszi a szervezet természetes vérrög -lízis mechanizmusainak normális működését a kialakult vérrögök lebontásához. A heparint általában véralvadásgátlóként használják a következő esetekben:
- Akut koszorúér -szindróma , pl. NSTEMI
- Pitvarfibrilláció
- Mélyvénás trombózis és tüdőembólia
- Cardiopulmonalis bypass a szívműtét
- ECMO áramkör a testen kívüli életfenntartáshoz
- Hemofiltráció
- Belső központi vagy perifériás vénás katéterek
A heparin és alacsony molekulatömegű származékai (pl, enoxaparin , dalteparin , tinzaparin ) megelőzésére hatásos mélyvénás trombózis és tüdő-embólia kockázatának kitett emberek, de nincs bizonyíték jelzi bármelyike hatékonyabb, mint a többi megelőzésében mortalitás.
Az angiográfiában 2–5 egység/ml frakcionálatlan heparin -sóoldatot használnak, hogy megakadályozzák a véralvadást a vezetőhuzalokban, hüvelyekben és katéterekben, ezáltal megakadályozva, hogy a trombus ezekből az eszközökből keringjen a keringési rendszerbe.
Káros hatások
A heparin súlyos mellékhatása a heparin által kiváltott thrombocytopenia (HIT), amelyet egy olyan immunológiai reakció okoz, amely a vérlemezkéket az immunválasz célpontjává teszi , ami a vérlemezkék lebomlását eredményezi, ami thrombocytopeniát okoz. Ez az állapot rendszerint a kezelés abbahagyásakor megfordul, és általában szintetikus heparinok alkalmazásával elkerülhető. Ezenkívül a thrombocytopenia jóindulatú formája összefügg a korai heparinhasználattal, amely a heparin leállítása nélkül megszűnik.
A heparin kezelés két nem vérzéses mellékhatása ismert. Az első a szérum aminotranszferáz szint emelkedése, amelyről a heparint kapó betegek 80% -ánál számoltak be. Ez a rendellenesség nem jár májműködési zavarokkal, és a gyógyszer abbahagyása után eltűnik. A másik szövődmény a hiperkalémia , amely a heparint kapó betegek 5-10% -ában fordul elő, és a heparin által kiváltott aldoszteron szuppresszió eredménye. A hiperkalémia a heparinterápia kezdete után néhány napon belül megjelenhet. Ritkábban mellékhatások, alopecia és csontritkulás fordulhatnak elő krónikus alkalmazás esetén.
Mint sok gyógyszer esetében, a heparin túladagolása halálos lehet. 2006 szeptemberében a heparin világszerte nyilvánosságot kapott, amikor három koraszülött csecsemő meghalt, miután tévesen túladagolták a heparint egy indianapolisi kórházban.
Ellenjavallatok
A heparin ellenjavallt azoknál a betegeknél, akiknél fennáll a vérzés kockázata (különösen azoknál az embereknél, akiknél a vérnyomás nem szabályozott, májbetegségben és stroke -ban szenvednek), súlyos májbetegségben vagy súlyos hipertóniában.
A heparin ellenszere
Protamin -szulfátot adtak a heparin antikoaguláns hatásának ellensúlyozására (1 mg / 100 egység heparin, amelyet az elmúlt négy órában adtak). Alkalmazható azoknál, akik túladagolják a heparint, vagy visszafordítják a heparin hatását, ha már nincs rá szükség.
Fiziológiai funkció
A heparin normális szerepe a szervezetben nem világos. A heparint általában a hízósejtek szekréciós szemcséiben tárolják, és csak a szöveti sérülés helyén szabadítják fel az erekbe . Javasolták, hogy a heparin fő célja a véralvadásgátló helyett a védekezés az ilyen helyeken a behatoló baktériumok és más idegen anyagok ellen. Ezenkívül számos széles körben megfigyelhető fajnál is megfigyelhető, beleértve néhány gerinctelen állatot, amelyek nem rendelkeznek hasonló véralvadási rendszerrel. Ez egy erősen szulfatált glikozaminoglikán. Minden ismert biológiai molekula közül a legnagyobb negatív töltéssűrűséggel rendelkezik .
Evolúciós megőrzés
A szarvasmarha- és sertésszöveten kívül, amelyből a gyógyszerészeti minőségű heparint általában kivonják, az alábbiakból is kivonták és jellemezték:
A heparin biológiai aktivitása a 6–11. Ezek a fajok nem rendelkeznek olyan véralvadási rendszerrel, amely hasonló lenne az 1–5. A fenti lista azt is bemutatja, hogy a heparin milyen erősen konzerválódott az evolúció során , és hasonló szerkezetű molekulákat sok különböző fajhoz tartozó organizmusok termeltek .
Gyógyszertan
A természetben a heparin különböző láncméretű polimer . A frakcionálatlan heparin (UFH) gyógyszerként olyan heparin, amelyet nem frakcionáltak az alacsony molekulatömegű molekulák frakciójának elválasztására . Ezzel szemben az alacsony molekulatömegű heparin (LMWH) frakcionáláson esett át annak érdekében, hogy farmakodinamikája kiszámíthatóbb legyen. Gyakran vagy UFH vagy LMWH használható; bizonyos helyzetekben az egyik vagy a másik előnyösebb.
A cselekvés mechanizmusa
A heparin kötődik az antitrombin III (AT) enzimgátlóhoz , és konformációs változást okoz, amely aktiválódását eredményezi a reaktív hely hurok rugalmasságának növelése révén. Az aktivált AT ezután inaktiválja a trombint , a Xa faktort és más proteázokat. Ezen proteázok AT általi inaktiválásának sebessége akár 1000-szeresére is nőhet a heparin kötődése miatt. A heparin specifikus pentaszacharid -szulfatálási szekvencián keresztül kötődik az AT -heparin polimerben:
- GlcNAc/NS (6S) -GlcA-GlcNS (3S, 6S) -IdoA (2S) -GlcNS (6S)
A heparin-kötés AT konformációs változása közvetíti a Xa faktor gátlását. A trombin gátlásához azonban a trombinnak a pentaszacharidhoz közeli helyen is kötődnie kell a heparin polimerhez. A heparin rendkívül negatív töltéssűrűsége hozzájárul a trombinnal való erős elektrosztatikus kölcsönhatásához . Az AT, trombin és heparin közötti háromkomplex komplex képződése a trombin inaktiválását eredményezi. Emiatt a heparin trombinnal szembeni aktivitása méretfüggő, a terner komplexnek legalább 18 szacharid egységre van szüksége a hatékony képződéshez. Ezzel szemben az Xa antifaktor aktivitása AT-n keresztül csak a pentaszacharid-kötő helyet igényli.
Ez a méretkülönbség alacsony molekulatömegű heparinok (LMWH) és fondaparinux kifejlesztéséhez vezetett antikoagulánsként. A fondaparinux a Xa-faktor elleni aktivitást célozza meg, nem pedig gátolja a trombin-aktivitást, azzal a céllal, hogy elősegítse a véralvadás finomabb szabályozását és javítsa a terápiás indexet. Ez egy szintetikus pentaszacharid, amelynek kémiai szerkezete majdnem megegyezik a polimer heparinban és a heparán -szulfátban található AT -kötő pentaszacharid -szekvenciával .
LMWH és fondaparinux alkalmazása esetén csökken az osteoporosis és a heparin által kiváltott thrombocytopenia (HIT) kockázata . Az aktivált parciális tromboplasztin idő monitorozása szintén nem szükséges, és nem tükrözi az antikoaguláns hatást, mivel az APTT érzéketlen a Xa faktor változásaira.
A Danaparoid , a heparán -szulfát, a dermatán -szulfát és a kondroitin -szulfát keveréke antikoagulánsként használható olyan betegeknél, akiknél HIT alakult ki. Mivel a danaparoid nem tartalmaz heparint vagy heparin fragmentumokat, a danaparoid és a heparin által indukált antitestek keresztreakciója 10%-nál kisebb.
A heparin hatásait a laboratóriumban a részleges tromboplasztin idővel ( aPTT ) mérik, amely a vérplazma alvadásához szükséges idő egyik mértéke . A részleges tromboplasztinidőt nem szabad összetéveszteni a protrombin idővel vagy a PT -vel, amely a véralvadási időt a véralvadási kaszkád másik útján méri .
Adminisztráció
A heparint parenterálisan adják be, mivel nem szívódik fel a bélből, magas negatív töltése és nagy mérete miatt. Injektálható intravénásán vagy szubkután (a bőr alatt); az intramuszkuláris injekciókat (izomba) kerülik, mivel hematómák képződhetnek . Rövid , körülbelül egy órás biológiai felezési ideje miatt a heparint gyakran vagy folyamatos infúzióban kell beadni . A frakcionálatlan heparin felezési ideje körülbelül egy-két óra az infúzió után, míg az LMWH felezési ideje négy-öt óra. Az LMWH alkalmazása lehetővé tette a napi egyszeri adagolást, így nem szükséges a gyógyszer folyamatos infúziója. Ha a hosszú távú antikoaguláns van szükség, heparin gyakran csak megkezdeni az antikoaguláns terápiát, amíg az orális antikoaguláns pl warfarin lép.
Az American College of Chest Physicians közzéteszi a heparin adagolására vonatkozó klinikai irányelveket .
Természetes lebomlás vagy kiürülés
A frakcionálatlan heparin felezési ideje körülbelül egy-két óra az infúzió után, míg az alacsony molekulatömegű heparin felezési ideje körülbelül négyszer hosszabb. A kisebb adag heparin felezési ideje sokkal rövidebb, mint a nagyobbaké. A makrofág sejtekhez kötődő heparint a makrofágok internalizálják és depolimerizálják. Ezenkívül gyorsan kötődik az endothelsejtekhez , ami kizárja az antitrombinhoz való kötődést, ami antikoaguláns hatást eredményez. Nagyobb dózisú heparin esetén az endothelsejtek kötődése telített lesz, így a heparin vese által történő eltávolítása a véráramból lassabb folyamat lesz.
Kémia
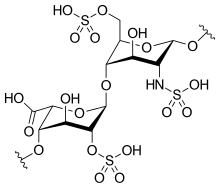
A heparin szerkezete
A natív heparin 3-30 kDa közötti molekulatömegű polimer , bár a legtöbb kereskedelmi forgalomban lévő heparin készítmény átlagos molekulatömege 12-15 kDa. A heparin egy tagja a glükózaminoglikán család szénhidrátok (amely magában foglalja a szorosan kapcsolódó molekula heparán-szulfát ), és egy változtathatóan szulfatált ismétlődő diszacharid egység. Az alábbiakban bemutatjuk a heparinban előforduló főbb diszacharid egységeket. A leggyakoribb diszacharid egységet 2-O-szulfatált iduronsav és 6-O-szulfatált, N-szulfatált glükózamin, IdoA (2S) -GlcNS (6S) alkotja. Ez például a marhahüvelyből származó heparinok 85% -át és a sertések bélnyálkahártyájának körülbelül 75% -át teszi ki.
Az alábbiakban nem láthatók azok a ritka diszacharidok, amelyek 3-O-szulfatált glükózamint (GlcNS (3S, 6S)) vagy szabad amincsoportot (GlcNH 3 + ) tartalmaznak. Fiziológiai körülmények között az észter- és amid -szulfát -csoportok deprotonálódnak, és pozitív töltésű ellenionokat vonzanak heparinsóvá. A heparint általában ebben a formában adják be antikoagulánsként.
GlcA = β- D - glükuronsav , IdoA = α- L - iduronsav , IdoA (2S) = 2- O szulfo- α- L -iduronic sav, GlcNAc = 2-dezoxi-2-acetamido-α- D - glükopiranozil, GlcNS = 2-dezoxi-2-szulfamido-α- D -glükopiranozil, GlcNS (6S) = 2-dezoxi-2-szulfamido-α- D -glükopiranozil-6- O -szulfát
Egy egység heparin (a " Howell -egység ") körülbelül 0,002 mg tiszta heparinnal egyenértékű mennyiség, amely elegendő ahhoz, hogy 1 ml macska vérfolyadékát 24 órán át 0 ° C -on tartsa.
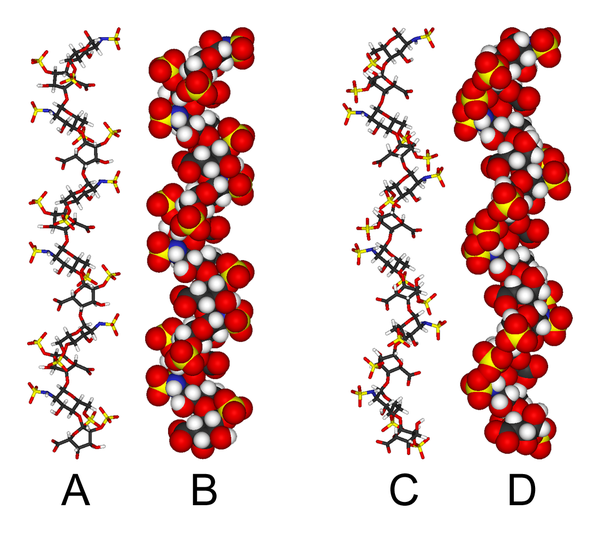
Háromdimenziós szerkezet
A heparin háromdimenziós szerkezete bonyolult, mivel az iduronsav két alacsony energiájú konformáció egyikében is jelen lehet, ha egy oligoszacharidon belül helyezkedik el. A konformációs egyensúlyt a szomszédos glükózamin -cukrok szulfatáltsága befolyásolja. Mindazonáltal a kizárólag hat GlcNS (6S) -IdoA (2S) ismétlődő egységből álló heparin-dodekasacharid oldatszerkezetét NMR-spektroszkópia és molekuláris modellezési technikák kombinációjával határozták meg. Két modellt gyártottak, az egyikben az összes IdoA (2S) 2 S 0 konformációban volt ( A és B lent), a másik pedig az 1 C 4 konformációban ( C és D alább). Nincs azonban bizonyíték arra, hogy e konformációk közötti változások összehangoltan történnének. Ezek a modellek megfelelnek az 1HPN fehérjeadat -kódnak.
A fenti képen:
- A = 1HPN (minden IdoA (2S) maradék 2 S 0 konformációban) Jmol viewer
- B = a van der Waals sugár kalottamodell az A
- C = 1HPN (minden IdoA (2S) maradék 1 C 4 konformációban) Jmol viewer
- D = a van der Waals sugár kalottamodell a C
Ezekben a modellekben a heparin spirális konformációt alkalmaz, amelynek forgatásával a szulfátcsoportok rendszeres időközönként körülbelül 17 angström (1,7 nm ) távolságra helyezkednek el a spirális tengely mindkét oldalán.
Depolimerizációs technikák
A heparin és a heparán -szulfát (HS) szerkezetére és funkciójára vonatkozó elemzések túlnyomó többségét kémiai vagy enzimatikus depolimerizációs technikák vagy a kettő kombinációja képezi.
Enzimatikus
A heparin vagy a HS emésztésére hagyományosan használt enzimeket a Pedobacter heparinus (korábbi nevén Flavobacterium heparinum ) talajbaktérium termeli . Ez a baktérium képes heparint vagy HS -t használni egyetlen szén- és nitrogénforrásként. Ehhez, az általa előállított enzimek sorát, mint például a liázok , glükuronidázok , sulfoesterases , és sulfamidases . A lázokat főként heparin/HS vizsgálatokban használták. A baktérium termel három liázok, heparinázok I ( EC 4.2.2.7 ), II (nincs EK-szám hozzárendelve) és III ( EC 4.2.2.8 ), és mindegyik különböző szubsztrát specificitással alábbiakban részletezett.
| Heparináz enzim | Aljzat sajátossága |
| Heparináz I | GlcNS (± 6S) -IdoA (2S) |
| Heparináz II | GlcNS/Ac (± 6S) -IdoA (± 2S) GlcNS/Ac (± 6S) -GlcA |
| Heparináz III | GlcNS/Ac (± 6S) -GlcA/IdoA (előnyben részesítve a GlcA-t) |
A lázok béta -eliminációs mechanizmussal hasítják a heparint/HS -t . Ez a hatás telítetlen kettős kötést hoz létre az uronát maradék C4 és C5 között. A C4-C5 telítetlen uronátot ΔUA vagy UA-nak nevezik. Ez egy érzékeny UV -kromofór (maximális abszorpció 232 nm -en), és lehetővé teszi az enzim emésztésének sebességének követését, valamint kényelmes módszert biztosít az enzim -emésztéssel előállított fragmensek kimutatására.
Kémiai
Salétromsav használható a heparin/HS kémiai depolimerizálására. A salétromsav használható 1,5 pH -nál vagy magasabb pH 4 -nél. Mindkét körülmények között a salétromsav a lánc deaminatív hasítását eredményezi.
Mind a „magas” (4), mind az „alacsony” (1,5) pH-értéknél a dezaminatív hasítás a GlcNS-GlcA és a GlcNS-IdoA között történik, bár a magasabb pH-nál lassabban. A dezaminálási reakció és ezáltal a lánc hasítása függetlenül attól, hogy bármely monoszacharid egység O-szulfatál.
Alacsony pH, dezaminálásos hasítás eredményeképpen a felszabaduló szervetlen SO 4 , és az átalakítás a GlcNS be anhidro (AMAN). Az alacsony pH-jú salétromsav-kezelés kiváló módszer az N-szulfatált poliszacharidok, például a heparin és a HS megkülönböztetésére a nem N-szulfatált poliszacharidokkal, mint például a kondroitin-szulfát és a dermatán-szulfát , a kondroitin-szulfát és a dermatán-szulfát, amelyek nem érzékenyek a salétromsav-hasításra.
Észlelés a testnedvekben
A heparinra vonatkozó jelenlegi klinikai laboratóriumi vizsgálatok a gyógyszer hatásának közvetett mérésén alapulnak, nem pedig kémiai jelenlétének közvetlen mérésén. Ezek közé tartozik az aktivált parciális tromboplasztin idő (APTT) és az Xa antifaktor aktivitás. A választott minta általában friss, nem hemolizált plazma, amelyet vérből citrát, fluorid vagy oxalát alvadásgátlása követett.
Egyéb funkciók
- A heparin lítium sóját (lítium -heparint) véralvadásgátlóként használó kémcsöveket, vacutainereket és kapilláriscsöveket általában zöld matricákkal és zöld felsőkkel jelölik. A heparin előnye az EDTA -val szemben, hogy nem befolyásolja a legtöbb ion szintjét . Az ionizált kalcium koncentrációja azonban csökkenhet, ha a heparin koncentrációja a vérmintában túl magas. A heparin azonban zavarhat bizonyos immunvizsgálatokat . Mivel általában lítium -heparint használnak, ezekből a csövekből egy személy lítiumszintjét nem lehet megállapítani; erre a célra nátrium- heparint tartalmazó királykék tetejű (és sötétzöld tetejű) vacutainereket használnak.
- Heparinnal bevont vér oxigenizátorok állnak rendelkezésre szív-tüdő gépekben. Többek között úgy gondolják, hogy ezek a speciális oxigenátorok javítják az általános biokompatibilitást és a gazdasejt homeosztázisát azáltal, hogy a natív endotéliumhoz hasonló tulajdonságokkal rendelkeznek.
- Az RNS polimeráz DNS kötőhelyeit heparin foglalhatja el, megakadályozva a polimeráz kötődését a promoter DNS -hez. Ezt a tulajdonságot számos molekuláris biológiai vizsgálat során használják fel.
- A gyakori diagnosztikai eljárások megkövetelik a páciens DNS -ének PCR -amplifikációját, amely könnyen kinyerhető a heparinnal kezelt fehérvérsejtekből. Ez potenciális problémát vet fel, mivel a heparin a DNS -sel együtt kivonható, és úgy találták, hogy 50 μl -es reakcióelegyben akár 0,002 U -nál is zavarja a PCR -reakciót.
- A heparint kromatográfiás gyantaként használták, affinitás ligandumként és ioncserélőként egyaránt . Polianionos szerkezete utánozhatja a nukleinsavakat, például a DNS-t és az RNS-t, így hasznos lehet nukleinsav-kötő fehérjék, köztük DNS- és RNS-polimerázok és transzkripciós faktorok tisztításához . Heparin fajlagos affinitása VSV-G , a virális burok -glikoprotein gyakran használják, hogy a pszeudotípus retrovírus és lentivirális vektorok a génterápiás , lehetővé teszi, hogy használható downstream tisztítására virális vektorok.
Társadalom és kultúra
A szennyeződés emlékeztet
Figyelembe véve a gyógyszerészeti heparin állati eredetét, a lehetséges szennyeződések száma viszonylag nagy a teljesen szintetikus terápiás szerhez képest. A lehetséges biológiai szennyeződések körébe tartoznak a vírusok, bakteriális endotoxinok, transzmisszív szivacsos agyvelőbántalom (TSE) ágensek, lipidek, fehérjék és DNS. A gyógyszerészeti minőségű heparin állati szövetekből történő előállítása során szennyeződéseket, például oldószereket, nehézfémeket és idegen kationokat vezethetnek be. Mindazonáltal az előfordulás minimalizálására és ezen szennyeződések azonosítására és/vagy megszüntetésére alkalmazott módszerek jól megalapozottak, és fel vannak sorolva az iránymutatásokban és a gyógyszerkönyvekben. A heparin szennyeződések elemzésének legnagyobb kihívása a szerkezetileg rokon szennyeződések kimutatása és azonosítása. A heparin legelterjedtebb szennyeződése a dermatán-szulfát (DS), más néven kondroitin-szulfát B. A DS építőeleme egy diszacharid, amely 1,3-kapcsolt N-acetil-galaktozaminból (GalN) és egy uronsav-maradékból áll. 1,4 kötésen keresztül a polimert. A DS három lehetséges uronsavból (GlcA, IdoA vagy IdoA2S) és négy lehetséges hexozaminból (GalNAc, Gal-NAc4S, GalNAc6S vagy GalNAc4S6S) építőelemekből áll. Az iduronsav jelenléte a DS -ben megkülönbözteti az A és C krondroitin -szulfáttól, és a heparinhoz és a HS -hez hasonlítja. A DS negatív töltéssűrűsége összességében alacsonyabb, mint a hepariné. Gyakori természetes szennyező, a DS 1–7% -os mennyiségben van jelen a heparin API -ban, de nincs bizonyított biológiai aktivitása, amely befolyásolja a heparin véralvadásgátló hatását.
2007 decemberében az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) visszahívta a heparin szállítmányát a baktériumok ( Serratia marcescens ) növekedése miatt a termék több bontatlan fecskendőjében. A S. marcescens életveszélyes sérülésekhez és/vagy halálhoz vezethet.
2008 -as visszahívás a kábítószerek hamisítása miatt Kínából
2008 márciusában az FDA bejelentette a heparin jelentős visszahívását a Kínából importált nyers heparinállomány szennyeződése miatt. Az FDA szerint a hamisított heparin közel 80 embert ölt meg az Egyesült Államokban. A hamisítót a kondroitin -szulfát " túlszulfatált " származékaként azonosították , amely népszerű kagylófélékből származó kiegészítő , amelyet gyakran használnak ízületi gyulladásra , és amelynek célja a tényleges heparin helyettesítése volt a potenciális tesztekben.
A New York Times szerint : "Az ügynökségnek jelentett heparinnal kapcsolatos problémák közé tartozik a légzési nehézség, hányinger, hányás, túlzott izzadás és gyorsan csökkenő vérnyomás, amely egyes esetekben életveszélyes sokkhoz vezetett".
Felhasználás emberölésben
2006 -ban Petr Zelenka , a Cseh Köztársaságban dolgozó ápolónő szándékosan adott be nagy adagokat a betegeknek, heten megöltek, tíz embert pedig meg akartak ölni.
Túladagolási problémák
2007-ben a Cedars-Sinai Medical Center ápolónője tévesen adott Dennis Quaid színész 12 napos ikreinek olyan adag heparint, amely 1000-szerese volt a csecsemőknek ajánlott adagnak. A túladagolás állítólag azért következett be, mert a termék felnőtt és csecsemő változatának címkézése és kialakítása hasonló volt. A Quaid család ezt követően beperelte a gyártót, a Baxter Healthcare Corp. -t , és 750 000 dollárért állapodott meg a kórházzal. A Quaid balesetet megelőzően hat újszülött csecsemőt túladagoltak az indianapolisi metodista kórházban. A csecsemők közül három meghalt a hiba után.
2008 júliusában a déli Christus Spohn Kórházban, a texasi Corpus Christi -ben született másik ikrek haltak meg, miután véletlenül beadták a kábítószert. A túladagolás a kórházi gyógyszertárban történt keverési hiba miatt következett be, és nem kapcsolódott a termék csomagolásához vagy címkézéséhez. 2008 júliusától az ikrek halálának pontos okát vizsgálták.
2010 márciusában egy kétéves texasi transzplantációs beteg halálos heparint kapott a Nebraskai Egyetem Orvosi Központjában. Halálának körülményeit még vizsgálják.
Termelés
A gyógyszerészeti minőségű heparin levágott húsállatok nyálkahártya- szöveteiből származik , például sertés (sertés) belekből vagy szarvasmarha (szarvasmarha) tüdőből. 2003 -ban és 2008 -ban előrelépés történt a heparin szintetikus előállítása terén. 2011 -ben egy kemoenzimatikus folyamatról számoltak be, amely egyszerű diszacharidokból állít elő alacsony molekulatömegű heparinokat.
Kutatás
Amint azt az alábbi táblázat részletezi, a potenciál nagyszerű a heparin-szerű struktúrák kifejlesztésében, amelyek gyógyszerek széles körének kezelésére szolgálnak , azon túl, hogy jelenleg antikoagulánsként használják őket.
| A heparinra érzékeny betegségek | A heparin hatása kísérleti modellekben | Klinikai állapot |
| Szerzett immunhiányos szindróma | Csökkenti az 1. és 2. típusú humán immunhiányos vírus adszorpciós képességét a tenyésztett T4 -sejtekbe. | - |
| Felnőtt légzési distressz szindróma | Csökkenti a sejtek aktiválódását és felhalmozódását a légutakban, semlegesíti a mediátorokat és a citotoxikus sejttermékeket, és javítja a tüdőfunkciót állatmodellekben | Kontrollált klinikai vizsgálatok |
| Allergiás encephalomyelitis | Hatékony állatmodellekben | - |
| Allergiás nátha | Hatások, mint a felnőttkori légzési distressz szindróma esetében, bár specifikus orrmodellt nem teszteltek | Kontrollált klinikai vizsgálat |
| Ízületi gyulladás | Gátolja a sejtek felhalmozódását, a kollagén pusztulását és az angiogenezist | Anekdotikus jelentés |
| Asztma | Ami a felnőttkori légzési distressz szindrómát illeti, a kísérleti modellekben azt is kimutatták, hogy javítja a tüdőfunkciót | Kontrollált klinikai vizsgálatok |
| Rák | Gátolja a tumor növekedését, áttéteket és angiogenezist, és állatmodellekben növeli a túlélési időt | Számos anekdota jelentés |
| Késleltetett típusú túlérzékenységi reakciók | Hatékony állatmodellekben | - |
| Gyulladásos bélbetegség | Általában gátolja a gyulladásos sejtek szállítását, nincs specifikus modell tesztelve | Kontrollált klinikai vizsgálatok |
| Intersticiális cystitis | Hatékony az intersticiális cystitis humán kísérleti modelljében | A rokon molekulát most klinikailag használják |
| A transzplantátum elutasítása | Meghosszabbítja az allograft túlélését állatmodellekben | - |
- - azt jelzi, hogy nincs információ
A heparin ilyen sokféle betegségre gyakorolt hatásának eredményeképpen valóban számos olyan gyógyszer kifejlesztés alatt áll, amelyek molekuláris szerkezete azonos vagy hasonló a polimer heparinlánc egyes részeiben található molekulákhoz.
| Gyógyszermolekula | Az új gyógyszer hatása a heparinhoz képest | Biológiai tevékenységek |
| Heparin -tetraszacharid | Nem antikoaguláns, nem immunogén, orálisan aktív | Antiallergiás |
| Pentosan poliszulfát | Növényi eredetű, kevés véralvadásgátló hatású, gyulladáscsökkentő, szájon át aktív | Gyulladáscsökkentő, tapadásgátló, antimetasztatikus |
| Foszfomannopentanóz -szulfát | Erősen gátolja a heparanáz aktivitást | Antimetasztatikus, antiangiogén, gyulladáscsökkentő |
| Szelektíven kémiailag O-deszulfatált heparin | Hiányzik az antikoaguláns aktivitás | Gyulladáscsökkentő, antiallergén, tapadásgátló |
Hivatkozások
További irodalom
- Marcum JA (2000. január). "A heparin felfedezésével kapcsolatos vita eredete". Journal of the History of Medicine and Allied Sciences . 55. (1): 37–66. doi : 10.1093/jhmas/55.1.37 . PMID 10734720 . S2CID 30050513 .
- Mulloy B, Hogwood J, Grey E, Lever R, CP oldal (2016. január). "A heparin és a hozzá kapcsolódó gyógyszerek farmakológiája" . Farmakológiai vélemények . 68. (1): 76–141. doi : 10.1124/pr.115.011247 . PMID 26672027 .
Külső linkek
- "Heparin" . Gyógyszerinformációs portál . Amerikai Országos Orvostudományi Könyvtár.
- A heparin története