Neuromuszkuláris csomópont - Neuromuscular junction
| Neuromuszkuláris csomópont | |
|---|---|
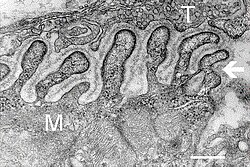
Elektronmikroszkópos felvétel, amely a neuromuszkuláris csomópont keresztmetszetét mutatja. T az axon terminál, M az izomrost. A nyíl keresztmetszeteket mutat a bazális réteggel . Az aktív zónák a hajtások közötti tippeken láthatók. A skála 0,3 μm. Forrás: NIMH
| |
 A neuromuszkuláris csomópont részletes nézete:
| |
| Részletek | |
| Azonosítók | |
| latin | synapssis neuromuscularis; junctio neuromuscularis |
| Háló | D009469 |
| TH | H2.00.06.1.02001 |
| FMA | 61803 |
| Anatómiai terminológia | |

A neuromuszkuláris csomópont (vagy myoneuralis csomópont ) kémiai szinapszis a motoros neuron és az izomrost között .
Lehetővé teszi a motoros neuron számára, hogy jelet továbbítson az izomrosthoz, ami izomösszehúzódást okoz .
Az izmoknak beidegzésre van szükségük a működéshez - és még csak az izomtónus fenntartásához is , elkerülve a sorvadást . A neuromuszkuláris rendszerben a központi idegrendszer és a perifériás idegrendszer idegei összekapcsolódnak és együtt dolgoznak az izmokkal. A szinaptikus átvitel a neuromuszkuláris csomópontban akkor kezdődik, amikor egy akciós potenciál eléri a motoros neuron preszinaptikus végét, amely aktiválja a feszültségfüggő kalciumcsatornákat , hogy a kalciumionok bejussanak a neuronba. A kalciumionok a szinaptikus vezikulákon kötődnek a szenzorfehérjékhez ( szinaptotagmin ), kiváltva a vezikulák fúzióját a sejtmembránnal, majd a neurotranszmitter felszabadulását a motoros neuronból a szinaptikus hasadékba . A gerincesekben a motoros neuronok acetilkolint (ACh), egy kis molekulájú neurotranszmittert szabadítanak fel , amely diffundál a szinaptikus hasadékon, és kötődik az izomrost sejtmembránján található nikotinos acetilkolin receptorokhoz (nAChR), más néven sarkolemmának . Az nAChR -ek ionotróp receptorok, azaz ligandummal kötött ioncsatornák . Az ACh receptorhoz való kötődése depolarizálhatja az izomrostot, ami kaszkádot okoz, ami végül izomösszehúzódást eredményez.
Neuromuszkuláris junkció betegségek lehetnek genetikai és autoimmun eredetű. Genetikai rendellenességek, mint például a Duchenne -féle izomdisztrófia , a neuromuszkuláris csomópontot tartalmazó mutált szerkezeti fehérjékből származhatnak, míg az autoimmun betegségek, mint például a myasthenia gravis , akkor fordulnak elő, amikor a szarkolemma nikotinos acetilkolin -receptorok ellen antitesteket termelnek.
Szerkezet és funkció
Kvantális átvitel
A neuromuszkuláris csomópontban a preszinaptikus motoros axonok 30 nanométerre végződnek az izomrost sejtmembránjától vagy szarkolemmájától . A csomópontban található sarcolemma invaginációkkal rendelkezik, amelyeket posztjunkcionális redőknek neveznek, amelyek növelik a szinaptikus hasadék felé néző felületét. Ezek az utólagos funkcionális redők alkotják a motor véglapját, amely nikotinos acetilkolin receptorokkal (nAChR) van ellátva 10 000 receptor/mikrométer 2 sűrűségben . A preszinaptikus axonok dudorokban végződnek, amelyeket terminális boutonoknak (vagy preszinaptikus termináloknak) neveznek, amelyek a sarkolemma posztfunkcionális redői felé vetülnek. A békában minden motoros idegvégződés körülbelül 300 000 hólyagot tartalmaz , átlagos átmérőjük 0,05 mikrométer. A hólyagok acetilkolint tartalmaznak. Ezen vezikulumok egy részét ötven fős csoportokba gyűjtik, és az idegmembránhoz közeli aktív zónákban helyezkednek el. Az aktív zónák körülbelül 1 mikrométer távolságra vannak egymástól. Az idegvégződés és a véglemez közötti 30 nanométeres hasadék acetilkolinészteráz (AChE) hálóját tartalmazza, 2600 enzimmolekula /mikrométer 2 sűrűségben, amelyet a dystrophin és a rapsyn strukturális fehérjék tartanak . Szintén jelen van a receptor tirozin-kináz fehérje MuSK , egy jeladó fehérje részt vesz a fejlesztés a neuromuszkuláris junkció, ami szintén tartja a helyén rapsyn.
Körülbelül másodpercenként egy nyugalmi csomópontban véletlenszerűen az egyik szinaptikus vezikulum összeolvad a preszinaptikus neuron sejtmembránjával a SNARE fehérjék által közvetített folyamatban . A fúzió eredményeképpen a vezikulum 7000-10 000 acetilkolin molekula tartalmát kiürítik a szinaptikus hasadékba , ezt a folyamatot exocitózisnak nevezik . Következésképpen az exocitózis acetilkolint szabadít fel csomagokban, amelyeket kvantumoknak neveznek. Az acetilkolin -kvantum az acetil -kolinészteráz hálón keresztül diffundál, ahol a magas helyi adó -koncentráció elfoglalja az enzim összes kötési helyét az útjában. A véglemezhez érkező acetilkolin ~ 2000 acetilkolin receptort aktivál, és megnyitja ioncsatornáikat, ami lehetővé teszi a nátriumionok bejutását a véglemezbe, ami 0,5 mV -os depolarizációt eredményez, miniatűr véglemez potenciálként (MEPP). Mire az acetilkolin felszabadul a receptorokból, az acetilkolinészteráz elpusztította a megkötött ACh -t, ami körülbelül 0,16 ms, és így rendelkezésre áll a receptorokból felszabaduló ACh megsemmisítésére.
Amikor a motor stimuláltuk van késés csak 0,5-0,8 msec közötti érkezése az ingerület a motoros idegvégződésekből és az első válasz a véglemez Az érkezés a motoros ideg akciós potenciál a preszinaptikus neuron terminál megnyílik feszültség -függő kalciumcsatornák és Ca 2+ ionok áramlanak az extracelluláris folyadékból a preszinaptikus neuron citoszoljába . A Ca 2+ beáramlása miatt több száz neurotranszmitter -tartalmú vezikulum összeolvad a preszinaptikus neuron sejtmembránjával a SNARE fehérjéken keresztül, és exocitózis útján felszabadítja acetilkolin kvantumaikat. A véglemez depolarizációját a felszabadult acetilkolin hatására véglemez potenciálnak (EPP) nevezik. Az EPP akkor valósul meg, amikor az ACh megköti a motor véglapján található nikotinos acetilkolin -receptorokat (nAChR), és nátriumion -beáramlást okoz. Ez a nátriumion-beáramlás generálja az EPP-t (depolarizációt), és akciós potenciált vált ki, amely feszültségfüggő nátriumcsatornákon keresztül a T-tubulusokon (keresztirányú tubulusokon) keresztül a szarkolemma mentén és az izomrostokba jut . Az akciós potenciálok vezetése a T-csövek mentén stimulálja a feszültségfüggő Ca 2+ csatornák nyitását, amelyek mechanikusan kapcsolódnak a Ca 2+ felszabadító csatornákhoz a szarkoplazmatikus retikulumban. A Ca 2+ ezután diffundál a szarkoplazmatikus retikulumból a miofibrillákba, így serkenti az összehúzódást. A véglemez potenciálja tehát felelős az izomrost akciós potenciáljának kialakításáért, amely kiváltja az izomösszehúzódást. Az idegből az izomba történő átvitel olyan gyors, mert minden acetilkolin -kvantum millimoláris koncentrációban éri el a véglemezt, elég magas ahhoz, hogy egy alacsony affinitású receptorral kombinálódjon, ami gyorsan felszabadítja a kötött adót.
Acetilkolin receptorok

- Ion csatornához kapcsolt receptor
- Ionok
- Ligandum (például acetilkolin )
Az acetil-kolin egy neurotranszmitter szintetizált étrendi kolin és acetil-CoA (ACoA), és részt vesz a stimuláció az izomszövet a gerincesek , valamint néhány gerinctelen állatok. A gerinceseknél a vázizmok neuromuszkuláris csomópontjában található acetilkolin receptor altípus a nikotinos acetilkolin receptor (nAChR), amely egy ligandum-kapu ioncsatorna . Ennek a receptornak minden alegysége rendelkezik egy jellegzetes "cys-hurokkal", amely egy cisztein- maradékból, majd 13 aminosavból és egy másik cisztein-maradékból áll. A két cisztein aminosav diszulfidkötést képez, amelynek eredményeként létrejön a "cys-loop" receptor, amely képes megkötni az acetilkolint és más ligandumokat. Ezek a cys-hurok receptorok csak az eukariótákban találhatók meg , de a prokarióták hasonló tulajdonságokkal rendelkező ACh receptorokkal rendelkeznek. Nem minden faj használ kolinerg neuromuszkuláris csomópontot; pl. rákok és gyümölcslegyek glutamaterg neuromuszkuláris csomóponttal rendelkeznek.
A csontváz neuromuszkuláris csomópontjában lévő AChR -ek két α, egy β, egy ɛ és egy δ alegységből álló heteropentamereket alkotnak. Amikor egyetlen ACh ligandum kötődik az ACh receptor egyik α alegységéhez, konformációs változást indukál a második AChR α alegységgel való interfészen. Ez a konformációs változás a második α alegység megnövekedett affinitását eredményezi egy második ACh ligandum iránt. Ezért az AChR -ek szigmoidális disszociációs görbét mutatnak ennek az együttműködő kötésnek köszönhetően . Az inaktív, köztes receptor szerkezet jelenléte egyetlen kötéssel rendelkező ligandummal megtartja az ACh-t a szinapszisban , amely egyébként elveszhet a kolinészteráz hidrolízise vagy diffúziója miatt. Ezen ACh ligandumok szinapszisban való megmaradása hosszan tartó posztszinaptikus választ okozhat.
Fejlődés
A neuromuszkuláris csomópont kialakulásához mind a motoros idegsejt termináljáról, mind az izomsejt központi régiójáról jelezni kell. A fejlődés során az izomsejtek acetilkolin receptorokat (AChR) termelnek, és a középső régiókban fejezik ki őket az előmintázásnak nevezett folyamatban. Agrin , a heparin proteoglikán , pézsma kináz úgy gondolják, hogy segít stabilizálni a felhalmozási AChR a központi régióban az izomsejt. A MuSK egy receptor tirozin -kináz, ami azt jelenti, hogy a sejtek jelátvitelét indukálja azáltal, hogy a foszfátmolekulákat olyan régiókhoz köti , mint a tirozinok , és a citoplazma más célpontjaihoz . A ligand agrin által történő aktiválás után a MuSK két " Dok-7 " és " rapsyn " nevű fehérjén keresztül jelzi az acetilkolin-receptorok "csoportosulását". Az ACh felszabadulása motoros neuronok kifejlesztésével posztszinaptikus potenciált hoz létre az izomsejtben, ami pozitívan erősíti a fejlődő neuromuscularis csomópont lokalizációját és stabilizációját.
Ezeket a megállapításokat részben egér " kiütéses " vizsgálatok igazolták. Az egerekben, amelyekben sem az agrin, sem a MuSK hiánya hiányzik, a neuromuszkuláris csomópont nem jön létre. Továbbá a Dok-7-ben hiányos egerek sem acetilkolin receptor klasztereket, sem neuromuszkuláris szinapszist nem képeztek.
A neuromuscularis csomópontok kialakulását többnyire modellszervezetekben, például rágcsálókban tanulmányozzák. Ezenkívül 2015-ben teljesen humán neuromuscularis csomópontot hoztak létre in vitro humán embrionális őssejtek és szomatikus izom őssejtek felhasználásával. Ebben a modellben a preszinaptikus motoros neuronokat az optogenetika aktiválja, és válaszul a szinaptikusan összekapcsolt izomrostok megrándulnak a fény stimulációja hatására.
Kutatási módszerek
José del Castillo és Bernard Katz ionoforézissel határozták meg a nikotinos acetilkolin -receptorok (nAChR -ok) elhelyezkedését és sűrűségét a neuromuszkuláris csomópontban. Ezzel a technikával egy mikroelektródát helyeztek az izomrost motoros véglapjába, és egy acetilkolinnal (ACh) töltött mikropipettát helyeztek közvetlenül a véglap elé a szinaptikus hasadékba. Pozitív feszültséget alkalmaztunk a mikropipetta hegyén, ami pozitív töltésű ACh molekulák kitörését okozta a pipettából. Ezek a ligandumok a szinaptikus hasadékot reprezentáló térbe áramlottak és AChR -hez kötődtek. Az intracelluláris mikroelektróda figyelte a motor véglemez depolarizációjának amplitúdóját , válaszul az ACh nikotin (ionotrop) receptorokhoz való kötődésére. Katz és del Castillo kimutatták, hogy a depolarizáció amplitúdója ( gerjesztő posztszinaptikus potenciál ) függ az ACh -ionokat a véglemezre felszabadító mikropipetta közelségétől. Minél távolabb volt a mikropipetta a motor véglemezétől, annál kisebb volt a depolarizáció az izomrostokban. Ez lehetővé tette a kutatók számára, hogy megállapítsák, hogy a nikotinos receptorok nagy sűrűségben lokalizálódtak a motor véglapján.
Toxinokat használnak az acetilkolin receptorok neuromuszkuláris csomópontban való elhelyezkedésének meghatározására is. Az α-bungarotoxin a Bungarus multicinctus kígyófajban található toxin , amely ACh antagonistaként működik, és visszafordíthatatlanul kötődik az AChR-ekhez. A vizsgálható enzimek, például a tormaperoxidáz (HRP) vagy a fluoreszcens fehérjék, például a zöld fluoreszcens fehérje (GFP) α-bungarotoxinhoz kapcsolásával az AChR-ek vizualizálhatók és számszerűsíthetők.
A neuromuszkuláris csomópontot befolyásoló toxinok
Idegi gázok
Az ideggázok és az italok károsítják ezt a területet.

Botulinum toxin
A botulinum toxin (más néven botulinum neurotoxin, és Botox márkanéven forgalmazzák) gátolja az acetilkolin felszabadulását a neuromuscularis csomópontban azáltal, hogy zavarja a SNARE fehérjéket. Ez a toxin az endocitózis folyamatán keresztül behatol az idegvégződésbe, és ezután zavarja a SNARE fehérjéket, amelyek szükségesek az ACh felszabadulásához. Ezáltal átmeneti petyhüdt bénulást és kémiai denervációt indukál az érintett csíkos izomban. Az ACh felszabadulás gátlása csak az injekció beadása után körülbelül két héttel kezdődik. Három hónappal a gátlás után az idegsejtek aktivitása elkezdi visszanyerni a részleges funkciót, és hat hónappal a teljes neuronális funkció helyreáll.
Tetanusz toxin
A tetanusz toxin, más néven tetanospasmin , egy erős neurotoxin, amelyet a Clostridium tetani termel, és a betegség állapotát, a tetanuszt okozza. Ennek a toxinnak az LD 50 -ét megközelítőleg 1 ng/kg -ra értékelték, így a második helyen áll a botulinum toxin D mögött, mint a világ leghalálosabb toxinja. Nagyon hasonlóan működik, mint a botulinum neurotoxin, mivel a preszinaptikus idegvégződéshez kapcsolódik és endocitóz, és zavarja a SNARE fehérjekomplexeket. Néhány szempontból különbözik a botulinum neurotoxintól, leginkább a végső állapotában, ahol a tetanospasmin merev / spasztikus bénulást mutat , szemben a botulinum neurotoxinnal kimutatott petyhüdt bénulással.
Latrotoxin
Az özvegy pókok mérgében található latrotoxin (α-latrotoxin) szintén befolyásolja a neuromuszkuláris csomópontot azáltal, hogy acetilkolint szabadít fel a preszinaptikus sejtből. A hatásmechanizmusok közé tartozik a preszinaptikus sejt receptoraihoz való kötődés, amely aktiválja az IP3/DAG útvonalat, és a kalcium felszabadulása az intracelluláris raktárakból, és pórusképződés, ami közvetlenül a kalciumionok beáramlását eredményezi. Bármelyik mechanizmus fokozott kalciumot okoz a preszinaptikus sejtekben, ami az acetilkolin szinaptikus vezikuláinak felszabadulásához vezet. A latrotoxin fájdalmat, izomösszehúzódást és kezeletlen bénulást és halált okoz.
Kígyóméreg
A kígyóméreg toxinként hat a neuromuszkuláris csomópontban, és gyengeséget és bénulást okozhat . A méreg preszinaptikus és posztszinaptikus neurotoxin is lehet.
A preszinaptikus neurotoxinok, közismert nevén β-neurotoxinok, befolyásolják a neuromuszkuláris csomópont preszinaptikus régióit. Ezen neurotoxinok többsége gátolja a neurotranszmitterek, például az acetilkolin felszabadulását a neuronok közötti szinapszisba. Azonban ezeknek a toxinoknak egy része is ismert, hogy fokozza a neurotranszmitter felszabadulását. Azok, amelyek gátolják a neurotranszmitter felszabadulását, neuromuszkuláris blokádot hoznak létre, amely megakadályozza, hogy a jelzőmolekulák elérjék posztszinaptikus célreceptorukat. Ennek során e kígyómarás áldozata mély gyengeségben szenved. Az ilyen neurotoxinok nem reagálnak jól az antiméregre. Ezen toxinok, köztük a notexin és a taipoxin egy órás oltása után sok érintett idegvégződés visszafordíthatatlan fizikai károsodás jeleit mutatja, így nincsenek szinaptikus hólyagok .
A posztszinaptikus neurotoxinok, más néven α-neurotoxinok, ellentétben hatnak a preszinaptikus neurotoxinokkal, és kötődnek a posztszinaptikus acetilkolin receptorokhoz. Ez megakadályozza a kölcsönhatást a preszinaptikus terminál által felszabaduló acetilkolin és a posztszinaptikus sejt receptorai között. Valójában tilos az ezekhez az acetilkolin receptorokhoz kapcsolódó nátriumcsatornák megnyitása, ami neuromuszkuláris blokádot eredményez, hasonlóan a preszinaptikus neurotoxinok hatásához. Ez bénulást okoz az érintett csomópontokban érintett izmokban. A preszinaptikus neurotoxinokkal ellentétben a posztszinaptikus toxinokat könnyebben befolyásolják az anti-mérgek, amelyek felgyorsítják a toxin receptoroktól való disszociációját, és végül a bénulás visszafordítását okozzák. Ezek a neurotoxinok kísérletileg és minőségileg segítik az acetilkolin receptorok sűrűségének és forgalmának vizsgálatát, valamint olyan vizsgálatokban, amelyek megfigyelik az antitestek irányát az érintett acetilkolin receptorok felé myasthenia gravis diagnosztizált betegeknél .
Betegségek
Minden olyan rendellenességet, amely veszélyezteti a motoros idegsejt és az izomsejt közötti szinaptikus átvitelt, a neuromuszkuláris betegségek gyűjtőfogalma alá kell besorolni . Ezek a rendellenességek öröklődhetnek vagy szerzhetők, súlyosságuk és halálozásuk eltérő lehet. Általában a legtöbb ilyen rendellenességet általában mutációk vagy autoimmun rendellenességek okozzák. Az autoimmun rendellenességek neuromuszkuláris betegségek esetén általában humorális , B -sejt -közvetítettek, és a motoros idegsejt vagy izomrostfehérje ellen helytelenül létrehozott antitestet eredményeznek, amely zavarja a szinaptikus átvitelt vagy jelzést.
Autoimmun
Myasthenia gravis
A Myasthenia gravis egy autoimmun betegség, amelyben a szervezet vagy az acetilkolin-receptor (AchR) (az esetek 80% -ában), vagy a posztszinaptikus izom-specifikus kináz (MuSK) ellen termel antitesteket (az esetek 0–10% -ában). A szeronegatív myasthenia gravis alacsony sűrűségű lipoproteinreceptorhoz kapcsolódó fehérjét 4 az IgG1 célozza meg , amely ligandumának versenyképes gátlója, és megakadályozza, hogy a ligandum megkötje receptorát. Nem ismert, hogy a szeronegatív myasthenia gravis reagál -e a standard terápiákra.
Újszülött MG
Az újszülöttkori MG autoimmun rendellenesség, amely 8 gyermek közül 1 -et érint, akik anyáktól születtek, akiknél myasthenia gravis (MG) diagnosztizáltak. Az MG átvihető az anyából a magzatba az AChR antitestek placentán keresztüli mozgásával . Ennek a betegségnek a születésekor a jelei közé tartozik a gyengeség, amely reagál az antikolinészteráz gyógyszerekre, valamint a magzati akinézia vagy a magzat mozgásának hiánya. A betegség ezen formája átmeneti, körülbelül három hónapig tart. Bizonyos esetekben azonban az újszülöttkori MG más egészségügyi hatásokhoz, például arthrogryposishoz és akár magzati halálhoz is vezethet. Úgy gondolják, hogy ezek a feltételek akkor kezdődnek, amikor az anyai AChR antitesteket a magzati AChR -re irányítják, és a terhesség 33. hetéig tarthatnak , amikor az AChR γ alegységét az ε alegység váltja fel.
Lambert-Eaton myasthenic szindróma
A Lambert-Eaton myasthenic szindróma (LEMS) egy autoimmun betegség, amely a neuromuszkuláris csomópont preszinaptikus részét érinti. Ezt a ritka betegséget a tünetek egyedi hármasa jellemezheti: proximális izomgyengeség, autonóm diszfunkció és areflexia. A proximális izomgyengeség a P/Q típusú feszültségfüggő kalciumcsatornák ellen irányuló kórokozó autoantitestek terméke , ami viszont csökkenti az acetilkolin felszabadulását a preszinaptikus sejt motoros idegvégződéseiből. A LEMS által okozott autonóm diszfunkcióra példák a férfiaknál fellépő merevedési zavar , székrekedés és leggyakrabban a szájszárazság . Kevésbé gyakori rendellenességek közé tartozik a száraz szem és a megváltozott izzadás . Az areflexia olyan állapot, amelyben az ínreflexek csökkennek, és egy edzés után átmenetileg enyhülhetnek .
A LEMS-ben diagnosztizált betegek 50–60% -ánál van egy kapcsolódó daganat is , amely tipikusan kissejtes tüdőkarcinóma (SCLC). Ez a fajta daganat feszültségfüggő kalciumcsatornákat is kifejez . Gyakran előfordul, hogy a LEMS a myasthenia gravis mellett is előfordul.
A LEMS kezelése első lépésként a 3,4-diaminopiridin használatából áll, amely az összetett izomaktív potenciál és az izomerő növelésére szolgál azáltal, hogy meghosszabbítja azt az időt, ameddig a feszültségfüggő kalciumcsatornák nyitva maradnak a feszültségfüggő káliumcsatornák blokkolása után. Az Egyesült Államokban a 3,4-diaminopiridinnel történő kezelés a jogosult LEMS-betegek számára díjmentesen elérhető egy kiterjesztett hozzáférési program keretében. A további kezelés magában foglalja a prednizon és azatioprin alkalmazását abban az esetben, ha a 3,4-diaminopiridin nem segít a kezelésben.
Neuromyotonia
A neuromyotonia (NMT), más néven Isaac -szindróma, eltér sok más neuromuscularis csomópontban jelen lévő betegségtől. Ahelyett, hogy izomgyengeséget okozna, az NMT a motoros idegek túlzott izgatottságához vezet. Az NMT ezt a túlzott izgatottságot okozza, mivel hosszabb feszültségfüggő káliumcsatornák szabályozásával hosszabb depolarizációt eredményez , ami nagyobb neurotranszmitter felszabadulást és ismétlődő tüzelést okoz. Ez a tüzelési sebesség növekedése aktívabb átvitelhez és ennek következtében nagyobb izomaktivitáshoz vezet az érintett személyben. Úgy gondolják, hogy az NMT is autoimmun eredetű, mivel összefüggésben van az érintett személy autoimmun tüneteivel.
Genetikai
Veleszületett myasthenic szindrómák
A veleszületett myasthenic szindrómák (CMS) funkcióikban nagyon hasonlítanak az MG -hez és a LEMS -hez, de az elsődleges különbség a CMS és az említett betegségek között az, hogy a CMS genetikai eredetű. Pontosabban, ezek a szindrómák olyan betegségek, amelyek mutációk miatt fordulnak elő, jellemzően recesszív , legalább 10 gén közül 1 -ben, amelyek befolyásolják a preszinaptikus, szinaptikus és posztszinaptikus fehérjéket a neuromuszkuláris csomópontban. Az ilyen mutációk általában az AChR ε-alegységében fordulnak elő, ezáltal befolyásolják a receptor kinetikáját és expresszióját. Egyetlen nukleotid szubsztitúció vagy deléció funkcióvesztést okozhat az alegységben. Más mutációk , például az acetil -kolinészterázt és az acetiltranszferázt érintő mutációk is okozhatják a CMS expresszióját, ez utóbbi kifejezetten epizodikus apnoéhoz kapcsolódik . Ezek a szindrómák az egyén életének különböző időpontjaiban jelentkezhetnek. Előfordulhatnak a magzati fázisban, magzati akineziát okozva , vagy a perinatális időszakban, amikor bizonyos állapotok, például arthrogryposis , ptosis , hypotonia , oftalmoplegia és táplálkozási vagy légzési nehézségek figyelhetők meg. Serdülőkorban vagy felnőttkorban is aktiválódhatnak, ami az egyén lassú csatornás szindróma kialakulását idézheti elő.
A CMS bizonyos altípusainak (posztszinaptikus gyorscsatornás CMS) kezelése hasonló az egyéb neuromuszkuláris rendellenességek kezeléséhez. A 3,4-diaminopiridin , az LEMS első vonalbeli kezelése, az Egyesült Államokban a CMS ritka gyógyszereként fejlesztés alatt áll, és a jogosult betegek számára elérhetővé válik egy kiterjesztett hozzáférési program keretében, díjmentesen.
Bulbospinalis izomsorvadás
A bulbospinalis izomsorvadás , más néven Kennedy -kór, ritka recesszív trinukleotid, poliglutamin -rendellenesség, amely az X -kromoszómához kapcsolódik . Az X -kromoszómához való kapcsolódása miatt jellemzően nőstényeken keresztül terjed. A Kennedy -betegség azonban csak felnőtt hímekben fordul elő, és a betegség kialakulása jellemzően az élet későbbi szakaszában van. Ezt a betegséget kifejezetten a CAG-tandem ismétlés expanziója okozza az 1. exonban, amely az Xq 11-12 kromoszóma androgén-receptor (AR) génjén található . A poli-Q-expandált AR felhalmozódik a sejtek magjaiban, ahol fragmentálódni kezd. A fragmentáció után megkezdődik a sejt lebomlása, ami mind a motoros idegsejtek, mind a háti gyökér ganglionok elvesztéséhez vezet .
A Kennedy -kór tünetei közé tartozik az arc bulbar és végtag izmainak gyengesége és fáradtsága , valamint érzékszervi és endokrinológiai zavarok, például gynecomastia és csökkent termékenység . Egyéb tünetek közé tartozik a megnövekedett tesztoszteron- és egyéb nemi hormonszint, a hiper-CK-emia kialakulása, a motoros és érzékszervi idegeken keresztüli kóros vezetés, valamint az izomsejtek biopsziájának neuropátiás vagy ritkán myopátiás elváltozásai.
Duchenne izomsorvadás
A Duchenne-féle izomdisztrófia egy X-hez kapcsolódó genetikai rendellenesség, amelynek következtében a neuromuszkuláris csomópontban hiányzik a strukturális fehérje dystrophin . 3 600–6 000 férfi közül 1 -et érint, és 30 éves koráig gyakran halált okoz. A dystrophin hiánya izomdegenerációt okoz , és a betegek a következő tünetekkel jelentkeznek: kóros járás , a borjúizmok hipertrófiája és emelkedett kreatin -kináz . Ha nem kezelik, a betegek légzési nehézségeket szenvedhetnek , ami halálhoz vezethet.
Lásd még
Külső linkek
- Szövettani kép: 21501lca - A Bostoni Egyetem hisztológiai tanulási rendszere
További irodalom
- Kandel, ER ; Schwartz JH; Jessell TM. (2000). A neurális tudomány elvei (4. kiadás). New York: McGraw-Hill. ISBN 0-8385-7701-6.
- Nicholls, JG; AR Martin; BG Wallace; PA Fuchs (2001). A neurontól az agyig (4. kiadás). Sunderland, MA .: Sinauer Associates. ISBN 0-87893-439-1.
- Engel, AG (2004). Miológia (3. kiadás). New York: McGraw Hill Professional. ISBN 0-07-137180-X.


