Afrikai trypanosomiasis - African trypanosomiasis
| Afrikai trypanosomiasis | |
|---|---|
| Más nevek | Alvászavar, afrikai alvászavar |
 | |
| Trypanosoma vérkenetben képződik | |
| Különlegesség | Fertőző betegség |
| Tünetek |
1. szakasz : Láz, fejfájás, viszketés, ízületi fájdalmak 2. szakasz : Alvászavar , zavartság , rossz koordináció |
| Szokásos kezdet | 1-3 héttel az expozíció után |
| Típusok | Trypanosoma brucei gambiense ( TbG ), Trypanosoma brucei rhodesiense (TbR) |
| Okoz | A Trypanosoma brucei tsetse legyek által terjed |
| Diagnosztikai módszer | Vérkenet , ágyéki punkció |
| Gyógyszer | Fexinidazol , pentamidin , suramin , eflornitin , nifurtimox |
| Prognózis | Kezelés nélkül halálos |
| Frekvencia | 977 (2018) |
| Halálozások | 3500 (2015) |
Az afrikai trypanosomiasis , más néven afrikai alvási betegség vagy egyszerűen alvási betegség , az emberek és más állatok rovarok által terjesztett parazitafertőzése . A Trypanosoma brucei faj okozza . Az embereket két típus fertőzi, a Trypanosoma brucei gambiense ( TbG ) és a Trypanosoma brucei rhodesiense (TbR). A TbG a bejelentett esetek több mint 98% -át okozza. Mindkettőt általában egy fertőzött csigalégy harapása továbbítja, és a leggyakoribb a vidéki területeken.
Kezdetben a betegség első szakaszát láz, fejfájás, viszketés és ízületi fájdalmak jellemzik, amelyek a harapás után egy -három héttel kezdődnek. Hetek -hónapok múlva a második szakasz zavartsággal, rossz koordinációval, zsibbadással és alvászavarral kezdődik. A diagnózis az, hogy megtalálják a parazitát egy vérkenetben vagy egy nyirokcsomó folyadékában. A lumbálpunkcióval gyakran van szükség, hogy mi a különbség az első és második stádiumú.
A súlyos betegségek megelőzése magában foglalja a veszélyeztetett populáció szűrését vérvizsgálattal a TbG -re. A kezelés könnyebb, ha a betegséget korán észlelik, és mielőtt neurológiai tünetek jelentkeznek. Az első szakasz kezelése pentamidin vagy suramin gyógyszerekkel történt . A második szakasz kezelése magában foglalta az eflornitint vagy a nifurtimox és az eflornitin kombinációját a TbG kezelésére. A fexinidazol egy újabb kezelés, amelyet szájon át lehet szedni a TbG bármely szakaszában. Míg a melarsoprol mindkét típusnál működik, a súlyos mellékhatások miatt jellemzően csak TbR -re használják. Kezelés nélkül az alvászavar általában halált okoz.
A betegség rendszeresen előfordul a Szaharától délre fekvő Afrika egyes régióiban, a veszélyeztetett népesség 36 országban mintegy 70 millió. 2015 -ben becslések szerint 11 000 embert fertőztek meg 2800 új fertőzéssel. 2018 -ban 977 új esetet regisztráltak. 2015 -ben mintegy 3500 halálesetet okozott, szemben az 1990. évi 34 000 -vel. Az esetek több mint 80% -a a Kongói Demokratikus Köztársaságban található . Három nagy kitörés történt a közelmúltban: egy 1896 és 1906 között, elsősorban Ugandában és a Kongói -medencében , kettő pedig 1920 -ban és 1970 -ben több afrikai országban. Elhanyagolt trópusi betegségnek minősül . Más állatok, például tehenek hordozhatják a betegséget, és megfertőződhetnek, ebben az esetben Nagana vagy állati trypanosomiasis néven ismert .
jelek és tünetek
Az afrikai trypanosomiasis tünetei két szakaszban jelentkeznek: a hemolimfatikus szakaszban és a neurológiai szakaszban (ez utóbbit a központi idegrendszer parazita inváziója jellemzi). A neurológiai tünetek azonban a kezdeti jellemzőkön kívül jelentkeznek, és a két szakaszt önmagában a klinikai jellemzők alapján nehéz lehet megkülönböztetni.
A betegségről beszámoltak, hogy atipikus tünetekkel jár a nem endémiás területekről származó fertőzött személyeknél (pl. Utazók). Ennek okai tisztázatlanok és genetikai eredetűek lehetnek. Az ilyen esetek alacsony száma is torz eredményekkel járhat. Az ilyen személyeknél a fertőzés főleg gyomor -bélrendszeri tünetekkel (pl. Hasmenés és sárgaság) járó lázként jelentkezik, és a limfadenopátia csak ritkán alakul ki.
Trypanosomális chancre
A szisztémás megbetegedést néha a fertőző légycsípés helyén kialakuló trypanosomalis chancre feltételezi a fertőzés után 2 napon belül. A chancre leggyakrabban T. b. rhodesiense fertőzés, és csak ritkán T. b. gambiense (azonban T. b. gambiense fertőzésben a chancres gyakoribb a nem endémiás területekről származó személyeknél).
Hemolimfás fázis
Az inkubációs idő 1-3 hét T. b. rhodesiense, és hosszabb (de kevésbé pontosan jellemzett) a T. b. gambiense fertőzés. Az első/kezdeti szakaszt, amelyet hemolimfatikus fázisnak neveznek, nem specifikus, általános tünetek jellemzik, mint például: láz (szakaszos) , fejfájás (súlyos), ízületi fájdalmak , viszketés , gyengeség, rossz közérzet, fáradtság, fogyás, limfadenopátia és hepatosplenomegalia.
A diagnózis késhet a kezdeti tünetek homályossága miatt. A betegség összetéveszthető a maláriával is (ami valójában társfertőzésként is előfordulhat).
Időszakos láz
A láz időszakos, a rohamok egy naptól egy hétig tartanak, néhány naptól egy hónapig vagy tovább tartva. A láz epizódjai ritkábban fordulnak elő a betegség során.
Limfadenopátia
A parazita keringési és nyirokrendszeri inváziója a nyirokcsomók súlyos duzzanatával jár , gyakran hatalmas méretekig. Leggyakrabban a hátsó nyaki nyirokcsomók érintettek, azonban hónalji, inguinalis és epitrochleáris nyirokcsomó -érintettség is előfordulhat. Megjelenhet Winterbottom jele , az árulkodó duzzadt nyirokcsomók a tarkó hátsó részén. Winterbottom jele gyakori T. b. gambiense fertőzés.
Más funkciók
Az érintettek ezenkívül bőrkiütéssel, hemolitikus anémiával, hepatomegalia és kóros májfunkcióval, splenomegalia, endokrin rendellenesség, szív érintettség (pl. Pericarditis és pangásos szívelégtelenség) és szemészeti érintettséggel járhatnak.
Számos vérzéses folt a láb bőrébe egy T. fertőzött személynél . B. rhodesiense
Neurológiai fázis
A betegség második szakasza, a neurológiai fázis (más néven meningoencephalicis stádium ) akkor kezdődik, amikor a parazita a vér -agy gáton áthatol a központi idegrendszerbe . A neurológiai fázis előrehaladása 21–60 nap elteltével következik be T. b. rhodesiens e fertőzés, és 300–500 nap T. b. gambiense fertőzés.
Valójában a két fázis átfedésben van, és csak a klinikai jellemzők alapján nehéz megkülönböztetni őket; a betegség tényleges stádiumának meghatározását a cerebrospinális folyadék parazita jelenlétére vonatkozó vizsgálatával érjük el .
Alvászavarok
Az alvás-ébrenlét zavarai a neurológiai stádium egyik fő jellemzője, és a betegségnek az afrikai alvási betegség általános nevét adta . A fertőzött személyek szervezetlen és töredezett alvás-ébrenléti ciklust tapasztalnak. Az érintettek alvásinverziót tapasztalnak, ami nappali alvást és aluszékonyságot, valamint éjszakai ébrenlétet és álmatlanságot eredményez. Ezenkívül az érintettek hirtelen álmosságot is tapasztalnak.
Neurológiai/neurokognitív tünetek
A neurológiai tünetek közé tartozik: remegés , általános izomgyengeség, hemiparézis , végtagi bénulás , rendellenes izomtónus, járászavar, ataxia, beszédzavarok, paresztézia, hyperaesthesia, érzéstelenítés, látászavar, kóros reflexek, görcsök és kóma. Parkinson -szerű mozgások léphetnek fel a nem specifikus mozgási rendellenességek és beszédzavarok miatt.
Pszichiátriai/viselkedési tünetek
Az egyének pszichiátriai tüneteket mutathatnak, amelyek néha uralják a klinikai diagnózist, és lehetnek agresszivitás, apátia , ingerlékenység, pszichotikus reakciók és hallucinációk , szorongás , érzelmi labilitás , zavartság , mánia , figyelemhiány és delírium .
Előrehaladott/késői betegség és kimenetelei
Kezelés nélkül a betegség változatlanul halálos, a fokozódó mentális romlás kómához, szisztémás szervi elégtelenséghez és halálhoz vezet. Kezeletlen fertőzés T. b. A rhodesiense hónapokon belül halált okoz, míg a kezeletlen T. b. A gambiense több év múlva halált okoz. A neurológiai fázisban okozott károk visszafordíthatatlanok.
Ok
A Trypanosoma brucei gambiense okozza az afrikai trypanosomiasis esetek többségét, az átvitelhez szükséges fő tartály az ember, míg a Trypanosoma brucei rhodesiense főleg zoonózisos, esetenként emberi fertőzéssel. Az afrikai trypanosomiasis függ a parazita (trypanosome) kölcsönhatásától a tsetse legyekkel (vektor), valamint a gazdával (a Trypanosoma brucei gambiense esetében az emberrel , és az állatokkal a Trypanosoma brucei rhodesiense -vel ). Az afrikai trypanosomiasis megbetegedésének kockázata attól függ, hogy kapcsolatba kerül -e fertőzött tsetse legysel.
Trypanosoma brucei
A parazita két alfaja felelős a betegség elindításáért az emberekben. Trypanosoma brucei gambiense okozza a betegségeket Nyugat- és Közép- Afrikában , mivel Trypanosoma brucei rhodesience korlátozott földrajzi tartományban, és ami felelős a betegség Kelet- és Dél-Afrikában. Ezenkívül a Trypanosoma brucei brucei néven ismert parazita harmadik alfaja felelős az állatok, de nem az emberek befolyásolásáért.
Az emberek a fő tározó T. b. gambiense, de ez a faj sertésekben és más állatokban is megtalálható. Vad vadak és szarvasmarhák a T. b. rhodesiense . Ezek a paraziták elsősorban a Szaharától délre fekvő Afrikában élő egyedeket fertőzik meg, mert ott található a vektor (tsetse fly). A betegség két emberi formája is nagymértékben eltérő intenzitású. T. b. A gambiense krónikus állapotot okoz, amely hónapokig vagy évekig passzív fázisban maradhat a tünetek megjelenése előtt, és a fertőzés körülbelül három évig tarthat a halál bekövetkezése előtt.
T. b. rhodesiense a heveny formában a betegség, és a halál is előfordulhat néhány hónapon belül, mivel a tünetek jelennek heteken belül, és ez több, virulens és gyorsabban fejlődő, mint a T. b. gambiense . Ezenkívül a tripanoszómákat bevonat veszi körül, amely változatos felületi glikoproteinekből (VSG) áll. Ezek a fehérjék védik a parazitát az emberi plazmában jelen lévő lítikus tényezőktől. A gazdaszervezet immunrendszere felismeri a parazita szőrén található glikoproteineket, amelyek különböző antitestek (IgM és IgG) termelődéséhez vezetnek .
Ezek az antitestek ezután elpusztítják a vér körül keringő parazitákat. A plazmában található számos parazita közül azonban néhányuk felületi rétegében változásokat tapasztal, amelyek új VSG -k kialakulását eredményezik. Így az immunrendszer által termelt antitestek már nem ismerik fel a proliferációhoz vezető parazitát, amíg új antitesteket nem hoznak létre az új VSG -k leküzdésére. Végül az immunrendszer nem lesz képes harcolni a parazitával a VSG állandó változása miatt, és fertőzés lép fel.
Vektor
| típus | Trypanosoma | terjesztés | V ector |
|---|---|---|---|
| Krónikus | T. brucei gambiense | Nyugat -Afrika |
G. palpalis
G. tachinoides G. morsitans |
| Akut | T. brucei rhodesiense | Kelet -Afrika |
G. morsitans
G. swynnertoni G. pallidipes G. fuscipes |
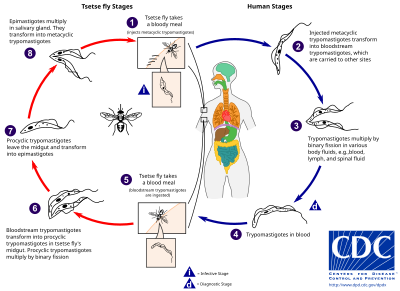
A tsetse légy ( Glossina nemzetség ) egy nagy, barna, harapós légy, amely mind a trippanoszóma paraziták gazdája, mind vektora . Miközben emlősállat -gazdától vért vesznek, a fertőzött tsetse légy metaciklusos trypomastigotot fecskendez a bőrszövetbe. A harapástól kezdve a paraziták először belépnek a nyirokrendszerbe, majd átjutnak a véráramba. Az emlős gazdaszervezetben a véráram trypomastigotgá alakulnak át, és a test más részeire szállítják őket, eljutnak más testnedvekhez (pl. Nyirok, gerincvelői folyadék), és tovább replikálódnak bináris hasadással .
Az afrikai trippanoszómák teljes életciklusát az extracelluláris szakaszok képviselik. A tsetse légy megfertőződik a véráramban lévő trypomastigotokkal, amikor véres ételt vesz egy fertőzött emlős gazdaszervezeten. A légy középbélében a paraziták prociklikus trypomastigotgá alakulnak át, bináris hasadással szaporodnak, elhagyják a középbélt és epimaszigótákká alakulnak. Az epimaszigóták elérik a légy nyálmirigyeit, és folytatják a szaporodást bináris hasadással.
A légy teljes életciklusa körülbelül három hetet vesz igénybe. A tsetse légy harapása mellett a betegséget a következők terjeszthetik:
- Anya-gyermek fertőzés: a tripanoszóma néha átjuthat a méhlepényen és megfertőzheti a magzatot.
- Laboratóriumok: véletlen fertőzések, például fertőzött személy vérének kezelése és szervátültetés révén, bár ez nem ritka.
- Vérátömlesztés
- Szexuális kapcsolat (ez lehetséges)
Bögölyök ( Tabanidae ) és stabil legyek ( Muscidae ) esetleg szerepet játszanak a továbbítása nagana (az állat formájában álomkór), és a humán betegség formájában.
Patofiziológia
A triptofol egy kémiai vegyület, amelyet a tripanoszomális parazita termel alvási betegségben, és amely alvást idéz elő emberekben.
Diagnózis

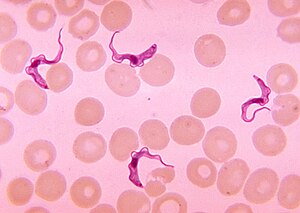
A diagnózis aranystandardja a trippanoszómák azonosítása a mintában mikroszkópos vizsgálattal. A diagnózishoz használható minták közé tartozik a chancre -folyadék, a nyirokcsomó -aspirátumok, a vér, a csontvelő és a neurológiai szakaszban a cerebrospinális folyadék . A tripanoszóma-specifikus antitestek kimutatása használható diagnosztizálásra, de ezeknek a módszereknek az érzékenysége és specificitása túl változó ahhoz, hogy önmagukban klinikai diagnózishoz lehessen használni. Továbbá a szerokonverzió a klinikai tünetek megjelenése után következik be egy T. b. rhodesiense fertőzés, ezért csak korlátozottan használható diagnosztikában.
A tripanoszómákat két különböző készítmény segítségével lehet kimutatni a mintákból. Nedves készítménnyel lehet keresni a mozgékony tripanoszómákat. Alternatív megoldásként rögzített (szárított) kenetet festhetünk Giemsa vagy Field technikájával, és mikroszkóp alatt megvizsgálhatjuk. Gyakran előfordul, hogy a parazita viszonylag kis mennyiségben fordul elő a mintában, ezért a paraziták koncentrálására szolgáló technikák alkalmazhatók a mikroszkópos vizsgálat előtt. Vérminták esetében ezek közé tartozik a centrifugálás, majd a buffy bevonat vizsgálata ; mini anioncsere/centrifugálás; és a kvantitatív buffy coat (QBC) technika. Más minták, például a gerincvelő esetében a koncentrációs technikák közé tartozik a centrifugálás, majd az üledék vizsgálata.
Három szerológiai vizsgálat is rendelkezésre áll a parazita kimutatására: a mikro-CATT (kártya-agglutinációs teszt trypanosomiasisra), wb-CATT és wb-LATEX. Az első szárított vért, míg a másik kettő teljes vérmintát használ. Egy 2002-es tanulmány megállapította, hogy a wb-CATT a leghatékonyabb a diagnózishoz, míg a wb-LATEX jobb vizsga olyan helyzetekben, amikor nagyobb érzékenységre van szükség.
Megelőzés
Jelenleg kevés az orvosilag kapcsolódó megelőzési lehetőség az afrikai trypanosomiasisra (azaz nincs immunitás elleni vakcina). Bár a tsetse légycsípés okozta fertőzésveszély csekély (becslések szerint kevesebb, mint 0,1%), a legjobb a rovarriasztó szerek használata, hosszú ujjú ruházat viselése, a tsetse-sűrű területek elkerülése, a bokormentesítési módszerek és a vadak levágása az érintett területek helyi lakosai számára a fertőzés elkerülésére szolgáló lehetőségek.
2000 júliusában határozatot hoztak a Páfrikai Tsetse és Trypanosomiasis felszámolási kampány (PATTEC) létrehozásáról. A kampány működik felszámolása a cecelégy vektort populáció szintjén, és ezt követően a protozoa-okozta betegség, a használata rovarirtóval impregnált célokat, fly csapdák, rovarirtóval kezelt szarvasmarha, ultra-alacsony dózisú emelők / föld a permetezés (SAT) a cecelégy nyugalmi oldalak és a steril rovar technika (SIT). A SIT használata Zanzibárban hatékonynak bizonyult a tsetse legyek teljes populációjának megszüntetésében, de drága volt, és viszonylag nem praktikus az afrikai trypanosomiasisban szenvedő endemikus országokban.
Egy szenegáli kísérleti program akár 99% -kal is csökkentette a tsetse légyállományt azáltal, hogy bevezette a gamma -sugárzással sterilizált hímlegyeket .
A rendszeres aktív megfigyelés, amely magában foglalja az új fertőzések észlelését és azonnali kezelését, valamint a tsetse légyirtás az alvási betegség kezelésére használt stratégia gerincét jelenti. A veszélyeztetett közösségek szisztematikus szűrése a legjobb megoldás, mivel az eseti szűrés nem praktikus az endémiás régiókban. A szisztematikus szűrés lehet mobil klinikák vagy rögzített szűrőközpontok, ahol a csapatok naponta utaznak a magas fertőzési arányú területekre. Az ilyen szűrővizsgálatok azért fontosak, mert a korai tünetek nem nyilvánvalóak vagy elég súlyosak ahhoz, hogy a gambiense betegségben szenvedők orvosi segítséget kérjenek, különösen a nagyon távoli területeken. Ezenkívül a betegség diagnosztizálása nehéz, és az egészségügyi dolgozók nem társíthatják az ilyen általános tüneteket a trypanosomiasishoz. A szisztematikus szűrés lehetővé teszi a betegség korai stádiumú kimutatását és kezelését, mielőtt a betegség előrehaladna, és eltávolítja a lehetséges emberi tartályt. A nyugat -afrikai alvási betegség szexuális átvitelének egyetlen esetét jelentették.
Kezelés
Első fázis
Az első stádiumú betegség kezelése fexinidazol szájon át vagy pentamidin injekció formájában T. b. gambiense . Az injekciós szuramint T. b. rhodesiense .
Második szakasz
A fexinidazol alkalmazható a TbG második szakaszában, ha a betegség nem súlyos. Ellenkező esetben a nifurtimox és az eflornitin kombinációját , a nifurtimox-eflornitin kombinációs kezelést (NECT) vagy önmagában az eflornitint tartalmazó kombináció hatékonyabbnak tűnik, és kevesebb mellékhatást eredményez. Ezek a kezelések, ha rendelkezésre állnak, helyettesíthetik a melarsoprolt . A NECT előnye, hogy kevesebb eflornitin -injekciót igényel.
Az intravénás melarsoprol korábban a második stádiumú (neurológiai fázisú) betegség standard kezelése volt, és mindkét típusnál hatékony. A Melarsoprol az egyetlen kezelés a második stádium T. b. rhodesiense ; azonban a befogadók 5% -ában halált okoz. Melarsoprol rezisztencia léphet fel.
Prognózis
Ha nem kezelik, T. b. A gambiense szinte mindig halálhoz vezet, és csak néhány személy bizonyult a hosszú távú 15 éves követés során, hogy túlélték a kezelés megtagadását. T. b. A rhodesiense , a betegség akutabb és súlyosabb formája, következetesen halálos, ha nem kezelik. A betegség előrehaladása nagymértékben változik a betegség formájától függően. Azoknál az egyéneknél, akiket T. b. gambiense , amely az összes bejelentett eset 98% -át teszi ki, egy személy hónapokig vagy akár évekig is megfertőződhet jelek és tünetek nélkül, amíg a betegség előrehaladott stádiumában van, amikor már késő a sikeres kezelés. A T. által érintett egyének számára . rhodesiense , amely az összes bejelentett eset 2% -át teszi ki, a tünetek a fertőzés után heteken vagy hónapokon belül jelentkeznek. A betegség előrehaladása gyors, és behatol a központi idegrendszerbe, rövid időn belül halált okozva.
Járványtan

2010-ben mintegy 9000 halálesetet okozott, az 1990-es 34 000-ről. 2000-től az alvási betegség miatt elvesztett fogyatékossággal kiigazított életév (9-10 év) 2,0 millió. 2010–2014 között becslések szerint 55 millió ember volt veszélyeztetve a gambiense afrikai trypanosomiasisra, és több mint 6 millió ember volt veszélyeztetve a rhodesiense afrikai trypanosomiasisra. 2014 -ben az Egészségügyi Világszervezet 3797 emberi afrikai trypanosomiasis esetet jelentett, amikor az előrejelzett esetek száma 5000 volt. A bejelentett esetek száma 2014 -ben 86% -kal csökkent a 2000 -ben bejelentett összes esethez képest.
A betegséget 37 országban, a Szaharától délre eső Afrikában regisztrálták. Rendszeresen előfordul Uganda délkeleti részén és Nyugat -Kenyában, és 2008 -ban több mint 48 000 afrikai embert ölt meg. A Kongói Demokratikus Köztársaság a világ leginkább érintett országa, amely a Trypanosoma brucei gambiense esetek 75% -át teszi ki . A veszélyeztetett népesség körülbelül 69 millió fő, és ennek egyharmada „nagyon magas” vagy „mérsékelt” kockázatú, a fennmaradó kétharmada pedig „alacsony” vagy „nagyon alacsony” kockázatú. A betegség által érintett emberek száma csökkent. Ilyenkor az alvási betegség megszüntetése lehetséges. Az Egészségügyi Világszervezet 2030 -ra tervezi az alvászavar felszámolását.
| Trypanosoma brucei gambiense | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Angola | 1498 | 2094 | 2406 | 1796 | 1274 | 2441 | 6726 | 8275 | 6610 | 5351 | 4546 | 4577 | 3621 | 3115 | 2280 | 1727 | 1105 | 648 | 517 | 247 | 211 | 154 | 70 | 69 | 36 | 35 | 19 | 18 | 79 | 30 |
| Benin | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Burkina Faso | 27 | 27 | 20 | 17 | 18 | 13 | 12 | 1 | 15 | 15 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| Kamerun | 86 | 69 | 21 | 3 | 20 | 21 | 17 | 10 | 54 | 32 | 27 | 14 | 32 | 33 | 17 | 3 | 15 | 7 | 13 | 24 | 16 | 15 | 7 | 6 | 7 | 6 | 6 | 5 | 7 | 17 |
| Közép-Afrikai Köztársaság | 308 | 197 | 362 | 262 | 368 | 676 | 492 | 730 | 1068 | 869 | 988 | 718 | 572 | 539 | 738 | 666 | 460 | 654 | 1194 | 1054 | 395 | 132 | 381 | 59 | 194 | 147 | 124 | 76 | 57 | 86 |
| Csád | 20 | 221 | 149 | 65 | 214 | 315 | 178 | 122 | 134 | 187 | 153 | 138 | 715 | 222 | 483 | 190 | 276 | 97 | 196 | 510 | 232 | 276 | 197 | 195 | 95 | 67 | 53 | 28 | 12 | 16 |
| Kongó | 580 | 703 | 727 | 829 | 418 | 475 | 474 | 142 | 201 | 91 | 111 | 894 | 1005 | 717 | 873 | 398 | 300 | 189 | 182 | 87 | 87 | 61 | 39 | 20 | 21 | 36 | 18 | 15 | 24 | 17 |
| Elefántcsontpart | 365 | 349 | 456 | 260 | 206 | 326 | 240 | 185 | 121 | 104 | 188 | 92 | 97 | 68 | 74 | 42 | 29 | 13 | 14 | 8 | 8 | 10 | 9 | 7 | 6 | 3 | 0 | 3 | 2 | 1 |
| Kongói Demokratikus Köztársaság | 7515 | 5825 | 7757 | 11384 | 19021 | 18182 | 19342 | 25094 | 26318 | 18684 | 16951 | 17300 | 13816 | 11459 | 10339 | 10249 | 8013 | 8155 | 7318 | 7178 | 5624 | 5590 | 5968 | 5647 | 3205 | 2351 | 1769 | 1110 | 660 | 604 |
| Egyenlítői-Guinea | 63 | 36 | 45 | 30 | 85 | 37 | 46 | 67 | 62 | 28 | 16 | 17 | 32 | 23 | 22 | 17 | 13 | 15 | 11 | 7 | 8 | 1 | 2 | 3 | 0 | 0 | 3 | 4 | 4 | 3 |
| Gabon | 80 | 45 | 33 | 80 | 61 | 20 | 32 | 11 | 6 | 38 | 45 | 30 | 26 | 26 | 49 | 53 | 31 | 30 | 24 | 14 | 22 | 17 | 9 | 17 | 10 | 9 | 10 | 9 | 16 | 8 |
| Ghána | 3 | 6 | 16 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Guinea | 52 | 29 | 24 | 27 | 26 | 33 | 38 | 88 | 99 | 68 | 52 | 72 | 132 | 130 | 95 | 94 | 48 | 69 | 90 | 79 | 68 | 57 | 70 | 78 | 33 | 29 | 107 | 140 | 74 | 69 |
| Mali | 0 | 0 | 0 | 27 | 17 | 11 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Nigéria | 24 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 27 | 14 | 14 | 26 | 31 | 10 | 21 | 3 | 0 | 0 | 0 | 2 | 3 | 2 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Dél Szudán | 67 | 58 | 28 | 62 | 69 | 56 | 157 | 737 | 1726 | 1312 | 1801 | 1919 | 3121 | 3061 | 1742 | 1853 | 789 | 469 | 623 | 373 | 199 | 272 | 317 | 117 | 63 | 45 | 17 | 12 | 17 | 11 |
| Menni | 2 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Uganda | 2066 | 1328 | 2042 | 1764 | 1469 | 1062 | 981 | 1123 | 971 | 1036 | 948 | 310 | 604 | 517 | 378 | 311 | 290 | 120 | 198 | 99 | 101 | 44 | 20 | 9 | 9 | 4 | 4 | 0 | 1 | 2 |
| Teljes | 12756 | 10987 | 14088 | 16607 | 23266 | 23671 | 28736 | 36585 | 37385 | 27862 | 25841 | 26095 | 23799 | 19941 | 17100 | 15624 | 11372 | 10466 | 10380 | 9680 | 6973 | 6632 | 7091 | 6228 | 3679 | 2733 | 2131 | 1420 | 953 | 864 |
| Trypanosoma brucei rhodesiense | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
| Kenya | 91 | 8 | 4 | 2 | 1 | 0 | 2 | 5 | 14 | 22 | 15 | 10 | 11 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Malawi | 228 | 195 | 143 | 53 | 31 | 15 | 8 | 7 | 10 | 11 | 35 | 38 | 43 | 70 | 48 | 41 | 58 | 50 | 49 | 39 | 29 | 23 | 18 | 35 | 32 | 30 | 37 | 7 | 15 | 91 |
| Mozambik | 3 | 7 | 24 | 10 | 16 | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | 1 | Nincs adat | 1 | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat |
| Uganda | 1417 | 832 | 606 | 503 | 342 | 497 | 178 | 217 | 283 | 283 | 300 | 426 | 329 | 338 | 335 | 473 | 261 | 119 | 138 | 129 | 112 | 84 | 71 | 43 | 70 | 28 | 10 | 13 | 4 | 5 |
| Tanzániai Egyesült Köztársaság | 187 | 177 | 366 | 262 | 319 | 422 | 400 | 354 | 299 | 288 | 350 | 277 | 228 | 113 | 159 | 186 | 127 | 126 | 59 | 14 | 5 | 1 | 4 | 1 | 1 | 2 | 3 | 3 | 0 | 3 |
| Zambia | 7 | Nincs adat | 4 | 1 | 1 | 1 | 3 | Nincs adat | Nincs adat | 15 | 9 | 4 | 5 | 15 | 9 | 7 | 6 | 10 | 13 | 4 | 8 | 3 | 6 | 6 | 12 | 8 | 2 | 3 | 5 | 15 |
| Zimbabwe | Nincs adat | Nincs adat | Nincs adat | Nincs adat | 1 | Nincs adat | Nincs adat | 9 | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | Nincs adat | 3 | Nincs adat | Nincs adat | 0 | 3 | 2 | 4 | 9 | 1 | 3 | 3 | 1 | 1 | 0 | 2 |
| Teljes | 1933 | 1219 | 1147 | 831 | 710 | 935 | 591 | 583 | 606 | 619 | 709 | 755 | 617 | 536 | 552 | 707 | 453 | 305 | 259 | 187 | 154 | 111 | 101 | 85 | 115 | 68 | 52 | 27 | 24 | 116 |
Történelem

Ez az állapot évezredek óta jelen van Afrikában. Az őslakosok közötti utazás hiánya miatt az emberek alvási betegségei elszigetelt zsebekre korlátozódtak. Ez megváltozott, miután arab rabszolga -kereskedők keletről, a Kongó folyót követően beléptek Közép -Afrikába , és parazitákat hoztak magukkal. A gambiai alvási betegség felfelé haladt a Kongó folyón, majd kelet felé.
Egy XIV. Századi arab író a következő leírást hagyta a Mali Királyság szultánja esetében: "A végét az alvó betegség ( illat an-nawm ) előzte meg, amely gyakran e lakosságot érinti. országok, különösen a főnökeik. Az alvás oly módon előzi meg egyiküket, hogy alig lehet felébreszteni. "
John Atkins brit haditengerészeti sebész leírta a betegséget, amikor 1734 -ben hazatért Nyugat -Afrikából:
A Sleepy Distemper (gyakori a négerek körében) nem ad más korábbi értesítést, mint étvágytalanságot 2 vagy 3 nappal azelőtt; az alvásuk egészséges, és az Érzékelés és az Érzés nagyon kevés; mert a húzás, csöpögés vagy ostorozás alig fogja felkavarni az érzéket és az erőt ahhoz, hogy mozogjon; és a pillanat, amikor abbahagyja az okosok verését, elfelejtődik, és lefelé ismét az Érzéketlenség állapotába esnek, és folyamatosan a Szájból hajtanak, mint a mély nyálban; lassan lélegezzen, de ne egyenlőtlenül és ne horkoljon. A fiatalok jobban ki vannak téve ennek, mint az öregek; és az általánosan kimondott ítélet a halál, a prognosztikus ritkán bukik el. Ha időnként valamelyikük meggyógyul, minden bizonnyal elveszíti azt az apró okot, ami megvolt, és megfordítja Ideot ...
Francia haditengerészeti sebész Marie-Théophile Griffon du Bellay kezelt és leírt esetek míg állomásozó fedélzetén a kórház hajót Caravane a Gabon a késő 1860-as évek.
1901-ben Ugandában pusztító járvány tört ki , amely több mint 250 000 embert ölt meg, köztük az érintett tóparti lakosság mintegy kétharmadát. A The Cambridge History of Africa szerint: "Becslések szerint az emberek fele fele halt meg alvási betegségben és himlőben Kongó alsó folyójának két partján ."
A kórokozót és a vektort David Bruce azonosította 1903 -ban , a protozoonok alfaját pedig 1910 -ben különböztették meg. Bruce korábban kimutatta, hogy a T. brucei volt a ló és szarvasmarha hasonló betegsége, amelyet a tsetse légy továbbított ( Glossina morsitans ).
Az első hatékony kezelést, az atoxilt , az arzén alapú gyógyszert, amelyet Paul Ehrlich és Kiyoshi Shiga fejlesztett ki , 1910 -ben vezették be, de a vakság súlyos mellékhatás volt.
A Suramint először Oskar Dressel és Richard Kothe szintetizálta 1916 -ban a Bayer számára . 1920 -ban vezették be a betegség első szakaszának kezelésére. 1922 -re a Suramint általában tripszarzamiddal (egy másik ötértékű organoarszenicus gyógyszerrel) kombinálták, az első gyógyszerrel, amely belépett az idegrendszerbe, és hasznos volt a gambiense forma második szakaszának kezelésében. Tryparsamide jelentette be a Journal of Experimental Medicine 1919-ben teszteltük a Belga Kongóban által Louise Pearce a Rockefeller Intézet 1920-ban is használták alatt a nagy járvány Nyugat- és Közép-Afrikában több millió ember volt a támasza a terápiát, amíg 1960 -as évek. Az amerikai orvosi misszionárius, Arthur Lewis Piper 1925 -ben aktívan használta a tryparsamidot alvási betegség kezelésére Belga Kongóban.
A pentamidint , a betegség első stádiumában rendkívül hatékony gyógyszert 1937 óta használják. Az 1950 -es években széles körben használták profilaktikus szerként Nyugat -Afrikában, ami a fertőzések arányának hirtelen csökkenéséhez vezetett. Akkoriban azt hitték, hogy a betegség felszámolása kéznél van.
Az 1940-es években kifejlesztett organoarzenikus melarsoprol (Arsobal) hatékony a második stádiumú alvási betegségben szenvedők számára. Azonban az injekciózottak 3–10% -a reaktív encephalopathiában (görcsök, progresszív kóma vagy pszichotikus reakciók) szenved, és az ilyen esetek 10–70% -a halált okoz; okozhat agykárosodást azok, akik túlélik a encephalopathia. Hatékonyságának köszönhetően azonban a melarsoprolt ma is használják. A melarsoprollal szembeni rezisztencia növekszik, és a nifurtimox kombinációs terápiát jelenleg kutatják.
Az eflornitint (difluormetilornitint vagy DFMO -t), a legmodernebb kezelést az 1970 -es években fejlesztette ki Albert Sjoerdsma, és az 1980 -as években klinikai vizsgálatoknak vetették alá. A gyógyszert az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala hagyta jóvá 1990-ben. Az Aventis , a gyártásáért felelős vállalat, 1999-ben leállította a termelést. 2001-ben az Aventis a Médecins Sans Frontières és az Egészségügyi Világszervezettel együttműködésben aláírt egy hosszú hosszú távú megállapodás a gyógyszer előállításáról és adományozásáról.
Az alvási betegség mellett a korábbi nevekben szerepelt a néger letargia, a maladie du sommeil (Fr), a Schlafkrankheit (Ger), az afrikai letargia és a kongói trypanosomiasis.
- A brit vezetésű Alvó Betegség Bizottság tsetse legyeket gyűjt, Uganda és Nyasaland , 1908-1913
Kutatás
A parazita genomját szekvenálták, és számos fehérjét azonosítottak a gyógyszeres kezelés lehetséges célpontjaiként. A genom elemzése azt is feltárta, hogy miért volt ilyen nehéz oltást előállítani erre a betegségre. A T. brucei több mint 800 gént tartalmaz, amelyek a fehérjéket a parazitákká „keverik”, hogy elkerüljék az immunrendszer észlelését.
A baktériumok géntechnológiával módosított formájának használatát vizsgálják, amely a kórokozók bélében természetes módon fordul elő.
A legújabb eredmények azt mutatják, hogy a parazita nem képes túlélni a véráramban a zászlaja nélkül . Ez a felismerés új szöget biztosít a kutatóknak a parazita támadására.
A trypanosomiasis elleni vakcinák kutatások alatt állnak.
Ezenkívül a Kábítószerek az elhanyagolt betegségekért kezdeményezés hozzájárult az afrikai alvási betegség kutatásához azáltal, hogy kifejlesztett egy fexinidazol nevű vegyületet . Ez a projekt eredetileg 2007 áprilisában indult, és 749 embert vettek fel a KDK -ban és a Közép -afrikai Köztársaságban . Az eredmények a betegség mindkét szakaszában bizonyították a hatékonyságot és a biztonságot, mind felnőtteknél, mind 6 évesnél idősebb és ≥ 20 kg súlyú gyermekeknél. Az Európai Gyógyszerügynökség 2018 novemberében jóváhagyta az Európán kívüli első és második stádiumú betegség kezelésére. A kezelést a KDK -ban 2018 decemberében hagyták jóvá.
Finanszírozás
A jelenlegi finanszírozási statisztikák szerint az emberi afrikai trypanosomiasis kinetoplasztid fertőzésekhez van csoportosítva. A kinoplasztidok a zászlós protozoák csoportjára utalnak. A kinetoplasztid fertőzések közé tartozik az afrikai alvási betegség, a Chagas -kór és a leishmaniasis. Összességében ez a három betegség 4,4 millió fogyatékossággal korrigált életévet (DALY) és további 70 075 halálesetet jelentett évente. A kinetoplasztid fertőzések esetében a teljes globális kutatási és fejlesztési finanszírozás megközelítőleg 136,3 millió dollár volt 2012 -ben. Mindhárom betegség, az afrikai alvási betegség, a Chagas -kór és a leishmaniasis mindegyike a finanszírozás körülbelül egyharmadát kapta, ami körülbelül 36,8 millió dollár volt. , 38,7 millió dollár, illetve 31,7 millió dollár.
Az alvási betegség esetében a finanszírozást alapkutatásra, gyógyszerkutatásra, oltásokra és diagnosztikára osztották fel. A legtöbb támogatást a betegség alapkutatására fordították; körülbelül 21,6 millió dollárt irányítottak erre az erőfeszítésre. Ami a terápiás fejlesztést illeti, körülbelül 10,9 millió dollárt fektettek be.
A kinetoplasztid fertőzések kutatásának és fejlesztésének legfőbb finanszírozói állami források. A finanszírozás mintegy 62% -a magas jövedelmű országokból, míg 9% -a alacsony és közepes jövedelmű országokból származik. A magas jövedelmű országok állami finanszírozása a legnagyobb hozzájárulás az elhanyagolt betegségkutatási erőfeszítésekhez. Az elmúlt években azonban a magas jövedelmű országokból származó finanszírozás folyamatosan csökkent; 2007-ben a magas jövedelmű országok adták a teljes finanszírozás 67,5% -át, míg 2012-ben a magas jövedelmű országok közpénzei csak a teljes finanszírozás 60% -át nyújtották a kinetoplasztid fertőzésekhez. Ez a csökkenő tendencia hiányt hagy más finanszírozók, például a jótékonysági alapítványok és a magán gyógyszergyárak számára.
Az afrikai alvási betegség és az elhanyagolt betegségek kutatása terén elért előrehaladás nagy része a többi nem állami finanszírozó eredménye. E fő finanszírozási források egyike olyan alapítványoktól származik, amelyek egyre inkább elkötelezettek a 21. századi elhanyagolt betegségkutatás iránt. 2012 -ben a jótékonysági források a teljes finanszírozás 15,9% -át biztosították. A Bill és Melinda Gates Alapítvány vezető szerepet játszott az elhanyagolt betegség elleni gyógyszerfejlesztés finanszírozásában. 2012 -ben 444,1 millió dollárt biztosítottak az elhanyagolt betegségek kutatására. Eddig több mint 1,02 milliárd dollárt adományoztak az elhanyagolt betegségfeltárási erőfeszítésekhez.
A kinetoplasztid fertőzésekre 2007 és 2011 között évente átlagosan 28,15 millió dollárt adományoztak. Az emberi afrikai trypanosomiasis-t nagy lehetőségnek minősítették, ami azt jelenti, hogy ez egy olyan betegség, amely a legnagyobb lehetőséget kínálja az ellenőrzésre, megszüntetésre és felszámolása új gyógyszerek, vakcinák, közegészségügyi programok és diagnosztika kifejlesztésével. Ezek az elhanyagolt betegségek második legmagasabb finanszírozási forrásai, közvetlenül az Egyesült Államok Nemzeti Egészségügyi Intézetei mögött. Abban az időben, amikor az állami finanszírozás csökken, és a tudományos kutatásokhoz nyújtott állami támogatások nehezebben szerezhetők be, a jótékonysági világ lépett a kutatás előmozdítására.
A megnövekedett érdeklődés és finanszírozás másik fontos összetevője az iparág. 2012-ben összesen 13,1% -kal járultak hozzá a kinetoplasztid kutatási és fejlesztési erőfeszítésekhez, emellett fontos szerepet játszottak azáltal, hogy hozzájárultak a köz-magán partnerségekhez (PPP), valamint a termékfejlesztési partnerségekhez (PDP). A köz- és magánszféra közötti partnerség egy vagy több közjogi szervezet és egy vagy több magánszervezet közötti megállapodás, amely meghatározott egészségügyi eredmény elérése vagy egészségügyi termék előállítása céljából létezik. A partnerség számos módon létezhet; pénzeszközöket, vagyont, felszerelést, emberi erőforrásokat és szellemi tulajdont oszthatnak meg és cserélhetnek. Ezeket a köz- és magánszféra közötti partnerségeket és termékfejlesztési partnerségeket azért hozták létre, hogy kezeljék a gyógyszeripar kihívásait, különösen az elhanyagolt betegségkutatással kapcsolatban. Ezek a partnerségek a különböző forrásokból származó különböző ismeretek, készségek és szakértelem felhasználásával növelhetik a terápiás fejlesztésre irányuló erőfeszítések mértékét. Az ilyen típusú partnerségek hatékonyabbnak bizonyultak, mint az ipar vagy az önállóan működő állami csoportok.
Más állatok és tározó
A rhodesiense és a gambiense típusú trypanosoma más állatokat is érinthet, például szarvasmarhákat és vadon élő állatokat. Az afrikai trypanosomiasist általában antroponotikus betegségnek tekintették, és ezért ellenőrzési programja elsősorban az átvitel megállítására összpontosított, emberi esetek kezelésével és a vektor eltávolításával. A jelentések szerint azonban az állati tározók fontos szerepet játszhatnak az afrikai trypanosomiasis endemikus természetében, valamint a nyugat- és közép -afrikai történelmi gócokban való újbóli megjelenésében.
Hivatkozások
Külső linkek
| Szkolion egy téma profilt afrikai álomkór . |
- "Az orvos álma" . stories.dndi.org . Letöltve: 2020. május 14 .
- "Alvó betegség" . Médecins Sans Frontières . 2013. október 23 -án archiválva az eredetiből .
- Linkek az alvó betegség képeihez (Hardin MD/ Iowai Egyetem )
- Hale Carpenter G (1920). Természettudós a Viktória-tónál, alvásbetegségről és a Tse-tse légyről . Unwin. OCLC 2649363 .
| Osztályozás | |
|---|---|
| Külső erőforrások |