Nucleus accumbens - Nucleus accumbens
| Nucleus accumbens | |
|---|---|
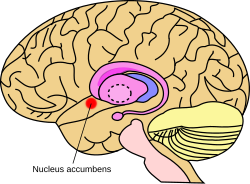 A sejtmag hozzávetőleges elhelyezkedése az agyban
| |
 Az egér agy nukleusz accumbensje
| |
| Részletek | |
| Része |
Mezolimbikus út Basalis ganglionok ( Ventral striatum ) |
| Alkatrészek | Nucleus accumbens héja Nucleus accumbens mag |
| Azonosítók | |
| latin | nucleus accumbens septi |
| Betűszavak | NAc vagy NAcc |
| Háló | D009714 |
| NeuroNames | 277 |
| NeuroLex azonosító | birnlex_727 |
| TA98 | A14.1.09.440 |
| TA2 | 5558 |
| FMA | 61889 |
| A neuroanatómia anatómiai feltételei | |
A nucleus accumbens ( NAc vagy NAcc ; továbbá ismert, mint a accumbensben mag , vagy korábban, mint a nucleus accumbens Septi , latin a „ mag szomszédos septum ”) egy régió a bazális előagy rostralis a preoptikus területen a hipotalamusz . A nucleus accumbens és a szaglógumó együttesen alkotja a hasi striatumot . A hasi striatum és a dorsalis striatum együttesen alkotják a striatumot , amely a bazális ganglionok fő összetevője . A dopaminerg neuronok a mezolimbikus pályát kivetítjük a GABAerg közepes tüskés neuronok a nucleus accumbens és a szaglószervi. Minden agyféltekének megvan a maga accumbens magja, amely két struktúrára osztható: a nucleus accumbens magra és a nucleus accumbens héjra. Ezek az alszerkezetek különböző morfológiával és funkciókkal rendelkeznek.
A különböző NAcc alrégiók (mag vs héj) és az egyes régiókon belüli neuron-alpopulációk ( D1 típusú vs D2 típusú közepes tüskés neuronok) felelősek a különböző kognitív funkciókért . Összességében a nucleus accumbensnek jelentős szerepe van a motiváció , az idegenkedés , a jutalom (azaz az ösztönző figyelem , az öröm és a pozitív megerősítés ) kognitív feldolgozásában és a megerősítő tanulásban (pl. Pavlov-instrumentális transzfer ); ezért jelentős szerepe van a függőségben . Ezenkívül a nucleus accumbens magjának egy része központi szerepet játszik a lassú alvás kiváltásában . A nucleus accumbens kisebb szerepet játszik a félelem (az idegenkedés egy formája), az impulzivitás és a placebo -hatás feldolgozásában . Részt vesz az új motorprogramok kódolásában is.
Szerkezet
A nucleus accumbens a neuronok összessége, amelyet külső héjjal és belső maggal írnak le.
Bemenet
A nucleus accumbens fő glutamatergikus bemenetei közé tartozik a prefrontális kéreg (különösen a prelimbicus kéreg és az infralimbicus kéreg ), a bazolaterális amygdala , a ventralis hippocampus , a thalamus magok (különösen a thalamus középső vonalú thalamikus magjai és intralamináris magjai ), valamint a ventralis glutamatergális projekciók terület (VTA). A nucleus accumbens dopaminerg bemeneteket kap a ventrális tegmentális területről, amelyek a mezolimbikus úton kapcsolódnak össze . A nucleus accumbens-t gyakran a cortico-bazális ganglionok-thalamo-corticalis hurok egyik részeként írják le .
A VTA dopaminerg bemenetei modulálják a GABAerg neuronok aktivitását a nucleus accumbensben. Ezeket az idegsejteket közvetlenül vagy közvetve euforáns gyógyszerek (pl. Amfetamin , opiátok stb.) Aktiválják , és jutalmazó élményekben (pl. Szex, zene, testmozgás, stb.) Vesznek részt.
Egy másik jelentős forrása a bemeneti származik a CA1 és a ventrális subiculum a hippocampus a dorsomediális területe nucleus accumbens. A nucleus accumbens sejtjeinek enyhe depolarizációja korrelál a hippocampus idegsejtjeinek pozitivitásával, izgatottabbá téve őket. A nucleus accumbens közepes tüskés idegsejtjeinek ezen izgatott állapotainak korrelált sejtjei egyenlő arányban oszlanak meg a subiculum és a CA1 között. A subiculum neuronok hiperpolarizálódnak (növelik a negativitást), míg a CA1 neuronok "hullámzanak" (tűz> 50 Hz) az alapozás elvégzése érdekében.
A nucleus accumbens azon kevés régiók egyike, amelyek hisztaminerg vetületeket kapnak a tuberomammilláris magból ( az agyban a hisztamin neuronok egyedüli forrása ).
Kimenet
A nucleus accumbens kimeneti neuronjai axonális vetületeket küldenek a bazális ganglionokba és a globus pallidus ventrális analógjába , amelyet ventral pallidum (VP) néven ismernek . A VP viszont a háti thalamus mediális dorsalis magjába vetül, amely a prefrontális kéregbe, valamint a ventrálisba és a dorsalis striatumba vetül ki . Egyéb efferensei a nucleus accumbens közé kapcsolatokat a farok a ventrális tegmentális területen , substantia nigra , és a formatio reticularis a pons .
Héj
A nucleus accumbens shell ( NAcc shell ) a nucleus accumbens alszerkezete. A héj és a mag együtt alkotják az egész magot.
Elhelyezkedés: A héj a nucleus accumbens külső régiója, és - ellentétben a maggal - a kiterjesztett amygdala részének tekinthető , amely a rostrális pólusán található.
Sejt típusok: A sejtmagban lévő neuronok többnyire közepes tüskés idegsejtek (MSN-ek), amelyek főként D1 típusú (azaz DRD1 és DRD5 ) vagy D2 típusú (azaz DRD2 , DRD3 és DRD4 ) dopaminreceptorokat tartalmaznak . Az MSN-ek egy alpopulációja egyaránt tartalmaz D1 típusú és D2 típusú receptorokat, a striatális MSN-ek körülbelül 40% -a expresszálja mind a DRD1, mind a DRD2 mRNS-t. Ezek a vegyes típusú NAcc MSN-ek mind D1 típusú, mind D2 típusú receptorokkal többnyire az NAcc héjra korlátozódnak. A héj idegsejtjei a maghoz képest alacsonyabb dendritikus tüskékkel , kevesebb terminális szegmenssel és kevesebb elágazási szegmenssel rendelkeznek, mint a magban. A héjneuronok a ventralis pallidum subcommissuralis részére , valamint a ventralis tegmentális területre, valamint a hypothalamus és a kiterjesztett amygdala kiterjedt területeire vetülnek.
Funkció: A nucleus accumbens héja részt vesz a jutalom kognitív feldolgozásában , beleértve a szubjektív "tetszés" -reakciókat bizonyos kellemes ingerekre , a motivációt , és a pozitív megerősítést . Az NAcc héjról kimutatták, hogy közvetíti a specifikus pavlovi-műszeres átvitelt is , amely jelenség egy klasszikusan kondicionált inger módosítja az operáns viselkedést . A "hedonikus hotspot" vagy örömközpont, amely felelős néhány belső jutalom kellemes vagy "tetszés" -komponenséért, szintén egy kis rekeszben található a mediális NAcc héjon belül. Az addiktív gyógyszerek nagyobb hatást gyakorolnak a dopamin felszabadulására a héjban, mint a magban.
Mag
A nucleus accumbens mag ( NAcc core ) a nucleus accumbens belső alszerkezete.
Elhelyezkedés: A nucleus accumbens magja a hasi striatum része, a bazális ganglionokban található. Sejt típusok: Az NAcc magját főként közepes tüskés idegsejtek alkotják, amelyek főként D1 típusú vagy D2 típusú dopamin receptorokat tartalmaznak. A D1 típusú közepes tüskés neuronok jutalommal kapcsolatos kognitív folyamatokat közvetítenek, míg a D2 típusú közepes tüskés neuronok az averzióval kapcsolatos megismerést közvetítik. A mag idegsejtjei a héj idegsejtjeihez képest megnövelt sűrűségű dendritikus tüskékkel, elágazó szegmensekkel és terminális szegmensekkel rendelkeznek. Az idegsejtek a magtól kezdve más szubkortikális területekre vetülnek, mint például a globus pallidus és a substantia nigra. A GABA az egyik fő neurotranszmitter a NAcc -ban, és a GABA receptorok is bőségesek.
Funkció: A nucleus accumbens magja részt vesz a motoros funkció kognitív feldolgozásában, ami a jutalommal és megerősítéssel, valamint a lassú alvás szabályozásával kapcsolatos . Pontosabban, a mag új motorprogramokat kódol, amelyek megkönnyítik egy adott jutalom megszerzését a jövőben. A közvetett útvonalú (azaz D2-típusú) neuronok az NAcc magban, amelyek együttesen expresszálják az adenozin A 2A receptorokat, aktivációfüggően elősegítik a lassú alvást. A NAcc magról azt is kimutatták, hogy közvetíti az általános pavlovi-műszeres átvitelt , egy olyan jelenséget, amelyben a klasszikusan kondicionált inger módosítja az operáns viselkedést.
Sejt típusok
Az NAcc idegsejtjeinek körülbelül 95% -a GABAerg közepes tüskés neuron (MSN), amely elsősorban vagy D1 típusú vagy D2 típusú receptorokat expresszál; a fennmaradó idegsejt -típusok körülbelül 1-2% -a nagy méretű aszpirin kolinerg interneuron , további 1-2% -a GABAerg interneuron. A héjban lévő GABAerg MSN -ekhez képest a magban lévők dendritikus tüskék, ágszegmensek és terminális szegmensek sűrűsége megnövekedett. Az idegsejtek a magtól kezdve más szubkortikális területekre vetülnek, mint például a globus pallidus és a substantia nigra. A GABA az egyik fő neurotranszmitter a NAcc -ban, és a GABA receptorok is bőségesek. Ezek az idegsejtek egyben a nucleus accumbens fő vetületi vagy kimeneti neuronjai is.
Neurokémia
Néhány olyan neurotranszmitter, neuromodulátor és hormon, amelyek a sejtmagban lévő receptorokon keresztül jeleznek:
Dopamin : A dopamin jutalmazó ingereknek , például szabadidős szereknek, például helyettesített amfetaminoknak , kokainnak , nikotinnak és morfinnak való kitettsége után szabadul fel az atommagba.
Fenetil -amin és tiramin : A fenetil -amin és a tiramin nyomelemek, amelyeket az aromás aminosav -hidroxiláz (AADC) enzimet expresszáló idegsejtekben szintetizálnak, beleértve az összes dopaminerg neuront. Mindkét vegyület működnek dopaminerg neuromodulátorként amelyek szabályozzák az újrafelvétel és dopamin felszabadulását a NAcc keresztül kölcsönhatások VMAT2 és TAAR1 a axonterminál a mezolimbikus dopamin neuronok.
Glükokortikoidok és dopamin: A glükokortikoid receptorok az egyetlen kortikoszteroid receptorok a nucleus accumbens héjában. Az L-DOPA , a szteroidok és kifejezetten a glükokortikoidok jelenleg ismert egyedüli ismert endogén vegyületek, amelyek pszichotikus problémákat idézhetnek elő, így a glükokortikoid-receptorok dopaminerg előrejelzéseinek hormonális kontrolljának megértése új kezelésekhez vezethet a pszichotikus tünetek kezelésére. Egy nemrégiben végzett tanulmány kimutatta, hogy a glükokortikoid receptorok elnyomása a dopamin felszabadulásának csökkenéséhez vezetett, ami jövőbeni, glükokortikoid-ellenes gyógyszerekkel kapcsolatos kutatásokhoz vezethet a pszichotikus tünetek enyhítésére.
GABA: A GABA agonistákat és antagonistákat használó patkányokon végzett nemrégiben végzett vizsgálat azt mutatta, hogy a NABC héjban lévő GABA A receptorok gátolják a dopamin által befolyásolt fordulási viselkedést, és a GABA B receptorok gátolják az acetilkolin által közvetített viselkedést .
Glutamát : A vizsgálatok kimutatták, hogy a glutamaterg NMDA receptorok helyi blokádjaa NAcc magban rontja a térbeli tanulást. Egy másik tanulmány kimutatta, hogy mind az NMDA, mind az AMPA (mindkettő glutamát receptor ) fontos szerepet játszik a műszeres tanulás szabályozásában.
Szerotonin (5-HT): Összességében az 5-HT szinapszisok bőségesebbek, és több szinaptikus kontaktusa van a NAcc héjában, mint a magban. Ezek is nagyobbak és vastagabbak, és több nagy sűrű maghólyagot tartalmaznak, mint a magban lévő társaik.
Funkció
Jutalom és megerősítés
A nucleus accumbens, amely a jutalmazási rendszer egyik része, fontos szerepet játszik a jutalmazó ingerek feldolgozásában, az inger erősítésében (pl. Étel és víz), valamint azokban, amelyek egyszerre jutalmaznak és erősítenek (addiktív drogok, szex és testmozgás). A sejtmagban lévő idegsejtek túlnyomó válasza a jutalmazó szacharózra a gátlás; ennek ellenkezője igaz az averz kinin beadására adott válaszként . A farmakológiai manipulációkból származó lényeges bizonyítékok arra is utalnak, hogy a neuronok ingerlékenységének csökkentése a nucleus accumbensben kifizetődő, mint például a μ-opioid receptor stimuláció esetén. A nucleus accumbens vér oxigénszinttől függő jele (BOLD) szelektíven növekszik a kellemes, érzelmeket felkeltő képek észlelése és a kellemes, érzelmi jelenetek mentális képei során. Mivel azonban a BOLD a regionális nettó gerjesztés és gátlás közvetett mértékének tekinthető, a BOLD mennyire nem méri a vegyértékfüggő feldolgozást. A limbikus régiókból származó sok NAcc bemenet és a motoros régiók erős NAcc kimenetei miatt Gordon Mogensen a nucleus accumbens -t a limbikus és motoros rendszer közötti interfészként írta le.

A nucleus accumbens ok -okozati összefüggésben áll az élvezet élményével. Mikro-opioid agonisták, δ-opioid agonisták vagy κ-opioid agonisták mikroinjekciói a mediális héj rostrodorzális kvadránsában fokozzák a "tetszést", míg a több caudalis injekció gátolhatja az undorító reakciókat, a tetszési reakciókat vagy mindkettőt. A nucleus accumbens azon országai, amelyek okozati szerepet játszhatnak az öröm előállításában, anatómiailag és kémiailag is korlátozottak, mivel az opioid agonisták mellett csak az endokannabinoidok fokozhatják a tetszést. A nucleus accumbens egészében a dopamin, a GABA -receptor agonista vagy az AMPA -antagonisták kizárólag a motivációt módosítják, míg ugyanez igaz az opioidokra és az endokannabinoidokra a hotspoton kívül, a mediális héjban. Van egy rostro-caudális gradiens az étvágygerjesztő és a félelmetes válaszok fokozására, amelyek közül az utóbbi hagyományosan úgy gondolja, hogy csak a D1 receptor funkciót igényli, az előbbi pedig mind a D1, mind a D2 funkciót. Ennek a megállapításnak az egyik értelmezése, a gátlási hipotézis azt állítja, hogy az accumbens MSN -ek (amelyek GABAerg) gátlása gátolja a downstream struktúrákat, lehetővé téve az étvágygerjesztő vagy fogyasztó viselkedés kifejezését. Az AMPA antagonisták és kisebb mértékben a GABA agonisták motivációs hatásai anatómiailag rugalmasak. A stresszes körülmények kibővíthetik a félelmet kiváltó régiókat, míg az ismerős környezet csökkentheti a félelmet kiváltó régió méretét. Ezenkívül az orbitofrontális kéreg (OFC) kérgi bemenete torzítja a választ az étvágygerjesztő viselkedésre, és az infralimbikus bemenet, amely egyenértékű az emberi szubgenualis cinguláris kéreggel, elnyomja a választ, függetlenül a valenciától.
A nucleus accumbens nem szükséges és nem elegendő a hangszeres tanuláshoz, bár a manipulációk befolyásolhatják az instrumentális tanulási feladatok teljesítményét. Az egyik feladat, ahol a NAcc léziók hatása nyilvánvaló, a Pavlovian-instrumentális transzfer (PIT), ahol egy meghatározott vagy általános jutalommal párosított jelzés fokozhatja az instrumentális választ. Az NAcc magjához tartozó elváltozások rontják a teljesítményt a leértékelés után, és gátolják az általános szja hatását. Másrészt a héj elváltozásai csak rontják a specifikus szja hatását. Úgy gondolják, hogy ez a megkülönböztetés tükrözi a fogyasztó és étvágygerjesztő kondicionált válaszokat az NAcc héjban és az NAcc magban.
A dorsalis striatumban dichotómiát figyeltek meg a D1-MSN-ek és a D2-MSN-ek között, az előbbi megerősítette és fokozta a mozgást, míg az utóbbi averzív és csökkentette a mozgást. Hagyományosan feltételezték, hogy ez a megkülönböztetés a nucleus accumbensre is vonatkozik, de a farmakológiai és optogenetikai vizsgálatok bizonyítékai ellentmondásosak. Ezenkívül az NAcc MSN -ek egy részhalmaza mind D1, mind D2 MSN -eket expresszál, és a D1 és D2 receptorok farmakológiai aktivációjának nem feltétlenül kell pontosan aktiválnia az idegpopulációkat. Míg a legtöbb tanulmány nem mutatja a D1 vagy D2 MSN-ek szelektív optogenetikus stimulációjának hatását a mozgásszervi aktivitásra, az egyik tanulmány a bazális mozgás csökkenéséről számolt be D2-MSN stimulációval. Míg két tanulmány beszámolt a kokain D2-MSN aktivációval járó csökkentett megerősítő hatásairól, egy tanulmány nem számolt be hatásról. A NAcc D2-MSN aktivációról szintén beszámoltak arról, hogy fokozza a motivációt, amint azt a PIT értékeli, és a D2 receptor aktivitás szükséges a VTA stimuláció megerősítő hatásaihoz. Egy 2018 -as tanulmány arról számolt be, hogy a D2 MSN aktiválása fokozta a motivációt a ventralis pallidum gátlásával, ezáltal gátolva a VTA -t.
Anyai viselkedés
Egy 2005 -ben elvégzett fMRI vizsgálat megállapította, hogy amikor az anya patkányok kölykeik jelenlétében voltak, az agy megerősítésében részt vevő régiói, beleértve a nucleus accumbens -t, nagyon aktívak voltak. A dopamin szintje megnő az atommagban az anyai viselkedés során, míg ezen a területen a léziók felborítják az anyák viselkedését. Amikor a nőknek nem rokon csecsemőkről készült képeket mutatnak be, az fMRI -k megnövekedett agyi aktivitást mutatnak a nucleus accumbensben és a szomszédos caudate magban, arányosan azzal, hogy a nők mennyire "aranyosnak" találják ezeket a csecsemőket.
Idegenkedés
A D1-típusú MSN-ek aktiválása a nucleus accumbensben a jutalomban rejlik, míg a D2-típusú MSN-ek aktiválása a nucleus accumbens-ben elősegíti az idegenkedést .
Lassú hullámú alvás
A késői 2017-tanulmányok rágcsálók, amelyek felhasznált optogenetic és chemogenetic módszereket találtuk, hogy a közvetett útvonal (azaz, D2-típusú) közepes tüskés neuronok a nucleus accumbens magot amelyek együtt expresszálják adenozin A2A receptorok és a projekt, hogy a ventrális pallidum részt vesznek a lassú alvás szabályozása . Különösen ezeknek a közvetett útvonalú NAcc magneuronoknak az optogenetikai aktiválása lassú hullámú alvást indukál, és ugyanazon idegsejtek kemogenetikus aktiválása növeli a lassú hullámú alvási epizódok számát és időtartamát. Ezen NAcc magneuronok kemogenetikus gátlása elnyomja az alvást. Ezzel szemben a D2 típusú, közepes tüskés idegsejtek az NAcc héjában, amelyek adenozin A 2A receptorokat expresszálnak, nem játszanak szerepet a lassú alvás szabályozásában.
Klinikai jelentőség
Függőség
A krónikus kábítószer -használatból származó függőség jelenlegi modelljei megváltoztatják a mezokortikolimbikus vetület génexpresszióját . A legfontosabb transzkripciós faktorok , amelyek ezeket a változásokat okozzák , a ΔFosB , a ciklikus adenozin -monofoszfát ( cAMP ) válaszelem -kötő fehérje ( CREB ) és a nukleáris faktor kappa B ( NFκB ). ΔFosB a legjelentősebb gén transzkripciós faktor függőség óta virális vagy genetikai túlexpressziója a nucleus accumbensben, a szükséges és elégséges sok a neurális adaptációk és viselkedési hatások (pl, expresszió dózisfüggő növekedését önigazgatása és jutalom szenzibilizáló ) látható drog függőség. A ΔFosB túlzott expressziója többek között az alkohol (etanol) , a kannabinoidok , a kokain , a metilfenidát , a nikotin , az opioidok , a fenciklidin , a propofol és a helyettesített amfetamin -függőséggel jár . A nucleus accumbens ΔJunD expressziójának növekedése csökkentheti, vagy nagymértékben akár blokkolhatja is a krónikus kábítószerrel való visszaélés során észlelt idegi elváltozások nagy részét (azaz a ΔFosB által közvetített elváltozásokat).
A ΔFosB fontos szerepet játszik a természetes jutalmakra, például az ízletes ételekre, a szexre és a testmozgásra adott viselkedési válaszok szabályozásában is. A természetes jutalmak, mint a visszaélés gyógyszerei, ΔFosB -t indukálnak a nucleus accumbens -ben, és ezeknek a jutalmaknak a krónikus megszerzése hasonló patológiás addiktív állapotot eredményezhet a ΔFosB túlexpresszió révén. Következésképpen a ΔFosB a legfontosabb transzkripciós tényező, amely a természetes jutalmak függőségében is szerepet játszik; különösen a ΔFosB a nucleus accumbens -ben kritikus fontosságú a szexuális jutalom megerősítő hatásai szempontjából. A természetes és gyógyszeres jutalmak közötti kölcsönhatás kutatása azt sugallja, hogy a pszichostimulánsok és a szexuális viselkedés hasonló biomolekuláris mechanizmusokra hatnak, hogy ΔFosB-t indukáljanak a nucleus accumbens-ben, és keresztérzékenyítő hatásokat fejtsenek ki, amelyeket a ΔFosB közvetít.
A gyógyszerjutalmakhoz hasonlóan a nem gyógyszeres jutalmak is növelik az extracelluláris dopamin szintjét a NAcc héjában. A kábítószer által kiváltott dopamin-felszabadulás az NAcc-héjban és az NAcc-magban általában nem hajlamos a szoktatásra (azaz a gyógyszer-tolerancia kialakulására : a dopamin-felszabadulás csökkenése a jövőbeni gyógyszer-expozícióból az ismételt gyógyszer-expozíció következtében); ellenkezőleg, a dopamin -felszabadulást kiváltó gyógyszerekkel való ismételt expozíció az NAcc héjában és magjában jellemzően szenzibilizációt eredményez (azaz a jövőbeni gyógyszer -expozíció következtében a NAcc -ban felszabaduló dopamin mennyisége megnő az ismételt gyógyszer -expozíció következtében). A dopamin-felszabadulás szenzibilizálása az NAcc-héjban az ismételt gyógyszeres expozíciót követően erősíti az inger-kábítószer-társulásokat (azaz a klasszikus kondicionálást, amely akkor következik be, amikor a kábítószer-használatot többször párosítják a környezeti ingerekkel), és ezek az asszociációk kevésbé hajlamosak a kihalásra (azaz „tanulás” ezek a klasszikusan kondicionált összefüggések a kábítószer -használat és a környezeti ingerek között nehezebbé válnak). Ismételt párosítás után ezek a klasszikusan kondicionált környezeti ingerek (pl. Összefüggések és tárgyak, amelyek gyakran párosulnak a kábítószer -használattal) gyakran kábítószer -jelzésekké válnak , amelyek a kábítószer -használat másodlagos megerősítőjeként működnek (azaz miután ezek az összefüggések létrejöttek, páros környezeti ingernek való kitettség) vágyat vagy vágyat vált ki a kábítószer használatára, amellyel kapcsolatban vannak ).
A drogokkal ellentétben a dopamin felszabadulása az NAcc héjában sokféle jutalmazó, nem gyógyszeres inger által általában megszokáson megy keresztül ismételt expozíció után (azaz a dopamin mennyisége, amely jutalmazó, nem gyógyszeres ingerek jövőbeni expozíciójából szabadul fel, általában csökken az adott inger ismételt expozíciója következtében).
| A neuroplaszticitás vagy viselkedési plaszticitás formája |
Erősítő típusa | Források | |||||
|---|---|---|---|---|---|---|---|
| Ópiátok | Pszichostimulánsok | Magas zsírtartalmú vagy cukros ételek | Nemi közösülés |
Fizikai gyakorlat (aerob) |
környezeti dúsítás |
||
|
ΔFosB expresszió a nucleus accumbens D1 típusú MSN - ekben |
↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |
| Viselkedési plaszticitás | |||||||
| A bevitel fokozása | Igen | Igen | Igen | ||||
| Pszichostimuláns keresztérzékenység |
Igen | Nem alkalmazható | Igen | Igen | Csillapított | Csillapított | |
| Pszichostimuláns önigazgatása |
↑ | ↑ | ↓ | ↓ | ↓ | ||
| Pszichostimuláns kondicionált helypreferencia |
↑ | ↑ | ↓ | ↑ | ↓ | ↑ | |
| A drogkereső magatartás visszaállítása | ↑ | ↑ | ↓ | ↓ | |||
| Neurokémiai plaszticitás | |||||||
|
CREB foszforiláció a nucleus accumbensben |
↓ | ↓ | ↓ | ↓ | ↓ | ||
| Érzékeny dopamin válasz a nucleus accumbensben |
Nem | Igen | Nem | Igen | |||
| Megváltozott striatális dopamin jelzés | ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD2 | ↑ DRD2 | ||
| Megváltozott striatális opioid jelzés | Nincs változás vagy ↑ μ-opioid receptorok |
↑ μ-opioid receptorok ↑ κ-opioid receptorok |
↑ μ-opioid receptorok | ↑ μ-opioid receptorok | Nincs változás | Nincs változás | |
| Változások a striatális opioid peptidekben | ↑ dynorphin Nincs változás: enkephalin |
↑ dinorfin | ↓ enkefalint | ↑ dinorfin | ↑ dinorfin | ||
| Mezokortikolimbikus szinaptikus plaszticitás | |||||||
| A dendritek száma a nucleus accumbensben | ↓ | ↑ | ↑ | ||||
|
A gerinc dendritikus sűrűsége a accumbens magban |
↓ | ↑ | ↑ | ||||
Depresszió
2007 áprilisában két kutatócsoport arról számolt be, hogy elektródákat illesztett be a nucleus accumbensbe annak érdekében, hogy mély agyi stimulációt használjon a súlyos depresszió kezelésére . 2010 -ben a kísérletek arról számoltak be, hogy a nucleus accumbens mély agyi stimulációja sikeresen csökkentette a depresszió tüneteit azon betegek 50% -ában, akik nem reagáltak más kezelésekre, például az elektrokonvulzív terápiára . A Nucleus accumbens-t célpontként is alkalmazták a terápia-refrakter kényszerbetegségben szenvedő betegek kis csoportjainak kezelésére.
Abláció
A függőség kezelésére és a mentális betegségek kezelésére kísérletet végeztek a nucleus accumbens rádiófrekvenciás ablációjával . Az eredmények meggyőzőek és ellentmondásosak.
Placebo hatás
Kimutatták, hogy a NAcc aktiválása a gyógyszer hatékonyságának előrejelzésében fordul elő, amikor a felhasználó placebót kap , ami azt jelzi, hogy a nucleus accumbens hozzájárul a placebo -hatáshoz .
További képek
Lásd még
Hivatkozások
Külső linkek
- A nucleus accumbens szerepe a jutalomkörben. Az "Agy felülről lefelé" része. a thebrain.mcgill.ca oldalon
- Nucleus Accumbens - sejtközpontú adatbázis
- Festett agyi szelet képek, amelyek közé tartozik a „nucleus% 20accumbens” a BrainMaps projekt






