Stevens -Johnson szindróma - Stevens–Johnson syndrome
| Stevens -Johnson szindróma | |
|---|---|
 | |
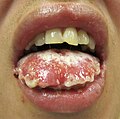
| Férfi Stevens -Johnson szindróma jellegzetes bőrelváltozásaival | |
| Különlegesség | Bőrgyógyászat |
| Tünetek | Láz, hólyagok , bőrhámlás, fájdalmas bőr, vörös szem |
| Szövődmények | Dehidratáció , szepszis , tüdőgyulladás , több szervi elégtelenség . |
| Szokásos kezdet | Kor <30 |
| Okoz | Bizonyos gyógyszerek, bizonyos fertőzések , ismeretlenek |
| Rizikó faktorok | HIV/AIDS , szisztémás lupus erythematosus , genetika |
| Diagnosztikai módszer | Az érintett bőr <10% -a, bőrbiopszia |
| Megkülönböztető diagnózis | Bárányhimlő , staphylococcus epidermolízis , staphylococcus leforrázott bőr szindróma , autoimmun bullous betegség |
| Kezelés | Kórházi kezelés, az ok megállítása |
| Gyógyszer | Fájdalomcsillapító gyógyszerek , antihisztaminok , antibiotikumok , kortikoszteroidok , intravénás immunglobulinok |
| Prognózis | Halálozás ~ 7,5% |
| Frekvencia | 1–2 / millió évente (a TEN -el együtt) |
A Stevens -Johnson -szindróma ( SJS ) a súlyos bőrreakciók egy fajtája . A toxikus epidermális nekrolízissel (TEN) és a Stevens – Johnson/toxikus epidermális nekrolízissel (SJS/TEN) együtt a betegség spektrumát képezi , az SJS kevésbé súlyos. Az erythema multiforme (EM) általában külön állapotnak tekinthető. Az SJS korai tünetei közé tartozik a láz és az influenzaszerű tünetek . Néhány nappal később a bőr elkezd hólyagosodni és hámlani, fájdalmas nyers területeket képezve. A nyálkahártyák , például a száj is jellemzően érintettek. A szövődmények közé tartozik a kiszáradás , a szepszis , a tüdőgyulladás és a több szervi elégtelenség .
A leggyakoribb ok bizonyos gyógyszerek, például lamotrigin , karbamazepin , allopurinol , szulfonamid antibiotikumok és nevirapin . Egyéb okok lehetnek fertőzések, például Mycoplasma pneumoniae és citomegalovírus , vagy az ok ismeretlen maradhat. A kockázati tényezők közé tartozik a HIV/AIDS és a szisztémás lupus erythematosus .
A Stevens -Johnson szindróma diagnózisa a bőr kevesebb mint 10% -ának érintettségén alapul. TEN néven ismert, amikor a bőr több mint 30% -a érintett, és köztes formának tekinthető, ha 10–30% -a érintett. Az SJS/TEN reakciók vélhetően egy IV. Típusú túlérzékenységi mechanizmust követnek . Az eozinofíliával és szisztémás tünetekkel (DRESS -szindróma), akut generalizált exantematózus pustulózissal (AGEP) és toxikus epidermális nekrolízissel járó gyógyszerreakcióba is beletartozik az ismert súlyos bőrreakciók (SCAR -ok) csoportjában.
A kezelés jellemzően kórházban történik , például égési osztályon vagy intenzív osztályon . Az erőfeszítések közé tartozhat az ok leállítása, fájdalomcsillapítás , antihisztaminok , antibiotikumok , intravénás immunglobulinok vagy kortikoszteroidok . A TEN -vel együtt az SJS évente 1–2 embert érint milliomonként. A tipikus megjelenés 30 év alatti. a teljes gyógyulás azonban hónapokig is eltarthat. Összességében az SJS halálának kockázata 5-10%.
jelek és tünetek
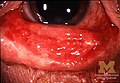
SJS általában kezdődik láz , torokfájás, és a fáradtság , amely általánosan téves diagnózis, ezért antibiotikumokkal kezelik. Az SJS, SJS/TEN és TEN tüneteit gyakran láz, torokfájás, köhögés és égő szemek jelzik 1-3 napig. Az ilyen rendellenességekben szenvedő betegek gyakran égető fájdalmat éreznek bőrükben a betegség kezdetén. Fekélyek és egyéb elváltozások kezdenek megjelenni a nyálkahártyákon, szinte mindig a szájban és az ajkakon, de a nemi szervekben és az anális régióban is. A szájban lévők általában rendkívül fájdalmasak, és csökkentik a beteg étkezési vagy ivási képességét. A kötőhártya -gyulladás az SJS -ben szenvedő gyermekek körülbelül 30% -ánál fordul elő. Körülbelül egy hüvelyk méretű kerek sérülések kiütése jelentkezik az arcon, a törzsön, a karokon és a lábakon, valamint a talpon, de általában nem a fejbőrön.
Nyálkahártya -hámlás Stevens -Johnson szindrómában szenvedő személynél
Konjunktivitisz SJS -ben
Okoz
Úgy gondolják, hogy az SJS az immunrendszer rendellenességéből származik. Az immunreakciót gyógyszerek vagy fertőzések válthatják ki. A genetikai tényezők az SJS -re való hajlamhoz kapcsolódnak. Az SJS oka az esetek negyedében-felében ismeretlen. Az SJS, SJS/TEN és TEN egyetlen betegségnek tekinthető, amelynek közös okai és mechanizmusai vannak.
Azok az egyének, akik bizonyos humán leukocita-antigén (azaz HLA) szerotípusokat (azaz genetikai allélokat ), genetikai alapú T-sejt-receptorokat, vagy hatékonyságuk eltéréseit fejezik ki , hogy felszívják , elosztják a szövetekben , metabolizálják vagy kiválasztják (ezt a kombinációt ADME- nek nevezik ), hajlamos az SJS kifejlesztésére.
Gyógyszerek
Bár az SJS -t vírusos fertőzések és rosszindulatú daganatok okozhatják, a fő ok a gyógyszerek. Vezető oknak tűnik az antibiotikumok , különösen a szulfa gyógyszerek alkalmazása . 100 és 200 között különböző gyógyszerek köthetők az SJS -hez. Nem létezik megbízható teszt, amely egy adott esetben kapcsolatot hozna létre egy adott gyógyszer és az SJS között. Annak megállapítása, hogy melyik gyógyszer az oka, a gyógyszer első használata és a bőrreakció kezdete közötti időintervallumon alapul. A nyálkahártya -fizikai leletek megjelenése előtt több mint 1 hónappal abbahagyott gyógyszerek nagy valószínűséggel nem okoznak SJS -t és TEN -t. Az SJS és a TEN leggyakrabban 4-28 nappal a bűnös gyógyszer beadása után kezdődik. A közzétett algoritmus (ALDEN) a kábítószer -okozati összefüggések felmérésére strukturált segítséget nyújt a felelős gyógyszer azonosításában.
SJS okozhatja a gyógyszerek rivaroxabanra , vankomicin , allopurinol , valproát , levofloxacin , diklofenak , etravirin , izotretinoin , flukonazol , valdekoxib , szitagliptin , oszeltamivir , penicillinek , barbiturátok , szulfonamidok , fenitoin , azitromicin , oxkarbazepin , zoniszamid , modafinil , lamotrigin , nevirapin , pirimetamin , ibuprofen , etoszuximid , karbamazepin , bupropion , telaprevir és nisztatin .
Azok a gyógyszerek, amelyekről hagyományosan ismert, hogy SJS -hez, erythema multiforme -hez és toxikus epidermális nekrolízishez vezetnek, a szulfonamid antibiotikumok, penicillin antibiotikumok, cefixim (antibiotikum), barbiturátok (nyugtatók), lamotrigin , fenitoin (pl. Dilantin ) ( görcsoldók ) és trimetoprim. A lamotrigin és nátrium -valproát kombinációja növeli az SJS kockázatát.
A nem szteroid gyulladáscsökkentők (NSAID-ok) ritka oka az SJS-nek felnőtteknél; a kockázat nagyobb az idősebb betegeknél, nőknél és a kezelést megkezdőknél. Jellemzően a gyógyszer okozta SJS tünetei a gyógyszeres kezelés megkezdését követő egy héten belül jelentkeznek. Az NSAID -okhoz hasonlóan a paracetamol (acetaminofen) is ritka SJS -es eseteket okozott. A szisztémás lupus erythematosusban vagy HIV- fertőzésben szenvedők hajlamosabbak a gyógyszerek által kiváltott SJS-re.
Fertőzések
Az SJS és a TEN második leggyakoribb oka a fertőzés, különösen gyermekeknél. Ide tartoznak a felső légúti fertőzések , a középfülgyulladás , a torokgyulladás és az Epstein -Barr vírus , a Mycoplasma pneumoniae és a citomegalovírus fertőzések. Az olyan gyógyszerek rutinszerű alkalmazása, mint az antibiotikumok , lázcsillapítók és fájdalomcsillapítók a fertőzések kezelésére, megnehezítheti annak megállapítását, hogy az eseteket a fertőzés vagy az alkalmazott gyógyszerek okozták -e.
Az SJS -t okozó vírusos betegségek a következők: herpes simplex vírus (valószínűleg; vitatott), AIDS , coxsackievirus , influenza , hepatitis és mumpsz .
Gyermekgyógyászati esetekben az Epstein-Barr vírust és az enterovírusokat társították az SJS-hez.
Az SJS -ben szenvedő betegek több mint fele számolt be a legújabb felső légúti fertőzésekről.
Az SJS-hez kapcsolódó bakteriális fertőzések közé tartozik az A csoportba tartozó béta-hemolitikus streptococcusok, diftéria , brucellózis , lymphogranuloma venereum , mycobacteriumok , Mycoplasma pneumoniae , rickettsialis fertőzések , tularemia és tífusz .
A kokcidioidomycosis , dermatophytosis és hisztoplazmózis gombás fertőzéseit szintén lehetséges okoknak tekintik. Malária és trichomoniasis , protozoális fertőzések is jelentettek okokat.
Patofiziológia
Az SJS egy IV. Típusú túlérzékenységi reakció, amelyben egy gyógyszer vagy metabolitja stimulálja a citotoxikus T -sejteket (azaz CD8 + T -sejteket) és a T -segítő sejteket (azaz a CD4 + T -sejteket), hogy autoimmun reakciókat indítsanak, amelyek megtámadják az önszöveteket. Ez különösen egy IV. Típusú, IVc. Altípusú késleltetett túlérzékenységi reakció, amely részben a természetes gyilkos sejtek szövetkárosító hatásaitól függ . Ez ellentétben áll az egyéb típusú SCAR-rendellenességekkel, azaz a DRESS-szindrómával, amely IV. Típusú, IVb. Altípus, a túlérzékenységi gyógyszerreakció, amely részben az eozinofilek szövetkárosító hatásától és az akut generalizált exanthematózus pustulózistól függ, amely IV. Típusú altípus. IVd, túlérzékenységi reakció, amely részben a neutrofilek szövetkárosító hatásától függ .
Más SCAR-indukáló gyógyszerekhez hasonlóan az SJS-indukáló gyógyszerek vagy metabolitjaik is stimulálják a CD8 + T-sejteket vagy a CD4 + T-sejteket, hogy autoimmun válaszokat indítsanak . Tanulmányok azt mutatják, hogy a gyógyszer vagy metabolitjai ennek elérésének mechanizmusa magában foglalja a veleszületett immunrendszer antigén -bemutatási útjainak felborítását . A gyógyszer vagy metabolitja kovalensen kötődik egy gazdaproteinnel, és nem önálló, gyógyszerrel kapcsolatos epitópot képez . Egy antigénbemutató sejt (APC) veszi fel ezeket az alter fehérjéket; kis peptidekké emészti őket; a peptideket horonyba helyezi a fő hisztokompatibilitási komplexük (azaz az MHC) humán leukocita antigén (azaz HLA) összetevőjén ; és bemutatja az MHC-hez kapcsolódó peptideket a CD8 + T-sejtek vagy CD4 + T-sejtek T-sejt-receptoraihoz . Azok a peptidek, amelyek valamely HLA fehérjeformájukon ( HLA-A , HLA-B , HLA-C , HLA-DM , HLA-DO , HLA-DP , HLA-DQ vagy HLA-DR ) kötődhet egy T-sejt-receptorhoz, és ezáltal stimulálja a receptort hordozó szülő T-sejtet, hogy támadásokat indítson az önszövetek ellen. Alternatív megoldásként egy gyógyszer vagy metabolitja stimulálhatja ezeket a T-sejteket úgy, hogy a HLA-fehérje hornyába illeszkedik, hogy nem önálló epitópként szolgáljon, vagy ezen a horonyon kívül kötődve megváltoztassa a HLA-fehérjét úgy, hogy nem önálló epitópot képezzen. Mindezekben az esetekben azonban egy nem önálló epitópnak kötődnie kell egy specifikus HLA szerotípushoz (azaz variációhoz) a T-sejtek stimulálása érdekében. Mivel az emberi populáció mintegy 13 000 különböző HLA szerotípust expresszál, míg az egyén csak töredékét, és mivel egy SJS-indukáló gyógyszer vagy metabolit csak egy vagy néhány HLA szerotípussal lép kölcsönhatásba, a gyógyszer SCAR-ok előidézésére való képessége azon személyekre korlátozódik, akik expresszálja a gyógyszer vagy metabolitja által megcélzott HLA szerotípusokat. Ennek megfelelően csak ritka egyének hajlamosak arra, hogy SCAR -ok alakuljanak ki egy adott gyógyszerre válaszul a HLA szerotípusok kifejezése alapján: A vizsgálatok számos HLA szerotípust azonosítottak , amelyek bizonyos gyógyszerekre adott válaszként az SJS, SJS/TEN vagy TEN kialakulásához kapcsolódnak . Általában ezek az egyesületek az idézett populációkra korlátozódnak.
Néhány vizsgált kelet-ázsiai populációban ( han kínai és thai ) a karbamazepin és fenitoin által indukált SJS szorosan összefügg a HLA-B*1502 ( HLA-B75 ), a szélesebb HLA-B15 szerotípus HLA- B szerotípusával . Egy európai tanulmány szerint a génmarker csak a kelet -ázsiaiak szempontjából releváns. Ennek klinikai jelentősége van, mivel egyetértés van abban, hogy mielőtt kínai származású betegnél elkezdenének gyógyszert, például allopurinolt, mérlegelni kell a HLA-B*58: 01 vizsgálatot.
Az ázsiai eredmények alapján Európában hasonló vizsgálatok kimutatták, hogy az allopurinollal indukált SJS/TEN betegek 61% -a hordozza a HLA -B58 -at ( a B*5801 allél fenotípus gyakorisága európaiakban jellemzően 3%). Egy tanulmány arra a következtetésre jutott: "Még akkor is, ha a HLA-B allélok erős kockázati tényezőkként viselkednek, mint az allopurinol esetében, nem elegendőek és nem szükségesek a betegség magyarázatához."
Az SJS, SJS/TEN vagy TEN kifejlődésével, valamint bizonyos populációkban meghatározott gyógyszerek bevitelével kapcsolatos egyéb HLA -asszociációk a SCAR -okkal rendelkező HLA -asszociációkban találhatók .
T-sejt receptorok
Amellett, hogy egy gyógyszer vagy metabolitja a HLA fehérjéken keresztül kötődik a T-sejt receptorhoz, megkerülheti a HLA fehérjéket, hogy közvetlenül kötődjön a T-sejt receptorhoz, és ezáltal stimulálja a CD8 + T vagy CD4 + T sejteket, hogy autoimmun válaszokat indítsanak. Mindkét esetben úgy tűnik, hogy ez a kötődés csak bizonyos T -sejt receptorokon alakul ki. Mivel ezeknek a receptoroknak a génjei erősen szerkesztettek , azaz megváltoztak, hogy különböző aminosavszekvenciájú fehérjéket kódoljanak, és mivel az emberi populáció több mint 100 billió különböző (azaz különböző aminosavszekvencia) T-sejt-receptort képes kifejezni, míg az egyén csak egy ezeknek a töredéke, egy gyógyszer vagy metabolitja a DRESS -szindróma T -sejtreceptorral való kölcsönhatás révén történő kiváltására képes azon személyekre korlátozódik, akiknek T -sejtjei olyan T -sejt -receptort expresszálnak, amely kölcsönhatásba léphet a gyógyszerrel vagy annak metabolitjával. Így csak ritka egyének hajlamosak arra, hogy SJS-t fejtsenek ki egy adott gyógyszerre adott T-sejt-receptor típusok expressziójuk alapján. Míg az alátámasztó bizonyítékok ez a T-sejt-receptor szelektivitás korlátozott, az egyik tanulmány szerint a preferenciális jelenléte a TCR-Vb és komplementaritást meghatározó régió 3 a T-sejt-receptorok találhatók a T-sejtek a hólyagok betegek allopurinol által kiváltott DRESS szindróma. Ez a megállapítás összeegyeztethető azzal az elképzeléssel, hogy a T-sejt-receptorok bizonyos típusai részt vesznek a specifikus gyógyszerek által kiváltott SCAR-ok kifejlesztésében.
ADME
Az ADME változásai , azaz az egyén hatékonysága a gyógyszer felszívódásában, szöveti eloszlásában, metabolizálásában vagy kiválasztásában különböző súlyos bőrre gyakorolt mellékhatások (SCARS), valamint más típusú mellékhatások esetén fordul elő . Ezek az eltérések befolyásolják a gyógyszerek vagy metabolitjaik szintjét és időtartamát a szövetekben, és ezáltal befolyásolják a gyógyszer vagy metabolit ezen reakciók kiváltására való képességét. Például a CYP2C9 fontos gyógyszer-metabolizáló citokróm P450 ; metabolizálja és ezáltal inaktiválja a fenitoint . Azok a tajvani, japán és malajziai egyének, akik a CYP2C9 CYP2C9*3 variánsát expresszálják, és amely a vad típusú (azaz CYP2c9*1) citokrómhoz képest csökkent metabolikus aktivitást mutat , megnövekedett a fenitoin vérszintje és magas az SJS előfordulása (valamint SJS/TEN és TEN) a gyógyszer bevétele során. A gyógyszer-metabolizáló enzimek rendellenességei mellett a vese-, máj- vagy emésztőrendszeri diszfunkciók, amelyek növelik a SCAR-indukáló gyógyszerek vagy metabolitok szintjét, javasolják az SCAR-válaszok elősegítését. Ezek az ADME -rendellenességek - azt is javasolják - kölcsönhatásba léphetnek bizonyos HLA fehérjékkel és T -sejt receptorokkal, hogy elősegítsék a SCAR -rendellenességet.
Diagnózis
A diagnózis a bőr kevesebb mint 10% -ának érintettségén alapul. TEN néven ismert, amikor a bőr több mint 30% -a érintett, és egy köztes forma 10–30% -os érintettséggel. A pozitív Nikolsky -jel segít az SJS és a TEN diagnosztizálásában. A bőrbiopszia hasznos, de nem kötelező az SJS és a TEN diagnózisának megállapításához.
Patológia
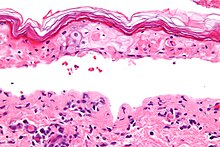
Az SJS -t, mint a TEN -t és az erythema multiforme -ot, az összefolyó epidermális nekrózis jellemzi , minimális gyulladással. Az élesség a stratum corneum (normál) kosárszövési mintázatából nyilvánvaló .
Osztályozás
A Stevens -Johnson szindróma (SJS) a toxikus epidermális nekrolízis (TEN) enyhébb formája . Ezeket a feltételeket először 1922 -ben ismerték fel. Az 1993 -ban először közzétett osztályozás, amelyet konszenzusos definícióként fogadtak el, azonosítja a Stevens -Johnson -szindrómát, a toxikus epidermális nekrolízist és az SJS/TEN átfedést. Mindhárom része a súlyos bőrreakciók (SCAR) spektrumának, amelyek hatással vannak a bőrre és a nyálkahártyákra. Az SJS, SJS/TEN átfedés és a TEN közötti megkülönböztetés az elváltozások típusán és a hólyagokkal és erózióval járó testfelületen alapul. Egyetértés van abban, hogy a legmegbízhatóbb módszer az EM, SJS és TEN osztályozására az elváltozás morfológiáján és az epidermális leválás mértékén alapul. A hólyagok és eróziók a test 3–10% -át fedik le SJS -ben, 11–30% -ban SJS/TEN átfedésben, és több mint 30% -át TEN -ben. A bőr minta leggyakrabban társított SJS elterjedt, gyakran csatlakozott (vagy megérinti összefolyt) papuric foltok ( foltok ) vagy sima kis hólyagok vagy nagy hólyagok , amelyek szintén csatlakoznak egymáshoz. Ezek elsősorban a törzsön fordulnak elő .
Az SJS, TEN és SJS/TEN átfedések összetéveszthetők az erythema multiforme -nal . Az erythema multiforme, amely szintén a SCAR spektrumon belül van, klinikai mintázatában és etiológiájában különbözik. Bár mind az SJS, mind a TEN fertőzéseket okozhat, ezek leggyakrabban a gyógyszerek káros hatásai.
Megelőzés
Javasolt vagy tanulmányozás alatt áll az egyének szűrése bizonyos hajlamosító génváltozatokra, mielőtt bizonyos SJS-, TEN/SJS- vagy TEN-indukáló gyógyszerekkel történő kezelést elkezdenének. Ezek az ajánlások jellemzően azokra a populációkra korlátozódnak, amelyek jelentős esélyt mutatnak a jelzett génvariáns meglétére, mivel a rendkívül alacsony előfordulási gyakoriságú populációk szűrése költséghatékonynak minősül. Azokat a személyeket, akik egy jelzett gyógyszerrel szembeni érzékenységgel kapcsolatos HLA allélt expresszálnak, nem szabad ezzel a gyógyszerrel kezelni. Ezek az ajánlások a következőket tartalmazzák. A karbamazepin-kezelés előtt a tajvani és az amerikai élelmiszer- és gyógyszerügyi hatóságok bizonyos ázsiai csoportokban a HLA-B*15: 02 szűrését javasolják. Ezt Tajvanon, Hongkongban, Szingapúrban és számos orvosi központban, Thaiföldön és Kínában hajtották végre. Az allopurinollal való kezelés előtt az American College of Rheumatology köszvény kezelésére vonatkozó irányelvei a HLA-B*58: 01 szűrést javasolják. Ezt számos orvosi központban biztosítják Tajvanon, Hongkongban, Thaiföldön és Kínában. Az abakavir-kezelés előtt az USA Food and Drug Administration javasolja a HLA-B*57: 01 szűrését kaukázusi populációkban. Ezt a szűrést széles körben alkalmazzák. Azt is javasolták, hogy minden olyan személy, aki ezt a HLA szerotípust expresszálja, kerülje az abakovir -kezelést. A jelenlegi vizsgálatok Tajvanon folynak annak érdekében, hogy meghatározzák a fenitoin elkerülésének költséghatékonyságát az SJS, SJS/TEN és TEN esetében a CYP2C9*3 allélját kifejező egyének esetében.
Kezelés
Az SJS bőrgyógyászati vészhelyzetet jelent. A dokumentált Mycoplasma fertőzésben szenvedő betegek orális makroliddal vagy orális doxiciklinnel kezelhetők .
Kezdetben a kezelés hasonló a betegek égési sérülések, és a folyamatos ellátás csak támogató (pl intravénás folyadékot és nazogasztrikus vagy parenterális táplálás ) és tüneti (pl, fájdalomcsillapító szájöblítő a szájfekély ). A bőrgyógyászok és sebészek általában nem értenek egyet abban, hogy a bőrt le kell -e csupaszítani .
Az ilyen típusú támogató ellátáson túl az SJS kezelése nem fogadható el. A kortikoszteroidokkal való kezelés ellentmondásos. A korai retrospektív vizsgálatok azt sugallták, hogy a kortikoszteroidok növelik a kórházi tartózkodást és a szövődmények arányát. Az SJS esetében nem végeztek randomizált kortikoszteroid -vizsgálatokat, és ezek nélkül sikeresen kezelhető.
Más szereket is alkalmaztak, beleértve a ciklofoszfamidot és a ciklosporint , de egyik sem mutatott nagy terápiás sikert. Az intravénás immunglobulin -kezelés ígéretesnek bizonyult a reakció hosszának csökkentésében és a tünetek javításában. Egyéb gyakori szupportív tartalmazzák a lokális fájdalom érzéstelenítők és antiszeptikumok , fenntartása meleg környezetben, és intravénás analgetikumok.
Egy szemész konzultálni kell azonnal, amint SJS gyakran okoz a hegszövet belsejében a szemhéj, ami a szaruhártya vascularizatio látászavarokhoz, és számos más szemészeti problémák. Az SJS által okozott krónikus szemfelszíni betegségben szenvedők némi javulást tapasztalhatnak a PROSE kezelés ( a szemfelszíni ökoszisztéma kezelésének protézisének cseréje ) során.
Prognózis
Az SJS (a testfelület kevesebb, mint 10% -a) halálozási aránya körülbelül 5%. A toxikus epidermális nekrolízis (TEN) halálozási aránya 30–40%. A halál kockázatát a SCORTEN skála segítségével lehet megbecsülni , amely számos prognosztikai mutatót vesz figyelembe. Hasznos a SCORTEN kiszámítása a kórházi kezelés első 3 napján. Egyéb eredmények közé tartozik a szervkárosodás/-elégtelenség, a szaruhártya karcolása és a vakság. SJS és TEN -ben szenvedő betegeknél korlátozó tüdőbetegség alakulhat ki a kezdeti akut pulmonális érintettség után. A gyógyszer által okozott SJS vagy TEN -ben szenvedő betegek prognózisa jobb, minél hamarabb kivonják a kórokozó gyógyszert.
Járványtan
Az SJS ritka állapot, a bejelentett incidencia körülbelül 2,6-6,1 esetet jelent millió ember évente. Az Egyesült Államokban évente mintegy 300 új diagnózist állítanak fel. Az állapot gyakoribb felnőtteknél, mint gyermekeknél.
Történelem
Az SJS nevét Albert Mason Stevens és Frank Chambliss Johnson amerikai gyermekorvosokról kapta, akik 1922 -ben közösen tették közzé a betegség leírását az American Journal of Diseases of Children -ben.
Nevezetes esetek
- Ab-Soul , amerikai hip-hop felvevő művész , a Black Hippy tagja
- Padma Lakshmi , színésznő, modell, televíziós személyiség és szakácskönyvíró
- Manute Bol , az NBA korábbi játékosa. Bol meghalt Stevens -Johnson szindróma szövődményei, valamint veseelégtelenség miatt.
- Gene Sauers , háromszoros PGA Tour győztes
- Samantha Reckis, egy hét éves Plymouth, Massachusetts lány, aki elvesztette a bőr, amely 95% -át a testét miután a gyermekek Motrin 2003-ban 2013-ban, a zsűri neki $ 63m a pert Johnson & Johnson , az egyik a legnagyobb ilyen jellegű perek. A döntést 2015 -ben helybenhagyták.
- Karen Elaine Morton , modell és színésznő, aki szerepelt Tommy Tutone " 867-5309/Jenny " című videójában, és a hónap játszótársa volt a Playboy Magazine 1978. júliusi számában .
Kutatás
2015-ben az NIH és az Élelmiszer- és Gyógyszerügyi Hatóság (FDA) workshopot szervezett "Kutatási irányok a genetikailag közvetített Stevens-Johnson-szindróma/toxikus epidermális nekrolízis" címmel.
Hivatkozások
Külső linkek
- Bentley, John; Sie, David (2014. október 8.). "Stevens-Johnson szindróma és toxikus epidermális nekrolízis" . A Gyógyszerészeti Lap . 293 (7832)] . Letöltve: 2014. október 8 .
| Osztályozás | |
|---|---|
| Külső erőforrások |