Takrolimusz - Tacrolimus
 | |
 | |
| Klinikai adatok | |
|---|---|
| Kereskedelmi nevek | Prograf, Advagraf, Protopic, mások |
| Más nevek | FK-506, fujimycin |
| AHFS / Drugs.com | Monográfia |
| MedlinePlus | a601117 |
| Licencadatok | |
| Terhesség kategória |
|
| Az adminisztráció módjai |
Helyileg , szájon át , intravénásan |
| ATC kód | |
| Jogi státusz | |
| Jogi státusz | |
| Farmakokinetikai adatok | |
| Biológiai hozzáférhetőség | 24% (5–67%), kevesebb a zsíros ételek fogyasztása után |
| Fehérje kötés | ≥ 98,8% |
| Anyagcsere | Máj CYP3A4 , CYP3A5 |
| Eliminációs felezési idő | 11,3 óra transzplantált betegeknél (3,5–40,6 óra) |
| Kiválasztás | Többnyire széklet |
| Azonosítók | |
| |
| CAS -szám | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| CHEMBL | |
| PDB ligandum | |
| CompTox műszerfal ( EPA ) | |
| ECHA InfoCard |
100,155,367 |
| Kémiai és fizikai adatok | |
| Képlet | C 44 H 69 N O 12 |
| Moláris tömeg | 804,031 g · mol −1 |
| 3D modell ( JSmol ) | |
| |
| |
|
| |
A takrolimusz , amelyet többek között Prograf márkanéven forgalmaznak , immunszuppresszív gyógyszer . Az allogén szervátültetés után a szerv kilökődésének kockázata mérsékelt. A szerv kilökődésének kockázatának csökkentése érdekében takrolimuszt adnak. A gyógyszer helyi gyógyszerként is értékesíthető a T-sejt által közvetített betegségek, például az ekcéma és a psoriasis kezelésében . Például a csontvelő -átültetés utáni súlyos refrakter uveitis , a minimális változás , a Kimura -betegség és a vitiligo súlyosbodása esetén írják fel . Alkalmazható száraz szem szindróma kezelésére macskáknál és kutyáknál.
A takrolimusz gátolja a kalcineurint , amely részt vesz a termelés interleukin-2 , egy molekula, amely elősegíti a fejlődést és proliferációját a T-sejtek , részeként a test tanult (vagy adaptív ) immunválasz.
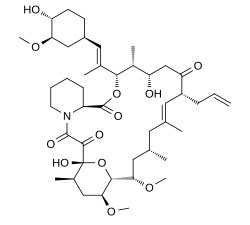
Kémiai szempontból ez egy makrolid lakton , amelyet először 1987 -ben fedeztek fel, egy japán talajminta fermentleveséből, amely a Streptomyces tsukubaensis baktériumot tartalmazta .
Az Egészségügyi Világszervezet alapvető gyógyszerek listáján szerepel .
Orvosi felhasználás
Szervátültetés
Hasonló immunszuppresszív tulajdonságokkal rendelkezik, mint a ciklosporin , de sokkal hatásosabb. A takrolimusszal végzett immunszuppresszió az akut kilökődés szignifikánsan alacsonyabb arányához kapcsolódott a ciklosporin-alapú immunszuppresszióhoz képest (30,7% vs 46,4%) egy vizsgálatban. A klinikai eredmény jobb a takrolimusszal, mint a ciklosporinnal a májtranszplantáció első évében. A hosszú távú eredmény nem javult ugyanolyan mértékben. A takrolimuszt általában a transzplantáció utáni koktél részeként írják fel, beleértve a szteroidokat , a mikofenolátot és az IL-2 receptor gátlókat, például a baziliximabot . Az adagokat a gyógyszeres kezelés után meghatározott időpontokban a célszintekhez igazítják.
Bőr
Mint egy kenőcs , takrolimusz használják kezelésére ekcéma , különösen atópiás dermatitis . A szteroidokhoz hasonló módon elnyomja a gyulladást , és ugyanolyan hatékony, mint a közepes hatású szteroid. A takrolimusz fontos előnye, hogy a szteroidokkal ellentétben nem okoz bőrritkulást ( sorvadást ) vagy más szteroidokkal kapcsolatos mellékhatásokat.
Az aktív elváltozásokra alkalmazzák, amíg ki nem gyógyulnak, de folyamatosan, alacsony dózisban (hetente kétszer) is alkalmazható, és az arc és a szemhéjak vékonyabb bőrére is felvihető. Egy évig tartó klinikai vizsgálatokat végeztek. A közelmúltban a szegmentális vitiligo kezelésére is alkalmazták gyermekeknél, különösen az arcon.
Ellenjavallatok és óvintézkedések
Az ellenjavallatok és óvintézkedések a következők:
- Szoptatás
- Beszűkült betegség
- Immunszuppresszió
- Csecsemők
- Fertőzés
- Neoplasztikus betegség, például:
- Oliguria
- Terhesség
- QT -intervallum megnyúlása
- Napfény ( UV ) expozíció
- Grapefruit juice
Helyi felhasználás
- Okkluzív öltözködés
- Ismert vagy feltételezett rosszindulatú elváltozások
- Netherton -szindróma vagy hasonló bőrbetegségek
- Bizonyos bőrfertőzések
Mellékhatások
Szájon át vagy intravénásan
A mellékhatások súlyosak lehetnek, beleértve a fertőzést, szívkárosodást, magas vérnyomást , homályos látást, máj- és veseproblémákat (takrolimusz nephrotoxicitás ), hiperkalémiát , hipomagnesémiát , hiperglikémiát , cukorbetegséget , viszketést , tüdőkárosodást (a szirolimusz tüdőkárosodást is okoz) és különböző neuropszichiátriai olyan problémák, mint az étvágytalanság, álmatlanság , reverzibilis encephalopathia szindróma , zavartság, gyengeség, depresszió, élénk rémálmok, görcsök, neuropátia, görcsök , remegés és katatónia .
Ezenkívül potenciálisan fokozhatja a meglévő gombás vagy fertőző állapotok, például a herpes zoster vagy a polyoma vírusos fertőzések súlyosságát .
Karcinogenezis és mutagenezis
Azoknál az embereknél, akik immunszuppresszánsokat kapnak a transzplantátum kilökődésének csökkentésére, a rosszindulatú daganatok (rák) fokozott kockázata elismert szövődmény. A leggyakoribb rákos megbetegedések a non-Hodgkin-limfóma és a bőrrák. Úgy tűnik, hogy a kockázat a kezelés intenzitásával és időtartamával függ össze.
Helyi felhasználás
A helyi takrolimusz kenőcsök használatával kapcsolatos leggyakoribb nemkívánatos események, különösen ha széles területen használják, az első alkalmazásban égő vagy viszkető érzést okoznak, fokozott érzékenységet a napfényre és a hőre az érintett területeken. Kevésbé gyakoriak az influenzaszerű tünetek , fejfájás, köhögés és égő szem.
A rák kockázatai
A takrolimuszt és egy rokon, ekcéma elleni gyógyszert ( pimekrolimuszt ) gyaníthatóan rákos megbetegedések hordoznak, bár az ügy még mindig vita tárgya. Az FDA 2005 márciusában egészségügyi figyelmeztetést adott ki a gyógyszerre állatmodellek és kis számú beteg alapján. Amíg további humán vizsgálatok nem hoznak meggyőzőbb eredményeket, az FDA azt javasolja, hogy a felhasználókat tájékoztassák a lehetséges kockázatokról. Az Egyesült Királyság bőrgyógyászainak jelenlegi gyakorlata szerint azonban ezt nem tekintik komoly aggodalomnak, és egyre inkább javasolják ezeknek az új gyógyszereknek a használatát.
Interakciók
A ciklosporinhoz hasonlóan széles körű kölcsönhatásokkal rendelkezik. A takrolimuszt elsősorban a májenzimek citokróm P450 rendszere metabolizálja , és sok olyan anyag van, amely kölcsönhatásba lép ezzel a rendszerrel, és indukálja vagy gátolja a rendszer metabolikus aktivitását.
A kölcsönhatások közé tartozik a grapefruit és a takrolimusz plazmakoncentrációjának növekedése. Mivel a fertőzések a morbiditás és mortalitás fő okai a transzplantációt követő betegekben, a leggyakrabban jelentett kölcsönhatások közé tartozik az antimikrobiális gyógyszerekkel való kölcsönhatás. A makrolid antibiotikumok, beleértve az eritromicint és a klaritromicint , valamint az újabb gombaellenes szerek több csoportja, különösen az azolosztály ( flukonazol , vorikonazol ), a citokróm enzimekért versengve növelik a takrolimusz szintjét.
Gyógyszertan
A cselekvés mechanizmusa
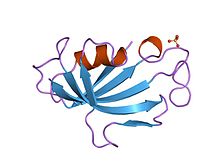
A takrolimusz egy makrolid kalcineurin inhibitor . A T-sejtekben a T-sejt-receptor aktiválása általában növeli az intracelluláris kalciumot, amely a kalmodulinon keresztül aktiválja a kalcineurint . A kalcineurin ezután defoszforilálja az aktivált T-sejtek (NF-AT) transzkripciós faktor nukleáris faktorát , amely a T-sejt magjába költözik, és növeli az IL-2-t és a kapcsolódó citokineket kódoló gének aktivitását. A takrolimusz megakadályozza az NF-AT defoszforilációját.
Részletesen, a takrolimusz csökkenti a peptidil -prolil -izomeráz aktivitást azáltal, hogy az FKBP12 immunofilinhez (FK506 -kötő fehérje) kötődik, új komplexet hozva létre. Ez az FKBP12 – FK506 komplex kölcsönhatásba lép a kalcineurinnal és gátolja azt, ezáltal gátolja mind a T- limfocita szignáltranszdukciót, mind az IL-2 transzkripciót. Bár ez a hatás hasonló a ciklosporinhoz, a takrolimusz alkalmazása csökkenti az akut kilökődés gyakoriságát a ciklosporinhoz képest. Bár a betegek és a graft túlélését illetően a rövid távú immunszuppresszió hasonlónak bizonyult a két gyógyszer között, a takrolimusz kedvezőbb lipidprofilt eredményez, és ez fontos hosszú távú következményekkel járhat, tekintettel a kilökődés prognózisos hatására a graft túlélésére.
Farmakokinetika
Az orális takrolimusz lassan felszívódik a gyomor -bél traktusban , a teljes biohasznosulása 20-25% (de 5-67% -os eltérésekkel), és a legmagasabb vérplazmakoncentráció (C max ) 1-3 óra múlva érhető el. A gyógyszer étkezéssel együtt történő fogyasztása, különösen zsíros ételek esetén, lassítja a felszívódást és csökkenti a biológiai hozzáférhetőséget. A vérben a takrolimusz elsősorban eritrocitákhoz kötődik ; csak 5% -a található meg a plazmában , amelyből több mint 98,8% a plazmafehérjékhez kötődik .
Az anyag metabolizálódik a májban, főként a CYP3A -n keresztül , és a bélfalban. A keringésben található összes metabolit inaktív. A biológiai felezési idő nagymértékben változik, és úgy tűnik, hogy magasabb az egészséges embereknél (átlagosan 43 óra), mint a májátültetett (12 óra) vagy vesetranszplantált (16 óra) betegeknél, a clearance különbségei miatt . A takrolimusz metabolitok formájában döntően a széklettel ürül ki.
Ekcémára helyileg alkalmazva a takrolimusz biológiai hozzáférhetősége alig vagy egyáltalán nincs.
Farmakogenetika
A takrolimusz metabolizmusáért felelős fő enzim a CYP3A5 . A CYP3A5 genetikai eltérései , amelyek a CYP3A5 fehérje aktivitásának megváltozását eredményezik, befolyásolhatják a takrolimusz koncentrációját a szervezetben. Különösen azoknak az egyéneknek, akik homozigóták a G allélra az egyetlen nukleotid polimorfizmusban (SNP) rs776746 (más néven CYP3A5 *3/ *3), nem funkcionális CYP3A5 fehérje van. A G allél gyakorisága világszerte változik, egyes afrikai populációk 4% -ától a kaukázusi populációk 80-90% -áig. Számos vizsgálat során kimutatták, hogy a G allél homozigóta egyénekben magasabb a takrolimusz -koncentráció, és alacsonyabb dózisú gyógyszerre van szükség, mint azoknál az egyéneknél, akik nem homozigóták a G allél tekintetében. A takrolimusz célkoncentrációjának elérése fontos - ha a szint túl alacsony, akkor fennáll a transzplantátum kilökődésének kockázata , ha a szint túl magas, akkor fennáll a gyógyszer toxicitás veszélye. Bizonyítékok arra utalnak, hogy az rs776746 genotípuson alapuló betegek adagolása a takrolimusz célszintek gyorsabb és gyakoribb elérését eredményezheti. Mindazonáltal hiányoznak a következetes bizonyítékok arra vonatkozóan, hogy az rs776746 genotípuson alapuló adagolás javítja -e a klinikai eredményeket (például csökkenti a transzplantátum kilökődésének kockázatát vagy a gyógyszer toxicitását), valószínűleg azért, mert a takrolimuszt szedő betegeket terápiás gyógyszerellenőrzésnek vetik alá .
Tanulmányok kimutatták, hogy a CYP3A5 -től eltérő gének, például az NR1I2 ( PXR -t kódoló ) genetikai polimorfizmusai is jelentősen befolyásolják a takrolimusz farmakokinetikáját.
Történelem
A takrolimuszt 1987 -ben fedezték fel; az első makrolid immunszuppresszánsok közé tartozott, amelyet a rapamicin (sirolimus) felfedezése előzött meg 1975 -ben a Rapa Nui -n (Húsvét -sziget). Ezt a talajbaktérium, a Streptomyces tsukubaensis termeli . A takrolimusz név a " Tsukuba makrolid immunszuppresszáns" -ból származik .
A takrolimuszt először az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) 1994 -ben hagyta jóvá májátültetésre ; az indikációkat kiterjesztették a vesére, a szívre, a vékonybélre, a hasnyálmirigyre, a tüdőre, a légcsőre, a bőrre, a szaruhártyára, a csontvelőre és a végtagátültetésre. A takrolimusz általános verzióit 2017 -ben hagyták jóvá az Egyesült Államokban.
A takrolimuszt 2002 -ben engedélyezték orvosi használatra az Európai Unióban, közepes vagy súlyos atópiás dermatitis kezelésére. 2007 -ben az indikációkat kiterjesztették a transzplantátum kilökődésének megelőzésére felnőtt vese- vagy máj allograft recipiensekben és az allograft kilökődés kezelésére, amely ellenáll más immunszuppresszív gyógyszerekkel történő kezelésnek felnőtteknél. 2009 -ben az indikációkat kiterjesztették a transzplantátum kilökődésének megelőzésére felnőtt- és gyermekgyógyászati, vese-, máj- vagy szív allograft -recipienseknél, valamint az allograft -kilökődés kezelésére, amely ellenáll más immunszuppresszív gyógyszerekkel felnőtteknek és gyermekeknek.
Elérhető űrlapok
A gyógyszer márkás változata az Astellas Pharma tulajdonában van , és Prograf márkanév alatt kerül forgalomba, naponta kétszer. Számos más gyártó rendelkezik forgalomba hozatali engedéllyel a naponta kétszer előállított készítmény alternatív márkái számára.
A napi egyszeri, forgalomba hozatali engedéllyel rendelkező készítmények közé tartozik az Advagraf (Astellas Pharma) és az Envarsus (az USA-ban Envarsus XR néven forgalmazza a Veloxis Pharmaceuticals, és Európában a Chiesi ). Ezek a készítmények a vérszint farmakokinetikai ingadozásának csökkentésére és az adagolás megkönnyítésére szolgálnak.
A helyi készítményt a LEO Pharma forgalmazza Protopic néven.
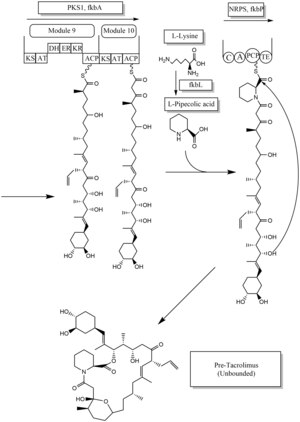
Bioszintézis
A takrolimusz bioszintézise az 1. típusú poliketid szintázok (PKS 1) és a nem riboszómális peptid szintézisek (NRPS) hibrid szintézise . A kutatás azt mutatja, hogy a hibrid szintézis tíz modul 1 -es típusú poliketid -szintázból és egy nem -riboszómális peptid -szintáz modulból áll. A takrolimusz szintetikus enzimjei 19 fkb nevű géncsoportban találhatók. A 19 gén fkbQ, fkbN, fkbM, fkbD, fkbA, fkbP, fkbO, fkbB, fkbC, fkbL, fkbK, fkbJ, fkbI, fkbH, fkbG, allD, allR, allK és allA.
A takrolimusz bioszintézisének számos lehetséges módja van. A bioszintézis alapvető egységei: nyúlási egységek. Két malonyl-CoA molekula azonban helyettesíthető két metoxi-malonil-CoA molekulával. Miután két malonil-CoA molekulát kicseréltek, a szintézis utáni személyre szabási lépésekre már nincs szükség, ahol két metoxi-malonil-CoA-molekula helyettesített. A metoxymalonyl CoA bioszintézisét Acyl Carrier fehérjévé öt enzim (fkbG, fkbH, fkbI, fkbJ és fkbK) hajtja végre. Az allilmalonil-CoA-t propionil-malonil-CoA is helyettesítheti.
A kiindulási egység, DHCHC a korizminsav- van kialakítva fkbO enzim és felvittük CoA-ligáz domént (col). Ezután NADPH -függő redukcióra (ER) megy. Három enzim, az fkbA, B, C hajtja végre a folyamatokat a betöltési modulból a 10-es modulba, a PKS 1 utolsó lépése. Az fkbB enzim felelős az allilmalonil-CoA szintézisért vagy esetleg a propionil-malonil-CoA-hoz C21-nél, ami szokatlan lépés általános PKS 1. Amint említettük, ha két metoxymalonyl CoA molekulát két malonyl-CoA molekulával helyettesítünk, akkor a 7. és 8. modulban (C13 és C15) kerül sor, és az fkbA enzim fogja érvényesíteni ezt a folyamatot. Az utolsó lépés után (modul 10) PKS 1, egy molekula L - pipekolinsav képződött L - lizin és katalizált keresztül fkbL enzim szintetizálja a molekulát a modul 10. Az eljárás L -pipekolinsav szintézis NRPS által kikényszerített fkbP enzim. A teljes alegység szintetizálása után a molekulát ciklizálják. A ciklizálás után a pre-takrolimusz molekula a szintézis utáni személyre szabási lépéseken megy keresztül, mint például az oxidáció és az S- adenozil-metionin . Különösen az fkbM enzim felelős a DHCHC indító egység alkoholját célzó alkohol metilezéséért (a szénatomszám 31 barna), az fkbD enzim pedig a C9 -ért felelős (zöld színnel). Ezen szabási lépések után a takrolimusz -molekula biológiailag aktívvá válik.
Kutatás
Lupus nephritis
A takrolimuszról kimutatták, hogy csökkenti a súlyos fertőzések kockázatát, ugyanakkor növeli a vesefunkció remisszióját lupus nephritis esetén .
Colitis ulcerosa
A takrolimuszt a fekélyes vastagbélgyulladással (UC), a gyulladásos bélbetegség egyik formájával kapcsolatos gyulladás elnyomására használták . Bár a takrolimuszt szinte kizárólag kísérleti esetekben alkalmazták, a takrolimusz szignifikánsan hatékonynak bizonyult az UC fellángolásának elnyomásában.
Hivatkozások
További irodalom
- Lv X, Qi J, Zhou M és mtsai. (2020 március). "20 graft-versus-host betegség megelőző terápia összehasonlító hatékonysága a betegek számára hematopoietikus őssejt-transzplantáció után: A többszörös kezelések hálózati metaanalízise". Crit. Rev. Oncol. Hematol . 150 : 102944. doi : 10.1016/j.critrevonc.2020.102944 . PMID 32247246 . S2CID 214794350 .
Külső linkek
- "Takrolimusz" . Gyógyszerinformációs portál . Amerikai Országos Orvostudományi Könyvtár.
- "Takrolimusz injekció" . MedlinePlus .
- "Aktuális takrolimusz" . MedlinePlus .
- A takrolimusz az amerikai National Library of Medicine orvosi tárgyszórendszere (mm)
- "Az FDA jóváhagyja a transzplantációs gyógyszer új alkalmazását valós bizonyítékok alapján" . Amerikai Élelmiszer- és Gyógyszerügyi Hivatal (FDA) .