Inzulin - Insulin
Inzulin ( / ɪ n . Sj ʊ . L ɪ n / , a latin insula , 'sziget') egy peptid hormon által termelt béta-sejtek a hasnyálmirigy-szigetek ; a test fő anabolikus hormonjának tekintik . Ez szabályozza a metabolizmust a szénhidrátok , zsírok és fehérjék által felszívódását segítő glükóz a vérből a máj , zsír és vázizom sejtek. Ezekben a szövetekben az abszorbeált glükóz alakítjuk vagy glikogén keresztül glikogenezissel vagy zsírok ( trigliceridek ) keresztül lipogenezis , vagy, abban az esetben a máj, mindkét. A máj glükóztermelését és szekrécióját erősen gátolja a vér magas inzulinkoncentrációja. A keringő inzulin a fehérjék szintézisét is befolyásolja a legkülönbözőbb szövetekben. Ezért ez egy anabolikus hormon, elősegíti a vérben lévő kis molekulák átalakítását a sejtek belsejében lévő nagy molekulákká. A vér alacsony inzulinszintje ellenkező hatást fejt ki, mivel elősegíti a széles körű katabolizmust , különösen a tartalék testzsír esetében .
A béta -sejtek érzékenyek a vércukorszintre, így a magas glükózszint hatására inzulint választanak ki a vérbe; és gátolják az inzulin kiválasztását, ha a glükózszint alacsony. Az inzulin fokozza a glükóz felvételt és anyagcserét a sejtekben, ezáltal csökkenti a vércukorszintet. Szomszédos alfa -sejtjeik a béta -sejtekből vett jeleik alapján glukagont választanak ki a vérbe az ellenkező módon: fokozott szekréciót, ha alacsony a vércukorszint, és csökkent szekréciót, ha magas a glükózkoncentráció. A glukagon növeli a vércukorszintet a máj glikogenolízisének és glükoneogenezisének stimulálásával . A glükóz homeosztázis elsődleges mechanizmusa az inzulin és a glukagon szekréciója a vérbe a vér glükózkoncentrációjának hatására .
Az inzulin aktivitás csökkenése vagy hiánya diabetes mellitushoz , magas vércukorszinthez (hiperglikémia) vezet. A betegségnek két típusa van. Az 1 -es típusú cukorbetegségben a béta -sejtek autoimmun reakcióval elpusztulnak, így az inzulin már nem szintetizálható vagy nem választható ki a vérbe. A 2 -es típusú cukorbetegségben a béta -sejtek pusztulása kevésbé hangsúlyos, mint az 1 -es típus esetében, és nem autoimmun folyamatnak köszönhető. Ehelyett az amiloid felhalmozódik a hasnyálmirigy -szigeteken, ami valószínűleg megzavarja anatómiájukat és fiziológiájukat. A 2-es típusú cukorbetegség patogenezisét nem jól ismerik, de ismert, hogy a szigetek béta-sejtpopulációja csökkent, a szigetek béta-sejtjei szekréciós funkciója csökkent, és túlélő, valamint a perifériás szövetek inzulinrezisztenciája. A 2 -es típusú cukorbetegséget a megnövekedett glukagonszekréció jellemzi, amelyet nem befolyásol a vércukorszint, és nem reagál a vércukorszintre. De az inzulin a vércukorszint hatására továbbra is kiválasztódik a vérbe. Ennek eredményeként a glükóz felhalmozódik a vérben.
A humán inzulin fehérje 51 aminosavból áll , molekulatömege 5808 Da . Ez egy A- és B-lánc hetero dimere , amelyek diszulfidkötésekkel kapcsolódnak egymáshoz . Az inzulin szerkezete kis mértékben változik az állatfajok között . Az állati eredetű inzulin hatékonysága ( szénhidrát -anyagcsere hatásai tekintetében) némileg eltér a humán inzulintól ezeknek az eltéréseknek köszönhetően. A sertés inzulin különösen közel áll az emberi változathoz, és széles körben alkalmazták az 1 -es típusú cukorbetegek kezelésére, mielőtt a humán inzulin nagy mennyiségben előállítható lenne rekombináns DNS -technológiákkal.
Az inzulin volt az első felfedezett peptid hormon. Frederick Banting és Charles Herbert Legjobb dolgozó laboratóriumában JJR Macleod a University of Toronto , voltak az elsők, izolátum inzulin kutya hasnyálmirigy 1921 Frederick Sanger szekvenálása aminosavstruktúrája 1951, amely lehetővé tette az inzulin az első fehérje lenni teljesen szekvenált. A szilárd halmazállapotú inzulin kristályszerkezetét Dorothy Hodgkin határozta meg 1969 -ben. Az inzulin egyben az első fehérje, amelyet kémiailag szintetizáltak és DNS rekombináns technológiával állítottak elő . A WHO alapvető gyógyszerek listáján szerepel , amelyek az alapvető egészségügyi rendszerhez szükséges legfontosabb gyógyszerek .
Evolúció és fajok elterjedése
Az inzulin több mint egymilliárd évvel ezelőtt keletkezhetett. Az inzulin molekuláris eredete legalább annyira visszanyúlik, mint a legegyszerűbb egysejtű eukarióták . Az állatokon kívül az inzulinszerű fehérjék is ismertek a gombák és a protisták királyságában.
Az inzulint a hasnyálmirigy -szigetek béta -sejtjei termelik a legtöbb gerincesben, a Brockmann -test pedig néhány távoli halban . Kúpcsigák A Conus geographus és a Conus tulipa , a mérgező tengeri csigák, amelyek kis halakra vadásznak, módosított inzulinformákat használnak méreg -koktéljaikban. Az inzulin toxin, amely szerkezetében közelebb áll a halakhoz, mint a csigák natív inzulinjához, lassítja a zsákmányhalakat, csökkentve vércukorszintjüket.
Gén
Az inzulin preproinzulin prekurzorát az INS gén kódolja , amely a 11p15.5 kromoszómán található. Egyes emlősökben, például patkányokban és egerekben, két inzulin gén létezik, amelyek közül az egyik a legtöbb emlős gén homológja ( Ins2 ), a másik pedig egy újraküldött másolat, amely tartalmazza a promóter szekvenciát, de hiányzik az intron ( Ins1 ). Mindkét rágcsáló inzulin gén funkcionális.
Allélok
számos mutáns allélt azonosítottak a kódoló régióban. Egy átolvasott gén , az INS-IGF2 átfedésben van ezzel a génnel az 5 'régióban és az IGF2 génnel a 3' régióban.
Szabályozás
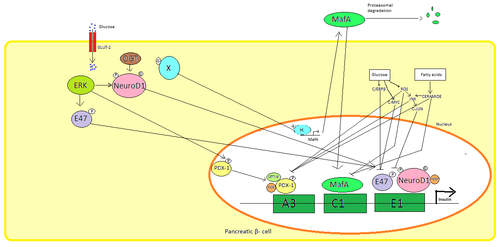
A hasnyálmirigy β-sejtek , a glükóz az elsődleges fiziológiás inger szabályozására az inzulin-szintézis. Az inzulint elsősorban a PDX1 , NeuroD1 és MafA transzkripciós faktorok szabályozzák .
Alacsony glükózállapotban a PDAC1 (hasnyálmirigy és nyombél homeobox fehérje 1) a nukleáris periférián helyezkedik el a HDAC1 és 2 kölcsönhatása következtében , ami az inzulin szekréció csökkenését eredményezi. A vércukorszint növekedése a PDX1 foszforilációját okozza , ami nukleáris transzlokáción megy keresztül, és megköti az A3 elemet az inzulin promoterben. A transzlokáció során kölcsönhatásba lép a HAT p300 és SETD7 koaktivátorokkal . A PDX1 befolyásolja a hiszton módosulásait acetilezéssel és dezacetilezéssel, valamint metilezéssel . Azt is mondják, hogy elnyomja a glukagont .
A NeuroD1 , más néven β2, szabályozza az inzulin exocitózisát a hasnyálmirigy β -sejtjeiben , közvetlenül indukálva az exocitózisban részt vevő gének expresszióját . Ez lokalizálódik a citoszolban , hanem, a magas glükóz válik glikozilált által OGT és / vagy foszforilált által ERK , ami transzlokációját a sejtmagba. A sejtmagban a β2 az E47-gyel heterodimerizálódik, az inzulin promoter E1 eleméhez kötődik, és a p300 koaktivátort toborozza, amely acetilálja a β2-t. Képes kölcsönhatásba lépni más transzkripciós faktorokkal, valamint az inzulin gén aktiválásában.
A MafA -t a proteaszómák lebontják alacsony vércukorszint esetén. A megnövekedett glükózszint ismeretlen fehérjét glikozilez . Ez a fehérje ismeretlen módon transzkripciós faktorként működik a MafA számára , és a MafA -t szállítják ki a sejtből. A MafA -t ezután visszahelyezik a magba, ahol megköti az inzulin promoter C1 elemét.
Ezek a transzkripciós tényezők szinergikusan és összetett elrendezésben működnek. A megnövekedett vércukorszint egy idő után tönkreteheti ezen fehérjék megkötő képességét, és ezáltal csökkentheti a kiválasztott inzulin mennyiségét, cukorbetegséget okozva . A csökkent kötési aktivitást a glükóz által kiváltott oxidatív stressz közvetítheti, és az antioxidánsok állítólag megakadályozzák a csökkent inzulinszekréciót a glükotoxikus hasnyálmirigy β -sejtekben . A stresszt jelző molekulák és a reaktív oxigénfajok gátolják az inzulin gént azáltal, hogy zavarják a transzkripciós faktorokat és magát a transzkripciós faktorokat kötő kofaktorokat.
Számos szabályozó szekvenciák a promoter régió a humán inzulin gén kötődnek transzkripciós faktorok . Általában az A-boxok a Pdx1 faktorokhoz, az E-boxok a NeuroD-hez , a C-boxok a MafA -hoz és a cAMP válaszelemek a CREB -hez kötődnek . Vannak olyan hangtompítók is, amelyek gátolják az átírást.
| Szabályozási sorrend | kötő transzkripciós faktorok |
|---|---|
| ILPR | Par1 |
| A5 | Pdx1 |
| negatív szabályozási elem (NRE) | glükokortikoid receptor , október 1 |
| Z (átfedő NRE és C2) | ISF |
| C2 | Pax4 , MafA (?) |
| E2 | USF1 / USF2 |
| A3 | Pdx1 |
| CREB RE | CREB , CREM |
| A2 | - |
| CAAT erősítő kötés (CEB) (részben átfedő A2 és C1) | - |
| C1 | - |
| E1 | E2A , NeuroD1 , HEB |
| A1 | Pdx1 |
| G1 | - |
Szerkezet

Ellentétben azzal a kezdeti vélekedéssel, hogy a hormonok általában kisméretű kémiai molekulák, mivel a szerkezetükről ismert első peptid hormonként az inzulint meglehetősen nagynak találták. A humán inzulin egyetlen fehérje (monomerje) 51 aminosavból áll , és molekulatömege 5808 Da . A humán inzulin molekuláris képlete a C 257 H 383 N 65 O 77 S 6 . Ez két peptidlánc ( dimer ) kombinációja, amelyet A- és B-láncnak neveznek, és amelyeket két diszulfidkötés köt össze . Az A-lánc 21 aminosavból áll, míg a B-lánc 30 aminosavból áll. Az összekötő (láncközi) diszulfidkötések az A7-B7 és A20-B19 pozíciók közötti ciszteincsoportokon jönnek létre. Az A-láncon belül további (láncon belüli) diszulfidkötés található az A6 és A11 pozíciókban lévő ciszteinmaradékok között. Az A-lánc két α-spirális régiót mutat az A1-A8 és az A12-A19 szakaszon, amelyek párhuzamosak; míg a B lánc központi α-hélixet tartalmaz (a B9-B19 maradványokat lefedi), mindkét oldalán a diszulfidkötés és két β-lap (B7-B10 és B20-B23).
Az inzulin aminosav -szekvenciája erősen konzervált, és csak kis mértékben változik fajonként. Szarvasmarha inzulin eltér a humán csak három aminosav maradék, és sertés inzulint egy. Még egyes halfajokból származó inzulin is eléggé hasonló az emberhez, hogy klinikailag hatékony legyen az emberekben. Egyes gerinctelenek inzulinja nagyon hasonló a humán inzulinhoz, és hasonló élettani hatásokkal rendelkezik. A különböző fajok inzulinszekvenciájában tapasztalható erős homológia arra utal, hogy az állatok evolúciós történetének nagy részében megmaradt. A proinzulin C-peptidje azonban sokkal jobban különbözik a fajok között; ez is hormon, de másodlagos.
Az inzulint hexamerként (hat inzulinmolekula egysége) állítják elő és tárolják a szervezetben, míg az aktív forma a monomer. A hexamer mérete körülbelül 36 000 Da. A hat molekula három dimer egységként kapcsolódik össze, hogy szimmetrikus molekulát képezzen. Fontos jellemzője a cinkatomok (Zn 2+ ) jelenléte a szimmetria tengelyén, amelyeket három vízmolekula és három hisztamin maradék vesz körül a B10 pozícióban.
A hexamer egy inaktív forma, hosszú távú stabilitással, amely arra szolgál, hogy a rendkívül reaktív inzulin védett legyen, mégis könnyen hozzáférhető. A hexamer-monomer konverzió az injekcióhoz való inzulin készítmények egyik központi eleme. A hexamer sokkal stabilabb, mint a monomer, ami gyakorlati okokból kívánatos; azonban a monomer sokkal gyorsabban reagáló gyógyszer, mivel a diffúziós sebesség fordítottan függ a részecskemérettől. A gyorsan reagáló gyógyszer azt jelenti, hogy az inzulin injekcióknak nem kell órákkal megelőzniük az étkezést, ami viszont rugalmasabbá teszi a cukorbetegek napi menetrendjét. Az inzulin összesíti és alkotnak rostos fésűs béta-lemezek . Ez injekciós amiloidózist okozhat , és megakadályozza az inzulin hosszú távú tárolását.
Szintézis, élettani hatások és lebomlás
Szintézis
Az inzulin a hasnyálmirigyben és a Brockmann -testben (egyes halakban) termelődik , és több inger észlelésekor szabadul fel. Ezek közé tartozik az aminosavak és a glükóz plazmakoncentrációjának emelkedése az élelmiszerek emésztése következtében. A szénhidrátok lehetnek egyszerű cukrok polimerei vagy maguk az egyszerű cukrok. Ha a szénhidrátok glükózt tartalmaznak, akkor ez a glükóz felszívódik a véráramba, és a vércukorszint emelkedni kezd. A cél sejtek inzulin kezdeményez jelátviteli , amelynek hatása egyre glükóz felvételét és tárolását. Végül az inzulin lebomlik, megszüntetve a választ.

Emlősökben az inzulin a hasnyálmirigyben szintetizálódik a béta -sejtekben. Egy -három millió hasnyálmirigy -sziget alkotja a hasnyálmirigy endokrin részét, amely elsősorban exokrin mirigy . Az endokrin rész a hasnyálmirigy teljes tömegének legfeljebb 2% -át teszi ki. A hasnyálmirigy -szigeteken belül a béta -sejtek az összes sejt 70-90% -át teszik ki.
Az inzulin két polipeptidláncból áll, az A- és a B-láncból, amelyeket diszulfidkötések kötnek össze. A béta -sejtekben azonban először egyetlen polipeptidként szintetizálják, amelyet preproinzulinnak neveznek . A preproinsulin 24-maradék szignálpeptidet tartalmaz, amely a születő polipeptidláncot a durva endoplazmatikus retikulumhoz (RER) irányítja . A szignálpeptid hasad, amikor a polipeptid a RER lumenébe transzlokálódik, és proinzulint képez . A RER -ben a proinzulin a megfelelő konformációba hajlik, és 3 diszulfidkötés jön létre. Körülbelül 5-10 perccel az endoplazmatikus retikulumban való összeszerelés után a proinzulin a transz-Golgi hálózatba (TGN) kerül, ahol éretlen granulátumok képződnek. A TGN -re történő szállítás körülbelül 30 percet vesz igénybe.
A proinzulin aktív inzulinná érik a prohormon konvertázok ( PC1 és PC2 ) néven ismert celluláris endopeptidázok , valamint az exoproteáz karboxipeptidáz E hatására . Az endopeptidázok 2 pozícióban hasadnak, felszabadítva a C-peptidnek nevezett fragmenst , és 2 peptidlánc, a B- és az A-lánc marad, amelyeket 2 diszulfidkötés köt össze. A hasítási helyek mindegyike egy bázikus maradékpár (lizin-64 és arginin-65, valamint arginin-31 és -32) után helyezkedik el. A C-peptid hasítása után ezt a 2 pár bázikus maradékot a karboxipeptidáz eltávolítja. A C-peptid a proinzulin központi része, és a proinzulin elsődleges szekvenciája a "BCA" nagyságrendbe esik (a B és A láncokat tömeg alapján azonosították, és a C-peptidet később fedezték fel).
A kapott érett inzulint az érett granulátumokba csomagolják, és várják a metabolikus jeleket (például leucint, arginint, glükózt és mannózt) és a vagus idegstimulációt a sejtekből a keringésbe.
Az inzulin endogén termelését több lépésben szabályozzák a szintézis útvonalán:
- Abban átírás a inzulin gén
- Az mRNS stabilitásában
- Az mRNS transzlációnál
- A fordítás utáni módosítások során
Az inzulin és a hozzá kapcsolódó fehérjék kimutatták, hogy az agyban termelődnek, és ezen fehérjék csökkent szintje az Alzheimer -kórhoz kapcsolódik.
Az inzulin felszabadulását a béta-2 receptor stimuláció is stimulálja, és az alfa-1 receptor stimuláció gátolja. Ezenkívül a kortizol, a glukagon és a növekedési hormon antagonizálják az inzulin hatását stressz idején. Az inzulin gátolja a zsírsavak felszabadulását a hormonszenzitív lipáz által a zsírszövetben.
Kiadás
Béta-sejtek a Langerhans-szigetek kiadás inzulin két fázisban. Az első fázis felszabadulása gyorsan elindul a megnövekedett vércukorszint hatására, és körülbelül 10 percig tart. A második fázis az újonnan képződött hólyagok tartós, lassú felszabadulása, amelyet a cukortól függetlenül váltanak ki, és 2-3 órán belül tetőzik. Az inzulin felszabadulásának két fázisa azt sugallja, hogy az inzulin granulátumok jelen vannak különböző populációkban vagy "medencékben". Az inzulin exocitózis első fázisában az exocitózisra hajlamos granulátumok nagy része felszabadul a kalcium internalizálása után. Ezt a medencét RRP (Readily Releasable Pool) néven ismerik. Az RRP granulátumok a teljes inzulintartalmú granulátum populáció 0,3-0,7% -át teszik ki, és közvetlenül a plazmamembrán mellett találhatók. Az exocitózis második fázisában az inzulin granulátumhoz a granulátumokat a plazmamembránhoz kell mobilizálni, és egy korábbi készítményt kell felszabadítani. Így az inzulin felszabadulás második fázisát a granulátumok felszabadulási sebessége szabályozza. Ezt a medencét Reserve Pool (RP) néven ismerik. Az RP lassabban szabadul fel, mint az RRP (RRP: 18 granulátum/perc; RP: 6 granulátum/perc). A csökkentett első fázisú inzulin felszabadulás lehet a legkorábban kimutatható béta-sejt-hiba, amely megjósolja a 2-es típusú cukorbetegség kialakulását . Az első fázis felszabadulása és az inzulinérzékenység a cukorbetegség független előrejelzői.
Az első fázis kiadásának leírása a következő:
- A glükóz a glükóz transzportereken , a GLUT2 -n keresztül jut be a β-sejtekbe . Ezeknek a glükóz transzportereknek viszonylag alacsony az affinitása a glükózhoz, biztosítva, hogy a glükóz β-sejtekbe jutásának aránya arányos legyen az extracelluláris glükózkoncentrációval (a fiziológiai tartományon belül). Alacsony vércukorszint esetén nagyon kevés glükóz jut be a β-sejtekbe; magas vércukorszint mellett nagy mennyiségű glükóz kerül ezekbe a sejtekbe.
- A β-sejtbe jutó glükózt glükóz-6-foszfáttá (G-6-P) foszforilálja glükokináz ( hexokináz IV ), amelyet a G-6-P nem gátol úgy, ahogyan a hexokinázok más szövetekben (hexokináz) I - III) befolyásolja ez a termék. Ez azt jelenti, hogy az intracelluláris G-6-P koncentráció arányos marad a vércukorszinttel.
- A glükóz-6-foszfát belép a glikolitikus útba , majd a piruvát-dehidrogenáz reakción keresztül a Krebs-ciklusba , ahol az acetil-CoA (a Krebs-ciklus szubsztrátja) oxidációjával több, nagy energiájú ATP- molekula keletkezik , ami a az ATP: ADP arány a cellán belül.
- A megnövekedett intracelluláris ATP: ADP arány bezárja az ATP-érzékeny SUR1/ Kir6.2 káliumcsatornát (lásd szulfonil-karbamid receptor ). Ez megakadályozza a káliumionok (K + ) elhagyását a sejtből a megkönnyített diffúzió révén, ami az intracelluláris káliumionok felhalmozódásához vezet. Ennek eredményeképpen a sejt belseje kevésbé negatív lesz a külsőhöz képest, ami a sejtfelszíni membrán depolarizációjához vezet.
- A depolarizáció után feszültségfüggő kalciumion (Ca 2+ ) csatornák nyílnak meg, lehetővé téve a kalciumionok bejutását a sejtbe a megkönnyített diffúzió révén.
- A citoszolos kalciumion -koncentrációt növelheti az is, ha a kalcium felszabadul az intracelluláris raktárakból a ryanodin receptorok aktiválása révén.
- A kalciumion -koncentráció a béta -sejtek citoszoljában is növelhető, vagy ezenkívül növelhető a foszfolipáz C aktiválásával, ami egy extracelluláris ligandum (hormon vagy neurotranszmitter) G -fehérjéhez kapcsolt membránreceptorhoz való kötődéséből adódik. A foszfolipáz C hasítja a membrán foszfolipid, foszfatidil-inozitol 4,5-bifoszfát , figyelembe inozit-1,4,5-trifoszfát és a diacil-glicerin . Az inozitol-1,4,5-triszfoszfát (IP3) ezután az endoplazmatikus retikulum (ER) plazmamembránjában lévő receptorfehérjékhez kötődik . Ez lehetővé teszi a Ca 2+ ionok felszabadulását az ER-ből IP3-védett csatornákon keresztül, ami növeli a kalciumionok citoszol koncentrációját, függetlenül a magas vércukorszint koncentrációjától. A hasnyálmirigy -szigetek paraszimpatikus stimulációja ezen az úton működik, hogy fokozza az inzulin szekrécióját a vérbe.
- A sejtek citoplazmájában jelentősen megnövekedett kalciumionok mennyisége a korábban szintetizált inzulin vérbe történő felszabadulását okozza, amelyet intracelluláris szekréciós vezikulákban tároltak .
Ez az inzulin felszabadulásának elsődleges mechanizmusa. Egyéb anyagok, amelyekről ismert, hogy stimulálják az inzulin felszabadulását, az arginin és a leucin aminosavak, az acetilkolin paraszimpatikus felszabadulása (a foszfolipáz C útvonalán keresztül hat), a szulfonil-karbamid , a kolecisztokinin (CCK, szintén a foszfolipáz C-n keresztül) és a gasztrointesztinális eredetű inkretinok , például a glukagon. mint a peptid-1 (GLP-1) és a glükóz-függő inzulinotróp peptid (GIP).
Az inzulin felszabadulását erősen gátolja a noradrenalin (noradrenalin), ami a vércukorszint megnövekedéséhez vezet stressz alatt. Úgy tűnik, hogy felszabadulását katecholaminok által szimpatikus idegrendszer van ellentmondó hatások az inzulin felszabadulását a béta-sejtek, mivel az inzulin felszabadulását gátolja α 2 adrenerg receptorok és stimulálja β 2 adrenerg receptorok. A szimpatikus idegekből származó norepinefrin és a mellékvesékből származó epinefrin nettó hatása az inzulin felszabadulására gátlás az α-adrenerg receptorok dominanciája miatt.
Amikor a glükózszint a szokásos élettani értékre csökken, az inzulin felszabadulása a β-sejtekből lelassul vagy leáll. Ha a vércukorszint ennél alacsonyabbra csökken, különösen veszélyesen alacsony szintre, a hiperglikémiás hormonok (a legelterjedtebb glukagon a Langerhans -alfa -sejtek szigeteiből) felszabadulása kényszeríti a glükóz felszabadulását a vérbe a máj glikogénraktáraiból, kiegészítve glükoneogenezissel, ha a glikogén az üzletek kimerülnek. A vércukorszint növelésével a hiperglikémiás hormonok megelőzik vagy korrigálják az életveszélyes hipoglikémiát.
A glükóztolerancia-teszt bizonyítja a zavart első fázisú inzulin-felszabadulást, amelyet a glükózterhelés (75 vagy 100 g glükóz) bevétele után 30 perccel jelentősen megnövekedett vércukorszint mutat, majd lassú csökkenés a következő 100 percben, hogy a vizsgálat megkezdése után két óra múlva 120 mg/100 ml felett maradjon. Egy normális emberben a vércukorszint a vizsgálat végére korrigálódik (és akár kissé túl is korrigálható). Az inzulin -tüske az első válasz a vércukorszint -emelkedésre, ez a válasz egyéni és dózisfüggő, bár korábban azt feltételezték, hogy csak élelmiszer -specifikus.
Oszcillációk
Még az emésztés során is, általában egy -két órával az étkezés után, a hasnyálmirigyből az inzulin felszabadulása nem folyamatos, hanem 3–6 perces periódus alatt ingadozik, és a vér inzulinkoncentrációja meghaladja a körülbelül 800 p mol /l értéket. kevesebb, mint 100 pmol/l (patkányokban). Úgy gondolják, hogy ez elkerüli az inzulinreceptorok alulszabályozását a célsejtekben, és segíti a májat az inzulin vérből történő kivonásában. Ezt az oszcillációt fontos figyelembe venni az inzulin-stimuláló gyógyszerek beadásakor, mivel az inzulin felszabadulásának rezgő vérkoncentrációját kell elérni, ideális esetben nem állandó magas koncentrációt. Ezt úgy érhetjük el, hogy ritmikusan juttatjuk be az inzulint a portális vénába , könnyű aktivált bejuttatással vagy szigetsejt -transzplantációval a májba.
A vér inzulin szintje
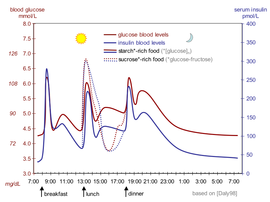
A vér inzulinszintje nemzetközi egységekben mérhető , például µIU/ml vagy moláris koncentrációban , például pmol/l, ahol 1 µIU/ml 6,945 pmol/l. Az étkezések közötti tipikus vérszint 8–11 μIU/ml (57–79 pmol/l).
Jelátvitel
Az inzulin hatását a sejtmembránban lévő receptorhoz, az inzulinreceptorhoz (IR) való kötődés indítja el . A receptormolekula α- és β-alegységeket tartalmaz. Két molekulát egyesítenek, hogy homodimerként ismertté váljanak. Az inzulin kötődik a homodimer α-alegységeihez, amelyek a sejtek extracelluláris oldala felé néznek. A β alegységek tirozin -kináz enzim aktivitással rendelkeznek, amelyet az inzulin -kötés vált ki. Ez az aktivitás provokálja a β alegységek autofoszforilációját, majd a fehérjék foszforilációját a sejten belül, inzulin receptor szubsztrátok (IRS) néven. Az IRS foszforilezése aktiválja a jelátviteli kaszkádot, amely más kinázok aktiválásához vezet, valamint olyan transzkripciós faktorokat, amelyek közvetítik az inzulin intracelluláris hatásait.
A kaszkád, amely GLUT4 glükóz transzporterek beillesztéséhez vezet az izom- és zsírsejtek sejtmembránjába, valamint a glikogén szintéziséhez a májban és az izomszövetben, valamint a glükóz trigliceridekké alakításában a májban, a zsírban és a szoptató emlőben mirigyszövet, a foszfoinozitol 3 kináz ( PI3K ) IRS-1 általi aktiválásával működik . Ez az enzim a sejtmembránban lévő foszfolipidet , foszfatidil-inozitol 4,5-biszfoszfát (PIP2) néven foszfatidil-inozitol 3,4,5-trifoszfáttá (PIP3) alakítja át , ami viszont aktiválja a protein-kináz B-t (PKB). Az aktivált PKB megkönnyíti a GLUT4 -et tartalmazó endoszómák fúzióját a sejtmembránnal, ami a GLUT4 transzporterek növekedését eredményezi a plazmamembránban. A PKB foszforilálja a glikogén szintetáz kinázt (GSK) is, ezáltal inaktiválja ezt az enzimet. Ez azt jelenti, hogy a szubsztrátja, a glikogén szintetáz (GS) nem foszforilálható, de defoszforilezett marad, és ezért aktív. Az aktív enzim, a glikogén szintetáz (GS) katalizálja a sebességkorlátozó lépést a glikogén glükózból történő szintézisében. Hasonló dephosphorylations befolyásolja az enzimek sebességének a vezérlésére annak glikolízis szintéziséhez vezető zsírok keresztül malonil-CoA a szövetekben, amely képes generálni trigliceridek , valamint az enzimek, amelyek szabályozzák az arány a glükoneogenezis a májban. Ezen végső enzimdefoszforilációk összhatása az, hogy azokban a szövetekben, amelyek képesek végrehajtani ezeket a reakciókat, stimulálják a glükózból származó glikogén- és zsírszintézist, és gátolják a máj glükóztermelését a glikogenolízis és a glükoneogenezis révén . A trigliceridek zsírszövet általi bontása szabad zsírsavakká és glicerinné szintén gátolt.
Miután az inzulin receptorához való kötődésének eredményeképpen létrejött intracelluláris jel létrejött, a jelátvitelt meg kell szakítani. Amint az alábbiakban a lebomlásról szóló részben említettük, az endocitózis és az inzulinhoz kötött receptor lebomlása a fő jelátviteli mechanizmus. Ezenkívül a jelátviteli utat a különböző jelzőutakban lévő tirozinmaradékok tirozin -foszfatázokkal történő defoszforilezése is megszünteti. A szerin/treonin kinázokról is ismert, hogy csökkentik az inzulin aktivitását.
Az inzulin- inzulin receptor komplex szerkezetét röntgenkristályos módszerrel határozták meg .
Fiziológiai hatások


Az inzulin globális emberi anyagcsere -szintre gyakorolt hatásai a következők:
- Bizonyos anyagok, különösen a glükóz izom- és zsírszövetben (a testsejtek körülbelül kétharmada), sejtbevitelének növekedése
- A DNS -replikáció és a fehérjeszintézis fokozása az aminosavfelvétel szabályozásával
- Számos enzim aktivitásának módosítása .
Az inzulin (közvetett és közvetlen) sejtre gyakorolt hatásai a következők:
- Serkenti a glükózfelvételt - Az inzulin csökkenti a vércukorszintet azáltal, hogy a sejtek glükózbevitelt indukál . Ez azért lehetséges, mert az inzulin a GLUT4 transzporter bejutását okozza az izom- és zsírszövetek sejtmembránjába, ami lehetővé teszi a glükóz bejutását a sejtbe.
- Fokozott zsírszintézis - az inzulin rákényszeríti a zsírsejteket a vércukorszint felvételére, amely trigliceridekké alakul át ; az inzulin csökkenése fordított helyzetet okoz.
- A zsírsavak fokozott észterezése - arra kényszeríti a zsírszövetet, hogy a zsírsavakból semleges zsírokat (azaz triglicerideket ) állítson elő; az inzulin csökkenése fordított.
- Csökkent lipolízis - csökkenti a zsírsejtek lipidraktárainak vérzsírsavvá és glicerinné történő átalakulását; az inzulin csökkenése fordított helyzetet okoz.
- Indukálja a glikogén szintézist - Ha a glükózszint magas, az inzulin a hexokináz enzim aktiválásával indukálja a glikogén képződését, amely foszfátcsoportot ad hozzá a glükózhoz, így olyan molekulát eredményez, amely nem tud kilépni a sejtből. Ugyanakkor az inzulin gátolja a glükóz-6-foszfatáz enzimet, amely eltávolítja a foszfátcsoportot. Ez a két enzim kulcsfontosságú a glikogén képződéséhez. Ezenkívül az inzulin aktiválja a foszfofruktokináz és a glikogén szintáz enzimeket, amelyek felelősek a glikogén szintéziséért.
- Csökkent glükoneogenezis és glikogenolízis - csökkenti a glükóz termelését nem szénhidrát szubsztrátokból, elsősorban a májban (a májba érkező endogén inzulin túlnyomó része soha nem hagyja el a májat); Az inzulin csökkenése a máj glükóz termelését okozza a különböző szubsztrátokból.
- Csökkent proteolízis - csökkenti a fehérje lebomlását
- Csökkent autofágia - a sérült organellák degradációjának csökkenése. Az étkezés utáni szintek teljesen gátolják az autofágia kialakulását.
- Fokozott aminosavfelvétel - rákényszeríti a sejteket a keringő aminosavak felszívására; az inzulin csökkenése gátolja a felszívódást.
- Artériás izomtónus - ellazítja az artériás falizmokat, fokozza a véráramlást, különösen a mikroartériákban; az inzulin csökkenése csökkenti az áramlást azáltal, hogy lehetővé teszi ezen izmok összehúzódását.
- A sósav szekréciójának növekedése a gyomor parietális sejtjei által.
- Fokozott káliumfelvétel - arra kényszeríti a sejteket, hogy glikogént (egy nagyon szivacsos, "nedves" anyagot, amely növeli az intracelluláris víz és az azt kísérő K + -ionok tartalmát) szintetizáló káliumot felszívja az extracelluláris folyadékokból; az inzulin hiánya gátolja a felszívódást. Az inzulin növekedése a sejtek káliumfelvételében csökkenti a vérplazma káliumszintjét. Ez valószínűleg a Na + /K + -ATPáz inzulin által kiváltott transzlokációjával történik a vázizomsejtek felszínére.
- Csökkent nátrium -vesekiválasztás.
Az inzulin befolyásolja a test egyéb funkcióit is, például az érrendszeri megfelelőséget és a megismerést . Miután az inzulin belép az emberi agyba, javítja a tanulást és a memóriát, és különösen előnyös a verbális memóriára. Az agyi inzulin jelzés intranazális inzulin beadásával történő fokozása fokozza az ételre adott akut termoregulációs és glükoregulációs választ is, ami azt sugallja, hogy a központi ideg inzulin hozzájárul az emberi szervezetben zajló homeosztatikus vagy szabályozó folyamatok széles körének összehangolásához . Az inzulin stimuláló hatást fejt ki a hypothalamusból származó gonadotropin-felszabadító hormonra is , ezáltal kedvez a termékenységnek .
Lebomlás
Miután az inzulinmolekula kikötődött a receptorhoz és hatást fejtett ki, vissza lehet engedni az extracelluláris környezetbe, vagy a sejt lebonthatja. Az inzulin clearance két elsődleges helye a máj és a vese. A máj a legtöbb inzulint üríti az első áthaladás során, míg a vese az inzulin nagy részét a szisztémás keringésben. A lebomlás általában az inzulin-receptor komplex endocitózisával jár , amelyet az inzulinbontó enzim hatása követ . A béta-sejtek által endogén úton előállított inzulinmolekula becslések szerint körülbelül egy órán belül lebomlik a kezdeti forgalomba kerülése után (az inzulin felezési ideje ~ 4–6 perc).
Az endokannabinoid anyagcsere szabályozója
Az inzulin az endokannabinoid (EC) metabolizmus fő szabályozója, és az inzulinkezelésről kimutatták, hogy csökkenti az intracelluláris EC-ket, a 2-arachidonoil-glicerint (2-AG) és az anandamidot (AEA), amelyek megfelelnek az inzulin-érzékeny expressziós változásoknak az EK-anyagcsere enzimekben . Az inzulinrezisztens zsírsejtekben az inzulin által kiváltott enzimek expressziós mintái megzavaródnak, összhangban az emelkedett EC szintézissel és a csökkent EC degradációval. Az eredmények azt sugallják, hogy az inzulinrezisztens zsírsejtek nem szabályozzák az EC metabolizmusát, és nem csökkentik az intracelluláris EC szintet az inzulin stimuláció hatására, ezáltal az elhízott inzulinrezisztens egyének megnövekedett EC koncentrációt mutatnak. Ez a diszreguláció hozzájárul a túlzott zsigeri zsírfelhalmozódáshoz és csökkentette az adiponektin felszabadulását a hasi zsírszövetből, valamint számos kardiometabolikus kockázati tényező megjelenéséhez, amelyek az elhízáshoz és a 2 -es típusú cukorbetegséghez kapcsolódnak .
Hipoglikémia
A hipoglikémia , más néven "alacsony vércukorszint", amikor a vércukorszint a normál szint alá csökken. Ez különféle tüneteket okozhat, beleértve ügyetlenséget, beszédproblémákat, zavartságot, eszméletvesztést , görcsöket vagy halált. Éhségérzet, izzadás, remegés és gyengeség is előfordulhat. A tünetek általában gyorsan jelentkeznek.
A hipoglikémia leggyakoribb oka a cukorbetegség kezelésére használt gyógyszerek, például az inzulin és a szulfonilureák . A kockázat nagyobb azoknál a cukorbetegeknél, akik a szokásosnál kevesebbet ettek, a szokásosnál többet edzettek vagy alkoholt fogyasztottak . A hipoglikémia egyéb okai közé tartozik a veseelégtelenség , bizonyos daganatok , például inzulinóma , májbetegség , hypothyreosis , éhezés , veleszületett anyagcsere -hiba , súlyos fertőzések , reaktív hipoglikémia és számos gyógyszer, beleértve az alkoholt is. Alacsony vércukorszint fordulhat elő egyébként egészséges csecsemőknél, akik néhány órán keresztül nem ettek.
Betegségek és szindrómák
Az inzulin zavara többféleképpen kóros:
-
Diabetes mellitus - általános kifejezés, amely minden olyan állapotra utal, amelyet hiperglikémia jellemez. A következő típusok lehetnek:
- 1. típus -az inzulint termelő β-sejtek autoimmun mediált pusztulása a hasnyálmirigyben, ami abszolút inzulinhiányhoz vezet
-
2. típus- vagy a béta-sejtek nem megfelelő inzulin termelése, vagy inzulinrezisztencia, vagy mindkettő teljesen nem tisztázott okok miatt.
- összefüggés van az étrenddel , az ülő életmóddal, az elhízással , az életkorral és a metabolikus szindrómával . Az okozati összefüggést több modellszervezetben is bizonyították, beleértve az egereket és a majmokat; fontos, hogy a nem elhízottak 2-es típusú cukorbetegséget kapnak az étrend, az ülő életmód és az ismeretlen kockázati tényezők miatt, bár fontos megjegyezni, hogy ez nem okozati összefüggés.
- valószínű, hogy bizonyos környezeti feltételek mellett genetikai hajlam áll fenn a 2 -es típusú cukorbetegség kialakulására
- Más típusú károsodott glükóztolerancia (lásd Cukorbetegség )
- Insulinoma - béta -sejtek daganata, amely felesleges inzulint termel vagy reaktív hipoglikémiát okoz .
- Metabolikus szindróma - rosszul értelmezett állapot, amelyet Gerald Reaven először X szindrómának nevezett . Nem világos, hogy a szindrómának egyetlen, kezelhető oka van, vagy a 2 -es típusú cukorbetegséghez vezető testváltozások eredménye. Jellemzője a magas vérnyomás, a diszlipidémia (a vér koleszterin -formáinak és más vérzsírok zavarai) és a megnövekedett derékbőség (legalábbis a fejlett világ nagy részénél). Az alapvető kiváltó ok a 2 -es típusú cukorbetegséget megelőző inzulinrezisztencia lehet, amely egyes szövetekben (pl. Izom, zsír) csökkent inzulinválasz -képesség . Gyakori, hogy olyan betegségek alakulnak ki , mint az esszenciális magas vérnyomás , az elhízás , a 2 -es típusú cukorbetegség és a szív- és érrendszeri betegségek (CVD).
- Policisztás petefészek szindróma - komplex szindróma a reproduktív években lévő nőknél, ahol az anovuláció és az androgén -felesleg általában hirsutizmusként jelenik meg . A PCOS sok esetben inzulinrezisztencia van jelen.
Orvosi felhasználás
A klinikai felhasználásra szánt bioszintetikus humán inzulint (inzulin humán rDNS, INN) rekombináns DNS -technológiával állítják elő . A bioszintetikus humán inzulin tisztasága megnövekedett az extraháló állati inzulinhoz képest, fokozott tisztaságú, csökkenti az antitestek képződését. A kutatóknak sikerült bevezetniük a növényekbe az emberi inzulin génjét, mint egy másik módszert az inzulin előállítására ("biopharming") a pórsáfrányban . Ez a technika várhatóan csökkenti a termelési költségeket.
A humán inzulin számos analógja áll rendelkezésre. Ezek az inzulinanalógok szorosan kapcsolódnak a humán inzulin szerkezetéhez, és a glikémiás szabályozás bizonyos vonatkozásaira lettek kifejlesztve, a gyors hatás (prandiális inzulin) és a hosszú hatás (bazális inzulin) tekintetében. Az első bioszintetikus inzulinanalógot étkezés közbeni klinikai használatra fejlesztették ki (étkezési inzulin), a Humalog -ot (lispro inzulin), a bőr alatti injekció beadása után gyorsabban szívódik fel, mint a szokásos inzulin, az injekció beadása után 15 perccel. További gyors hatású analógok a NovoRapid és az Apidra , hasonló profillal. Mindegyik gyorsan felszívódik az aminosavszekvenciák miatt, amelyek csökkentik a dimerek és hexamerek képződését (a monomer inzulinok gyorsabban szívódnak fel). A gyors hatású inzulinokhoz nincs szükség a humán inzulinra és állati inzulinra korábban ajánlott injekció-étkezés intervallumra. A másik típus a hosszú hatású inzulin; ezek közül az első a Lantus (glargin inzulin) volt. Ezek tartós hatást fejtenek ki 18 óráról 24 órára. Hasonlóképpen, egy másik elhúzódó inzulinanalóg ( Levemir ) zsírsav -acilezési megközelítésen alapul. Ehhez az analóghoz mirisztinsav -molekula kapcsolódik, amely az inzulin molekulát a bőséges szérumalbuminhoz társítja, ami meghosszabbítja a hatást és csökkenti a hipoglikémia kockázatát. Mindkét elhúzódó analógot csak egyszer kell bevenni, és az 1 -es típusú cukorbetegeknél bazális inzulinként alkalmazzák. Gyors hatású és elhúzódó inzulin kombinációja is rendelkezésre áll, így a betegek nagyobb valószínűséggel olyan inzulinprofilt érnek el, amely utánozza a szervezet saját inzulin felszabadulását.
Az inzulin általában venni, mint a szubkután injekciókat által egyszer használatos fecskendők és tűk , keresztül inzulin szivattyúval , vagy ismételt használatra inzulin tollak eldobható tűvel. Inhalációs inzulin is kapható az amerikai piacon.
Sok gyógyszerrel ellentétben az inzulint nem lehet szájon át bevenni , mivel szinte minden más, a gasztrointesztinális traktusba bejuttatott fehérjéhez hasonlóan fragmentumokra redukálódik, ami után minden aktivitás elveszik. Volt néhány kutatás arra vonatkozóan, hogyan lehet megvédeni az inzulint az emésztőrendszertől, így azt orálisan vagy szublingválisan is be lehet adni.
2021 -ben az Egészségügyi Világszervezet hozzáadta az inzulint az alapvető gyógyszerek listájához .
Tanulmánytörténet
Felfedezés
1869 -ben , amikor a hasnyálmirigy szerkezetét mikroszkóp alatt tanulmányozta , Paul Langerhans , Berlini orvostanhallgató néhány korábban észrevétlen szövetcsomót azonosított a hasnyálmirigy nagy részében. A funkció a „kis halmokat a sejtek”, később nevén a Langerhans-szigetek , kezdetben ismeretlen maradt, de Édouard Laguesse később azt javasolta, hogy esetleg termelnek váladékot, hogy játszanak szabályozó szerepet az emésztést. Paul Langerhans fia, Archibald is segített megérteni ezt a szabályozó szerepet.
1889 -ben Oskar Minkowski orvos Joseph von Meringrel együttműködve eltávolította a hasnyálmirigyet egy egészséges kutyától, hogy tesztelje az emésztésben betöltött szerepét. A vizelet vizsgálatakor cukrot találtak, ami először hozta létre a kapcsolatot a hasnyálmirigy és a cukorbetegség között. 1901 -ben Eugene Lindsay Opie amerikai orvos és tudós újabb jelentős lépést tett , amikor elkülönítette a hasnyálmirigy szerepét Langerhans szigeteivel: "Cukorbetegség, amikor a hasnyálmirigy elváltozásának következménye a Langerhans -szigeteken, és csak akkor fordul elő, ha ezeket a testeket részben vagy egészben megsemmisítik. "
A következő két évtizedben a kutatók számos kísérletet tettek a szigetek váladékának izolálására. 1906 -ban George Ludwig Zuelzer részleges sikert ért el a kutyák hasnyálmirigy -kivonattal történő kezelésében, de nem tudta folytatni munkáját. 1911 és 1912 között EL Scott a Chicagói Egyetemen vizes hasnyálmirigy -kivonatokat próbált ki, és megállapította, hogy "a glikozúria kissé csökken", de nem tudta meggyőzni igazgatóját munkája értékéről; le volt zárva. Israel Kleiner hasonló hatásokat mutatott be a Rockefeller Egyetemen 1915 -ben, de az első világháború megszakította munkáját, és nem tért vissza hozzá.
1916 -ban Nicolae Paulescu kifejlesztett egy vizes hasnyálmirigy -kivonatot, amelyet cukorbeteg kutyába fecskendezve normalizáló hatással volt a vércukorszintre . Az első világháború miatt meg kellett szakítania kísérleteit , és 1921 -ben négy dolgozatot írt a Bukarestben végzett munkájáról és a cukorbeteg kutyán végzett tesztjeiről. Ugyanebben az évben publikálta a "Research on the Role of the Pancreas in Food Assimilation" c.
Az "inzulin" nevet Edward Albert Sharpey-Schafer alkotta 1916 - ban egy hipotetikus molekula számára, amelyet Langerhans hasnyálmirigy-szigetei (latin sziget sziget vagy sziget) termelnek, és amely szabályozza a glükóz anyagcserét. Sharpey-Schafer tudomása nélkül Jean de Meyer 1909-ben vezette be a nagyon hasonló "inzulin" szót ugyanazon molekulára.
Kivonás és tisztítás
1920 októberében a kanadai Frederick Banting arra a következtetésre jutott, hogy az emésztési váladékok, amelyeket Minkowski eredetileg tanulmányozott, lebontják a szigetek váladékát, ezáltal lehetetlenné téve a sikeres kivonást. Banting sebész volt, és tudta, hogy a hasnyálmirigy -csatorna elzáródása a hasnyálmirigy nagy részét sorvadáshoz vezeti, miközben Langerhans szigeteit érintetlenül hagyja. Úgy érvelt, hogy viszonylag tiszta kivonatot lehet készíteni a szigetekről, ha a hasnyálmirigy többi része már eltűnt. Egy megjegyzést fűzött magához: "Ligázza a kutya hasnyálmirigy -csatornáit. Tartsa életben a kutyákat, amíg az acini degenerálódik a szigetekről. Próbálja elkülöníteni ezek belső szekrécióját és enyhíti a glikozúriát."

1921 tavaszán Banting Torontóba utazott, hogy elmagyarázza ötletét JJR Macleodnak , a Torontói Egyetem élettani professzorának . Macleod kezdetben szkeptikus volt, mivel Banting nem rendelkezett kutatási háttérrel, és nem ismerte a legújabb szakirodalmat, de beleegyezett abba, hogy laboratóriumi teret biztosít Bantingnak ötleteinek kipróbálására. Macleod ezen a nyáron két egyetemi hallgatót is elrendelt Banting laboratóriumi asszisztenseként, de Bantingnak csak egy laboratóriumi asszisztensre volt szüksége. Charles Best és Clark Noble érmét dobtak; A Best megnyerte az érmefeldobást, és elvitte az első műszakot. Ez sajnálatosnak bizonyult Noble számára, hiszen Banting egész nyáron a Bestet tartotta, végül Nobel -díjának és a felfedezésért járó hitelének felét megosztotta Besttel. 1921. július 30-án a Banting és a Best sikeresen kivont egy kivonatot ("szigetecske") a légcsatornába kötött kutya szigeteiből, és beadta egy cukorbeteg kutyának, megállapítva, hogy a kivonat 40% -kal csökkentette vércukorszintjét 1 óra alatt.
A Banting és a Best bemutatta eredményeit Macleodnak, amikor 1921 őszén visszatért Torontóba, de Macleod rámutatott a kísérleti tervezés hibáira, és azt javasolta, hogy a kísérleteket több kutyával és jobb felszereléssel ismételjék meg. Áthelyezte a Bantingot és a Bestet egy jobb laboratóriumba, és kutatási ösztöndíjaiból fizetést kezdett fizetni Bantingnak. Néhány héttel később a kísérletek második fordulója is sikeres volt, és Macleod novemberben segített közzétenni az eredményeket Torontóban. Banting, akit a csatornakötő kutyák időigényes feladata feszegetett, és néhány hétig várt az inzulin kivonására, ráébredt arra az ötletre, hogy inzulint vonnak ki a borjú magzati hasnyálmirigyéből, amely még nem fejlesztette ki az emésztőmirigyeket. Decemberre az inzulint is sikerült kivonniuk a felnőtt tehén hasnyálmirigyéből. Macleod abbahagyta minden egyéb kutatását laboratóriumában, amely az inzulin tisztítására összpontosított. Meghívta James Collip biokémikust, hogy segítsen ebben a feladatban, és a csapat úgy érezte, készen áll egy klinikai vizsgálatra egy hónapon belül.
1922. január 11-én Leonard Thompson , egy 14 éves cukorbeteg, aki haldoklóan feküdt a Torontói Általános Kórházban , megkapta az első inzulin injekciót. A kivonat azonban annyira tisztátalan volt, hogy Thompson súlyos allergiás reakciót szenvedett , és a további injekciókat törölték. A következő 12 napban Collip éjjel-nappal azon dolgozott, hogy javítsa az ökör-hasnyálmirigy kivonatot. Január 23-án beadtak egy második adagot, amely teljesen megszüntette a cukorbetegségre jellemző glikozúriát anélkül, hogy nyilvánvaló mellékhatásokat okozna. Az első amerikai beteg Elizabeth Hughes volt , Charles Evans Hughes amerikai külügyminiszter lánya . Az Egyesült Államokban kezelt első beteg James D. Havens leendő fametszet -művész volt ; Dr. John Ralston Williams inzulint importált Torontóból a New York -i Rochesterbe, Havens kezelésére.
A Banting és a Best soha nem működött jól Collip -szal, úgy tekintett rá, mint egy betolakodóra, és Collip nem sokkal később elhagyta a projektet. 1922 tavaszán Bestnek sikerült olyan mértékben fejlesztenie technikáit, hogy igény szerint nagy mennyiségű inzulint lehetett kivonni, de a készítmény tisztátalan maradt. Az Eli Lilly and Company droggyártó cég nem sokkal az 1921 -es kiadványok után felajánlotta segítségét, és áprilisban elfogadták Lillyt. Novemberben Lilly vezető vegyésze, George B. Walden izoelektromos csapadékot fedezett fel, és nagy mennyiségű, nagyon finomított inzulint tudott előállítani. Röviddel ezután az inzulint eladásra kínálták a nagyközönségnek.
Szabadalom
1922. január vége felé az inzulin és a Collip négy "felfedezője" közötti feszültség röviden azzal fenyegetőzött, hogy külön szabadalmaztatja tisztítási folyamatát. John G. FitzGerald , a Connaught Laboratories nem kereskedelmi népegészségügyi intézmény igazgatója ezért lépett be béketeremtőként. Az így létrejött, 1922. január 25 -i megállapodás két kulcsfontosságú feltételt állapított meg: 1) hogy a kollaboránsok szerződést írnak alá, amelyben megállapodnak abban, hogy a Connaught -tal való kezdeti munkaidő alatt nem vesznek fel szabadalmat egy kereskedelmi gyógyszercéggel; és 2) hogy a kutatási politikában semmilyen változtatás nem megengedett, hacsak először nem tárgyalják meg FitzGerald és a négy együttműködő között. Segített megfékezni a nézeteltéréseket, és a kutatást Connaught nyilvános megbízatásához kötötte.
Kezdetben a Macleod és a Banting orvosi etika miatt különösen vonakodtak szabadalmaztatni az inzulinra vonatkozó eljárásukat. Mindazonáltal továbbra is aggályok merültek fel azzal kapcsolatban, hogy egy magántulajdonban lévő harmadik fél elrabolja és monopolizálja a kutatást (ahogy Eli Lilly és Company utalt rá), és hogy a biztonságos forgalmazást nehéz garantálni a minőségellenőrzési kapacitás nélkül. Ennek érdekében Edward Calvin Kendall értékes tanácsokat adott. 1914 -ben izolálta a tiroxint a Mayo Klinikán , és szabadalmaztatta az eljárást egy megállapodás, a Mayo testvérek és a Minnesotai Egyetem között , és átadta a szabadalmat az állami egyetemnek. Április 12 -én Banting, Best, Collip, Macleod és FitzGerald közösen írt a Torontói Egyetem elnökének, hogy javasoljanak hasonló megállapodást azzal a céllal, hogy szabadalmat rendeljenek el az Egyetem Kormányzótanácsához. A levél hangsúlyozta, hogy:
A szabadalmat nem használnák más célra, mint annak megakadályozására, hogy más személyek kivonják a szabadalmat. Az elkészítési módszer részleteinek közzétételekor bárki szabadon elkészítheti a kivonatot, de senki sem biztosíthat nyereséges monopóliumot.
A megbízást a Torontói Egyetem Kormányzótanácsába 1923. január 15 -én fejezték be, 1,00 dolláros jelképes fizetésért. Az elrendezést 1923 -ban a The World's Work című könyvben gratulálták, mint "előrelépést az orvosi etikában". A 2010 -es években is nagy figyelmet kapott a média az egészségügy és a gyógyszerek megfizethetősége kérdésében .
Az Eli Lilly azon kísérletei miatt, hogy a gyártási folyamat egyes részeit külön szabadalmaztatni próbálja, a Connaught igazgatóhelyettese és az inzulinosztály vezetője, Robert Defries szabadalmazási politikát dolgozott ki, amely megköveteli a gyártótól, hogy szabadon osszák meg a gyártási folyamat fejlesztéseit a megfizethetőség veszélyeztetése nélkül.
Szerkezeti elemzés és szintézis
A tisztított állati eredetű inzulin kezdetben az egyetlen inzulin típus volt, amely kísérletekhez és cukorbetegek számára rendelkezésre állt. John Jacob Abel volt az első, aki 1926 -ban előállította a kristályosított formát. A fehérje természetéről először Michael Somogyi , Edward A. Doisy és Philip A. Shaffer adtak bizonyítékot 1924 -ben. Teljes mértékben bebizonyosodott, hogy Hans Jensen és Earl A. Evans Jr. 1935 -ben izolálta a fenilalanin és a prolin aminosavakat.
Az aminosav szerkezetét inzulint először azzal jellemezve, 1951 Frederick Sanger , és az első szintetikus inzulint állítanak egyidejűleg a laboratóriumban a Panayotis Katsoyannis a University of Pittsburgh és Helmut Zahn a Aacheni Egyetem a 1960-as évek. Szintetikus, kristályos szarvasmarha inzulin úgy értük el, a kínai kutatók 1965-ben a teljes 3-dimenziós szerkezet inzulin határoztuk meg röntgenkrisztallográfiás in Dorothy Hodgkin laboratóriumában 1969-ben.
Az első genetikailag módosított, szintetikus „humán” inzulin elő E. coli 1978-ban Arthur Riggs és Keiichi Itakura a Beckman Kutató Intézet a város Hope együttműködve Herbert Boyer a Genentech . A Swanson, Boyer és Eli Lilly és Company által alapított Genentech 1982 -ben értékesítette az első kereskedelmi forgalomban kapható bioszintetikus humán inzulint Humulin márkanéven . A világszerte használt inzulin túlnyomó többsége bioszintetikus rekombináns "humán" inzulin vagy analógjai. A közelmúltban egy másik megközelítést alkalmazott kanadai kutatók úttörő csoportja, egy könnyen termesztett pórsáfránynövényt használva sokkal olcsóbb inzulin előállítására.
A rekombináns inzulint vagy élesztőben (általában Saccharomyces cerevisiae ) vagy E. coliban állítják elő . Az élesztőben az inzulin egyláncú fehérjévé alakítható, amelynek KexII endoproteáz (a PCI/PCII élesztőhomológja) helye van, amely elválasztja az A inzulin láncot a C-terminálisan csonka B inzulin lánctól. Egy kémiailag szintetizált C-terminális farkat ezután fordított proteolízissel oltunk inzulinra az olcsó proteáz-tripszin alkalmazásával; jellemzően a C-terminális farkán lévő lizint egy kémiai védőcsoport védi, hogy megakadályozza a proteolízist. A moduláris szintézis könnyűsége és a módosítások viszonylagos biztonsága az adott régióban a C-terminális módosításokat tartalmazó gyakori inzulinanalógok (pl. Lispro, aszpart, glulizin). A Genentech szintézis és a teljesen kémiai szintézis, például Bruce Merrifield nem előnyös, mert a két inzulinlánc újbóli kombinálásának hatékonysága alacsony, elsősorban a B inzulin lánc kicsapásával való verseny miatt.
Nobel -díjak
A Nobel -díjas bizottság 1923 -ban a Torontói Egyetem egyik csapatának tulajdonította az inzulin gyakorlati kivonását, és két férfit kapott: Nobel -díjat: Frederick Banting és JJR Macleod . Az inzulin felfedezéséért 1923 -ban fiziológiai vagy orvosi Nobel -díjat kaptak . Banting, feldühödve, hogy Bestet nem említették, megosztotta vele a nyereményét, Macleod pedig azonnal megosztotta James Colliptel . Az inzulin szabadalmát egy dollárért eladták a Torontói Egyetemnek .
Két másik Nobel -díjat ítéltek oda az inzulinnal kapcsolatos munkáért. Frederick Sanger brit molekuláris biológus , aki 1955 -ben meghatározta az inzulin elsődleges szerkezetét , 1958 -ban kémiai Nobel -díjat kapott . Rosalyn Sussman Yalow 1977 -ben orvosi Nobel -díjat kapott az inzulinra vonatkozó radioimmunvizsgálat kifejlesztéséért.
Számos Nobel -díj közvetett kapcsolatban áll az inzulinnal is. George Minotnak , a vészes vérszegénység első hatékony kezelésének kifejlesztéséért 1934-ben Nobel-díjat kapott , cukorbetegsége volt . Dr. William Castle megjegyezte, hogy az 1921 -es inzulin felfedezés, amely időben érkezett Minot életben tartásához, ezért felelős a vészes vérszegénység gyógymódjának felfedezéséért is . Dorothy Hodgkin 1964 -ben kémiai Nobel -díjat kapott a kristálytanítás kifejlesztéséért , amely technikát 1969 -ben az inzulin teljes molekuláris szerkezetének megfejtésére használta.
Vita
A Banting, a Best, a Collip és a Macleod által publikált munka a humán betegek számára alkalmas tisztított inzulin kivonat készítését képviselte. Bár Paulescu felfedezte a kezelés alapelveit, sóoldat -kivonatát embereken nem lehetett használni; az 1923 -as Nobel -díj nem említette. Ian Murray professzor különösen aktívan dolgozott a "történelmi tévedés" kijavításán Nicolae Paulescu ellen . Murray volt élettan professzora a Anderson College of Medicine Glasgow , Skócia , a tanszékvezető anyagcsere-betegségek egy vezető Glasgow kórház, alelnöke a British Association of Diabetes, és alapító tagja a Nemzetközi Diabétesz Szövetség . Murray írta:
Nem megfelelő elismerést kapott Paulescu, a kiváló román tudós, aki abban az időben, amikor a torontói csapat megkezdte kutatásait, már sikerült kinyernie a hasnyálmirigy antidiabetikus hormonját, és bizonyítani annak hatékonyságát a cukorbeteg kutyák hiperglikémiájának csökkentésében.
Privát kommunikációban Arne Tiselius professzor , a Nobel Intézet korábbi vezetője személyes véleményét fejezte ki, miszerint Paulescu is méltó a díjra 1923 -ban.
Lásd még
- Kezelés
- Anatómia és fiziológia
- Egyéb orvosi / diagnosztikai felhasználások
- Inzulin jelátviteli út
- Egyéb felhasználások
Hivatkozások
További irodalom
- Törvények GM, Reaven A (1999). Az inzulin rezisztencia: a metabolikus X-szindróma . Totowa, NJ: Humana Press. doi : 10.1226/0896035883 (inaktív 2021. május 31.). ISBN 978-0-89603-588-1.CS1 maint: A DOI inaktív 2021 májusától ( link )
- Leahy JL, Cefalu WT (2002-03-22). Inzulinterápia (1. kiadás). New York: Marcel Dekker. ISBN 978-0-8247-0711-8.
- Kumar S, O'Rahilly S (2005-01-14). Inzulinrezisztencia: az inzulinhatás és betegségei . Chichester, Anglia: Wiley. ISBN 978-0-470-85008-4.
- Ehrlich A, Schroeder CL (2000-06-16). Orvosi terminológia az egészségügyi szakmák számára (4. kiadás). Thomson Delmar tanulás. ISBN 978-0-7668-1297-0.
- Draznin B , LeRoith D (1994. szeptember). A cukorbetegség molekuláris biológiája: autoimmunitás és genetika; Az inzulin szintézise és kiválasztása . Totowa, New Jersey: Humana Press. doi : 10.1226/0896032868 (2021. május 31. inaktív). ISBN 978-0-89603-286-6.CS1 maint: A DOI inaktív 2021 májusától ( link )
- Híres kanadai orvosok: Sir Frederick Banting a Kanadai Könyvtárban és Levéltárban
- McKeage K, Goa KL (2001). "Glargin inzulin: az 1-es és 2-es típusú cukorbetegség kezelésére szolgáló hosszú hatású szerként történő terápiás alkalmazásának áttekintése". Gyógyszerek . 61. (11): 1599–624. doi : 10.2165/00003495-200161110-00007 . PMID 11577797 . S2CID 46972328 .
- de Leiva A, Brugués E, de Leiva-Pérez A (2011. november). "[Az inzulin felfedezése: folytatódó viták kilencven év után]". Endocrinologia y Nutricion (spanyolul). 58. (9): 449–56. doi : 10.1016/j.endonu.2011.10.001 . PMID 22036099 .
- Vecchio I, Tornali C, Bragazzi NL, Martini M (2018). "Az inzulin felfedezése: fontos mérföldkő az orvostudomány történetében" . Határok az endokrinológiában . 9 : 613. doi : 10.3389/fendo.2018.00613 . PMC 6205949 . PMID 30405529 .
Külső linkek
- A Torontói Egyetem Könyvtárgyűjteménye: Az inzulin felfedezése és korai fejlesztése, 1920–1925
- CBC digitális archívum - Banting, Best, Macleod, Collip: Chasing a Cure for Diabetes
- Animációk az inzulin hatásáról a szervezetben a AboutKidsHealth.ca oldalon
- Az előzetes tájékoztatóban az UniProt : P01308 (inzulin) szerkezeti információinak áttekintése a PDBe-KB-ban .