Metilprednizolon - Methylprednisolone
 | |
 | |
| Klinikai adatok | |
|---|---|
| Kereskedelmi nevek | Medrol, Depo-Medrol ( acetátként ), Solu-Medrol ( szukcinátként ), mások |
| Más nevek | 6α-metilprednizolon; 11β, 17,21-trihidroxi-6α-metil-δ 1 -progesterone; 11β, 17,21-trihidroxi-6α-metilpregna-1,4-dién-3,20-dion |
| AHFS / Drugs.com | Monográfia |
| MedlinePlus | a682795 |
| Licencadatok | |
| Terhesség kategória |
|
| Az adminisztráció módjai |
Szájon át , IM ( acetátként ), IA ( acetátként ), IV ( szukcinát , szuleptanát ) |
| ATC kód | |
| Jogi státusz | |
| Jogi státusz | |
| Farmakokinetikai adatok | |
| Fehérje kötés | 78% |
| Anyagcsere | Elsősorban a máj , a vese , a szövetek ; CYP3A4 |
| Eliminációs felezési idő | 18-26 óra |
| Kiválasztás | Vizelet |
| Azonosítók | |
| |
| CAS -szám | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| CHEMBL | |
| CompTox műszerfal ( EPA ) | |
| ECHA InfoCard |
100,001,343 |
| Kémiai és fizikai adatok | |
| Képlet | C 22 H 30 O 5 |
| Moláris tömeg | 374,4477 g · mol −1 |
| 3D modell ( JSmol ) | |
| Olvadáspont | 228-237 ° C (442-459 ° F) |
| vízben oldhatóság | 1,20x10+2 mg/ml (20 ° C) |
| |
| |
| (ellenőrizze) | |
A metilprednizolon (Depo-Medrol, Medrol, Solu-Medrol) egy szintetikus glükokortikoid , amelyet elsősorban gyulladáscsökkentő és immunszuppresszív hatásai miatt írnak fel. Krónikus betegségek esetén vagy alacsony dózisban, vagy akut fellángolás során nagy dózisokkal együtt alkalmazzák. A metilprednizolont és származékait orálisan vagy parenterálisan adhatjuk be.
Az alkalmazás módjától függetlenül a metilprednizolon szisztémásan integrálódik, amint azt a hatékonysága mutatja, hogy gyorsan csökkenti a gyulladást akut fellángolások során. Sok olyan mellékhatással jár, amelyek a gyógyszer leállítását igénylik, amint a betegség kordában van. Súlyos mellékhatások közé tartozik az iatrogén Cushing -szindróma, a magas vérnyomás, a csontritkulás, a cukorbetegség, a fertőzés és a bőr sorvadása.
Kémiai szempontból a metilprednizolon egy szintetikus pregnán szteroid hormon, amely hidrokortizonból és prednizolonból származik . A szintetikus glükokortikoidok és általában a kortikoszteroidok osztályába tartozik . Mineralokortikoid és glükokortikoid receptor agonistaként működik. Más exogén glükokortikoidokhoz képest a metilprednizolon nagyobb affinitással rendelkezik a glükokortikoid receptorokkal szemben, mint a mineralokortikoid receptorokkal.
A glükokortikoidok nevét a szénhidrát -anyagcsere szabályozásában való részvételük felfedezése után kapták. A glükokortikoidok, például a metilprednizolon sejtfunkciói ma már úgy értik, hogy szabályozzák a homeosztázt, az anyagcserét, a fejlődést, a megismerést és a gyulladást. Kritikus szerepet játszanak a környezeti, fizikai és érzelmi stressz alkalmazkodásában és reagálásában.
A metilprednizolont először a The Upjohn Company (ma Pfizer) szintetizálta és gyártotta, és az FDA 1957. október 2 -án hagyta jóvá az Egyesült Államokban. 2018 -ban ez volt a 153. leggyakrabban felírt gyógyszer az Egyesült Államokban, több mint 4 millió receptje alapján. A metilprednizolont előírt terápiának írták le a COVID-19 világjárvány közepette , de nincs bizonyíték arra, hogy biztonságos vagy hatékony lenne erre a célra.
Farmakodinamika
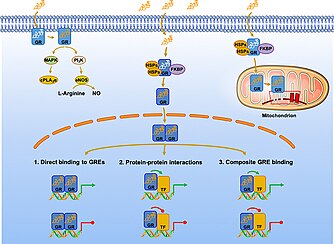
A metilprednizolon egy szintetikus glükokortikoid (GC), amely pleiotrop hatást fejt ki számos fiziológiai mechanizmusra. Azonban széles körben felírták őket gyulladásra és immunitásra gyakorolt hatásuk miatt. A szintetikus glükokortikoidok, például a metilprednizolon hatásai attól függnek, hogy milyen kapcsolatban állnak az intracelluláris glükokortikoid receptorokkal (GR), és kisebb mértékben az mineralokortikoid receptorokkal (MR). A GR -ek széles körben elterjedtek, szemben az MR -ekkel, amelyek korlátozott szöveti eloszlást mutatnak. Ezzel a mechanizmussal a ligandumhoz kötött receptor transzlokálódik a sejtmaghoz és modulálja a génexpressziót.
Jelátvitel
Endogén vagy szintetikus GC -k hiányában a monomer GR -ek a citoplazmában helyezkednek el, és multiprotein komplexeket képeznek hősokk fehérjékkel (HSP), immunofilinekkel és más chaperonokkal, például src és p23. A GR ligandumfüggő módon hat, és a komplex a GR-t inaktív formában tartja, és a ligandumra specifikus. Amikor a plazmából vagy az intersticiális folyadékból származó metilprednizolon passzívan diffundál a sejtmembránon, akkor kötődik a GR-hez, konformációs változást és GC-GR dimerizációt indukálva. Korábban úgy gondolták, hogy ez a konformációs változás szükséges a multiprotein komplex szétválasztásához, hogy a ligandumhoz kötött receptor transzlokálódhasson a maghoz. A legújabb tanulmányok azonban azt mutatták, hogy a kísérők szerepet játszanak a nukleáris importban. A most aktív metilprednizolon-GR komplex vagy nem genomiális változásokat képes transzdukálni a citoplazmában, vagy transzlálódni a sejtmagba, és közvetlen, kötöző vagy összetett mechanizmusokkal szabályozhatja a célgének transzkripciós aktivitását.
Genomikus jelzés
A genomi mechanizmusok, függetlenül attól, hogy milyen típusúak, lassú kezdetű és lassú disszipációjú válaszokat váltanak ki. Ez az mRNS transzkripció és transzláció időtartamának tulajdonítható. A glükokortikoidok nagyjából 100-1000 gént képesek szabályozni a sejttípusra specifikusan.
Három fő mechanizmus ismertette, hogy az MP-GR komplex hogyan változtatja meg a génexpressziót DNS-hez vagy transzkripciós modulátorokhoz kötődve. A genomiális jelátvitel egyik mechanizmusa akkor fordul elő, amikor az MP-GR komplex közvetlenül kötődik a glükokortikoid válaszelemek (GRE) nevű DNS-szekvenciákhoz . A GRE -k a célgének szabályozó régióiban helyezkednek el, és közvetítik azok transzaktivációját vagy transzrepresszióját. Például a lipokortin 1 (ANAX1) aktiválása negatívan zavarja a prosztaglandinok és leukotriének termelését , amelyek ismert gyulladásgátló jelek. Hasonlóképpen, a negatív GRE -k (nGRE -k) felelősek az immunsejtek aktiválásában részt vevő gének elnyomásáért.
Transzkripciós módosítások közzététele
A transzláció utáni módosítások (PTM-ek) szintén hozzájárulnak a metilprednizolon jelátvitelhez, és genomiális és nem genomiális hatásokat válthatnak ki. A GR számos helyet tartalmaz a foszforilezéshez, a sumoilációhoz, az ubikvitinációhoz és az acetilezéshez, amelyek elsősorban a sejten belüli metilprednizolon GR -hez való kötődése után következnek be. A PTM -ek számos funkciót modulálnak, beleértve a nukleáris transzlokációt, a receptor jelzés erősségét és időtartamát, valamint a kofaktor kölcsönhatást. Egy specifikus példa a hiszton-dezacetiláz 2 (HDACe) általi deacetilezés, amelyre szükség volt az NF-κB transzpressziójához.
Nem genomiális jelátvitel
A nem genomiális jelátvitel mechanizmusai különböznek a genomiális jelzéstől, mégis hasonló utakat közvetítenek és terápiás relevanciát nyújtanak. Ezeket a mechanizmusokat úgy jellemzik, hogy gyorsan (kevesebb, mint 15 perc) kezdődnek, mivel nem támaszkodnak időigényes transzkripcióra vagy transzlációra, és nem módosítják őket a transzkripció gátlói.
A metilprednizolon által indukált nem genomiális jelátvitelt három mechanizmus szerint osztályozzák: (1) citoplazmatikus glükokortikoid receptor (cGR) által közvetített nem genomiális hatások, (2) membránhoz kötött glükokortikoid receptor (mGR) nem genomiális hatások és (3) fizikokémiai kölcsönhatások sejtmembránokkal (nem specifikus, nem genomiális hatások).
Az aktivált GC-cGR komplexről disszociáló fehérjék intracelluláris transzkripciótól független mechanizmusokat indítanak el. Bizonyíték arra, hogy a disszociált SRC felelős az arachidonsav (AA) felszabadulásának gátlásáért a sejtmembrán foszfolipidjeiből. Az AA szükséges a gyulladásos mediátorok (prosztaglandinok és leukotriének) szintéziséhez, és így az AA gátlása számos fontos útvonalat közvetít, például a sejtnövekedést, az anyagcserét és a gyulladást.
Korábbi vizsgálatok mGR -eket azonosítottak limfóma sejtekben, de csak 2004 -ben azonosítottak mGR -eket humán perifériás mononukleáris sejtekben. Az mGR -ek prevalenciája sejttípusonként változik, a legnagyobb koncentráció a B -limfocitákban, akár 12,3%, a monocitákban akár 9,2%, és nincs jelen a T -limfocitákban. A vizsgálatok pozitív összefüggést mutattak az mGR-pozitív sejtek és a betegséggel kapcsolatos aktivitás között. Jelenleg nincs bizonyított jelátviteli útvonal az mGR -hez. Egyes kutatók azt feltételezik, hogy a magas betegségaktivitás aktiválja az mGR expresszióját, és a metilprednizolon beadásakor negatív visszacsatolási ciklust hoz létre az apoptózis kiváltásával.
A metilprednizolon magas koncentrációja interkalálódik a plazmában és a mitokondriális sejtmembránokban. Ez az összefüggés megváltoztatja a membrán fizikai -kémiai tulajdonságait; aktiválja a membránfehérjéket, megváltoztatja a sejtfunkciókat és végső soron befolyásolja a kation transzportját a plazmamembránon keresztül, és stimulálja a protonszivárgást a belső mitokondriális membránon keresztül. A gátolt oxidatív foszforiláció veszélyezteti az ATP termelést, amely a sejtek energia -anyagcseréjének és immunfunkciójának egyik fő forrása. A Con-A által stimulált timociták (patkányokban) és az emberi immunsejtek in vivo vizsgálatai (patkányokban), amelyek nagy dózisú metilprednizolont kaptak, kimutatták, hogy dózisfüggő módon gátolják a légzést, gátolják a plazma kalcium- és nátriumfelvételét, és növelik a citoplazmatikus kalciumkoncentrációt. Az összegző folyamat a következő: A metilprednizolon bejut a plazmamembránba, fizikai -kémiai változásokat okoz, aktiválja a membránfehérjéket, amelyek gátolják a plazma kalcium- és nátriumfelvételét (utánozva az energiahiányos állapotot). Az ATP -fogyasztás csökken (hasonlít a gátolt légzéshez), ami fehérje -permeabilitást eredményez a belső mitokondriális membránon és az oxidatív foszforiláció leválasztását. Figyelemre méltó jelentőségű a DNS/RNS szintézis. A háztartó sejtek és az immunsejtek ATP -től való függősége immunszuppressziót eredményez az ATP -hiány során. A folyamat által specifikus immunfunkciók a citokinézis, a migráció, a fagocitózis, az antigén feldolgozása és bemutatása, az antitestek szintézise, a citotoxicitás és a szabályozás.
A HPA tengely
A hipotalamusz-hipofízis tengely (HPA tengely) aktiválása serkenti az endogén glükokortikoidok termelését a mellékvesekéregben. A HPA tengely értelmezi az ingereket (stressz, gyulladás és cirkadián jelek), és ennek megfelelő fizikai -kémiai választ ad át. A vérben felszabaduló glükokortikoidok hírvivőként szolgálnak, mivel kötődnek a glükokortikoid receptorokhoz, széles eloszlásban a testben, beleértve a HPA tengelyt is. Így a GC -k élettani tartományát a negatív visszacsatolási hurok GC -k figyelik a HPA tengely bármely részén. A metilprednizolon szerkezetileg és funkcionálisan utánozza az endogén kortikoidokat, és hasonló módon hat a HPA tengelyre.
Farmakokinetika
A metilprednizolon orális és parenterális adagolásra engedélyezett. Az orális adagolásra szánt metilprednizolon (Medrol) 2 mg, 4 mg, 8 mg, 16 mg vagy 32 mg tabletta formájában kapható. Mind a metilprednizolon-acetát (Depo-Medrol), mind a metilprednizolon-szukcinát (Solu-Medrol) engedélyezett az intramuszkuláris injekcióhoz. A Depo-Medrol emellett intralesionalis, intraartikuláris és lágyrészes injekciókhoz is engedélyezett. A Depo-Medrol steril vizes oldatban kapható 20 mg/ml, 40 mg/ml vagy 80 mg/ml erősségben. A Solu-Medrol az egyetlen metil-prednizolon-származék, amelyet intravénás infúzióra engedélyeztek, mivel a steril por vízben oldódik és hígítószerrel keverhető. Az erősségek 40 mg és 2 g között változnak.
A szintetikus glükokortikoidok hasonlóak az endogén szteroidokhoz az anyagcserében, de különböznek a glükokortikoid- és mineralokortikoid-receptorok iránti affinitásban, a fehérjékhez való kötődésben, az eliminációs sebességben és az anyagcsere-termékekben.
Az orális metilprednizolon könnyen felszívódik a gyomor -bél traktusból, biológiai hozzáférhetősége 89,9%. Az endogén GC -kkel ellentétben a metilprednizolon nem kötődik a glikoprotein transzkortinhoz (kortikoszteroid -kötő globulin, CBG), de mérsékelten kötődik a fehérjékhez az albuminhoz. Így a metilprednizolon farmakokinetikája lineáris, és nem mutat dózisfüggést. Azok a betegek, akik alacsony albumin -koncentrációt mutatnak, veszélyeztetettek a glükokortikoid -kezelés során fellépő mellékhatásoknak. Az orális metilprednizolon mérsékelt eloszlása a szövetekben 1,38 l/kg.
A metilprednizolont elsősorban a máj metabolizmusa és a metabolitok vesén keresztül történő kiválasztása eliminálja; változatlan metil -prednizolon vesén keresztül történő kiválasztódásával mindössze 1,3–9,2%. A metilprednizolont metil -prednizonnal lehet átalakítani. A máj metabolizmusát 11 béta-hidroxiszteroid dehidrogenáz (11p-HSD) és 20-ketoszteroid reduktázok közvetítik. A metilprednizolon a hidrofil inaktív metabolitok, köztük a 20-karboxi-metil-prednizolon és a 6p-hidroxi-20a-hidroxi-metilprednizolon vesén keresztül ürül.
| Szintetikus glükokortikoid | Egyenértékű dózis (mg) | Gyulladáscsökkentő tevékenység 1 | Mineralokortikoid aktivitás 1 | Biológiai felezési idő (óra) | Hivatkozások |
|---|---|---|---|---|---|
| Rövid és közepes hatású glükokortikoidok | |||||
| Hidrokortizon | 20 | 1 | 1 | 8-12 | |
| Kortizon | 25 | 0.8 | 0.8 | 8-12 | |
| Prednizolon | 5 | 4 | 0.3 | 12-36 | |
| Prednizolon | 5 | 4-5 | 0.3 | 12-36 | |
| Metilprednizolon | 4 | 5 | 0,25-0,5 | 12-36 | |
| Meprednizolon | 4 | 5 | 0 | ||
| Közepes hatású glükokortikoidok | |||||
| Triamcinolon | 4 | 5 | 0 | 12-36 | |
| Paramethasone | 2 | 10 | 0 | N/A | |
| Fluprednizolon | 1.5 | 15 | 0 | ||
| Hosszú hatású glükokortikoidok | |||||
| Betametazon | 0.6 | 25-40 | 0 | 36-72 | |
| Dexametazon | 0,75 | 30 | 0 | 36-72 | |
| Mineralokortikoidok | |||||
| Fludrokortizon | 2 | 10 | 250 | 18-36 | |
| Dezoxikortikoszteron -acetát | 0 | 20 | |||
Orvosi felhasználás
Amint azt korábban említettük, a metilprednizolon elsődleges alkalmazása a gyulladásos és immunválaszok elnyomása. A metilprednizolon ezt elsősorban a leukociták, citokinek és kemokinek számának és működésének szabályozásával éri el. Széles körben elterjedt gyulladáscsökkentő szerepe számos betegségben alkalmazható, függetlenül a patológiától. A metilprednizolont általában akut fellángolások rövid távú terápiájaként írják fel, ahogy az akut köszvényes ízületi gyulladásban is megfigyelhető. A mellékhatások monitorozásától függően alacsonyabb dózisokban is felírható a folyamatban lévő terápia során. Az adagolási erősséget és a készítményt orvosi felhasználásra optimalizálják.
Asztma
2001–2002 között az asztmás betegek diagnosztizált és járóbeteg-látogatáson látott betegek 11,4% -ának orális kortikoszteroidokat írtak fel hosszú távú kontrollterápiaként. A Nemzeti Asztma Oktatási és Megelőzési Program (NAEPP) jelzi a szisztémás metilprednizolont mind a rövid, mind a hosszú távú terápiákban, hogy gyorsan ellenőrizzék és elnyomják a tartós asztmát. Azok a súlyosbodások, amelyek a Sürgősségi Osztály (ED) felkeresését eredményezik, az orális metilprednizolont részesítik előnyben az intravénás alkalmazással szemben, kivéve, ha a ragaszkodással vagy a hányással kapcsolatos problémák merülnek fel. Az orális metilprednizolon kevésbé invazív, és a vizsgálatok azt mutatták, hogy az intravénás metilprednizolonnal összehasonlított hatékonyság egyenértékű. A 60–80 mg/nap vagy 2 mg/kg/nap feletti adagolás nem ajánlott, mivel nem bizonyított, hogy megváltoztatja a tüdőfunkciót, a felvételi arányt vagy a kórházban tartózkodás időtartamát az alacsonyabb adagokhoz képest. Az ED-mentesítés után ajánlatos ötnapos metilprednizolon-kúrát előírni a relapszus vagy az elvonási tünetek valószínűségének csökkentése érdekében.
Reumás betegségek
A metilprednizolont számos reumás betegség kezelésére használják, mint például a szisztémás lupusz eritematózusz (SLE) és a reumatoid artritisz (RA). A metilprednizolon adagolása és beadása ezeknél a betegségeknél nagyon változó, mivel a betegségek között és az adott betegséggel diagnosztizált betegeken belül eltérő a patofiziológia. A SLE gyakori megnyilvánulása, a Lupus Nephritis esetében a betegek gyakran metilprednizolont írnak fel egyidejűleg immunszuppresszánsokkal. Súlyos manifesztációkat gyakran ciklofoszfamiddal vagy rituksimabbal és három dózisú metilprednizolon IV-impulzusos kezeléssel kezelnek (az ACR-irányelvek szerint), mielőtt fenntartás céljából áttérnének az orális prednizolonra és azatioprinra.
Az intraartikuláris kortikoszteroid injekciók (IACI) egy második vonalbeli terápia a rheumatoid arthritis okozta ízületi fájdalmak enyhítésére. Leggyakrabban a térd és a váll ízületeibe fecskendezik. Bár az injekció helyi, a vizsgálatok kimutatták a szisztémás felszívódást, amit a távoli ízületekre gyakorolt jótékony hatások is bizonyítanak. A HPA -szuppresszió minimalizálása érdekében az FDA irányelvei az IACI -ket évente háromra korlátozták, az injekciók között legalább 30 nappal.
Elsődleges vagy másodlagos mellékvesekéreg -elégtelenség
A metilprednizolon általában nem ajánlott primer vagy szekunder mellékvesekéreg -elégtelenségben, összehasonlítva más kortikoszteroidokkal, amelyek nagyobb affinitással rendelkeznek a mineralokortikoid receptorok és a sómegtartó tulajdonságok iránt.
Címkézett jelzések
Az alábbi címkézett indikációkat az alkalmazás módja, majd az orvosi fegyelem szerint kategorizálják.
Orális metilprednizolon
- Allergia és immunológia: angioneurotikus ödéma , asztma , csalánkiütés , szezonális vagy örökérvényű allergiás nátha, gyógyszer -túlérzékenységi reakciók és szérumbetegség .
- Bőrgyógyászat: toxikus epidermális nekrolízis, atópiás dermatitis , kontakt dermatitis , pemphigus , erythema multiforme , Steven-Johnson-szindróma , bullous dermatitis herpetiformis, súlyos seborrheás dermatitis , exfoliatív dermatitis, mycosis fungoides és súlyos psoriasis .
- Endokrinológia: veleszületett mellékvese -hiperplázia , rákhoz kapcsolódó hiperkalcémia , nem szuppuratív pajzsmirigy -gyulladás és primer vagy másodlagos mellékvesekéreg -elégtelenség .
- Gasztroenterológia: gyulladásos bélbetegség és fekélyes vastagbélgyulladás .
- Hematológia: szerzett (autoimmun) hemolitikus anaemia , idiopátiás thrombocytopeniás purpura , másodlagos thrombocytopenia, eritroblastopenia, leukémia , limfóma és veleszületett (eritroid) hypoplasticus anaemia.
- Tüdő: aspirációs tüdőgyulladás , krónikus berillium betegség , eozinofil tüdőgyulladás , tüneti szarkoidózis és tüdő tuberkulózis antituberkulózis kemoterápiával együtt.
- Nefrológia: nefrotikus szindróma , idiopátiás típus vagy másodlagos a lupus nephritis miatt .
- Neurológia: szklerózis multiplex .
- Szemészet: scleritis , retina vasculitis , uveitis , choroiditis, iritis, iridocyclitis, keratitis , optic neuritis , allergiás kötőhártya -gyulladás , allergiás szaruhártya -fekélyek, herpes zoster ophthalmicus , szimpatikus oftalmia és chorioretinitis.
- Reumatológia: reumatoid artritisz , reumás carditis , akut köszvényes ízületi gyulladás , spondylitis ankylopoetica , dermatomyositis és polymyositis , pszoriázisos arthritis , szisztémás lupus erythematosus , akut és szubakut bursitis , osteoarthritis szinovitisz , poszttraumás osteoarthritis és epicondylitis .
- Egyéb: trichinosis neurológiai vagy miokardiális érintettséggel.
Parenterális metilprednizolon
- Intraartikuláris vagy lágyszöveti injekciók: akut köszvényes ízületi gyulladás, akut és szubakut bursitis, akut tenosynovitis, epicondylitis és osteoarthritis synovitis.
- Intralesionális injekciók: alopecia areata , discoid lupus erythematosus , keloidok , granuloma annulare , lichen planus , lichen simplexronicus , pikkelysömör plakkok, necrobiosis lipoidica diabeticorum .
- Az intramuszkuláris injekciókat az orális beadásra jelzett számos feltétel kezelésére használják. Az intramuszkuláris injekciókat az orális terápia alternatívájaként adják be.
A címkén kívüli jelzések
A metilprednizolon néhány, a címkén kívüli javallata közé tartozik az akut gerincvelő-sérülés , akut légzési distressz szindróma , alkoholos hepatitis , hormonális újraélesztés a holttestek helyreállításában és a krónikus obstruktív tüdőbetegség .
Elérhető űrlapok
| Hatóanyag | Márkanév | ROA | Forma | Erősség 1 | Inaktív összetevők |
|---|---|---|---|---|---|
| metilprednizolon | Medrol | Orális | tabletta | 2, 4, 8, 16, 32 mg | kalcium -sztearát, kukoricakeményítő, laktóz, ásványi olaj, szorbinsav, szacharóz és eritrozin -nátrium (csak 2 mg), FD&C sárga 6. szám (csak 8 és 32 mg) |
| metilprednizolon | Medrol | Orális | tabletta | 4 mg; 21 tabletta (adagcsomag) | kalcium -sztearát, kukoricakeményítő, laktóz, szacharóz |
| metilprednizolon -acetát | Depo-Medrol | Parenterális:
intraartikuláris vagy lágy szövetek, intralesional vagy intramuscularis |
felfüggesztés | 20, 40, 80 mg/ml | Polietilénglikol 3350, poliszorbát 80, egybázisú nátrium -foszfát, kétbázisú nátrium -foszfát USP, benzil -alkohol 2 tartósítószerként |
| metilprednizolon -acetát 3 | Depo-Medrol | Parenterális:
intraartikuláris vagy lágy szövetek, intralesional vagy intramuscularis |
felfüggesztés | 40 vagy 80 mg/ml (egyadagos injekciós üveg) | Polietilénglikol 3350
Mirisztil-gamma-pikolinium-klorid |
| metilprednizolon -szukcinát | Solu-Medrol | Parenterális:
intravénás vagy intramuszkuláris |
oldat, feloldva | 500, 1000, 2000 mg/injekciós üveg, 2000 mg hígítószerrel (többadagos injekciós üveg) | vízmentes egybázisú nátrium -foszfát, szárított kétbázisú nátrium -foszfát és vízmentes laktóz. Hígítószerként bakteriosztatikus vizet és 2 -benzil -alkoholt adnak hozzá tartósítószerként |
| metilprednizolon -szukcinát 3 | Solu-Medrol | Parenterális:
intravénás vagy intramuszkuláris |
oldat, feloldva | 40, 125, 500, 1000 mg/injekciós üveg (egyszeri dózisú injekciós üveg) | vízmentes egybázisú nátrium -foszfát, szárított kétbázisú nátrium -foszfát és vízmentes laktóz. |
Lábjegyzetek:
1 A rendelkezésre álló űrlapok különböző erősségeit jelzi. Nem jelzi a gyakoriságot és a napi kumulatív dózist; beteg és állapot szerint változik.
2 A benzil -alkoholt nem szabad újszülötteknél alkalmazni
3 Tartósítószermentes készítmény
Ellenjavallatok
A metilprednizolont nem szabad szájon át szedni szisztémás gombás fertőzésben szenvedőknek, kivéve a Depo-Medrol-t, ha intraartikuláris injekcióként alkalmazzák a lokális ízületi betegségekben. A metilprednizolon ellenjavallt azoknál, akik ismerten túlérzékenyek a metilprednizolonnal vagy összetevőivel szemben. A szteroidokat óvatosan kell alkalmazni fekélyes vastagbélgyulladásban, szívbetegségben vagy magas vérnyomásban, peptikus fekélyben, veseelégtelenségben, csontritkulásban, myasthenia gravisban, glaukómában és cukorbetegségben szenvedő betegeknél. A metilprednizolon szedése során pszichés megnyilvánulások jelenhetnek meg, kezdve az eufóriától, az álmatlanságtól, a személyiségváltozásoktól a depresszióig. Óvatosság szükséges a hajlamos pszichózisban szenvedő betegeknél, mivel a kortikoszteroidok szedése során a pszichotikus hajlamok súlyosbodhatnak.
A Solu-Medrol 40 mg dózis tehéntejből előállított laktóz-monohidrátot tartalmaz; Nem szedheti senki, aki ismert túlérzékenységgel rendelkezik a tejtermékekkel vagy összetevőivel szemben. Súlyos egészségügyi események társultak a Solu-Medrol és a Depo-Medrol epidurális alkalmazásához, beleértve a gerincvelő-infarktust, a paraplegiát, a quadriplegia-t, a kérgi vakságot és a stroke-ot. Az idiopátiás thrombocytopeniás purpurában szenvedőknek intramuszkuláris injekciót nem szabad adni. A Solu-Medrol és a Depo-Medrol benzil-alkoholt tartalmazó készítményei ellenjavalltak koraszülötteknél. Az idegszövet túlzott mennyiségű benzil -alkohol expozíciója toxicitással jár, és ritka esetekben halálhoz vezetett.
Mellékhatások
A mellékhatások beárnyékolhatják a metilprednizolon terápiás hatását.
Központi idegrendszer
Minimális klinikai diagnosztikai kritériumok vannak a metil -prednizolon alkalmazásával járó pszichés káros hatások (PAE) meghatározására szisztémás lupus erythematosus (SLE) betegeknél. A prevalencia a felnőtt betegek 1,3-62% -a között változik. A neuropszichiátriai tünetek típusa és súlyossága is jelentősen eltér a betegek között, a betegek 33% -a enyhe vagy közepes súlyosságú PAE-t, 5-10% -a súlyos PAE-t jelentett. A metilprednizolon dózisa és időtartama szerepet játszik a PAE fejlődésében. 20 mg/nap prednizon (16 mg/nap metilprednizolon) a küszöbdózis a PAE kialakulásához, amelyet számos tanulmány megállapított. A nagy dózisú rövid távú impulzusos IV terápia a mániás és hipomániás tünetek gyors megjelenésével jár, ahol a hosszú távú terápia depressziós tüneteket okoz (ritka öngyilkossági kísérletek). A PAE visszafordítható a kezelés csökkentésével vagy abbahagyásával.
Metabolikus és endokrin
Az Iatrogén Cushing -szindróma a glükokortikoid terápia közvetlen szövődménye, és az exogén Cushing -szindróma leggyakoribb oka. A Cushing -szindróma klinikai jellemzői a glükokortikoid -terápia számos káros hatását tartalmazzák. A hagyományos tünetek közé tartozik a súlygyarapodás, a myopathia, a csontritkulás, a megnövekedett fertőzésveszély, a magas vérnyomás és a pszichológiai hatás. A zsírlerakódás a törzsön, a vállak között ("bivalypúp") és az arcon ("holdarc") van központosítva. A betegoktatás és a szolgáltatói felügyelet az első lépés az Iatrogén Cushing -szindróma felismerésében és diagnosztizálásában. Az exogén glükokortikoidok elnyomják az adrenokortikotrop hormon (ATCH) termelését, amit AM biokémiai elemzéssel lehet ellenőrizni. A mellékhatások megjelenése változó; neuropszichiátriai tünetek néhány órán belül jelentkezhetnek, míg a csontritkulás hónapokig tart.
A metilprednizolon szedésének metabolikus hatásai magukban foglalják a fehérjék folyamatos lebontását a glükoneogenezishez, ami növeli az inzulin szükségességét. Ez hiperlipidémiát, súlygyarapodást és myopathiát eredményez, ami arra késztetheti a beteget, hogy vegye igénybe a kezelést.
Fertőzések
Az Immunhiányos szakasz a glükokortikoid által kiváltott immunhiányban ismert aggodalomra okot adó patogéneket tartalmazza.
Mozgásszervi
A csontritkulás a csontbetegségek egy típusa, amelyet a csontsűrűség, a tömeg és az architektúra elvesztése jellemez, ami miatt a beteg hajlamos a törésekre. Az Egészségügyi Világszervezet (WHO) a csontritkulást a kaukázusi posztmenopauzás nőknél csont ásványi sűrűségként (BMD) és -2,5 vagy annál alacsonyabb T -pontszámként határozza meg. Az SLE-ben szenvedő betegeknél az osteoporosis prevalenciája földrajzilag változik, és egyesek a BMD és a T-pontszám diagnosztikai megfelelőségének tulajdonítják. Brit 10,3%, kínai 21,7%A kanadai klinikai gyakorlati irányelvek és az American College of Rheumatology áttértek a Z-pontszám használatára a csontritkulás diagnosztikai markereként, de nem találtak klinikai diagnosztikai küszöböt. Ezenkívül egy Egyesült Királyságban végzett tanulmány kimutatta, hogy a BMD alulreprezentálhatja az SLE-ben szenvedő beteget, mivel a törések kockázata 22% -kal magasabb, mint az egészséges egyéneknél.
Az exogén kortikoszteroidok csontritkulást idéznek elő a csontreszorpció fokozásával és a csontképződés csökkentésével. A csontvesztés a metilprednizolon -kezelés megkezdésének első néhány hónapjában nyilvánulhat meg, krónikus alkalmazás esetén pedig folyamatosan csökken. Az ágyéki gerinc trabekuláris csontvesztése megelőzi a combnyak kortikális csontvesztését.
Kimerítő lista
Allergiás: allergiás vagy túlérzékenységi reakciók, anafilaktoid reakció, anafilaxia és csalánkiütés.
Szív- és érrendszer: magas vérnyomás, pangásos szívelégtelenség fogékony betegeknél, idő előtti érelmeszesedés, aritmia és esetleges hiperlipidémia.
Bőrgyógyászati: károsodott sebgyógyulás, petechiák és ekchimózisok, a bőr elvékonyodása, az arc erythema és fokozott izzadás.
Endokrin: Cushingoid jellegzetességek, növekedéscsökkentés gyermekeknél, másodlagos mellékvesekéreg és agyalapi mirigy válaszreakció, menstruációs zavarok, csökkent szénhidrát -intolerancia és látens diabetes mellitus. Cukorbetegségben szenvedő betegeknél fokozott inzulin- vagy orális hipoglikémiás szerek szükségessége.
Folyadék- és elektrolit -zavarok: nátrium -visszatartás, folyadék -visszatartás, káliumvesztés, hipokalémiás alkalózis vagy pangásos szívelégtelenség érzékeny betegeknél.
Emésztőrendszer: peptikus fekély, hasnyálmirigy -gyulladás, hasi duzzanat és fekélyes nyelőcsőgyulladás.
Metabolikus: fehérjék katabolizmusa, amely negatív nitrogén egyensúlyt okoz.
Mozgásszervi: izomgyengeség, izomtömegvesztés, szteroid myopathia, csontritkulás, ínszakadás (különösen Achilles), csigolya -kompressziós törések, combcsont- és felkarcsont fejek aszeptikus nekrózisa, valamint hosszú csontok kóros törése.
Neurológiai: fokozott koponyaűri nyomás papillémával, görcsökkel, szédüléssel és fejfájással.
Szemészet: hátsó szubkapszuláris szürkehályog, megnövekedett szemnyomás, glaukóma és exophthalmos.
Visszavonás
Az exogén glükokortikoidok visszacsatolása a hipotalamusz – hipofízis – mellékvese (HPA) tengelyen gátolja a kortikotropin-felszabadító hormon (CRH) és az adrenokortikotrop hormon (ATCH) szekrécióját a hipotalamuszban és az agyalapi mirigyekben. A hosszan tartó elnyomás nem megfelelő válaszokat eredményez a fizikai és érzelmi stresszekre, például betegségekre és traumákra. Az ATCH elnyomása mellékvese-hipoplaziát vagy másodlagos mellékvese-atrófiát eredményezhet a metilprednizolon-terápiát követő 6 héten belül, így a beteg életveszélyes mellékvese-elégtelenségi krízis kialakulásának veszélye áll fenn. A HPA tengely elnyomásának mértékét befolyásoló tényezők közé tartozik a szteroid hormon hatékonysága (a vegyület típusa és az alkalmazás módja), a kumulatív dózis, a kezelés időtartama és az egyidejű kábítószer -használat. Minden olyan személy, aki szteroid hormonokat szedett 2+ hétig, veszélyben van a HPA tengely elnyomásának kialakulásához. t A szisztémás metilprednizolon kockázatot mérsékeltnek jelölték a szintetikus glükokortikoidok osztályán belül.
A metilprednizolon bármilyen okból történő abbahagyása előtt konzultáljon orvosával. A gyógyszer hirtelen abbahagyása általában átmeneti, nem specifikus tüneteket okoz, mint például étvágytalanság, gyomorrontás, hányás, álmosság, zavartság, fejfájás, láz, ízületi és izomfájdalom, hámló bőr és súlycsökkenés. Ezek a tünetek a szteroid elvonási szindróma, a mellékvese -elégtelenség vagy a betegség kiújulásának tulajdoníthatók. Azok, akik metil-prednizolont szedtek hosszú távú kezelésként, fokozatosan csökkenthetők, hogy minimalizálják az elvonási tüneteket és a visszaesés lehetőségét. Ha a tünetek súlyosbodnak, a metilprednizolon adagjának ideiglenes növelése klinikai relevanciát mutatott. A metil -prednizolon elvonását követően a betegeket újra tesztelő vizsgálatok tartós mellékvese -elégtelenséget mutattak, egy vizsgálat szerint 3 év után 15%. A nyomon követési ütemtervben azonban széles körű volt az elterjedtség és hiányzott az egységesség.
Gyógyszerkölcsönhatások
Óvatosság szükséges, ha a metilprednizolont az alábbiakban leírt gyógyszerekkel egyidejűleg szedik.
Enziminduktorok
Minden gyógyszer, amely az enziminduktorok osztályába tartozik, növeli a metil-prednizolon clearance-ét és csökkenti a felezési idejét. A fenobarbitál , fenitoin , rifampin , karbamazepin és barbiturátok növelik a májenzimeket és az eliminációs sebességet, ezáltal csökkentve a metilprednizolon immunszuppresszív hatását. A metilprednizolon kívánt hatásának eléréséhez nagyobb adagokra lehet szükség.
Citokróm P450 (CYP) 3A4 inhibitorok
A troleandomicin , a ketokonazol és a klaritromicin gátolják az anyagcserét; csökkentheti a metil-prednizolon eliminációs sebességét és növelheti felezési idejét. A mellékhatások elkerülése érdekében az adagokat ennek megfelelően csökkenteni kell. Egy másik CYP 3A4 inhibitor, a grapefruit juice meghosszabbítja az orális metilprednizolon felezési idejét.
Szájon át szedhető fogamzásgátló
Az orális fogamzásgátlók gátolják az oxidatív folyamatokat, amint azt a metil -prednizolon -clearance csökkentésére való képessége is kiemeli.
P-glikoprotein inhibitorok
A metilprednizolon a P-glikoprotein szubsztrátja; gátlásáról feltételezik, hogy növeli a metilprednizon felszívódását és eloszlását. Nincs klinikai jelentőség.
Ciklosporin, takrolimusz, szirolimusz (Rapamycin)
A metilprednizolon és a ciklosporin gátolják az anyagcserét, és ezért növelik annak valószínűségét, hogy bármelyik gyógyszerrel kapcsolatban mellékhatásokat tapasztalnak. Az ismert egyéni mellékhatások mellett görcsöket is jelentettek.
Cox1 inhibitorok
A metilprednizolon növelheti az eliminációs sebességet krónikus nagy dózisú aszpirinnal . A betegek fokozott szalicilát szérum szintre vagy szalicilát toxicitásra érzékenyek a metilprednizolon leállításakor. Túlzott óvatossággal kell eljárni, amikor metilprednizolont és aszpirint írnak fel hipoprotrombinémiában szenvedő betegeknek .
Antikoagulánsok
Az antikoagulánsok változó kölcsönhatásokat mutatnak; a kívánt hatás elérése érdekében ajánlott a véralvadási indexek monitorozása.
Fizikai tulajdonságok
Az orális metilprednizolon (Medrol) és származékai fehér, szagtalan kristályos por. Oldhatósága a vízben gyakorlatilag oldhatatlan, éterben nagyon kevéssé oldódó, acetonban és kloroformban gyengén oldódó, alkoholban, dioxánban és metanolban gyengén oldható. A metilprednizolon-acetát szuszpenzió (Depo-Medrol) a prednizolon 6-metil-származéka, amely 215 Celsius-fokon, némi bomlás mellett olvad. A metilprednizolon-nátrium-szukcinát (Solu-Medrol) a metilprednizolon nátrium-szukcinát-észtere. A fenti oldhatóságokkal ellentétben a metilprednizolon -nátrium -szukcinát vízben és alkoholban oldódik, acetonban enyhén oldódik és kloroformban nem oldódik
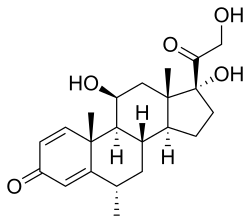
Kémiai tulajdonságok
Metilprednizolon, vagy 6α-metilprednizolon, más néven 11β, 17,21-trihidroxi-6α-metil-pregna-1,4-dién-3,20-dion, egy szintetikus pregnán szteroid és egy származékát a hidrokortizon (11β, 17α, 21 -trihidroxipregn-4-én-3,20-dion) és prednizolon (11β, 17α, 21-trihidroxi-pregn-1,4-dién-3,20-dion). Különféle jellemzőkkel rendelkező metilprednizolon -észterek léteznek és kerülnek forgalomba orvosi használatra. Ide tartoznak a metilprednizolon-aceponát (Advantan), a metilprednizolon-acetát (Depo-Medrol), a metilprednizolon-szukcinát (Solu-Medrol) és a metilprednizolon-szuleptanát (Medrosol, Promedrol).
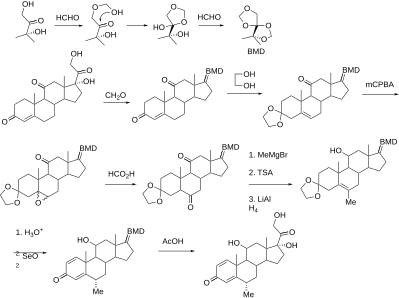
Szintézis
Szintetikus szteroidokat állítanak elő a kólsavból és a szarvasmarhákból, illetve a növényekből nyert szapogeninekből.
Történelem, társadalom és kultúra
A metilprednizolont először a The Upjohn Company (ma Pfizer) és az Egyesült Államokban 1957. október 2 -án jóváhagyott Food and Drug Administration (FDA) szintetizálta és gyártotta . A szabadalom azóta lejárt, és a generikus gyógyszerek már kaphatók. 2021 -ben a 153. leggyakrabban felírt gyógyszer az Egyesült Államokban, több mint négymillió recept alapján. A rangsorban négy helyet ugrott meg 2017-től. A metilprednizolont a COVID-19 világjárvány közepette írták elő , de nincs bizonyíték arra, hogy biztonságos vagy hatékony lenne erre a célra.
Hivatkozások
Külső linkek
- "Metilprednizolon" . Gyógyszerinformációs portál . Amerikai Országos Orvostudományi Könyvtár.